Etude de l`activité antibactérienne de quatre souches

RÉPUBLIQUE ALGÉRIENNE DÉMOCRATIQUE ET POPULAIRE
MINISTÈRE DE L’ENSEIGNEMENT SUPÉRIEUR ET DE LA RECHERCHE SCIENTIFIQUE
Université des Frères Mentouri Constantine
Faculté des Sciences de la Nature et de la
Vie
Département : Microbiologie générale
Mémoire
Présenté en vue de l’obtention du Diplôme de Master
Domaine : Sciences de la Nature et de la Vie
Filière : Sciences Biologiques
Spécialité : microbiologie générale et biologie moléculaire des microorganismes
Intitulé :
Présenté par :
Mesbah Amina Mansouri Ahlam
Soutenu Le : 02 /07/2015
Jury d’évaluation :
Présidente : Mme Kitouni-Oulmi L. Maitre de conférences classe B UFM Constantine
Rapporteur : Mme Diabi-Rghioua S. Maitre assistante classe A UFM Constantine
Examinateur : Mme Mergoud L. Maitre assistante classe A UFM Constantine
Année universitaire
2014 - 2015
Étude de l’activité antibactérienne de quatre
souches actinomycètales d’origine saharienne

Table des matières
Remerciements
Liste des abréviations
Liste des figures
Liste des Tableaux
Introduction
1
Revue Bibliographique
1. Les actinomycètes
2
1.1. Généralités
3
1.2. Classification des actinomycètes
3
1.3. Caractères culturaux des actinomycètes
4
1.4. Caractères morphologiques des actinomycètes
4
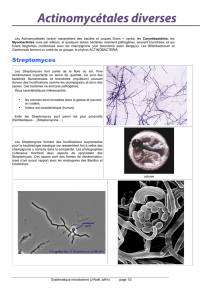
1.4.1 Streptomyces
5
1.4.2 Arthrobacter
5
1.5. Distribution et fonction écologique des actinomycètes
5
1.6. Production des molécules bioactives
6
1.7. Facteurs influençant la production d’agents antimicrobiens
6
1.7.1. Effet des sources nutritionnelles
7
1.7.2. Effet des conditions de culture
8
2. Les antibiotiques
9
2.1. Définition
9
2.2. Classification des antibiotiques
9
2.3. Mode d’action des antibiotiques
9
2.3.1. Inhibiteurs de la synthèse du peptidoglycane
10
2.3.2. Inhibiteurs de la synthèse protéique
10
2.3.3. Inhibiteurs de la synthèse des acides nucléiques
11
2.3.4. Antibiotiques qui provoquant l’altération des membranes
12
2.4. Résistance aux antibiotiques
12
2.4.1. Définition
12
2.4.2. La résistance naturelle
12
2.4.3. La résistance acquise
12
2.5. L’évolution de la résistance bactérienne au cours du temps
13
2.6. Mécanismes biochimiques de résistance bactérienne aux antibiotiques
14

Table des matières
2.6.1. Inhibition enzymatique
14
2.6.2. Diminution de la perméabilité
14
2.6.3. Altération (ou modification) des sites de liaison
14
2.6.4. Pompes à efflux
14
Matériel et méthodes
1. Bactéries-tests
15
1.1. Isolement et identification
15
1.2. Antibiogramme
15
2. les souches productrices d’antibactériens
15
2.1. Revivification
16
2.2. Purification
16
2.3. Test d’activité antibactérienne
16
2.3.1. Préparations des inocula bactériens
16
2.3.2. Technique des cylindres d’agar
16
3. La conservation des souches
16
4. Analyse statistique
17
Résultats et discussion
1. Purification des souches actinomycètales
18
2. Sensibilité des bactéries-tests aux antibiotiques
20
3. Mise en évidence de l’activité antibactérienne
20
Conclusion et perspectives
25
Références Bibliographiques
27
Annexes
Résumés

Liste des abréviations
Ac : Acide
AMX : Amoxicilline
ATCC : American Type Culture Collection
BLSE : ß-lactamases à Spectre Etendue
CA-SFM : Comité de l’antibiogramme de la Société Française de Microbiologie
CIP : Ciprofloxacine
CMI : Concentration Minimale Inhibitrice
COL : Colistine
CTX : Cefotaxime
CZL : Céfazoline
E : Erythromycine
F : Fosfomycine
FA : Acide Fucidique
FO : Fosfomycine
GEN : Gentamicine
IMP : Imipénème
K : Kanamycine
L : Lincomycine
NA : Acide Nalidixique
OMS : Organisation mondiale de Santé
P : Penicilline
PRL : Piperacilline
RA : Rifamycine
TE : Tétracycline
TOB : Tobramycine
VA : Vancomycine
λ : Langueur d’onde de la radiation

Liste des Figures
Figure 1 : Morphologies rencontrées au cours de cultures liquides…………………………04
Figure 2 : Cycle de développement de Streptomyces sur milieu solide……………………..05
Figure 3 : Origines des antibiotiques………………………………………………………...06
Figure 4: Principaux cibles et modes d'action des antibiotiques…………………………….12
Figure 5 : Evolution des résistances au cours du temps…………………………………..... 13
Figure 6 : Photographie présentant les cultures des souches actinomycétales……………….18
Figure 7 : Aspect microscopique des souches actinomycètales après coloration de Gram….18
Figure 8 : Photographie montrant la plus grande zone d’inhibition contre Staphylococcus
saprophyticus par la souche S3 cultivée sur GBA………………………………… 21
Figure 9 : Photographie montrant la plus grande zone d’inhibition contre Pseudomonas
aeruginosa ATCC par la souche S2 cultivée sur GELM…………………………21
Figure 10: Moyennes des pourcentages des activités détectés en fonction du milieu culture.21
Figure 11 : L’activité antibactérienne de la souche S1 en fonction du milieu de culture……23
Figure 12 : L’activité antibactérienne de la souche S2 en fonction du milieu de culture…....23
Figure 13 : L’activité antibactérienne de la souche S3 en fonction du milieu de culture…....23
Figure 14 : L’activité antibactérienne de la souche S4 en fonction du milieu de culture……23
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
1
/
68
100%