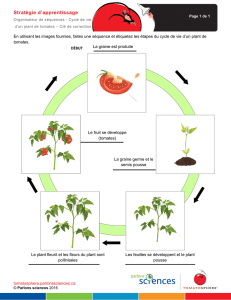
Symbioses telluriques : Rôle et mécanisme de Tolérance aux stress

Faculté des Sciences de la Nature et de la Vie
Département de Biotechnologie
Laboratoire de Biotechnologie des Rhizobia et Amélioration des Plantes
Thèse en vue de l’obtention du diplôme de Doctorat (LMD)
Option : Interactions Plantes-Microorganismes
Thème
Symbioses telluriques : Rôle et mécanisme de
Tolérance aux stress abiotiques
Présentée par
NEHILA Afaf
Soutenue le 23/05/2016
Devant le Jury composé de
Présidente Pr. BENBAYER Zoubida Université d’Oran 1 Ahmed Ben Bella
Examinateur Pr. BELKHODJA Moulay Université d’Oran 1 Ahmed Ben Bella
Examinateur Pr. BELAHCEN Miloud Centre universitaire d’Ain Témouchent
Examinateur Pr. Pierre FRENDO Université de Nice Sophia Antipolis
Rapporteur Pr. IGHILHARIZ Zohra Université d’Oran 1 Ahmed Ben Bella
Co-rapporteur Pr. BEKKI Abdelkader Université d’Oran 1 Ahmed Ben Bella

Remerciements
Louange à Dieu qui m’a aidé et aplani toutes les difficultés pour que je puisse réaliser ce
modeste travail.
Ce travail a été réalisé au Laboratoire de Biotechnologie des Rhizobia et Amélioration des
Plantes (LBRAP) sous la direction du Pr. Ighilhariz Zohra. Je la remercie pour son soutien, sa
disponibilité, ses conseils judicieux, ses encouragements et tout ce qu’elle a fait pour la réussite
de ce travail. Je lui assure le témoignage de ma profonde reconnaissance pour son humanité, son
travail rigoureux et pour le temps et la patience qu’elle m’a accordé tout au long de la réalisation
de cette thèse.
Mes sincères remerciements au Pr. Bekki Abdelkader pour m’avoir donné l’opportunité de
m’introduire dans le domaine de la Rhizobiologie. Ma gratitude envers son soutien pour les
stages dont j’ai bénéficié lors de ma recherche.
Mes vifs remerciements s’adressent au Pr. Benbayer Zoubida qui a accepté sans hésitation de
présider le jury de cette thèse et aux membres du jury Pr. Pierre Frendo, Pr. Moulay
Belkhodja, Pr. Miloud Belahcen d’avoir bien voulu accepter d’examiner ce travail et me faire
profiter de leur expérience scientifique.
Mes remerciements s’adressent aussi à toute l’équipe LBRAP pour l’aide et le soutien durant
mes années d’étude. L’équipe de l’Ecole Nationale Supérieure d’Agronomie (ENSA) d’Alger
pour leur coopération dans les analyses du sol. L’équipe symbiose de l’Institut Sophia
Agrabiotech de m’avoir accueillie et beaucoup aidée. L’équipe de l’Entreprise Publique
Communale de Terga (EPCT, Ain Témouchent) qui a mis à ma disposition tous les moyens
nécessaires pour les prélèvements des échantillons.
De grands remerciements aux enseignantes Mme Bekki Meriem, Mme Bouchentouf Lila et
Mme Merabet Chahinez pour leur soutien moral. Un grand merci pour Mme Boukhatem
Faiza pour sa disponibilité, sa contribution dans la correction de l’article et son soutien moral.
Je tiens à remercier Pr. Pierre Frendo, chef de l’équipe symbiose à l’Institut Sophia
Agrabiotech, Nice, pour son aide, son suivi et son excellent accueil et Geneviève Alloing,
chercheur à l’Institut Sophia Agrabiotech, Nice, pour son aide, son suivi, ses orientations, ses
conseils au cours de mon stage à Nice.
Je tiens à remercier également toutes les personnes qui ont contribué, de près ou de loin, à la
réalisation de ce travail.

Résumé
Une étude du statut mycorhizien est entreprise dans deux sites salins et deux sites dunaires à
partir du sol rhizisphérique des plantes d’intérêts afin d’isoler et de sélectionner des CMA
performants pour leur utilisation ultérieure dans l’inoculation d’A. saligna et de L. creticus.
Cette étude a décelé une différence entre les sites salins et les sites dunaires. Ces derniers abritent
un nombre réduit de propagules MA mais les racines de leurs plantes sont fortement
mycorhizées, contrairement aux sols salins, suggérant que la salinité affecte négativement la
germination des spores et la colonisation racinaire des plantes hôtes, provoquant l’accumulation
des spores dans le sol. Sur la base des caractéristiques morphologiques des spores, une diversité
de glomale (45 morphotypes) est mise en évidence. Elle est plus importante dans les sols
dunaires que dans les sols salins suggérant ainsi que les conditions édaphiques et pédologiques
affectent le comportement, la diversité et la distribution des CMA.
La performance des isolats, issus de culture monosporale, est testée vis-à-vis du stress salin et
hydrique, permettant de sélectionner cinq isolats des différents sites: AT6, LT3, LB2, SST5 et
3S6.
La croissance et les paramètres biochimiques, sous stress salin (150 mM et 300 mM de NaCl),
sont évalués chez A. saligna et L. creticus inoculées avec les isolats sélectionnés, un mixte des
CMA isolés et une combinaison de ce dernier avec une souche de rhizobium. Les résultats
montrent que la salinité a affecté négativement le développement d’A. saligna et de L. creticus
mais l’inoculation a permis de freiner l’effet dépressif du sel. La meilleure tolérance est observée
chez les plants inoculés avec la combinaison rhizobium et mixte de CMA, par contre, la simple
inoculation avec les isolats MA n’a aucun effet dans la tolérance d’A. saligna et de L. creticus.
Les résultats montrent également que pour A. saligna, l’efficacité des CMA ne semble pas liée à
leur adaptation au sel ni à la plante hôte alors qu’elle est liée à la plante hôte dans le cas de L.
creticus.
Mots clés : Symbiose mycorhizienne, symbiose rhizobienne, tolérance, Acacia saligna, Lotus
creticus, stress abiotique.

Abstract
In order to improve knowledge on the role of the mycorrhizal and rhizobial symbiosis in salt
stress tolerance of Acacia saligna and Lotus creticus plants, examine if the symbiotic
performance of AMF in salt stress condition is related to their adaptation to salinity or it depend
on specificity with host plant, a study of mycorrhizal status was undertaken in two salt sites and
in the rhizosphere of indicated plants (two dunes) to isolate and select efficient isolates for
subsequent use in inoculation of Acacia saligna and Lotus creticus plants.
A difference is noted between salt and dune sites. In dune plant species, mycorrhizal
colonization level is significantly more important than in halophyte plants. Saline soils were the
richest in AM spores, suggesting that salinity affect negatively AM spore germination and root
colonization of host plants, causing an accumulation of spores in soils. The morphological
characters of spores highlighted a diversity of glomale which is higher in dune soils. Thanks to
this characterization, 45 morphotypes originated from saline soils and from the rhizospere of A.
saligna and L. creticus are collected. Moreover, results obtained shows that edaphic and soil
conditions affect behavior, diversity and distribution of AM fungi.
Monospecific cultures of one spore representative of each morphotype were conducted to
produce inoculum of 42 morphotypes. Then, morphotypes performance under combined drought
and salinity stresses was tested and five AM isolates were selected (one isolate from each site) :
AT6, LT3, LB2, SST5 et 3S6.
Growth and biochemical parameters were measured in A. saligna and L. creticus plants
inoculated with already selected AM isolates, a mixture of AMF isolated during this work and a
combination of this mixture and a strain of rhizobium and subjected to NaCl (150 mM and 300
mM respectively). All parameters showed that salinity has adversely affected the development of
A. saligna and L. creticus seedlings. However, inoculation helped the seedlings to withstand the
negative effect of salt. The best tolerance is shown in plants inoculated with rhizobia- mixture of
AMF, on the other side, simple inoculation, with AMF isolated during this work, had no effect
on A. saligna and L. creticus seedlings tolerance. This results show also that, for A. saligna,
AMF efficiency appears to be unrelated to their adaptation to salt or to the plant host so that it is
linked to the host plant in the case of L. creticus.
Keywords: Mycorrhizal symbiosis, rhizobial symbiosis, tolerance, Acacia saligna, Lotus
creticus, abiotic stress.

ﺺﺨﻠﻣ
ﺑ فﺪﮭﻦﯿﺴﺤﺗ فرﺎﻌﻤﻟا لﻮﺣرود و ﺎﯿﺑوﺰﯾﺮﻟا ﻊﻣ ﺶﯾﺎﻌﺘﻟاتﺎﯾﺮﻄﻔﻟا ﺔﯾرﺬﺠﻟا ﻞﻤﺤﺗ ﻲﻓAcacia saligna وLotus
creticus ﺔﺑﺮﺘﻟا ﺔﺣﻮﻠﻤﻟ و ﻖﻘﺤﺘﻟا اذإ ﺎﻣ ﻧﺎﻛﺖ ﺔﯿﻟﺎﻌﻓ تﺎﯾﺮﻄﻔﻟا ﺔﯾرﺬﺠﻟا ﺔﻄﺒﺗﺮﻣ ﺎﮭﻔﯿﻜﺘﺑ ﻊﻣ ﺔﺣﻮﻠﻣ ﺔﺑﺮﺘﻟا مأ ﺎھدﻮﻌﺘﺑ ﻰﻠﻋ ﺔﺘﺒﻨﻟا
ﺔﻔﯿﻀﻤﻟاﺎﻧﺮﺷﺎﺑ ،، ﻦﻣ وﺑﺮﺗﺔ ﺔﺤﻟﺎﻣ و لﻮﺣ روﺬﺟ تﺎﺗﺎﺒﻨﻟا ةرﻮﻛﺬﻤﻟا ﻲﻓ نﺎﺒﺜﻛ ﺔﯿﻠﻣر لﺰﻌﺑ ،تﺎﯾﺮﻄﻔﻟا ﺔﯾرﺬﺠﻟا رﺎﯿﺘﺧا ﻢﺛﺔﻟﺎﻌﻔﻟا
ﻣﻨﮭةﺪﻋﺎﺴﻣ ﻲﻓ ﺎﻘﺣﻻ ﺎﮭﻣاﺪﺨﺘﺳﻻ ﺎAcacia saligna وLotus creticus ﻰﻠﻋ ﺔﺣﻮﻠﻤﻟا ﻞﻤﺤﺗ .هﺬھ ﻟاﺔﺳارﺪ تﺪﺻر فﻼﺘﺧا
ﺮﯿﺒﻛ ﻦﯿﺑ ﻊﻗاﻮﻤﻟا ﺔﺤﻟﺎﻤﻟا و نﺎﺒﺜﻜﻟا ﺔﯿﻠﻣﺮﻟا. ﺶﯾﺎﻌﺘﻟا ﺔﺟرد ﻊﻣ تﺎﯾﺮﻄﻔﻟا ﺔﯾرﺬﺠﻟا ﻲﻓ ﺔﯿﺤﻠﻤﻟا تﺎﺗﺎﺒﻨﻟا ىﺪﻟ ﺔﻀﻔﺨﻨﻣ ﺖﻈﺣﻮﻟ
تزوﺎﺠﺗ ﺎﮭﻧأ ﻦﯿﺣ80٪ ﺔﯿﻠﻣﺮﻟا نﺎﺒﺜﻜﻟا تﺎﺗﺎﺒﻧ ىﺪﻟ .غاﻮﺑأ ﺔﻓﺎﺜﻛ لﺪﻌﻣ تﺎﯾﺮﻄﻔﻟا ﺔﯾرﺬﺠﻟا دوﺪﺣ ﻲﻓ ﺖﻠﺠﺳ41 قﻮﻔﯾ ﺎﻣ ﻰﻟإ
300/ 100g باﺮﺘﻟا ﻦﻣ .ﻰﻠﻋ ﻢﻏﺮﻟا ﻦﻣ ﺔﺑﻮﻌﺻﻓوﺮﻇ قﻮﻔﯾ ﺎﻤﺑ غاﻮﺑﻷﺎﺑ ﻰﻨﻏﻷا ﻲھ ﺔﺤﻟﺎﻤﻟا ﺔﺑﺮﺘﻟا نﺈﻓ ،ﺎﮭ300/ 100g ﻦﻣ
باﺮﺘﻟا .ﺺﺋﺎﺼﺨﻟا ترﺎﺷأ ﺔﯿﺟﻮﻟﻮﻓرﻮﻤﻟا نأ غاﻮﺑﻸﻟتﺎﯾﺮﻄﻔﻟا ﺔﯾرﺬﺠﻟا ﻦﻣ ﺔﻧﻮﻜﺘﻣ ﺔﺳورﺪﻤﻟا6 ﻰﻟإ11 ،ﻲﻠﻜﺷ ﻂﻤﻧعﻮﻨﺗ
ﻆﺣﻼﻣ ﺮﺜﻛأ ﻲﻓ نﺎﺒﺜﻜﻟا ﺔﯿﻠﻣﺮﻟا ﺔﻧرﺎﻘﻣ ﺑﻊﻗاﻮﻤﻟﺎ ﺔﺤﻟﺎﻤﻟا.اﺬھ ﻒﯿﻨﺼﺘﻟا ﺢﻤﺳ ﺎﻨﻟ ﻊﻤﺠﺑ45 ﻲﻠﻜﺷ ﻂﻤﻧ.
فﺪﮭﺑرﺎﺒﺘﺧا تﻻﺰﻋ ﻞﻤﺤﺗتﺎﯾﺮﻄﻔﻟا ﺔﯾرﺬﺠﻟا تﺎﺗﺎﺒﻧ طﺎﺒﺗرا ﺔﺟردو ﻮﻤﻧ ﻢﯿﯿﻘﺗ ﻢﺗ ،فﺎﻔﺠﻟا و ﺔﺣﻮﻠﻤﻠﻟsorgho ﻒﻠﺘﺨﻣ ﻊﻣ
تﻻﺰﻋ تﺎﯾﺮﻄﻔﻟا ﺔﯾرﺬﺠﻟا ﺪﻌﺑ ﻚﻟذ و ،ﺮﻌﺗﯾﻀﺎﮭ ﺔﺣﻮﻠﻤﻠﻟ ﻢﺛ فﺎﻔﺠﻟا . هﺪھﺪﯾﺪﺤﺘﺑ ﺎﻨﻟ ﺖﺤﻤﺳ ﺔﺑﺮﺠﺘﻟا5 تﻻﺰﻋ ﻲھ AT6,
LT3, LB2, SST5 et 3S6 .
ﻞﻣاﻮﻌﻟا و ﻮﻤﻨﻟا ﻞﻣاﻮﻋ سﺎﯿﻗ ﻢﺗ ﺔﯿﺟﻮﻟﻮﯿﺴﻔﻟا تﺎﺗﺎﺒﻧ ىﺪﻟAcacia saligna وLotus creticus تﻻﺰﻌﻟا ﻊﻣ ﺎﮭﻃﺎﺒﺗرا ﺪﻌﺑ
ةرﺎﺘﺨﻤﻟا، ﻊﻣ ﺞﯾﺰﻣ ﻦﻣ تﺎﯾﺮﻄﻔﻟا ﺔﯾرﺬﺠﻟا ﺔﻟوﺰﻌﻣ لﻼﺧ اﺬھ ﻞﻤﻌﻟا و ﻊﻣ هﺬھ ةﺮﯿﺧﻷا ﻣﺔﻓﺎﻀ ﻰﻟإ ﺎﯿﺑوﺰﯾﺮﻟا ل ﺎﮭﻀﯾﺮﻌﺗ ﺪﻌﺑ و
150mM و 300 ﻦﻣﺪﯾرﻮﻠﻛ مﻮﯾدﻮﺼﻟا .تﺎﺗﺎﺒﻧ رﻮﻄﺗ ﻰﻠﻋ ﺎﺒﻠﺳ تﺮﺛأ ﺔﺣﻮﻠﻤﻟا نأ تﺎﺳﺎﯿﻘﻟا ﻒﻠﺘﺨﻣ تﺮﮭﻇأA. saligna و
L. creticus نأ ﺮﯿﻏ ﺶﯾﺎﻌﺘﻟاﺔﺣﻮﻠﻤﻠﻟ ﺔﯿﺒﻠﺴﻟا رﺎﺛﻵا ﻦﻣ ﺪﺤﻟا ﻰﻠﻋ ﺪﻋﺎﺳ . ﺎﯿﺑوﺰﯾﺮﻟﺎﺑ ﺔﻄﺒﺗﺮﻤﻟا تﺎﺗﺎﺒﻨﻟا ﺪﻨﻋ ﻞﺠﺳ ﻞﻤﺤﺗ ﻞﻀﻓأ
ﺑ وتﺎﯾﺮﻄﻔﻟﺎ ﺔﯾرﺬﺠﻟا ﺎﻤﻣ لﺪﯾ ﻰﻠﻋ رزﺂﺘﻟا ﻦﯿﺑ و ﺎﯿﺑوﺰﯾﺮﻟاتﺎﯾﺮﻄﻔﻟا ﺔﯾرﺬﺠﻟا. ﻰﻠﻋ ﻞﻛ تﻻﺰﻌﻟﺎﺑ طﺎﺒﺗرﻻا ﺮﮭﻈﯾ ﻢﻟ ﻞﺑﺎﻘﻤﻟا ﻲﻓ
تﺎﺗﺎﺒﻧ ﻞﻤﺤﺘﻟ ﻦﯿﺴﺤﺗ يأ اﺪﺣAcacia saligna وLotus creticus ﺔﺣﻮﻠﻤﻠﻟ. تﺮﮭﻇأﺞﺋﺎﺘﻧ هﺬھ ةﻮﻄﺨﻟا ﺎﻀﯾأ نأ ﺔﺒﺴﻨﻟﺎﺑ ل
Acacia saligna ﺔﯿﻟﺎﻌﻓ تﺎﯾﺮﻄﻔﻟا ﺔﯾرﺬﺠﻟا ﺮﯿﻏﺔﻄﺒﺗﺮﻣ ﻻﺎﮭﻔﯿﻜﺘﺑ ﻊﻣ ﺔﺣﻮﻠﻣ ﺔﺑﺮﺘﻟا و ﻻ ﺎھدﻮﻌﺘﺑ ﻰﻠﻋ ﺔﺘﺒﻨﻟا ﻔﯿﻀﻤﻟاﺔ .ﻲﻓ
ﻲھ ﻦﯿﺣﺔﻄﺒﺗﺮﻣ ﺎھدﻮﻌﺘﺑ ﻰﻠﻋ ﺔﺘﺒﻨﻟا ﻔﯿﻀﻤﻟاﺔ ﺔﺒﺴﻨﻟﺎﺑ لLotus creticus
تﺎﻤﻠﻜﻟا ﺔﯿﺣﺎﺘﻔﻤﻟا :ﺶﯾﺎﻌﺘﻟا، تﺎﯾﺮﻄﻔﻟا ﺔﯾرﺬﺠﻟا،ﻞﻤﺤﺘﻟا ،ﺎﯿﺑوﺰﯾﺮﻟا ،Acacia saligna ،Lotus creticus، ﺮﺗﻮﺘﻟا
يﻮﯿﺣﻼﻟا.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
 79
79
 80
80
 81
81
 82
82
 83
83
 84
84
 85
85
 86
86
 87
87
 88
88
 89
89
 90
90
 91
91
 92
92
 93
93
 94
94
 95
95
 96
96
 97
97
 98
98
 99
99
 100
100
 101
101
 102
102
 103
103
 104
104
 105
105
 106
106
 107
107
 108
108
 109
109
 110
110
 111
111
 112
112
 113
113
 114
114
 115
115
 116
116
 117
117
 118
118
 119
119
 120
120
 121
121
 122
122
 123
123
 124
124
 125
125
 126
126
 127
127
 128
128
 129
129
 130
130
 131
131
 132
132
 133
133
 134
134
 135
135
 136
136
 137
137
 138
138
 139
139
 140
140
 141
141
 142
142
 143
143
 144
144
 145
145
 146
146
 147
147
 148
148
 149
149
 150
150
 151
151
 152
152
 153
153
 154
154
 155
155
 156
156
 157
157
 158
158
 159
159
 160
160
 161
161
 162
162
 163
163
 164
164
 165
165
 166
166
 167
167
 168
168
 169
169
 170
170
 171
171
 172
172
 173
173
 174
174
 175
175
 176
176
 177
177
 178
178
 179
179
 180
180
 181
181
 182
182
 183
183
 184
184
 185
185
 186
186
 187
187
 188
188
 189
189
 190
190
 191
191
 192
192
 193
193
 194
194
 195
195
 196
196
 197
197
 198
198
1
/
198
100%