Pergoveris, INN-follitropin alfa and lutropin alfa - EMA

7 Westferry Circus ● Canary Wharf ● London E14 4HB ● United Kingdom
Telephone +44 (0)20 7418 8400 Facsimile +44 (0)20 7418 8416
E-mail [email protected] Website www.ema.europa.eu
An agency of the European Union
© European Medicines Agency, 2012. Reproduction is authorised provided the source is acknowledged.
EMA/422139/2012
EMEA/H/C/00714
Résumé EPAR à l’intention du public
Pergoveris
follitropine alfa / lutropine alfa
Ce document est un résumé du rapport européen public d'évaluation (EPAR) relatif à Pergoveris. Il
explique de quelle manière l’évaluation du médicament à laquelle le comité des médicaments à usage
humain (CHMP) a procédé l’a conduit à rendre un avis favorable à l'octroi d'une autorisation de mise
sur le marché et à établir ses recommandations relatives aux conditions d’utilisation de Pergoveris.
Qu’est-ce que Pergoveris?
Pergoveris se présente sous la forme d’une poudre et d’un solvant à mélanger pour l’obtention d’une
solution pour préparation injectable. Il contient les substances actives follitropine alfa et lutropine alfa.
Dans quel cas Pergoveris est-il utilisé?
Pergoveris est utilisé pour stimuler le développement des follicules (structures contenant un ovule) dans
les ovaires. Il est destiné aux femmes adultes souffrant d’un déficit sévère (faibles taux) d’hormone
lutéinisante (LH) et d’hormone folliculo-stimulante (FSH). Ces femmes sont généralement stériles.
Le médicament n’est délivré que sur ordonnance.
Comment Pergoveris est-il utilisé?
Tout traitement par Pergoveris doit être instauré sous la surveillance d’un médecin ayant l’expérience
du traitement des troubles de la fertilité.
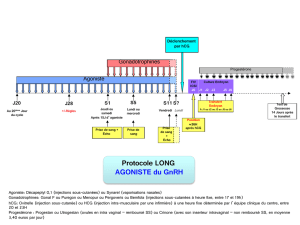
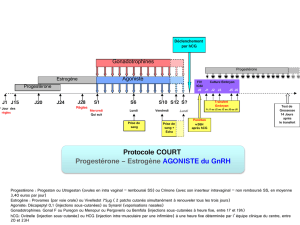
Pergoveris est à prendre une fois par jour jusqu’à ce que la patiente présente un follicule satisfaisant
(d’après les résultats de l’échographie et de l’analyse du taux d’œstrogène dans le sang). Jusqu’à
5 semaines de traitement peuvent s’avérer nécessaires pour l’obtention d’un résultat. La dose de
départ recommandée est d’un flacon une fois par jour, mais le traitement doit être adapté en fonction
de la réponse au traitement de chaque patiente. Il est possible qu’une dose inférieure à un flacon ne
soit pas suffisamment efficace pour stimuler un follicule. Si nécessaire, la dose de follitropine alfa peut

être augmentée en l’administrant comme un médicament séparé et en respectant un intervalle de 7 à
14 jours entre deux augmentations de doses.
Le médicament doit être mélangé immédiatement avant injection sous la peau. La première injection
sera impérativement menée sous surveillance médicale directe, mais la patiente peut procéder elle-
même aux injections suivantes après avoir reçu la formation adéquate. Elle devra en outre bénéficier
d’un contact facilité avec des experts médicaux en cas de questions.
Comment Pergoveris fonctionne-t-il?
Les substances actives contenues dans Pergoveris, la follitropine alfa et la lutropine alfa, sont des
copies des hormones FSH et LH naturelles. Dans l’organisme, la FSH stimule la production d’ovules et
la LH stimule leur libération. Pergoveris se substitue à ces hormones manquantes et permet ainsi aux
femmes présentant un déficit en FSH et LH de développer un follicule, lequel pourra libérer un ovule
après injection d’hormone gonadotrophine chorionique humaine (hCG). Il peut ainsi faciliter la
grossesse chez ces femmes.
Les substances actives de Pergoveris sont produites par une méthode appelée «technologie de l’ADN
recombinant»: elles sont produites par des cellules ayant reçu des gènes (ADN) leur permettant de
produire de la follitropine alfa et de la lutropine alfa.
Quelles études ont été menées sur Pergoveris?
Les deux substances actives contenues dans Pergoveris ont déjà reçu une autorisation de mise sur le
marché européen (UE): la follitropine alfa molécule en tant que GONAL-f et la lutropine alfa en tant
que Luveris. Par conséquent, le laboratoire a présenté des résultats issus des études menées au cours
du développement de Luveris pour soutenir l’utilisation de Pergoveris. Le laboratoire a également mené
des études de «bioéquivalence» afin d’évaluer le degré d’assimilation par l’organisme de l’injection des
deux substances combinées par rapport au degré d’assimilation par l’organisme des deux médicaments
administrés séparément.
Quels ont été les bénéfices démontrés par Pergoveris au cours de ces
études?
Au cours des études menées pour le développement de Luveris, l’association de la follitropine alfa et de
la lutropine alfa aux mêmes doses que celles présentes dans Pergoveris a permis la production de
follicules actifs. Les études de bioéquivalence ont confirmé que Pergoveris était assimilé par l’organisme
de la même manière que les deux substances actives administrées séparément et produisait des taux
sanguins similaires de follitropine alfa et de lutropine alfa.
Quels sont les risques associés à Pergoveris?
Les effets indésirables les plus fréquemment rapportés sous Pergoveris(observés chez plus d’un patient
sur 10) sont: des maux de tête, des kystes ovariens et des réactions au site d’injection (douleurs,
démangeaisons, rougeurs, apparition de bleus, gonflement ou irritation au site d’injection). Le
traitement peut être à l’origine d’une hyperstimulation des ovaires (connue sous le nom de syndrome
d’hyperstimulation ovarienne, OHSS), susceptible d’entraîner des problèmes médicaux graves. Les
formes légères à modérées d’OHSS sont courantes à l’inverse des formes graves qui sont inhabituelles.
Une thrombo-embolie (problèmes de caillots sanguins dans les vaisseaux sanguins) peut survenir très
rarement, normalement associée à un OHSS grave. Pour une description complète des effets
indésirables observés sous Pergoveris, veuillez vous reporter à la notice.
Pergoveris
EMA/422139/2012 Page 2/3

Pergoveris
EMA/422139/2012 Page 3/3
Pergoveris ne doit pas être utilisé chez les personnes hypersensibles (allergiques) à la follitropine alfa,
à la lutropine alfa ou à l’un des autres composants. Il est également contre-indiqué chez les personnes
souffrant de:
tumeurs de l’hypothalamus ou de l’hypophyse,
hypertrophie des ovaires ou de kystes ovariens non dus à un syndrome des ovaires polykystiques
et dont l’origine est inconnue,
saignements gynécologiques d’étiologie inconnue,
cancer de l’ovaire, de l’utérus ou du sein.
Pergoveris ne peut pas être utilisé lorsqu’un bénéfice ne peut pas être obtenu, notamment chez les
femmes souffrant d’une insuffisance ovarienne primaire (lorsque les ovaires arrêtent leur activité avant
la ménopause). Il ne peut pas être utilisé non plus chez les femmes présentant des malformations des
organes sexuels ou des fibromes de l’utérus qui les empêcheraient de tomber enceintes.
Pourquoi Pergoveris a-t-il été approuvé?
Le CHMP a décidé que les bénéfices de Pergoveris sont plus importants que ses risques et a
recommandé l’octroi d’une autorisation de mise sur le marché pour ce médicament.
Autres informations relatives à Pergoveris:
La Commission européenne a délivré une autorisation de mise sur le marché valide dans toute l’Union
européenne pour Pergoveris le 25 juin 2007.
L’EPAR complet relatif à Pergoveris est disponible sur le site web de l’Agence, sous:
ema.europa.eu/Find medicine/Human medicines/European public assessment reports. Pour plus
d’informations sur le traitement par Pergoveris, veuillez consulter la notice (également comprise dans
l’EPAR) ou contacter votre médecin ou votre pharmacien.
Dernière mise à jour du présent résumé: 06-2012.
1
/
3
100%