Differenciation cytophysiologique regionale de F epithelium

/.
Embryo/,
exp. Morph.
Vol.
46,
pp. 21-35, 1978
21
Printed
in Great
Britain
©
Company
of
Biologists
Limited
1978
Differenciation cytophysiologique
regionale
de
F epithelium uropygien chez Fembryon
de canard Anas platyrhynchos
Par JACQUELINE BRIDE1
Laboratoire de Zoologie
et
Embryologie,
ERA
CNRS no. 229,
Faculte des Sciences, Place
Mare'chal
Leclerc, Besancon
SUMMARY
The uropygial gland (preen gland),
an
epidermal derivative,
is a
bilobed, lipid-secreting
gland located over the base
of
the tail
of
most birds.
In the duck embryo Anas
platyrhynchos,
the internal branching morphogenesis
of
preen
gland
is set up at the
17th day
of
incubation. Each glandular lobe
is
made
of
numerous
epidermal columns each
of
which
is
terminated
by a
bulb
or
end-bud. The functional
dif-
ferentiation of the end-buds and the development of the cellular columns into collecting ducts
were investigated. The ductal epithelium, separated from
the
mesoderm
by a
continuous
basal lamina,
is
keratinized just
as in
normal embryonic avian epidermis. The features
which indicate glandular differentiation
in
the end-buds were described. Lipogenesis results
from progressive cellular differentiation characterized by proliferation and development
of
smooth membranes. The direct ecto-mesodermal contacts, which were observed
at
the end-
buds after
the
establishment
of
morphogenetic pattern
and
before
the
onset
of
glandular
secretory activity, suggest that
a
new interaction mechanism would
be
required
to
initiate
the functional differentiation.
INTRODUCTION
Pendant la formation de la glande uropygienne du Canard Anas platyrhynchos y
on peut distinguer plusieurs periodes:
une
phase
de
morphogenese pendant
laquelle
la
structure interne de
la
glande est mise en place (Fig. 1)
et
une phase
de differenciation cytologique de l'epiderme uropygien.
La morphogenese uropygienne precoce, c'est-a-dire
la
formation
des in-
vaginations, ainsi que
la
tubulogenese pendant laquelle les tubes uropygiens
se
constituent
a
partir
du
bourgeonnement
de la
paroi epidermique
des
invagi-
nations,
ont ete
decrites chez plusieurs types d'Oiseaux (Kossmann, 1871;
Pilliet, 1889; Orlandi, 1902; Lunghetti, 1906; Paris, 1913)
et
analysees experi-
mentalement chez
le
Canard
a
l'aide
de la
microscopie photonique (Gomot>
1959) et electronique (Bride & Gomot, 1978). L'ensemble de ces travaux montre
que chaque lobe glandulaire, constitue
de
nombreux tubes ectodermiques
1 Adresse
de
Vauteur: Laboratoire
de
Zoologie
et
Embryologie, ERA CNRS no. 229,
Faculte des Sciences, Place Marechal Leclerc, 25042 Besancon Cedex, France.

22J. BRIDE
Fig. 1. Representation schematique du developpement morphogenetique de la
glande uropygienne d'embryon de Canard.
(a-c) Schema de coupes transversales de la zone uropygienne d'embryons de
10
(a),
11 (b),
12
jours (c) d'incubation. L'epiderme est represente en pointille. Les
fleches indiquent le sens des mouvements morphogenetiques pendant la formation
de l'invagination et de la lumiere principale (L) du lobe uropygien.
(d, e) Schema de coupes transversales de lobes uropygiens d'embryons de
13,5 jours (d) et de 15 jours (e) d'incubation passant par le mamelon (m). Les
bourgeons ectodermiques primaires (be I) se forment a partir de la paroi de la
lumiere (L) et se dichotomisent en donnant les bourgeons secondaires (be II).
(/) Schema representant la disposition des tubes primaires (t I), secondaires (t II),
tertiaires (t III) et des bourgeons terminaux. Les fleches indiquent la zone ou
apparaissent des contacts ecto-mesodermiques particuliers entre les cellules basales
des bourgeons terminaux et la gaine conjonctive (g) du lobe.
plusieurs fois dichotomises se deversant dans une cavite centrale, possede son
architecture definitive au 17e jour d'incubation chez l'embryon de Canard
Anas platyrhynchos (Fig. 1). A ce stade terminal de la morphogenese, les tubes
uropygiens sont termines par un renflement ou bourgeon terminal situe au
contact de la gaine conjonctive du lobe et forme de cellules ectodermiques qui
possedent encore les caracteres de cellules embryonnaires non differenciees.
Par contre, au niveau de la lumiere centrale du lobe, l'epiderme est deja en cours
de differenciation.
Ce travail est consacre a l'etude des differents types de differenciation que
subissent les cellules en fonction de la position occupee dans les bourgeons qui
se sont developpes a partir de la paroi de l'invagination epidermique initiale.
MATERIEL ET TECHNIQUES
Les glandes uropygiennes ont ete prelevees sur des embryons de Canard Anas
platyrhynchos de race Pekin incubes a 38 °C.

Differentiation cytophysiologique regionale de Vepithelium 23
Techniques de microscopie electronique
Les lobes glandulaires sont sectionnes en fragments qui sont fixes pendant
1 a 3 h a la temperature de la salle par la glutaraldehyde a
2
% dans le tampon
cacodylate a 0,075
M
(PO = 350 m-osmoles). La post-fixation se fait par le
tetroxyde d'osmium a
1
% dans le tampon cacodylate (PO = 370 m-osmoles)
pendant 1 h, apres rincage pendant 12 h a quelques jours dans le tampon
cacodylate 0,15 M additionne de NaCl
0,035
M (PO = 370 m-osmoles). L'in-
clusion a lieu dans Pepon (Luft, 1961) ou dans PERL (Spurr, 1969). Les coupes
semi-fines sont colorees par le bleu de toluidine (Trump, Smucker & Benditt,
1961).
Les coupes ultrafines sont contrastees par Pacetate d'uranyle a 4%
dans Palcool ethylique a 50° puis par le citrate de plomb (Reynolds, 1963).
RESULTATS
I. Evolution de
la
paroi
e'pidermique
du systeme evacuateur de la
secretion uropygienne
La cytodifferenciation debute dans la paroi de la cavite centrale ou lumiere
du lobe glandulaire a partir du
15e
jour d'incubation pendant que les bourgeons
issus de cette paroi epidermique s'allongent et se dichotomisent en formant les
tubes uropygiens.
A la suite de Pallongement et de Pamincissement des cellules, la paroi de la
cavite centrale presente une structure caracteristique de Petape precedant la
keratinisation dont on observe ensuite les figures typiques (Fig. 2 a) semblables
a celles decrites dans Pepiderme de Poulet (Mottet & Jensen, 1968; Matoltsy,
1969).
Les cellules basales palissadiques sont separees du tissu mesodermique,
dont les espaces intercellulaires se sont enrichis en fibres de collagene (Fig. 2b),
par une lame basale ininterrompue. Elles contiennent un gros noyau rond ou
ovale avec un ou deux nucleoles, un ergastoplasme developpe, des ribosomes et
polysomes abondants, un appareil de Golgi
actif,
des mitochondries nombreuses
et de grande taille, des gouttelettes de lipides dont le contenu est dense aux
electrons. La zone des cellules intermediaires est caracterisee par les granules
de keratohyaline groupes a la peripherie du cytoplasme ou ils forment un
lisere le long des membranes cellulaires. Dans cette zone, on observe Papparition
de gouttelettes de lipides ainsi que de nombreuses vesicules. Certaines provien-
nent du developpement du reticulum lisse, d'autres paraissent d'origine gol-
gienne (Fig. 2a). Elles ont ete observees aussi pendant la differenciation de la
peau d'embryon de Poulet (Mottet & Jensen, 1968) ou elles sont associees a une
synthese de lipides importante. Les mitochondries degenerent et il est probable
qu'elles participent aussi a la formation des gouttelettes de lipides. Les cellules
cornees dont le centre est occupe par des lipides sont surmontees par les cellules
peridermiques dont la degenerescence est moins avancee. Ce phenomene est
caracteristique de la keratinisation de Pepiderme des Oiseaux (Wessells, 1961;

24
J.
BRIDE

Differentiation cytophysiologique regionale de Vepithelium 25
Mottet & Jensen, 1968). La cytodifferenciation des tubes collecteurs commence
lorsque les dichotomisations successives des bourgeons ectodermiques sont
terminees. La lumiere des tubes apparait au centre des cordons cellulaires avant
le debut de leur cytodifferenciation. La lumiere resulte d'un phenomene d'auto-
lyse partielle du cytoplasme. Les cellules ne sont pas detruites et plusieurs
observations de coupes transversales montrent que la lumiere se presente d'abord
sous la forme d'une cavite bordee de villosites occupant le centre d'une seuel
cellule (Fig. 2c). Pendant que la lumiere des tubes se creuse, les cellules ectoder-
miques basales se multiplient activement ce qui provoque repaississement de
la paroi et la compression des cellules qui deviennent minces et allongees. Dans
les couches superficielles bordant la lumiere apparaissent des granules perider-
maux (Fig. 3d) qui augmentent de taille au cours de la keratinisation. Ces
structures en 'maille de filet' ont ete etudiees d'abord par Fell (1964) puis
decrites par Mottet & Jensen (1968) sous le nom de 'corpuscula cribriformia'
et par Parakkal & Matoltsy (1968) sous le nom de 'peridermal granules' dans
l'epiderme d'embryons de Poulet. Dans les cellules intermediaires on observe
des corps multigranulaires (Fig. 3e) transitoires disparaissant avant l'eclosion,
identiques a ceux decrits dans l'epiderme de poussin nouveau-ne et considered
comme l'equivallent des corps d'Odland de l'epiderme des Mammiferes
(Matoltsy, 1969). En effet la structure lamellaire des granules contenus dans
les corps multigranulaires est semblable a celle des corps d'Odland (Farbman,
1964;
Matoltsy, 1966; Odland & Red, 1967; Wilgram & Weinstock, 1966).
La keratinisation de la paroi des tubes collecteurs est complete avant l'eclosion
et les couches superficielles commencent a se detacher des couches cornees et
sont eliminees dans la lumiere.
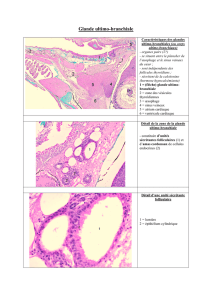
FIGURE
2
(a) Coupe montrant la keratinisation de la paroi de la lumiere principale d'une
glande uropygienne d'embryon de 23 jours d'incubation. (La couche de cellules
basales n'est pas montree.) Des grains de keratohyaline (k) apparaissent a la
peripherie des cellules des couches granulaires intermediaires. L'appareil de Golgi
(G) montre des vesicules dilatees dont revolution pourrait etre a l'origine de
certaines gouttelettes lipidiques (v). Les mitochondries (Mi) degenerent. P couches
peridermiques; CC, couches cornees; CG, couches granulaires; d, desmosome;
Li, lipides. x
22
500.
(b) Coupe transversale dans la paroi keratinisee d'un tube uropygien montrant
l'aspect des cellules basales et de l'interface ectomesodermique (embryon de 25 jours
d'incubation)
Ib,
lame basale; Co, collagene; Li, lipides. x 12600.
(c) Coupe transversale d'un tube uropygien avant le debut de la keratinisation dans
une glande d'embryon de 18
jours.
La lumiere
(L)
occupe
le
centre d'une seule cellule
x 19500.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%