The English version will soon replace this version

Atlas of Genetics and Cytogenetics in Oncology and Haematology
Architecture de la chromatine dans le noyau
interphasique (The English version will soon replace this version)
*
Introduction
I. Organisation 3D de la chromatine dans le noyau
interphasique
1. Relations de la chromatine avec les structures
nucléaires
2. Notion de territoires chromosomiques
3. Topographie des territoires
4. Interface entre territoires voisins
5. Modèle d’organisation de la chromatine dans le noyau
interphasique
II. Evolution relative des territoires les uns par rapport aux
autres au cours des cycles cellulaires successifs
III. Le noyau, une structure dynamique à 4 dimensions
Conclusion
*
Introduction
Depuis la fin du XIXe siècle et les travaux de Rabl, de nombreuses hypothèses ont
été émises quant à l'existence ou non d'une architecture organisée et contrôlée de la
chromatine pendant l'interphase, hypothèses qui ont évolué en fonction des
techniques disponibles pour les vérifier. Ainsi, pour Rabl, il devait exister une
compartimentalisation du noyau, chaque chromosome occupant un territoire défini.
Cette hypothèse reposait essentiellement sur des concepts théoriques puisque les
techniques de microscopie optique, si elles ont permis de décrire certaines structures
comme les nucléoles, n'avaient pas la résolution nécessaire pour distinguer les fibres
de chromatine les unes des autres. Cette idée de l'organisation du noyau
interphasique a été remise en cause par les travaux de microscopie électronique
effectués dans les années 60 et 70. Les résultats en ont été décevants puisque
malgré l'excellente résolution obtenue, aucune architecture particulière des
molécules d'ADN n'a pu être décrite. L'idée prévalente alors était que le noyau était
une « simple » enveloppe contenant les molécules d'ADN décondensées et
mélangées de façon aléatoire. Depuis une vingtaine d'années, l'apparition et le
développement rapide des techniques d'hybridation in situ fluorescente (FISH pour
Fluorescent In Situ Hybridization) a conduit à réexaminer le sujet grâce à des outils
d'imagerie qui permettent enfin de visualiser spécifiquement chaque molécule d'ADN
au sein du noyau.
Atlas Genet Cytogenet Oncol Haematol 2006; 4
661

I. Organisation 3D de la chromatine dans le noyau interphasique
1. Relations de la chromatine avec les structures nucléaires
Principal composant du noyau, la chromatine est en relation avec les deux
principales structures nucléaires identifiées en microscopie, la membrane nucléaire
et les nucléoles.
a. Les nucléoles ont été identifiés depuis longtemps comme étant le
lieu de synthèse des (ARNr). Ces structures intra-nucléaires ne sont
pas limitées par une enveloppe et s'assemblent en nombre variable (en
général 2 par noyau) lors de la reprise des transcriptions en G1, après
la mitose. Ils sont constitués de plusieurs domaines visibles en
microscopie électronique :
• Un ou plusieurs centres fibrillaires, correspondant à la zone de transcription à
partir des molécules d'ADN;
• Un composé fibrillaire dense qui entoure le(s) centre(s) fibrillaire(s), contenant
les transcrits primaires ;
• Un composé granulaire moins dense en périphérie, correspondant à la zone
d'assemblage des pré-ribosomes.
Il s'agit donc de structures fonctionnelles liées à la synthèse des ARNr
et non pas de structures pré-établies indispensables à cette synthèse.
Cette synthèse s'effectue à partir de répétés quelques centaines de fois
dans le génome et tous situés au niveau des bras courts des
chromosomes acrocentriques (chromosomes 13, 14, 15, 21 et 22). Ces
régions sont appelées régions organisatrices des nucléoles (NOR pour
Nucleolar Organising Regions) car leur rapprochement entraîne la mise
en place du nucléole par concentration en un endroit donné des
composants nécessaires à la transcription et à la maturation des ARNr.
Cette proximité physique des bras courts des chromosomes
acrocentriques peut se retrouver parfois jusque pendant la mitose où
l'on peut observer une juxtaposition des NORs de plusieurs
chromosomes acrocentriques.
b. Le noyau est délimité par une enveloppe constituée d'une double
membrane (membranes nucléaires interne et externe, séparées par
l'espace péri-nucléaire). A la face interne de la membrane nucléaire
interne, on trouve un feutrage de filaments intermédiaires, la lamina,
composée de trois protéines essentielles : les lamines A, B et C. La
lamina possède de très nombreuses interactions avec des protéines de
la membrane nucléaire interne et avec la chromatine, en relation avec
ses fonctions dans l'organisation de l'enveloppe nucléaire et
probablement dans la régulation de l'expression des gènes.
En effet, un certain nombre de régulateurs transcriptionnels
interagissent avec les lamines, de même que la protéine HP1 qui se
fixe spécifiquement sur l'hétérochromatine. Par le biais de la lamina,
l'enveloppe nucléaire pourrait donc participer à l'organisation de
Atlas Genet Cytogenet Oncol Haematol 2006; 4 662

l'hétérochromatine dans le noyau et plus largement au contrôle régional
de la par relocalisation de gènes au contact de l'hétérochromatine pour
les inactiver.
2. Notion de territoires chromosomiques
Au début des années 80, grâce à des expériences d'irradiation laser de cellules de
hamster, ont été apportés les premiers éléments d'observation en faveur de
l'existence de territoires chromosomiques. Mais c'est l'hybridation in situ avec des
sondes de peinture chromosomique qui, en permettant de visualiser directement le
matériel génétique spécifique à chaque chromosome, a montré que chacun occupe
un territoire bien délimité, sans mélange ni recouvrement avec les territoires voisins,
confirmant ainsi la théorie de Rabl. Ces résultats ont été retrouvés pour toutes les
paires chromosomiques et constituent la première preuve d'une organisation de la
chromatine pendant l'interphase. Au sein de ces territoires, la fibre de chromatine
conserve une organisation permettant d'identifier des sous-domaines correspondant
aux bras ou aux bandes chromosomiques. La surface occupée par ces territoires est
proportionnelle grossièrement à la taille du chromosome, mais d'autres paramètres
peuvent la moduler comme, par exemple, le niveau global d'expression du
chromosome. Ces territoires chromatiniens ne constituent pas des compartiments
nucléaires au même titre que les nucléoles car ils sont perméables comme le
démontre la diffusion passive de dont la taille peut aller jusqu'à 500 kDa dans tout le
noyau.
3. Topographie des territoires
Existe-t-il un arrangement précis et régulé des chromosomes les uns par rapport aux
autres pendant l'interphase? Cette question difficile n'est toujours pas résolue de
manière définitive car des résultats divergents et parfois contradictoires ont été
rapportés, soit en faveur, soit contre cette hypothèse, mais il faut souligner que les
premières études ont été menées sur des types cellulaires différents voire dans des
espèces différentes, ce qui suggère l'existence d'une variabilité fonctionnelle et/ou
tissulaire.
Cependant, les résultats les plus récents semblent confirmer l'existence d'un
arrangement non aléatoire des territoires chromosomiques les uns par rapport aux
autres pendant l'interphase, en fonction de leur taille et/ou de leur contenu en gènes.
Ainsi, il existe une localisation préférentielle des petits chromosomes vers l'intérieur
du noyau alors que les plus grands sont plus fréquemment observés vers la
périphérie. Cependant, le contenu en gènes intervient également comme le prouve le
cas des chromosomes 18 et 19. Bien que de tailles comparables, le chromosome 19
riche en gènes est situé plus vers le centre du noyau que le 18, pauvre en gènes et
observé en périphérie. Cette corrélation entre densité en gène accrue et position plus
centrale dans le noyau interphasique a depuis été retrouvée pour d'autres paires.
Si l'on admet donc l'existence d'une organisation non aléatoire des territoires au sein
du noyau, une autre question à résoudre est de savoir si elle est associée à un
arrangement particulier des homologues ou de certaines paires entre elles. Là
encore les résultats obtenus jusqu'ici sont discordants et ne permettent pas encore
de répondre de manière définitive. Cependant, quelques observations récentes
concernant les positions respectives de chromosomes impliqués dans certaines
translocations réciproques militent en faveur d'un positionnement non aléatoire des
chromosomes les uns par rapport aux autres.
Atlas Genet Cytogenet Oncol Haematol 2006; 4 663

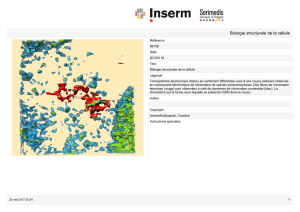
4. Interface entre territoires voisins (Figure 1)
Deux modèles sont proposés pour décrire les relations qui existent entre territoires
chromosomiques voisins.
a) Dans le premier modèle (modèle ICD : Interchromatin Domain), il
existerait des espaces dépourvus de chromatine appelés espaces
interchromatiniens. Ces espaces forment un réseau en trois dimensions
de canaux qui débutent au niveau des pores de la membrane nucléaire
et s'étendent entre les territoires chromosomiques dans lesquels ils
s'invaginent. Leur taille est variable, avec des lacunes de quelques
micromètres de diamètre alors que les régions les plus fines pourraient
n'avoir que quelques nanomètres de large. Ces espaces
interchromatiniens seraient l'endroit où serait concentré tout le matériel
non chromatinien (corps nucléaires, pré-ARNm, facteurs de
transcription) et constitueraient à ce titre soit un simple lieu de stockage
des macromolécules, soit directement le lieu des réactions
enzymatiques. En tout état de cause, il est en revanche déjà acquis
que ces espaces servent également de voies de circulation au sein du
noyau par simple diffusion passive permettant de distribuer les
protéines nécessaires à la transcription et d'exporter en retour les
produits.
b) Le deuxième modèle (modèle ICN : Interchromosomal network)
suppose au contraire qu'il existe des zones de recouvrement entre
territoires voisins au niveau desquelles les fibres de chromatine des
deux chromosomes sont étroitement associées. Ce modèle repose sur
des observations faites sur des coupes ultrafines qui permettent de
mieux conserver l'architecture de la chromatine que les préparations
standard de FISH 3D. Environ 40% de chaque territoire serait ainsi
mélangé en périphérie avec les territoires voisins. L'importance de la
zone frontalière serait fonction notamment de la compaction du
territoire chromosomique (plus la chromatine est compacte moins il y a
de possibilités d'interpénétration), elle-même étant proportionnelle à la
richesse en gènes du chromosome et à son activité transcriptionnelle.
Dans ce modèle, les protéines nécessaires à la transcription, la
réplication, la réparation de l'ADN ainsi que les ARN diffuseraient
librement entre les boucles de chromatine au sein de chaque territoire
sans être confinées au sein d'espaces spécialisés. Le principal intérêt
de ce modèle est de pouvoir concilier la notion de territoire
chromosomique avec la fréquence observée des translocations
réciproques. En effet, pour chaque chromosome, il existe une très
bonne corrélation entre la proportion de territoire mélangé avec les
territoires voisins et la fréquence des translocations réciproques
impliquant la paire considérée.
Atlas Genet Cytogenet Oncol Haematol 2006; 4 664

5. Modèle d'organisation de la chromatine dans le noyau interphasique
Des différentes observations réalisées jusqu'à maintenant, se dégage un modèle
d'organisation fonctionnelle du noyau interphasique constitué de territoires
chromosomiques contenant l'information génétique sous la forme de chromatine. Au
sein du noyau, les protéines et les ARN produits peuvent diffuser librement pour
atteindre leur site de fixation ou pour être exportés vers le cytoplasme, soit via un
réseau d'espaces canaliculaires connectés aux pores nucléaires et séparant les
territoires (modèle ICD), soit directement entre les boucles de chromatine des
différents territoires (modèle ICN). Dans les deux modèles, les activités de
transcription qui se font au contact de la chromatine peuvent être régulées en
modifiant l'accessibilité aux gènes. Les gènes actifs sont accessibles aux complexes
de transcription soit parce qu'ils sont proches d'un espace interchromatinien dans le
modèle ICD, soit parce qu'ils sont situés sur une grande boucle d'ADN dans le
modèle ICN. L'observation que l'activation d'un gène peut être associée à sa
relocalisation dans un territoire voisin permet de plus d'envisager de nouveaux
modes de co-régulation de gènes participants à des voies métaboliques communes
et éventuellement situés sur des chromosomes distincts.
Quelque soit le modèle qui s'avèrera le plus proche de la réalité, cette organisation
de la chromatine permet d'inactiver facilement des groupes de gènes en modifiant
leur position au sein des territoires et en les rendant ainsi inaccessibles à la
machinerie transcriptionnelle.
Parmi les nombreux points qui restent à élucider, il y a la question de savoir si
l'organisation en territoires chromosomiques est un préalable permettant d'organiser
Atlas Genet Cytogenet Oncol Haematol 2006; 4 665
 6
6
 7
7
 8
8
1
/
8
100%