manuel de référence à l`usage des personnels de laboratoire

MANUEL DE RÉFÉRENCE À L'USAGE DES PERSONNELS
DE LABORATOIRE
MANUEL DE RÉFÉRENCE À L'USAGE DES PERSONNELS
DE LABORATOIRE
ORGANISATION MONDIALE DE LA SANTÉ
Bureau régional de l'Afrique
Brazzaville
(n=u4(n- )+0 ×u3( -1-.000 3(1 ×u4(n-u4 ) 1 .02 n) 0 04×u n-)1)
MANUEL DE RÉFÉRENCE À L'USAGE DES PERSONNELS
DE LABORATOIRE

LE VIRUS
DE L'IMMUNODÉFICIENCE HUMAINE
ET SON DIAGNOSTIC
MANUEL DE RÉFÉRENCE À L'USAGE DES PERSONNELS
DE LABORATOIRE
ORGANISATION MONDIALE DE LA SANTÉ
Bureau régional de l'Afrique
Brazzaville • 2004
DIVISION DES MALADIES TRANSMISSIBLES
PROGRAMME RÉGIONAL SIDA

Les publications de l'Organisation mondiale de la Santé bénéficient de la protection par les
dispositions du Protocole No.2 de la Convention pour la Protection du Droit d'Auteur. Tous les
droits réservés.
Les désignations utilisées dans cette publication et la présentation des données qui y
figurent n'impliquent de la part du Secrétariat de l'Organisation mondiale de la Santé aucune
prise de position quant au statut juridique des pays, territoires, villes ou zones, de leurs
autorités, ni quant au tracé de leurs frontières ou limites.
Le fait de mentionner les produits de compagnies spécifiques ou de certains fabricants ne
signifie pas qu'ils sont approuvés ou recommandés par l'Organisation mondiale de la Santé de
préférence à d'autres produits de nature analogue qui ne sont pas mentionnés. A l'exception
des erreurs et des omissions, les noms des produits sont signalés par des majuscules au début
du mot.
Imprimé en République d' Afrique du Sud
Bureau régional de l'OMS pour l'Afrique
(2004)
©
ii

iii
SOMMAIRE
Page
Préface . . ……………………………………………………………………………………………. ....................................vii
INTRODUCTION ..................................................................................................................................1
I RAPPEL SUR LE VIRUS ET LA RÉPONSE IMMUNITAIRE ..........................................................................3
1. Le virus .....................................................................................................................................3
2. Les défenses immunitaires .........................................................................................................4
A. Les moyens de défense non spécifiques ............................................................................4
B. Les moyens de défenses spécifiques ..................................................................................4
a) Éléments intervenant dans la réaction immunitaire .................................................4
b) Réaction immunitaire ............................................................................................7
c) Modulation de la réponse immunitaire ..................................................................8
II. L'AGENT VIH .......................................................................................................................................11
1. Structure du virus ....................................................................................................................11
A. Le génome ....................................................................................................................13
a) Les gènes classiques ……………………………………………………….........................13
b) Les gènes supplémentaires ..................................................................................13
B. La capside virale …………………………………………………………………. ...........................14
C. La matrice ……………………………………………………………………….. ............................14
D. L'enveloppe ..................................................................................................................14
2. Multiplication du VIH .............................................................................................................15
A. Fixation sur la cellule cible .............................................................................................15
B. Pénétration ...................................................................................................................16
C. Décapsidation ..............................................................................................................17
D. Rétrotranscription et intégration .....................................................................................17
E. Expression de l'ADN intégré ..........................................................................................18
F. Assemblage-libération-maturation ................................................................................19
3. Variabilité génétique du VIH ...................................................................................................19
4. Les cellules cibles du VIH ........................................................................................................20
5. Caractéristiques physico-chimiques du virus ............................................................................21
SOMMAIRE

iv
III. ÉPIDÉMIOLOGIE DE L'INFECTION .....................................................................................................22
1. Les chiffres de l'infection ..................................................................................................................22
2. Modes de transmission du virus ........................................................................................................23
3. Répartition géographique des types et sous-types ..............................................................................23
IV. HISTOIRE NATURELLE DE LA MALADIE ..............................................................................................25
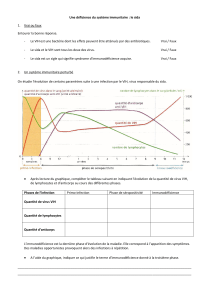
1. La contamination ...........................................................................................................................25
2. La primo-infection .........................................................................................................................25
3. La séro conversion .........................................................................................................................26
4. Le Syndrome de l'immunodéficience acquise ou SIDA ....................................................................26
V. LE DIAGNOSTIC DU VIH .....................................................................................................................27
1. Le diagnostic sérologique de l'infection à VIH ...................................................................................27
A. ELISA ou test immuno-enzymatique .........................................................................................27
a) Test ELISA indirect .........................................................................................................28
b) Test ELISA de compétition .............................................................................................28
c) Test ELISA sandwish ......................................................................................................29
d) Test d'immunocapture des anticorps ..............................................................................30
e) Les tests combinés de détection antigène/anticorps ........................................................31
2. Évolution des tests ELISA de diagnostic du VIH ..................................................................................31
3. Composition antigénique des tests de détection des anticorps ............................................................31
4. Tests de recherche de l'antigène p.24 ...............................................................................................32
B. Les tests rapides .......................................................................................................................32
5. Les tests de confirmation ..................................................................................................................36
A. Le western blot ou test d'immunoempreinte .............................................................................36
B. L'immunofluorescence indirecte .............................................................................................37
C. L'immunoanalyse en ligne .......................................................................................................38
D. La radio-immunoprécipitation (RIPA) .......................................................................................38
6. La mesure de la réplication virale ......................................................................................................38
7. La culture du virus ...........................................................................................................................39
8. Cas particulier de la transmission mère-enfant ...................................................................................39
VI. LES MESURES DE SÉCURITÉ AU LABORATOIRE ...................................................................................41
VII. STRATÉGIES OMS/ONUSIDA DE DIAGNOSTIC DU VIH .....................................................................42
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
1
/
70
100%