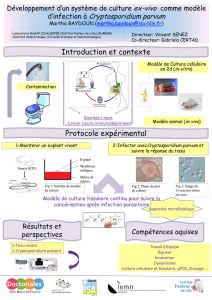
Demande d`allocation – ED Santé, Sciences Biologiques et Chimie

Demande d’allocation – ED Santé, Sciences Biologiques et Chimie du Vivant (SSBCV)
1. Informations administratives :
Nom de l’encadrant responsable de la thèse : Fabrice Laurent
Nom du co-encadrant :
Unité : UMR-INRA1282 ISP
Equipe :
Contrôle et Immunologie des Maladies Entériques du Nouveau-né (CIMEN)
Email de l’encadrant : [email protected]
2. Titre de la thèse : Fonction des cellules dendritiques CD103+ CD8α
αα
α+ dans le contrôle de
l’épithélium intestinal infecté par C. parvum.
3. Résumé :
L’équipe CIMEN étudie les réponses immunitaires intestinales qui se mettent en place chez le
nouveau-né en réponse à l’infection par Cryptosporidium parvum. La susceptibilité à l’infection par ce
parasite protozoaire zoonotique est étroitement liée au statut immunitaire de son hôte, affectant tout
particulièrement les jeunes individus et les immunodéprimés. Ce parasite dont le développement est
restreint à l’épithélium intestinal représente un bon modèle pour étudier l’initiation des réponses
mucosales et les mécanismes de contrôle de l’épithélium. Lors d’une thèse qui vient de se terminer
nous avons identifié la raison de la sensibilité des jeunes animaux à l’infection. Le contrôle de la phase
aigüe de l’infection dépend de la présence des cellules dendritiques (DC) CD103+ qui sont très peu
représentées dans la muqueuse intestinale des nouveau-nés. Leur amplification in vivo permet
d’accroitre considérablement la résistance des nouveau-nés à l’infection.
L’objet du projet consiste à déterminer le phénotype des cellules CD103+ impliquées dans le
processus de protection ainsi que le mécanisme précis par lequel ces cellules agissent pour contrôler la
multiplication du parasite dans l’épithélium.
I) Importance des cellules dendritiques CD103+CD8α
αα
α+ lors de la phase aigüe de l’infection à C.
parvum.
Il a récemment été décrit deux sous-populations de DC CD103+ au niveau intestinal, les CD103+
CD8α+ et les CD103+CD11b+ (Fujimoto et al. J. Immunol, 2011). Ces deux populations possèdent
des récepteurs de l’immunité innée spécifiques et des propriétés différentes quant à l’induction des
réponses immunes, la population CD103+ CD8α+ étant plus spécialisée dans l’induction des réponses
TH1 et la population CD103+CD11b+ pour l’induction des réponses IgA et régulatrices. Un article de
l’équipe de Kenneth Murphy, démontre le rôle déterminant des DC CD103+CD8α+ pour le contrôle
de l’infection par un autre protozoaire, T. gondii (Mashayekhi et al. Immunity 2011). Nos premières
données montrent que les cellules CD103+CD8α+ expriment le messager de l’IFNγ lors de
l’infection, une cytokine nécessaire pour contrôler la charge parasitaire. Cette sous-population de
cellules dendritiques attire donc tout particulièrement notre attention et nous souhaitons étudier son
rôle précis lors de la phase aigüe de l’infection à C. parvum. Nous analyserons tout d’abord le
recrutement et le positionnement (au contact des entérocytes ?) de ces cellules lors de l’infection. La
disponibilité récente de souris Batf3-/- qui sont sélectivement déficientes pour la sous-population
CD103+ CD8α+ au niveau intestinal (Edelson et al. J. Exp. Med, 2010) va nous permettre d’étudier la
contribution de ces cellules dans le processus de protection vis-à-vis de C. parvum. Nous analyserons

la sensibilité à l’infection chez les souris Batf3-/- et la conséquence de l’absence des DC CD103+
CD8α+ sur la réponse cytokinique des autres populations CD11c+ de l’intestin.
I) Mécanismes mis en jeux par les DC CD103+ CD8α
αα
α+ pour contrôler l’infection.
Les cellules dendritiques sont connues pour orchestrer les réponses immunes en agissant avec de
multiples partenaires cellulaires de l’immunité innée ou adaptative. Nos données obtenues avec des
souris transgéniques montrent que la protection contre l’infection lors de la phase aigüe de l’infection
est indépendante de la présence des lymphocytes T et des lymphocytes de l’immunité innée (Natural
killer, RORγt+ ILC) suggérant que les cellules dendritiques pourraient directement contribuer à la
protection sans passer par des intermédiaires cellulaires. Plusieurs expérimentations sont envisagées
pour clarifier définitivement le mécanisme de protection.
Nous avons observé que les cellules CD103+ CD8α+ expriment le messager pour l’IFNγ, mais il faut
démontrer fonctionnellement que la production de cette cytokine par ces cellules est déterminante pour
le processus de protection. Pour cela, nous utiliserons un modèle de souris chimères (Batf3-/- ;IFNγ-/-)
dans lesquelles seules les cellules CD103+CD8α+ seront déficientes pour la production d’IFNγ.
L’IFNγ est une cytokine activant de multiples cellules du système immunitaire. In vitro, l’addition de
cette cytokine sur des cellules épithéliales en culture permet de réduire partiellement le développement
du parasite. Nous déterminerons si l’effet de l’IFNγ sur son récepteur au pôle basolatéral de
l’entérocyte est nécessaire et suffisant pour contrôler l’infection in vivo grâce à d’autres types de
souris chimères (IFNγR-/- ; WT). Parallèlement, un modèle de co-culture in vitro permettra d’évaluer
la nécessité ou non d’un contact entre les DC CD103+ CD8α+ et les IEC infectées pour le contrôle du
développement parasitaire.
Enfin, les cellules dendritiques CD103+ peuvent phagocyter des micro-organismes ou des cellules
infectées et pourraient ainsi aussi contribuer au contrôle de l’infection. Nous évaluerons si cette prise
en charge s’applique à C. parvum par des techniques de microscopies confocales et électroniques.
Les attendus du projet, sont d’obtenir des connaissances génériques sur le contrôle de l’épithélium
intestinal en cas d’infection par des CD103+ CD8α+ tout en continuant d’illustrer les spécificités du
système immunitaire intestinal des nouveau-nés. Ce travail devrait aussi nous aider à mieux définir les
stratégies de stimulation du système immunitaire intestinal visant à favoriser la colonisation intestinale
précoce de la population de DC importante pour le contrôle de C. parvum.
Les techniques employées seront très variées faisant appel à de l’histologie, de la cytométrie, de la
biologie moléculaire (Q-RT-PCR, profiling arrays), de la Biologie cellulaire (Dosage Bio-
Plex/ELISA, culture in vitro, infection parasitaire) et de l’expérimentation animale sur modèle murin.
Biliographie : Edelson et al. J Exp Med. 2010 Apr 12;207(4):823-36 ; Fujimoto et al. J Immunol.
2011 Jun 1;186(11):6287-95 ; Mashayekhi et al. Immunity. 2011 August 26; 35(2): 249–259.
1
/
2
100%