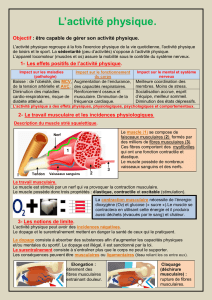
Mécanique musculaire

Mécanique musculaire
Chapitre 1 : Structure du muscle squelettique
Types de muscle:!
!- Lisse : Paroi des vaisseaux et des organes internes.
!- Cardiaque : Autocontrôle avec aide du SN et syst. endocrinien.
!- Squelettique : Contraction volontaire (objet du cours).
Rappels:
!
- Structure du muscle
!
!
!!Les fibres musculaires sont des cellules polynuclées.
!!Epimisyum, Endomysium, Périmysium sont des tissus conjonctifs
- Tissu conjonctif
!!Il est constitué de collagène (inextansible et résistant) et d’élastine (c’est elle
!!qui donne les propriétés élastique au muscle
!!
!!Trois fonctions principales:!
!!!1. Ancrage de la fibre muscu. en développement (donc donne la forme
!!!au muscle).
!!!2. Structure du périmysium permet le passage des vaisseaux
!!!sanguins et des connections nerveuses .
!!!3. Résister à l’étirement passif / distribuer les forces pour préserver la
!!!fibre musculaire.!
Mécanique Musculaire – Structure du muscle
5
Structure du muscle: vue globale
Muscle
Faisceau
Fibre (cellule) musculaire
Myofibrille
Sarcomère
Epimysium
Périmysium
Myosine
Actine
Noyau
Endomysium
Sarcolemme
18 septembre 2014
1

!!
Titre de la présentation
8
Périmysium
10 m 100 m
Delage, Annales de chirurgie plastique esthétique, 2012
Structure du muscle: tissu conjonctif
18 septembre 2014
!!Les trous permettent aux vaisseaux sanguins de passer.
-La fibre musculaire ou cellule musculaire
!!
Mécanique Musculaire – Structure du muscle
9
Fibre (cellule) musculaire
Coupe longitudinale Coupe transversale
18 septembre 2014
Le muscle squelettique:
- Quelques généralités
!!Il en existe plus de 600
!!Ils représentent 40% de la masse corporelle (plus grand organe du
!!corps humain).
!!Moteur interne, responsable des mouvements.
!!Doit croiser au moins deux articulations.
!!Relié par les tendons au squelette (attachement proximal = origine et
!!attachement distal = insertion).
!!Raccoucissement jusqu’à 70% de la longueur de repos.
!!Impliqués dans la production de chaleur
!!Le nombre de fibre dépend de la taille et de la fonction du muscle. On ne
!!peut pas prédire la force d'un muscle de part son poids et son nombre de
!!fibre. !Il y a des tendances mais pas de règle.
!!Ils sont souvent classifiés d’après l’arrangement des fibres qui le composent.
!!Les fibres d’un même faisceau sont parallèles, c’est l’arrangement des
!!faisceaux qui varie.
2

!!Il existe 5 catégories de muscles squlettiques :
!!1. Parallèle
!!2. Fusiforme
!!3. Penné
!!!Unipénnate : Faisceaux non parallèles à la direction de la force
!!!exercée.
!!!Bipénnate : Faisceaux des fibres vont dans des directions opposées.
!!!Multipénnte : Faisceaux capables d’aller dans toues les directions.
!!4. Convergent : Les faisceaux ont la même origine mais divergent ensuite.
!!5. Circulaire
!
!!On détermine le type de muscle par dissection, ultrasons ou IMR.
!- Détails des catégories de muscle
!!Avec muscles à fibres fusiformes, les muscles à fibres parallèles constituent
!!la majorité des muscles du corps humains. Leurs faisceaux sont arrangés le
!!long de la ligne d’action de la force musculaire.
!!1. Muscle à fibres parallèles
!!- Forme rectangulaire.
!!- Le racourcissement d’une fibre reflète le raccoucissement musclaire (car le
!!muscle est assez plat donc pas de question de volume qui entre en jeu ni de
!!direction différentes des fibres).
!!- Exemple : Rhomboïde, semi-tendineux.
!!2. Muscle à fibres fusiformes
!!
!!- Plus fins aux extrémités.
!!- Fibres en surface plus longues et plus incurvées que les fibres profondes
!!ce qui dénote des propriétés différentes des faisceaux).
!!- Pour les muscles longs, la longueur de la fibre est inférieur à la longueur du
!!faisceaux (soit parce que la fibre est légérement penné, soit parce que la
!!fibre est rattachée à une autre fibre par du tissu conjonctif pour aller jusqu’à
!!la fin du faisceau).
!!- Les différents faisceaux d’un même muscle peuvent avoir des propriétés
!!différentes dû notamment à leur orientation.
!!- Exemple : Biceps brachial, psoas.
!!3. Muscles pennés
- Penna = «plume» (entre 0° et 30°).
- Faisceaux attachés aux tendons avec un angle. Ce qui implique une
directions du raccourcissement des fibres qui n’est pas la même que le
mouvement des tendons. Le muscle se raccourci de toute façon de tendon
à tendon, mais avec un angle
- Les muscles pennés produisent plus de force de force que les autres
muscles (car plus de fibres musclaire pour une même longueur tendon à
tendon) mais on une moins grande capacité de raccouscissement.
3

- Ce sera surtout de gros muscles qui doivent produire de grosses forces.
- Exemple : Gluteus, vaste latéral, rectus femoris.
!!Avantage :
!!- Plus de fibres dans un même volume --> force totale produite peut être plus
!!importante.
!!Désavantage :
!!- Seule une composante de la force de la fibre contribue à la force muscu.
!!- FIbres plus courtes -> moins de sarcomères en séries --> racourcissement
!!max et vitesse max de raccourcissement plus faibles.
!!Comment calculer l’angle de pennation :
-Soit : Angle entre faisceaux de fibres musculaires superficielles
(superficielles car c’est celle que l’ont voit avec une écographie. Si on
descendait plus profond, l’angle serait différent) et la ligne d’action de la
force musculaire (partie externe du tendon).
- Soit : Angle entre faisceaux des fibres superficielles et l’aponévrose
(aponévrose = enveloppe du muscle, qui correspond plus ou moins à
l’épimysium).
- Important pour le calcul de la surface de section musclaire.
!!!
Mécanique Musculaire – Structure du muscle
17
•Angle de pennation (en général entre 0 et 30°)
Muscles pennés
Diversité des muscles squelettiques
18 septembre 2014
!!
!!4. Muscles à fibres convergents
- Large origine et zone d’insertion plus petite.
- Forme «triangulaire» («muscle triangulaire»).
- Principalement au niveau du tronc.
- Peuvent être considérés comme multipennés.
- Exemple : Pectoral, deltoïde.
!!!
!
!!5. Muscles circulaires
- Muscles orientés concentriquement autour d’une ouverture.
- Contration = réduction de l’ouverture.
Mécanique Musculaire – Structure du muscle
21
Diversité des muscles squelettiques
Muscles convergents
• Large origine et zone d’insertion plus petite
•Forme triangulaire (« muscles triangulaires »)
• Principalement au niveau du tronc
• Peuvent être considérés comme multipennés
• Ex: pectoral, deltoïde
18 septembre 2014
4

- Exemple : Orbicularis oris de la bouche
!- Longueur de la fibre VS longueur du faisceau
!1. Fibres qui vont du tendon d’origine au tendon d’insertion (lg fibres = lg !faisceaux
!--> deux jonctions myotendineuses) --> une plaque mortice au milieu de la fibre
!environ. C’est notamment le cas pour les muscles pénné. Lg fibres = lg faisceaux
!pas dans la longueur de raccourcissement mais dans la longueur myotendon
!myotendon. Car pour les muscles pennés, lg faisceaux < lg muscle.
!Exemple : Trapèze.
!2. Fibres qui s’arrêtent quelque part dans le faisceau --> insertions tendineuses qui
!tranmettent la force --> au moins deux plaques motrices pour le muscle (car le PA
!s'arrete au niveau de tendon).
!
!Fibres en séries (longueur du muscle 50 à 60 cm pour la sartorius alors que la
Mécanique Musculaire – Structure du muscle
20
Architecture musculaire – membre inférieur
Diversité des muscles squelettiques
18 septembre 2014
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
1
/
44
100%