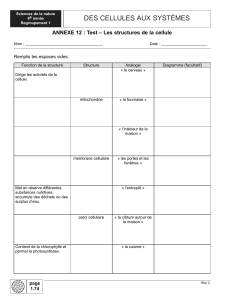
Etudes fonctionnelles sur modèles cellulaires

Études Fonctionnelles sur modèles cellulaires
I- Les techniques de fractionnement tissulaire et cellulaires
!
→ objectifs
Le problème est comment on va pouvoir séparer les cellules différentes. !
Un organe est constitué d'un ensemble de cellules différentes (ex : cœur, rein, vaisseau).
Ex : Dans un ventricule il y a pratiquement autant de cellules cardiaques que de
fibroblastes. Il va donc falloir séparer la cellule cardiaque du fibroblaste. 15 types de
cellules différentes pour le rein.
Sauf cas rares de cellules spontanément isolées, (immunologie, hématologie), les cellules
ne sont jamais isolée, il faut donc préalablement dissocier l'organe ou le tissu. Il faut
ensuite séparer les différents types cellulaires à partir d'un mélange cellulaire complexe.
On va essayer dʼavoir une suspension cellulaire, de différents types cellulaires, a ce
moment il y a donc un problème de dissociation.
Ex: le cœur. On a pas que des cellules cardiaques, on a aussi des fibroblastes..
On va utiliser les méthodes classiques de séparation d'un mélange de protéines, adaptées
à la survie des cellules et respectant l'intégrité des cellules en vue de leur éventuelle mise
en culture. L'intérêt est d'obtenir un seul type cellulaire en biologie, pharmacologie ou en
toxicologie.
Quelle différence y a t'il entre une protéine et une cellule ? (important)
Une protéine 10 000, 50 000 daltons (petit et simple) et une cellules c'est des milliers,
millions de cellules c'est beaucoup plus grand, la cellule est vivante, ainsi séparer 2
protéines, c'est beaucoup plus facile que de séparer deux cellules car on doit respecter
l'intégrité, la viabilité, la survie des cellules lors de la séparation.
Il y a une différences entre séparer des protéines et séparer des cellules. Une cellule est
fragile (maintenir lʼintégrité de la cellule) on va donc avoir des contraintes, à 45° et à pH
adapté a la cellule.
Les méthodes sur le principe sont les mêmes, mais les applications sont différentes,
l'adaptation est importante car il faut que les cellules soient préservées et continuent a
être vivantes.
Il faut des cellules dans un état parfait pour pouvoir les mettre en culture.
Intérêt pratique de la séparation des cellules. Domaine d'intérêt : la biochimie, la cytologie,
la culture cellulaire, l'hématologie.
Un organe est toujours composé de plus d'un type cellulaire, par exemple le coeur, une
artère, le rein etc …
Pour connaître la structure et/ou fonction d'un type cellulaire, il faut qu'elle soit isolée des
autres et qu'elle constitue une population cellulaire homogène purifiée.
Principe de la séparation cellulaire

!"#$%#!&'(&')*' +&!*"*,#-$' %&)).)*#"&'
! ! ! "#$%&#%$'!($)*+,"''!
! ! ! !!!!!!!!!-($)*+'.#,""%/!
!
! ! ! "%"0'+",(+!&'11%1*,$'!
!
! ! !!!!!"'0*$*#,(+!(%!#$,!&'11%1*,$'!
!
&'+#$,2%)*#,(+!!!!!!!!!!!!!!!! !!!!!!!!!!!!!!!!!!!!!!!!!!!! ! ! !
! ! ! !!!!!!!!!&3#(4'#$,'!'+!21%5!!
!!
! ! ! ! ! !!!!!!%1#$*6&'+#$,2%)*#,(+!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
&7$(4*#()$*07,'!
!!!!!!!!!͛&&/E/d!
!! ! !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
Techniques de fractionnement tissulaire, cellulaire et sub-cellulaire :
Ces techniques sont différentes suivant se que l'on veut faire et étudier.
- Les techniques douces (on a pas casser de membrane cellulaire) de fractionnement
(séparation des cellules d'un mélange), attaque enzymatique et/ou mécanique ménagée
(trypsine) préservent l'intégrité des cellules (cultures cellulaires)
- Les techniques plus brutales d'homogénéisation et de lyse cellulaire préservent l'intégrité
des organites sub-cellulaires (REG, noyau, mitochondries ...)
- Les techniques encore plus brutale d'homogénéisation, pour les dosages biochimiques
tissulaires. Disparition de la structure cellulaire ou sub-cellulaire d'origine. (par exemple
appareils a ultra sons qui vont casser la cellule). Pour des études biochimiques.
Parallèle entre la séparation de protéines et la séparation de cellules, certaines techniques
de séparations sont les mêmes : centrifugation, chromatographie, électrophorèse (:
séparation des protéines, cytoélectrophorèse : séparation des cellules).
Ces mêmes méthodes ont été adaptées a la séparation d'un mélange de cellules, en
essayant de préserver la structure initiale.
1- Sédimentation
Cʼest la méthode de fractionnement la plus simple, rapide et économique avec des
performances limitées. Elle utilise la gravitation universelle 1g.
Il faut pouvoir séparer des cellules de grande différence de taille ou de densité.
Lʼapplication, que vous connaissez tous, est la donnée biologique de base : NFVS
(Numération Formule- Vitesse Sédimentation (des hématies)). (laboratoire dʼanalyse)
2- La centrifugation cellulaire
Historique : augmenter g.
Formule de base et interprétation : La formule de la vitesse de déplacement V dʼune
particule (une cellule par exemple) nʼest pas a connaitre par coeur :
!"#$%&'()'(*+,'('-(./-'#0#'-+-."/(
(&1( 2345678( 98(71(:;<8==8(98(9>?71@858A<( B(
Ě͛ƵŶĞ(?14<;@678(C6A8(@877678(?14(8D85?78E(Ŷ͛ĞƐƚ!
"#$!%!&'((#)*+,!"#+!&',-+.!
( ( BF(94G9<F(1H(I(Cʌ?(ʹ(ʌ5E(I(ʘH(I(4(G(JKɻ(
JG(B(8=<(93A@("+'"'+*)'((,//,.!
( ( L(16(@144>(96(0)#12*+,!3#4(98(71(?14<;@678M(
( ( L(N(71(0)556+,(&,!0,!0,($)*6!98(71(?14<;@678(Cʌ?E(8<(
96(5;7;86(Cʌ5E(
( ( L(16(@144>(98(/#!7)*,$$,!#(8-/#)+,(96(43<34(CʘH(I(4(E(
HG(B(8=<(93A@()(7,+$,1,(*!"+'"'+*)'((,//,.!
( ( L(N(71(7)$&'$)*6!3ɻE(96(O419;8A<(98(98A=;<>(
(
Quels sont les paramètres qui vont déterminer la séparation des particules ?
- V est donc proportionnelle :
- au carré du diamètre (a) de la particule plus une particule est grosse, plus elle va au
fond.
- à la différence de densité de la particule (ρρ ) et du milieu (ρ m)

- au carré de la vitesse angulaire du rotor (ω².r) vitesse avec laquelle la centrifugeuse va
tourner.
Plus la particule est grosse, plus la différence de densité est grande entre la particule et le
milieu, plus la vitesse de séparation sera importante.
- V est donc inversement proportionnelle :
à la viscosité (eta) du gradient de densité
Plus la viscosité est importante, plus la particule sera retenue, se sera plus difficile a
séparer.
Les différents modes de centrifugation en gradient de densité discontinu ou continu :
Nous venons de voir que la séparation de deux particules (= par approximation, aux
cellules) dépend de deux paramètres majeurs : le diamètre et la densité cellulaire.
La séparation peut donc se faire grâce à la seule différence de densité cellulaire
(centrifugation isopycnique).
Ou la séparation peut se faire grâce à la différence de densité et de diamètre cellulaires
(velocity centrifugation)
Deux paramètres essentiels pour séparer les cellules : on utilise soit un paramètre soit les
deux paramètres.
3- L'ultracentrifugation différentielle
Définition : centrifugation à grande vitesse supérieure à 20.000g et pouvant atteindre
jusqu'à 100.000 à 200.000g
Principe : selon la taille et la densité, on peut séparer les sous-fractions cellulaires en en
faisant varier la vitesse de rotation et le temps de rotation.
Matériel : des ultra-centrifugeuses réfrigérées (échauffement avec la vitesse de rotation) à
basse température, de plus en plus rapides.
Résultats : c'est la méthode de référence pour séparer les organites sub-cellulaires
purifiés (noyaux, mitochondries, microsomes, ribosomes, etc … ).
=> Risque de contamination, marqueurs spécifiques.
Préparation des échantillons :
Voulant obtenir les sous-fractions cellulaires, il faut faire éclater les cellules. En règle
générale, on pratique un broyage mécanique des tissus, c'est l'homogénéisation des
tissus.
On peut aussi procéder, par lyse osmotique ou par vibration par ultrasons, en rompant les
membranes plasmiques cellulaires, tout en préservant les autres biomembranes des
organites.
Importance de l'ultracentrifugation différentielle en biologie cellulaire :
Couplée avec la microscopie électronique, l'ultracentrifugation a permis, dans les années
50 – 60, la découverte et la connaissance de la biochimie d'organites majeurs, comme les
lysosomes, les peroxysomes ou les ribosomes (on ne pouvait pas les voir avant que en
ME).
Obtention des sous – fractions cellulaires :
- Prélèvement et dissection d'un échantillon tissulaire (biopsie)
- Homogénéisation tissulaire par broyage mécanique
- Différentes centrifugations (1000, 10 000, 100 000)
- Centrifugation 1 (1000g) : noyaux et surnageant S1

- Centrifugation 2 (10.000g) : mitochondries et S2
- Centrifugation 3 (100.000g) : microsomes et S3
- Centrifugation 4 (10.000) reticulum et ribosomes. On reprend la fraction microsomes,
vésicules délimitées par une membranes qui sont des fractionnement du réticulum de
lʼappareil de Golgi. On ajoute un détergent pour décoller les ribosomes des membranes du
réticulum. Centrifugation.
Séparation de sous-fractions cellulaire par centrifugation :
!"#$%$&'()*+"*!(,!*-*.%$/&'()!*
/"00,0$'%"!*#$%*/")&%'.,1$&'()*
Biologie moléculaire de la cellule ± Lodish, 3ème édition
Empilement suivant la taille, la densité des molécules
Sous fraction nucléaire!!!!Sous fraction mitochondriale
!"#!$%$&'()*+",$,#)-.(+'.$
Biologie moléculaire de la cellule ± Lodish, 3èm e édition
!"#!$%$&'()*+",$-+*").",/'+(01$
Biologie moléculaire de la cellule ± Lodish, 3èm e édition
On ne peut pas assurer avoir 100% dʼun type cellulaire.
Si on a affaire a deux organites de tailles et de poids très différentes,
Si on a des organites de taille proche, en prenant une couche on va avoir une
contamination avec la couche du dessous.
On refait ensuite une centrifugation avec la couche qu'on a extrait et qui est un peu
contaminée. Après on est vraiment sure d'avoir 100% de l'organite que l'on veut.
Sous-fraction golgienne
!"#!$%$&'()*+",$-".-+/,,/$
Biologie moléculaire de la cellule ± Lodish, 3ème édition

Sous fraction microsomes dʼorigine de la fraction microsomes
!"#!$%$&'()*+",$-+)'"!"-.!$
"'+/+,.$0.$1($&'()*+",$-+)'"!"-.!$
Biologie moléculaire de la cellule ± Lodish, 3ème édition
Ce sont des vésicules délimitées par une membrane qui ne renferment par grand chose.
Fraction issue du REG, le détergent détache tous les ribosomes des membranes, on
centrifuge pour avoir la séparation.
4- La cyto-électrophorèse (electrophorése pour les cellules)
!!
a- Généralités sur l'électrophorèse et la cyto-électrophorèse
On peut séparer des protéines dans un champ électrique selon leur différence de charge :
c'est l'électrophorèse.
De même, on peut séparer des cellules dansun champ électrique selon leur différence de
charge, liée à leur surface cellulaire : c'est la cyto-électrophorèse.
En règle générale, les cellules sont électro-négatives (elles migrent vers le pole positif);
l'origine de cette électro-négativité est ?? Mais dans des conditions pathologiques,
l'électro-négativité diminue. Cette technique est particulièrement utilisée en immunologie.
b- Techniques d'électrophorèse dans l'espace
La séparation de deux particules est, sur terre, limité par la gravité. La séparation dans un
champ électrique s'accompagne d'un échauffement (effet Joule). Dommageable pour les
cellules.
Dans l'espace, en apesanteur, lors des vols Apollo et Soyouz, des expériences ont permis
de séparer des matériaux et des cellules 500 à 700 fois plus abondants et 4 à 5 fois plus
purs qu'à terre (ex : obtention de cellules neuro-endocrine, de neuromédiateurs).
5- Immunoselection cellulaire (chromatographie d'affinité cellulaire)
- Principe de la chromatographie d'affinité.
- Les phases non miscible ligand/matrice
- Séparation des cellules selon leur propriétés de surface membranaire
- Les différents ligands pour immuno-adsorber les cellules (anticorps, hormones, lectines)
- Applications
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
1
/
15
100%