Exercices Masse Volumique : Soufre, Or et Chlordécone
Telechargé par
promeneurlyndsay

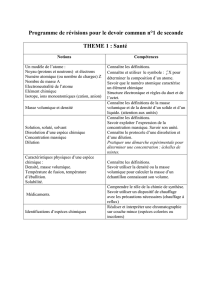
FICHE EXERCICES MASSE VOLUMIQUE
Exercice 1 : Le soufre de la Soufrière
Le soufre est présent dans les fumerolles de la Soufrière, en Guadeloupe. Il est
essentiel pour la synthèse des acides aminés soufrés qui entrent dans la
composition de la kératine, un constituant essentiel des cheveux et des ongles. On
utilise souvent le soufre en traitement pour les problèmes de peau et de cheveux.
Apprécié globalement pour ses propriétés antibactériennes, le soufre aide à traiter
plusieurs affections notamment respiratoires ! C’est la raison pour laquelle l’eau
soufrée (comme celle des bassins de bains jaunes situés à Saint-Claude) est
bénéfique pour les troubles respiratoires… et capillaires.
On prélève un bloc de soufre de m = 480 g et de volume V = 300 cm³.
1. Rappeler la formule de la masse volumique.
2. Calculer la masse volumique du soufre en g/cm³.
3. Comparer la valeur avec celle donnée dans le tableau (ρ(soufre) = 2,0 g/cm³).
La roche prélevée est-elle bien du soufre pur ?
Exercice 2 : L’or, un métal précieux
L’or est un métal durable qui conduit très bien l’électricité. En plus d’être utilisé
depuis l’Antiquité pour fabriquer bijoux, monnaies et objets décoratifs, il est employé
également. Sa densité très élevée explique pourquoi les objets en or semblent
“lourds” pour leur taille.
Un bijoutier fabrique une bague en or massif de masse m = 38,5 g.
On sait que la masse volumique de l’or est ρ = 19,3 g/cm³.
1. Calculer le volume de la bague en cm³.
2. Convertir ce volume en m³.
3. Rappeler l’unité de la masse volumique dans le S.I.
4. Exprimer la masse volumique en cette unité.

Exercice 3 : L’eau et le chlordécone
Le chlordécone est un pesticide utilisé autrefois dans certaines bananeraies,
notamment aux Antilles. Très toxique et persistant, il a contaminé durablement les
sols, l’eau et la chaîne alimentaire. Mesurer la masse volumique d’un échantillon
d’eau peut aider à détecter une pollution.
Un échantillon d’eau est analysé en laboratoire :
Volume : V = 250 mL
Masse totale mesurée : m = 252,5 g
1. Calculer la masse volumique de cet échantillon en g/mL.
2. Comparer avec celle de l’eau pure (ρ = 1,0 g/cm³).
3. Que peut-on conclure sur la présence éventuelle d’impuretés ou de pollution ?
1
/
2
100%