TRAVAUX DIRIGES DE CHIMIE ORGANIQUE GENERALE
Exercice 1
Pour effectuer l'analyse centésimale élémentaire d'un composé organique de
formule brute CxHyOz de masse molaire moléculaire M=46 g.mol-1, on prélève
un échantillon de 230 mg. On le chauffe en présence d'un excès d'oxyde de cuivre
de formule CuO. Dans ces conditions, on obtient du dioxyde de carbone, de l'eau
et du cuivre métallique. Une fois la transformation chimique terminée, on a obtenu
440 mg de dioxyde de carbone et 270 mg d'eau.
1. Ecrire l'équation de la réaction modélisant cette transformation chimique.
2. Quelle quantité de matière du composé organique contenait l'échantillon utilisé
?
3. Exprimer en fonction de x la quantité de matière de dioxyde de carbone et en
fonction de y la quantité de matière d'eau produite au cours de la transformation
chimique.
4. En déduire les valeurs de x, y et z ainsi que la formule brute du composé
organique étudié.
5. Déterminer les pourcentages en masse de chaque élément présent dans ce
composé.
On donne les masses molaires atomiques suivantes :
M(C)=12,0 g.mol-1 M(H)=1,0 g.mol-1 M(O)=16,0 g.mol-1
Exercice 2
Nommer les molécules suivantes selon la règle de nomenclature UICPA
ECOLE POLYTECHNIQUE DE
OUAGA
------------------------
Département des CPEI
………………………..
MPSI S2
ANNEE ACADEMIQUE 2024-2025
Enseignante : Dre OUEDRAOGO

Exercice 3
Représenter en formule topologique (zig-zag), les molécules suivantes :
1. 3,3,4-triméthylnona-1,6-diyne.
2. 3-tert-butyl-4-chlorohex-1-én-5-yne.
3. 3-sec-butylhept-5-én-1-yne
4. Oct-5-én-7-yn-2,4-dione.
5. 3-amino-7,7-dimethyloct-1-yn-4-ol
6. 3-éthoxy-4-éthylhexane
Exercice 4
Représenter les structures des composés suivants :
1. 4-(N-éthyl-N-méthylamino)hexan-1-ol.
2. 2-cyclohexylacétaldéhyde.
3. 7-hydroxy-4-phényloct-4-énal.

4. 3-butyl-4-chlorohexanedial.
5. Cyclopentane-1,3-dicarbaldéhyde.
6. 6-hydroxy-5-méthyloctane-2,4,7-tricarbaldéhyde
7. bicyclo[2.1.1]hexan-2,3-dione
8. 1-méthylbicyclo[4.2.0]oct-6-ène
9. 4-hydroxyspiro[2.5]octan-6-one
10. 3-bromo-1,7,7-triméthylbicyclo[2.2.1]heptan-2-one
Exercice 5
1-Déterminer les configuration absolues (R et S) des carbones asymétriques
dans les molécules suivantes
2- représenter les molécules e, f, g et h selon les projections de Newman et
Fischer
Exercice 6
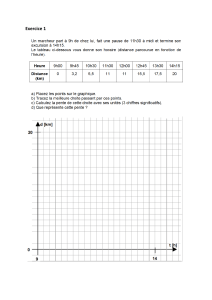
1
/
3
100%