Exercice1 :
On ajoute des morceaux d'aluminium métallique Al(s) au dibrome pur Br2
(l) liquide. Une réaction violente se produit. On constate la formation d'un
solide ionique blanc, le bromure d'aluminium: 𝑨𝒍𝟑++𝟑𝑩𝒓−.
1- Écrire les couples d'oxydoréduction intervenant dans cette réaction.
2- Écrire l'équation d'oxydoréduction qui a lieu entre Al et Br.
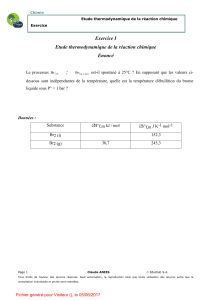
3- Calculer la masse maximale qui réagira avec 4mL de dibrome. On donne :
la densité du dibrome par rapport à l'eau d=3,1; La masse volumique de
l'eau ρeau = 1g/mL; les masses molaires de Br et Al ;M(Br)=79,9g/mol;
M(Al) = 27,0g/mol.
1
/
1
100%