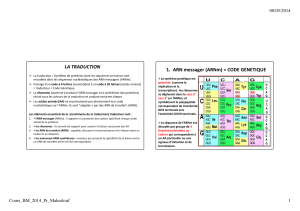
Biologie Moléculaire : Transcription et Machines Moléculaires
Telechargé par
Théo Damerval

3.01A Bruno Charpentier
1
Biologie moléculaire
Qui assure le déroulement des fonctions biologiques essentielles ?
Des machines moléculaires, ayant des complexités différentes dans les trois domaines du vivant :
(Bacteria, Archaea et Eucarya).
Formées par l’assemblage de nombreux constituants (les pièces) de nature protéique mais aussi
parfois d’acides ribonucléiques (ARN).
Les machines fondamentales ont été identifiées au cours des années 50-60. Elles permettent la
réplication, la transcription et la traduction, qui sont les fonctions fondamentales du dogme central
de la Biologie Moléculaire.
SCHEMA
Les machines essentielles mais aussi celles assurant des fonctions plus spécifiques :
D’autres machines, spécifiques d’un domaine du vivant, ont depuis été identifiées. Ces dernières
interviennent pour des mécanismes comme :
- L’épissage des pré-ARNm,
- La modification chimique de l’ADN, de l’ARN,
- La maturation de l’ARN, des protéines,
- L’interférence ARN(RNAi), etc.
Pour chacune, l’activité se déroule suivant le même principe dans tous les organismes, mais
évolution vers plus de complexité : machines bactériennes sont pratiquement toujours les moins
complexes.
Questions auxquelles tente de répondre le biologiste moléculaire :
- Quelle est la composition exacte de ces machines moléculaires ?
- Comment sont-elles assemblées dans les cellules ?
- Quel est le rôle précis de chaque constituant :
o Purement structural ?
o Directement impliqué dans leur activité ?
- Par quel mécanisme moléculaire fonctionnent-elles ? Peut-on identifier des étapes
réactionnelles intermédiaires ?
- Comment s’effectue la régulation de leur fonctionnement ? Beaucoup de pathologies sont
associées à des problèmes de dysfonctionnement de la régulation de ces machines
I) Après le réplisome, fonction d’une deuxième machine
fondamentale de biosynthèse des acides nucléiques : celle
assurant lors de la transcription, la synthèse d’ARN
A) Unités transcriptionnelles
Transcription : c’est une biosynthèse d’acides nucléique (ici ARN) qui repose :

3.01A Bruno Charpentier
2
- Sur la complémentarité des bases selon la loi des appariements Watson-Crick
- Sur une polymérisation s’effectuant de5’ vers 3’
- Sur la création de liaisons 3’->5’ phosphodiester entre les ribonucléotides tri-phosphate
(rNTP)
L’énergie nécessaire à la formation des
liaisons est fournie par les liaisons tri-
phosphate des nucléotide
Pour ADN seulement 3 règle changent :
liaison phosphodiester entre
désoxyribonucléotide
SCHEMAS
La brique élémentaire des polymères
d’acides nucléiques : le nucléotide !
B) ARN codants et non
codants
On distingue deux grandes familles de
polymérases :
- Les ADN polymérases :
o ADN dépendantes :
Réplication
o ARN dépendantes : Rétro-transcription ; télomérase
- Les ARN polymérases :
o ADN dépendantes : transcription
o ARN dépendantes : transcription ; réplication (virus à ARN)
Dans les types d’ARN produits dans les cellules par l’activité ARN polymérase, ondistingue 2 grandes
familles :
- Les ARN codant des protéines : ARN messagers (ARNm)
- Les ARN non codants (ARNnc) ou non messagers (ARNnm)

3.01A Bruno Charpentier
3
La part des génomes dédiée à l’epression des ARNnc VS ARNm :
C) ARN polymérase et régions promotrices
Les régions transcrites des génomes = unités
transcriptionnelles (UT)
Une UT en pleine activité : ici, polymérisations en cours de
transcrits précurseurs des ARNr, donnant l’apparence d’un
arbre de Noël

3.01A Bruno Charpentier
4
UT : régions des génomes permettant le déroulement d’évènements de transcription
- Initiation à un promoteur
- Elongation : biosynthèse ARN
- Terminaison à un terminateur
Il y a plrs types d’UT pouvant être rencontrés :
- Les UT permettant la production d’ARNm, portent des phases codantes traduites en
protéines : les ORF (Open Reading Frame)
o Cas des procaryotes,
o Cas des eucaryotes
- Les UT permettant la production des ARNnc
SCHEMA
Structure des ARN polymérases bactériennes, archées et eucaryotes
Des assemblages à plusieurs sous-unités de protéines, de plus en plus complexes au cours de
l’évolution
Structure des ARN polymérases bactériennes :
Chez les bactéries, une seule ARN polymérase pour toutes les UT.
Une forme apoenzyme (E) de 4 Sous Unités (α2 β et β’) portant l’activité ARN polymérase ADN
dépendante.
Un facteur protéique σ interagit avec l’apoenzyme et conduit à la formation d’une forme holoenzyme
E σ, seule capable d’initier la transcription au promoteur.
Plusieurs types de facteurs σ sont produits, conduisant à la formation de plusieurs types
d’holoenzymes. La spécificité de reconnaissance d’une famille de promoteurs est assurée par le
facteur σ
Structure des ARN polymérases des eucaryotes :
Chez les eucaryotes, 3ARN polymérases distinctes, chacune étant spécifique de la transcription d’un
type d’UT :

3.01A Bruno Charpentier
5
- ARN polymérase I
- ARN polymérase II
- ARN polymérase III
Formées par 4 sous-unités principales, rappelant les 4 SU bactériennes, plus 12 à 15 autres protéines.
In vivo, les trois formes d’ARN polymérases interagissent en plus avec de nombreux autres facteur sa
fin de pouvoir initier la transcription à un type de promoteur
Structure des ARN polymérases des archées :
Chez les archées, une seule ARN polymérase pour toutes les UT. Structure similaire à ARN
polymérase II des eucaryotes
Spécificité des ARN polymérases des eucaryotes :
ARN polymérase I : transcription dans le nucléole des ARNr 18S, 5.8S et 28S
ARN polymérase II : transcription dans le nucléoplasme de : tous les ARNm, 4 snRNA (U1, U2, U4 et
U5), snoRNA et scaRNA, miRNA
ARN polymérase III : transcription dans le nucléoplasme de : ARNt, ARNr 5S, snRNA U6, ARN 7S
Structure des promoteurs :
Alignement des séquences nucléotidiques connues pour être suffisantes à l’initiation de la
transcription : identification de la séquence consensus.
Principe de l’identification d’une séquence consensus : cas des promoteurs bactériens reconnus par
Eσ 70 => effectuer des alignements de séquences
SCHEMA
D) Etapes d’initiation, d’élongation et de terminaison
- Les grandes étapes du mécanisme d’initiation de la transcription
- Fixation spécifique de l’ARN polymérase sur un promoteur,
- Ouverture locale de l’ADN db: brin matrice disponible,
- Incorporation dans le site actif de l’ARN polymérase des premiers rNTP,
- Formation de la première liaison 3’->5’ phosphodiester,
- Départ de l’ARN polymérase du promoteur : passage de l’initiation à l’élongation de la
transcription
SCHEMA
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
1
/
21
100%