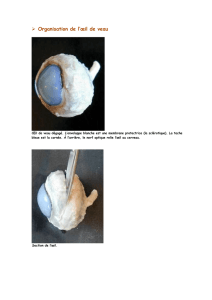
VII-3 : DYSFONCTIONNEMENTS VISUELS ASSOCIÉS - Lodel

Œil et Physiologie de la Vision - VII-3. 1ère partie
VII-3 : DYSFONCTIONNEMENTS VISUELS ASSOCIÉS À
QUELQUES MALADIES PÉDIATRIQUES MÉTABOLIQUES,
SYSTÉMIQUES et NEUROLOGIQUES. Apport du bilan
électrophysiologique
Première partie
Florence Rigaudière
Eliane Delouvrier
Pour citer ce document
Florence Rigaudière et Eliane Delouvrier, «VII-3 : DYSFONCTIONNEMENTS VISUELS
ASSOCIÉS À QUELQUES MALADIES PÉDIATRIQUES MÉTABOLIQUES, SYSTÉMIQUES et
NEUROLOGIQUES. Apport du bilan électrophysiologique», Oeil et physiologie de la vision
[En ligne], VII-Electrophysiologie pédiatrique, mis à jour le 18/06/2013, URL :
http://lodel.irevues.inist.fr/oeiletphysiologiedelavision/index.php?id=239,
doi:10.4267/oeiletphysiologiedelavision.239
Plan
Introduction
Erreurs du métabolisme énergétique
Déficits d’oxydation des acides gras (AG)
LCHAD-D : anomalie de la béta-oxydation des AG à longue chaîne avec rétinopathie
Déficit généralisé d’oxydation des AG sans rétinopathie
Commentaires : rétinopathie et déficits de l’oxydation des AG
Déficits de la chaîne respiratoire : cytopathies mitochondriales
A fond d’œil normal et oculomotricité normale
Commentaires sur les trois exemples à fond d’œil normal & oculomotricité normale
A fond d’œil normal et oculomotricité anormale
A fond d’œil anormal et oculomotricité normale
A fond d’œil anormal et oculomotricité anormale
Avec cataracte
Synthèse des huit cytopathies mitochondriales présentées
Commentaires sur les dysfonctionnements visuels des cytopathies mitochondriales présentées
Origines possibles des dysfonctionnements visuels au cours des cytopathies mitochondriales
Déficit indirect de la chaîne respiratoire mitochondriale : Ataxie de Friedreich
Signes cliniques généraux
Signes visuels
Evolution
Physiopathologie de l’ataxie de Friedreich
Traitements
Explorations sensorielles dans l’ataxie de Friedreich
Commentaires sur les dysfonctionnements visuels trouvés
Comparaison des dysfonctionnements visuels : cytopathies mitochondriales/ataxie de Friedreich
1

Œil et Physiologie de la Vision - VII-3. 1ère partie
Texte intégral
Collaboration : Anne Jacob & David Lebrun pour la prise en charge des enfants et
enregistrements des bilans.
Pour leurs suggestions, vifs remerciements au Dr Hélène Ogier de Baulny, service
Neurologie pédiatrique et des maladies métaboliques, hôpital Robert Debré, Paris et à
Pierre Rustin, INSERM U 676, hôpital Robert Debré, Paris.
Introduction
Les maladies métaboliques, systémiques et neurodégénératives sont pour un grand
nombre d’entre elles, à l’origine d’anomalies visuelles : troubles de transparence de la
cornée, ectopie cristalinienne ou cataracte, dysfonctionnements de la rétine et/ou des
voies visuelles [Fernandes J et al., 2006], [Lyon G, Evrard Ph, 2000], [Lyon G et al.,
2006], [Poll-The, Maillette de Buy Wenniger-Prick, 2011].
Alors que les signes visuels ne sont que rarement au premier plan, ces maladies doivent
faire l’objet d’un bilan ophtalmologique systématique, suivi d’un bilan
électrophysiologique. La découverte d’un dysfonctionnement visuel est un élément
important pour le diagnostic étiologique. L’évolution du dysfonctionnement visuel doit
être suivie afin que la prise en charge de l’enfant, souvent polyhandicapé, soit la mieux
adaptée possible.
Dans ce chapitre, nous présentons quelques exemples de dysfonctionnements visuels
dépistés ou suivis par électrophysiologie et associés à des maladies pédiatriques. Les
troubles oculomoteurs, lorsqu’ils sont présents, sont décrits succinctement mais leur
exploration ou leur résultat n’est pas détaillé.
Les cas présentés sont issus de notre collaboration régulière avec le service de
Neurologie pédiatrique et des maladies métaboliques de l’hôpital Robert Debré, Paris. En
aucun cas, ces exemples ne couvrent l’ensemble des dysfonctionnements visuels
rencontrés au cours des maladies pédiatriques.
Erreurs du métabolisme énergétique
L’énergie cellulaire est essentiellement d’origine mitochondriale. Elle est fournie sous
forme d’ATP par de nombreuses voies, l’oxydation des acides gras, l’oxydation de
l’acétyl-CoA dans le cycle de Krebs et la phosphorylation oxydative dans la chaîne
respiratoire (figure VII-3-1). Cette production d’énergie peut être déficiente, par exemple
par déficits d’oxydation des acides gras (partiels ou généralisés) ou par déficience du
fonctionnement d’un ou plusieurs éléments de la chaîne respiratoire mitochondriale dont
les manifestations multiples sont souvent regroupées sous le vocable de cytopathies
mitochondriales.
Atteintes visuelles et déficits d’oxydation des acides gras
Pour les atteintes visuelles et déficits d’oxydation des acides gras, nous présentons deux
exemples : °un sujet atteint de déficit de la béta-oxydation des acides gras par déficit en
Long Chain Hydroxyacyl-CoA Dehydrogenase (LCHAD) ou LCHAD-Deficiency (LCHAD-D)
et °un autre souffrant d’un déficit généralisé de l’oxydation des acides gras.
Atteintes visuelles et cytopathies mitochondriales
Pour les cytopathies mitochondriales, nous présenterons quelques exemples regroupés
autour de signes cliniques visuels. Enfin, nous exposerons quelques résultats
électrophysiologiques -dont certains sont originaux- trouvés au cours de déficits dit
« secondaires (ou indirects) de la chaîne respiratoire » ([De Lonlay P et al., 2001]) à
travers plusieurs cas d’ataxie de Friedreich.
2

Œil et Physiologie de la Vision - VII-3. 1ère partie
Déficits d’oxydation des acides gras (AG)
LCHAD-D : anomalie de la béta-oxydation des AG à longue chaîne
avec rétinopathie
Rappel sur les acides gras à longue chaîne et leur béta-
oxydation
Les acides gras à longue chaîne sont des acides carboxyliques stockés sous forme de
triglycérides, essentiellement dans le tissu adipeux, mais également dans le foie et dans
les muscles squelettiques. Ils ont un rôle énergétique majeur grâce à la béta-oxydation
catalysée par des enzymes mitochondriaux et sont, en aérobiose, source d’énergie dans
de nombreux tissus.
Entrée des acides gras dans la mitochondrie
Les acides gras à longue chaîne passent librement la membrane plasmique des cellules.
Dans le cytosol, ils sont activés en acyl-CoA par une synthétase. Les acyl-CoA ne pouvant
traverser la membrane mitochondriale, sont pris en charge par la navette carnitine. Le
groupement acyl est d’abord transféré de l’acyl-CoA sur la carnitine par une carnitine
palmityl transférase I (CPTI) située dans la membrane externe de la mitochondrie.
L’acyl-carnitine transite dans l’espace intermembranaire puis est transporté à travers la
membrane mitochondriale interne grâce à la carnitine acylcarnitine translocase (CACT). A
la face interne de la membrane interne de la mitochondrie, l’acyl-CoA est régénéré par la
carnitine palmityl-CoA transférase II (CPT II).
L’acyl-CoA est alors prêt à subir la béta-oxydation. Contrairement aux acyl-CoA à longue
chaîne, les acyl-CoA à moyenne et courte chaîne passent librement les membranes
mitochondriales.
La béta-oxydation permet la synthèse d’acétyl-CoA qui, de façon directe ou indirecte,
aboutit à la fourniture d’ATP mitochondrial (figure VII-3-1).
La béta-oxydation des AG à longue chaîne
Dans la matrice mitochondriale, les acyl-CoA sont progressivement dégradés en acétyl-
CoA par béta-oxydation. Ainsi un acyl-CoA à 20 atomes de carbone va-t-il générer 10
molécules d’acétyl-CoA. La production de chaque acétyl-CoA requiert l’intervention de
quatre enzymes qui agissent successivement [Stopek et al., 2008] : une acyl-CoA
déshydrogénase (1) puis une protéine trifonctionnelle qui catalyse les trois étapes
suivantes (2), (3), (4) [Uchida et al., 1992] (figure VII-3-2).
Cette protéine trifonctionnelle est composée de °quatre sous unités-alpha (HADHA) qui
abritent l’activité de l’énoyl-CoA hydratase (2) et de la 3-hydroxy-acyl-CoA
déshydrogénase (LCHAD) (3) et de °quatre sous unités-béta (HADHB) qui abritent
l’activité de la béta-cétothiolase (4) [Spiekerkoetter et al., 2003], [Zschocke J.,
Hoffmann GF., 2005].
L’acétyl-CoA qui en résulte, entre dans le cycle de Krebs. A l’état de jeûne, la béta-
oxydation hépatique génère des acétyl-CoA qui intègrent la synthèse des corps
cétoniques. Ces derniers sont déversés dans la circulation, captés par les tissus capables
de les oxyder en acétyl-CoA qui vont rejoindre le cycle de Krebs et la chaîne respiratoire
de ces tissus.
3

Œil et Physiologie de la Vision - VII-3. 1ère partie
En parallèle avec la synthèse d’acétyl-CoA, chaque tour d’oxydation produit une molécule
de FADH2 et une molécule NADH (essentiellement par le cycle de Krebs). L’électron du
NADH intègre la chaîne respiratoire au niveau du complexe I. Celui du FADH2 est
transporté par l’ETF (Electron-Transfer Flavoprotein) et l’ETF-DF (Electron-Transfer
Flavoprotein DeHydrogenase) jusqu’au coenzyme Q10 de la chaîne respiratoire (figure
VII-3-1) [Stopek, et al., 2008], [Zschocke J., Hoffmann GF., 2005].
L’oxydation mitochondriale des acides gras est en permanence source d’énergie pour de
nombreux organes en particulier le myocarde et les muscles squelettiques, mais aussi le
foie, le tissu adipeux. C’est l’une des sources principales d’énergie durant les états
catabolitiques, le jeûne, les exercices musculaires prolongés, la chirurgie, les infections
[Zschocke J., Hoffmann GF., 2005] (figure VII-3-3).
Déficits d’oxydation des acides gras
Dans la plupart des déficits de l’oxydation des acides gras, des intermédiaires de l’acyl-
CoA s’accumulent et sont trans-estérifiés sur la carnitine aboutissant à l’accumulation
d’acylcarnitines anormales. Les anomalies des acylcarnitines peuvent être analysées par
spectrométrie de masse. Selon le site du déficit, les profils des acylcarnitines sont
différents ce qui permet d’orienter le diagnostic [Morris, Spiekerkoetter, 2012].
Le déficit en LCHAD entraîne l’accumulation dans le plasma de 3-hydroxy acides gras à longue chaîne (OHFAs)
et, après estérification, de 3-hydroxyacylcarnitines (OHACs) [Fletcher et al., 2012].
Déficit en LCHAD ou LCHAD-D
Le déficit enzymatique de la 3ième étape de la béta-oxydation (LCHAD Deficiency) (figure
VII-3-4) est le plus fréquent des déficits congénitaux de la béta-oxydation des acides
gras à longue chaîne [Tyni, Pihko, 1999]. Il est cependant rare (1/200.000) [Fletcher, et
al., 2012], de transmission autosomique récessive [den Boer et al., 2002] et
fréquemment lié à une mutation G1528C [IJlst et al., 1996] dans le gène HADHA
[Fletcher, et al., 2012].
Manifestations générales du LCHAD-D
L’erreur de la béta-oxydation par déficit en LCHAD entraîne des manifestations variables
mais précoces dans la période néonatale ou durant l’enfance : coma hypoglycémique
hypocétosique avec hépatomégalie, acidose lactique, rhadomyolyse, myocardiopathie
souvent induits par une période de jeûne ou un état de stress catabolique intercurrent
tels ceux provoqués par une infection aussi banale puisse-t-elle être [Treem et al.,
1991], [Hayes et al., 2007] (figure VII-3-3).
Les mères d’enfants atteints peuvent avoir présenté des complications durant la
grossesse : stéatose ou un HELLP syndrome : Hémolyse, cytolyse hépatique (Elevated
Liver enzyme), thrombopénie (Low Platelet count).
La pierre angulaire du traitement est la prévention du jeûne et un régime pauvre en
graisses, enrichi en acides gras à chaîne moyenne. Malgré ce traitement, deux
complications notables sont reconnues. 5 à 10% des patients développent une
neuropathie périphérique et, environ 50%, une rétinopathie [Spiekerkoetter, 2010].
4

Œil et Physiologie de la Vision - VII-3. 1ère partie
Rétinopathie du LCHAD-D
Elle a été initialement décrite en 1989 et classée en quatre stades en 1998 [Tyni et al.,
1998a]. Stade 1 : fond d’œil hypopigmenté et fonctionnement normal des neurorétines ;
stade 2 : dépôt de pigments en zone maculaire avec dysfonctionnement des
neurorétines, mais acuité visuelle conservée ; stade 3 : disparition de la pigmentation
maculaire remplacée par une pâleur maculaire et une atrophie de la choriocapillaire,
apparition de pigments en périphérie, dysfonctionnement majeur des neurorétines avec
ERG pouvant être non discernable : à ce stade, les patients peuvent décrire une
héméralopie associée à une dyschromatopsie ; enfin, stade 4 : perte des photorécepteurs
et des vaisseaux de la choriocapillaire au pôle postérieur et perte de la vision centrale.
L’évolution se fait lentement vers une atrophie rétinienne avec, à long terme, une
diminution sévère de l’acuité visuelle [Hayes, et al., 2007].
Mécanismes possibles de la rétinopathie du LCHAD-D
Ils ne sont pas encore élucidés avec certitude. La rétinopathie affecte précocement
l'épithélium pigmentaire puis la choriocapillaire [Tyni et al., 1998b], [Tyni et al., 2002],
[Tyni et al., 2004], [Stopek, et al., 2008].
Déficience de l'épithélium pigmentaire
L’épithélium pigmentaire possède de très nombreuses mitochondries avec une activité de
béta-oxydation intense [Tyni, et al., 2002]. La déficience de l'épithélium pigmentaire
pourrait être due à l’accumulation d’acylcarnitines anormales (et toxiques ?) induisant
alors la mort des cellules de l'épithélium pigmentaire. Le retentissement sur les
photorécepteurs serait secondaire [Tyni, et al., 2004], [Roomets et al., 2008].
Gillingham et coll [Gillingham et al., 2005], Flechter et coll [Fletcher, et al., 2012]
observent une corrélation clinique entre l’évolution de la rétinopathie et le taux de 3-
hydroxyacylcarnitines dans le plasma de leurs patients, confortant ainsi l’hypothèse de la
toxicité des 3-hydroxyacylcarnitines sur la rétine. Cependant, Flechter et coll. soulignent
qu’aucune étude toxicologique directe n’a été publiée prouvant que les 3-hydroxy acides
à longue chaîne et les 3-hydroxyacylcarnitines sont spécifiquement toxiques pour les
cellules rétiniennes…
Après analyses histologiques d’épithéliums de patients atteints de LCHAD-D, Fletcher et
coll [Fletcher, et al., 2012] suggèrent que la mort des cellules de l'épithélium pigmentaire
résulterait de l’activité intense de nombreux macrophages trouvés dans l'épithélium
pigmentaire atteint, avec effet secondaire sur les photorécepteurs, plutôt que d’un effet
toxique.
Déficience des photorécepteurs
D’autres facteurs semblent participer à la survenue et l’évolution de la rétinopathie du
LCHAD-D comme le déficit énergétique important par manque d’ATP [Stopek, et al.,
2008]. Ce facteur pourrait expliquer la dissociation entre le dysfonctionnement du
système des cônes plus précoce que celui des bâtonnets, comme cela est illustré par
l’exemple que nous présentons et commentons ci-dessous.
Traitement
Il associe une supplémentation en triglycérides à chaîne moyenne et des précautions
diététiques : éviter le jeûne, une alimentation pauvre en acide gras à longue chaîne
[Jones et al., 2003]. Il lui est souvent associé une supplémentation en acide
docosahexaénoïque (DHA) qui est le principal constituant des membranes des
photorécepteurs et des cellules de l’épithélium pigmentaire [Tyni, et al., 2004]. Le DHA
améliore l’état général et ralentirait voire stabiliserait l’évolution de la rétinopathie
[Gillingham, et al., 2005], [Sturm, 2008], [Fletcher, et al., 2012].
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
1
/
58
100%