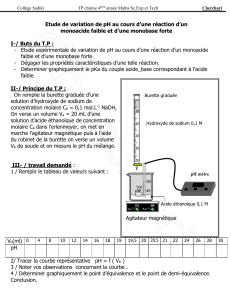
1
Calculs de masse à masse
Soyez logique!
Mettre en place la scène sous l'équation : Masse (en texte), Masse molaire, Moles
Placez les données dans la 'scène' ; les masses sont données en texte;
Calulez la masse molaire à partir des masses atomiques
Ensuite, faites les calculs : vers le bas, en travers et vers le haut
Étape 1 - Vers le bas - Trouvez le nombre de moles de l'espèce pour laquelle vous avez la masse
Étape 2 - À travers - Utilisez l'équation pour trouver les taupes de l'espèce sur laquelle vous êtes
interrogé.
Étape 3 - Vers le haut - Trouvez la masse de l'espèce sur laquelle vous êtes interrogé.
Exemple : Calculer la masse de HCl formée à partir de 6 g d'hydrogène
H2 + Cl2 _ _ 2HCl
Masse
RMM
grains
de
beauté
Etape 1 : Moles H 2 = 6 2.0 = 3 (masse masse molaire)
Étape 2 : Moles HCl = 3 x 2 (de l'équation) = 6
Étape 3 : Masse HCl = 6 x masse molaire = 6 x 36,5 = 219 g (moles x masse molaire)
CHECKPOINT ( auto-évaluation )
1) Quelle masse de sulfate de baryum serait produite à partir de 10,0 g de chlorure de baryum
dans la réaction suivante ?
BaCl 2 ( aq ) + H 2 SO 4 ( aq ) → BaSO 4 (s) + 2HCl ( aq )
2) Quelle masse de chlorure de potassium serait produite à partir de 20 g de carbonate de
potassium ?
K 2 CO 3 + 2 HCl → 2 KCl + CO 2 + H 2 O
3) Quelle masse d'éthanol faudrait-il faire réagir ensemble pour donner 1 g d'éthanoate d'éthyle ?
Quelle masse d'acide éthanoïque faudrait-il faire réagir ensemble pour donner 1 g d'éthanoate
d'éthyle ?
C 2 H 5 OH + CH 3 COOH → CH 3 COOC 2 H 5 + H 2 O
4) Quelle masse d'oxyde de fer( III) faudrait-il réduire pour produire 100 tonnes de fer dans un
haut fourneau ?
2 Fe 2 O 3 + 3 C 4 Fe + 3 CO 2
5) Quelle masse de nitrate d'argent en solution dans l'eau faudrait-il ajouter à 5 g de chlorure de
sodium pour assurer une précipitation complète du chlorure ?
AgNO 3 ( aq ) + NaCl ( aq ) → AgCl (s) + NaNO3( aq )
6) Une solution de sulfate de cuivre réagit avec une solution d'hydroxyde de sodium pour produire
un précipité d'hydroxyde de cuivre selon l'équation suivante :
(a) Quelle masse d'hydroxyde de sodium serait nécessaire pour convertir 15,95 g de sulfate de
cuivre en hydroxyde de cuivre et (b) quelle masse d'hydroxyde de cuivre serait produite ?
CuSO 4 ( aq ) + 2NaOH( aq ) → Cu( OH) 2 (s) + Na 2 SO 4 ( aq )

2
Réponses
1 11,2 grammes
2 21,6 g
3 0,682 g d'acide éthanoïque et 0,523 g d'éthanol
4 143 tonnes
5 14,5 g
6 8,0 g d'hydroxyde de sodium, 9,75 g d'hydroxyde de cuivre
1
/
2
100%