TP : Oxydation du fer
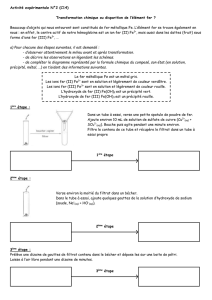
1ère expérience!
Étape 1 : FeSO4 + eau distillée!
Le sulfate ferreux est dissous dans l’eau.!
Équation de dissolution : FeSO4(aq)→Fe2+
+SO42-. La solution obtenue par dissolution
est couleur jaune trouble.!
Étape 2 : ajout d’hydroxyde de sodium!
La solution forme un précipité vert. Le
précipité vert indique la présence d’ions fer II
(Fe2+). En effet les ions Fe2+ réagissent avec
les ions hydroxyde selon la réaction Fe2+ +
2HO-→Fe(HO)2.#
2ème expérience FeSO4 + H2O2 + NaOH
Équation de dissolution de FeSO4 : FeSO4(aq)→Fe2++SO42-.!
Après ajout d’hydroxyde de sodium (Na++HO-), la solution forme
un précipité couleur rouille. Ce précipité indique la présence d’ions
Fer III (Fe3+). En effet les ions Fer III réagissent avec les ions
hydroxyde HO- présents dans la solution d’hydroxyde de sodium
pour formé un précipité de Fe(OH)3. La réaction est Fe3++3OH-→
Fe(OH)3!
On constate que les ions Fer II présents à la première expérience ont réagis pour former des ions
Fer III. Ces deux espèces chimiques forment un couple oxydant-réducteur : Fe3+(aq)/Fe2+(aq).!
La demi équation de ce couple s’écrit : Fe3+ + e- = Fe2+!
Lors de la deuxième expérience, de l’eau oxygénée à été ajoutée. !

Le deuxième couple mis en jeu est : O2(aq)/H2O(l). Le dioxygène provient de l’eau oxygénée
(dismutation).!
La demi équation est : O2+4H++4e- = 2H2O!
L’équation finale de la réaction est : O2+4H++4Fe2+ 2H2O + 4Fe3+!
Question 2 : On constate d’après le document 5, que le fer et l’oxygène réagissent ensemble pour
former de l’oxyde ferrique, ce qui a contribué à donner naissance aux fer rubanés (des roches
siliceuses). On en déduit ainsi que le dioxygène produit par les cyanobactéries des
stromatholithes dans les océans a réagit avec le fer apportés par les continents.!
Bilan : On sait que le dioxygène est apparu sur Terre avec les cyanobactéries des stromatholithes.
En effet, leur métabolisme suit la photosynthèse et capte donc du dioxyde de carbone pour
former du dioxygène. Cependant nous venons de voir que le dioxygène produit par les
cyanobactéries entre -3,8 et -2Ga a en fait précipité avec les ions Fer III en formant de l’oxyde
ferrique Fe2O3. D’après le graphique la teneur atmosphérique en dioxygène a augmenté lorsque le
nombre de gisements de fer rubanés a diminué il y a deux millions d’années.
1
/
2
100%