Thèse : Évolution des prématurés après opération du canal artériel
Telechargé par
Souhdou Ky

Université - Picardie
Unité de Formation et de Recherche de Médecine d'Amiens
THESE
Numéro 2015 - 130
Pour le
DIPLOME DE DOCTEUR EN MEDECINE
QUALIFICATION PEDIATRIE
Par
Claire BRETAGNE
Présentée et soutenue publiquement le 29 septembre 2015
ANALYSE DE DES PREMATURES APRES
OPERATION DU CANAL ARTERIEL : COHORTE RECENTE
2010-2014
Président du jury : Pr Philippe MERVIEL
Membres du Jury :
Pr Denis CHATELAIN
Pr Jean-Marc CONSTANS
Pr Jérôme AUSSEIL
Dr Lucie RAZAFIMANANTSOA
Dr Jannick RICARD
Directeur de thèse : Dr Guy KONGOLO

2
SOMMAIRE
ABBREVIATIONS3
INTRODUCTION6
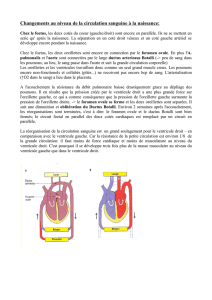
I- Le Canal Artériel8
A. Embryologie-Histologie8
B. Physiologie.9
1) Période anténatale.9
2) Période néonatale11
C. Causes de la persistance du canal artériel13
D. Conséquences de la persistance du canal artériel14
1) Complications circu14
2) Complications pulmonaires et 15
3) Complications
4) Complications 16
5) Complications 16
II- Evaluation de la sévérité du shunt ductal17
A. Critères cliniques17
B. Diagnostic échographique et évaluation des critères de sévérité.18
1) Evaluation directe du shunt ductal18
2) Evaluation indirecte du shunt ductal18
C. Nouveaux marqueurs20
D. Modalités exploratoires futures20
III- Prise en charge du canal artériel en pratique dans notre hôpital22
A. Mesures générales22
B. Traitement spécifique du canal artériel22
C. Traitement chirurgical23
1) Indication du traitement chirurgical23
2) Complications associées à la chirurgie du canal artériel23
OBJECTIFS.24

3
PATIENTS ET METHODES25
I- Population étudiée25
II- Paramètres étudiés27
III- Analyses statistiques29
RESULTATS30
DISCUSSION42
CONCLUSIONS48
ANNEXES49
BIBLIOGRAPHIE54
REMERCIEMENTS60

4
ABBREVIATIONS
AMM Autorisation de Mise sur le Marché
AMPc Adénosine-Mono Phosphate Cyclique
APG Artère Pulmonaire Gauche
APGAR Score
ATP Adénosine--Triphosphate
Ao Aorte
BNP Brain natriuretic peptide
CA Canal artériel
CGR Concentré de globule rouge
CHU Centre hospitalier universitaire
CPA Concentré plasmatique
DCS Density Cerebral Spectroscopy
DS Dérivation standard
ECG Electro-encéphalogramme
EEG Electro-encéphalogramme
ECUN Entérocolite Ulcéro-Nécrosante
EPO Erythropoïétine
ETF Echographie trans-fontanellaire
FIV Fécondation in vitro
GMPc Guanidyl-monophosphate cyclique
HAS Haute autorité de santé
HIV Hémorragie intra ventriculaire
IMF Infection materno-
Interféron Gamma
IR Index de résistance
IRM Imagerie par résonance magnétique
IV Intraveineux
LVO Left ventricular output
MAP Menace prématuré

5
NFS Numération formule sanguine
NIRS Near infrared spectroscopy
PAP Pression artérielle pulmonaire
PaO2 Pression partielle en oxygène dans le sang artériel
PaCO2 Pression partielle en gaz carbonique dans le sang artériel
PC-IRM Imagerie par résonance magnétique en produit de contraste
PFC Plasma Frais Congelé
PGE2 Prostaglandine E2
NO Monoxyde
O2 Oxygène
OD Oreillette droite
OG Oreillette gauche
PPR Pointes positives rolandiques
RCIU Retard de croissance intra-utérin
SA Semaine
SIMF Suspicion materno-
SVC Superior vena cava
TGF Transforming Growth Factor Beta
TNF Tumor Necrosis Factor Alpha
VEGF Vascular Endothelial Growth Factor
2D 2 Dimensions
Mots Clés : Canal artériel, prématurité, cure chirurgicale, bronchodysplasie pulmonaire,
hémorragie intra-ventriculaire, entérocolite ulcéro-nécrosante, insuffisance rénale, hémorragie
pulmonaire.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
1
/
62
100%