TP n°2 : Isolement de la microflore tellurique - Master Microbiologie Appliquée
Telechargé par
wouroud Abdeslam

Université d’Alger 1 Ben Youcef ben khedda
Spécialité : microbiologie appliqué
Niveau :master 1
Module: Interaction Microbienne et Socio-Microbiologie
Chargé Td du Module :Mme Guentri
TP n°2 : Isolement de la microflore tellurique
Réalisée par:
•Ahmed chaouch yasmine
•Abdeslam zine el wouroud
•Belhouane ahlem
•Benbelkheir manelGroupe :1

Introduction
•Le sol, où cohabitent , les racines ,les végétaux, les animaux et les microorganismes, est
la première ressource pour la vie de la planète , pour la production alimentaire, support
des activités humaines, source de minerais et de matériaux de construction, système
épurateur, réserve d’eau…
•À une échelle microscopique, le sol constitue un environnement où interagissent
directement ou indirectement de nombreux microorganismes telluriques, entre eux mais
aussi avec les composantes abiotiques du sol (matière organique, matrice minérale, etc.)
et avec les racines des plantes (au niveau de la rhizosphère)
La transformation du sol
facteurs
physico-
chimiques
structure texture matière
organique
facteurs
biotiques
potentialités
intrinsèques
relations trophiques entre
les espèces animales,
fongiques et procaryotiques

•Isoler et dénombrer des microorganismes qui se trouvent
dans un échantillon de sol par la méthode des dilutions tout
en maintenant le plan de travail aseptique.
Objectif

pourquoi faire
l’isolement des
microorganismes
du sol ?
Comment faire ce
isolement ?
déterminer le genre et l’espèce du
microorganisme vivant dans le sol
Connaître sa physiologie et son écologie
ainsi que son rôle utile souvent et nuisible
quelque fois
Trouver des applications à ces
microorganismes
Trouver des substrats qui stimulent la
croissance du microorganisme recherché tout en
limitant ou en supprimant le développement de
ses concurrents
.
La réussite d’un isolement dépend de:
l’efficacité de la méthode employée
la qualité de l’échantillonnage
la manière dont les échantillons sont conservés et traités

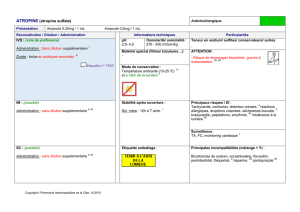
Les prélèvements à partir du sol sont faits à la tarière, à la
spatule ou à la pelle bêche désinfectées à l’alcool éthylique
pour éviter les contaminations entre échantillons, ces derniers
recueillis dans des sacs en plastique et sécher a T°modérée
après conserver dans un endroit frais ( 4-6 °C)
Prélèvement et échantillonnage
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
1
/
14
100%