Université de Mons 1
Analyse titrimétrique
(réactions de titrage)
Exercices Chimie physique
Analyse chimique quantitative basée sur la détermination du volume d’une
solution de concentration connue avec précision (solution titrante) qui est
nécessaire pour réagir complètement avec un volume donné d’une solution
de substance à analyser (solution titrée)
Connaissant l’équation chimique de la réaction => calcul du nombre de moles
(masse) de la substance titrée

Université de Mons 2
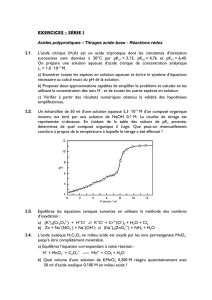
Exercices Chimie physique
En pratique :
Solution titrante
((C connue avec précision)
Solution titrée
(V prélevé avec précision)
Conditions :
➢Réaction complète
➢Réaction rapide
➢Point d’équivalence observable

Université de Mons 3
Exercices Chimie physique
Deux types de titrage :
➢Direct : les composés A et B sont en quantité stœchiométrique
A l’équivalence :
↔

Université de Mons 4
Exercices Chimie physique
➢En retour :
1) le composé B est en excès par rapport à A
2) l’excès de B est titré par un composé C
nBest le nombre de moles qui a réagi avec A cad :
le nb de moles initial de B –le nb de moles en excès de B: niBnexB
l’excès de B étant déterminé grâce au titrage par le composé C :
=
=

Université de Mons 5
Août 2013
Un mélange de KOH et de KCl, de masse totale 3 grammes est dissous dans 100 mL d’une solution aqueuse de sulfate
d’hydrogène 0,1 M. Le mélange final, basique, est titré par 25 mL d’une solution d’acide chlorhydrique 0,4 M. Quelles
sont les masses de KOH et KCl dans le mélange ?
Décembre 2019
L’acide citrique est un triacide organique de la forme R(COOH)3particulièrement abondant dans le citron. Afin de
connaitre la quantité d’acide citrique contenu dans un jus de citron, on dilue 10 mL de jus de citron fraichement
pressé jusqu’à 100 mL par addition d’eau et on titre 10 mL de cette solution diluée par une solution aqueuse de soude
9.10-2 M. Le volume de soude à l’équivalence est 13,5 mL. Quelle est la masse d’acide citrique contenue dans un litre
de jus de citron fraichement pressé (la masse molaire de l’acide citrique est 192 g.mol-1 ) ?
 6
6
 7
7
1
/
7
100%