Hydraulique souterraine Mme TAKORABT.M
1
CHAPITRE V : CHIMIE DES EAUX SOUTERRAINES
Généralités
a- L'hydrochimie est la science qui étudie les processus chimiques affectant la distribution et
la circulation des composés chimiques des eaux. Elle est essentiellement basée sur la chimie
mais aussi de la biologie et de la géologie. L'hydrochimie inclut l’ensemble des techniques et
protocoles d'échantillonnage des eaux, la détermination des fonds géochimiques naturels d’un
milieu, l'étude de la pollution des milieux aquatiques… Elle permet de définir la « qualité
d’une eau ». Elle étudie donc les interactions entre l’eau et le sol ou le sous-sol. Ce terme est
approprié pour décrire la chimie des eaux continentales (dont les eaux souterraines).
b- La géochimie est la science qui applique les principes de la chimie à l'explication des
processus géologiques, passés et présents, qui affectent les enveloppes terrestres internes
(noyau, manteau, croûtes) et externes (océans, atmosphère, biosphère).
c- Géochimie de l’eau
La composition géochimique de l’eau souterraine est influencée en grande partie par la
dissolution de certains minéraux présents dans les matériaux géologiques. Plus le temps de
résidence de l’eau dans un aquifère est long, plus l’eau souterraine sera minéralisée, c’est-à-
dire qu’elle contiendra des quantités plus importantes en minéraux dissous. Les conditions de
confinement des aquifères influencent la géochimie de l’eau souterraine :• Nappe libre : eau
récente, peu minéralisée, typique d’une eau météorique ;• Nappe semi-captive : eau
intermédiaire ;• Nappe captive : eau ancienne, fortement minéralisée parfois
saumâtre.(RQES,2015)
1. Minéralisation des eaux souterraines
Tout au long de son cycle, l’eau est soumise à des processus successifs qui modifient sa
composition chimique et affecte ainsi sa qualité. Les processus hydrogéochimiques sont
généralement contrôlés ou influencés par différents facteurs tels que la dissolution de certains
minéraux présents dans les roches et dans les sols, l’infiltration et l’écoulement de l’eau dans
l’aquifère, les interactions entre les minéraux dissous et avec la matière organique, et la
salinisation des eaux lorsque l'eau souterraine est en contact prolongé avec des argiles
d'origine marine. Plus le temps de résidence de l’eau dans un aquifère est long et plus elle
atteint des couches profondes, plus elle sera chargée en minéraux dissous. Selon les processus
auxquels elle est soumise, l’eau souterraine acquiert ainsi une signature géochimique
particulière en fonction du milieu où elle se trouve et de ceux qu’elle a traversés le long de
son parcours. Ces signatures permettent de retracer l’origine des eaux souterraines, l’histoire
de leurs interactions et leur âge.

Hydraulique souterraine Mme TAKORABT.M
2
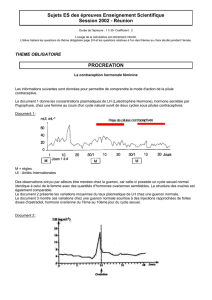
Fig. 1: Évolution géochimique des eaux souterraines
1.1. Origine de la minéralisation des eaux souterraines
L'eau de pluie est légèrement acide du fait de sa teneur en CO2 dissous :
CO2 dissous + H2O H2CO3 (acide carbonique, acide faible)
Au cours de son l’infiltration, du fait d’un contact avec terrains géologiques en présence, l’eau
se charge en divers éléments qui vont influer sur sa qualité. Certains de ces éléments sont
naturellement présents dans le sol, ils vont définir la qualité « naturelle » de l'eau brute.
Ainsi l'eau à l'état naturel peut contenir :
- des matières organiques,
- des matières dissoutes provenant des terrains traversés (ions majeurs et éléments traces)
- des particules en suspension.
D'autres éléments sont d'origine anthropique.
1.2. Mécanismes de bas
a- Dissociation ionique
Lorsqu’un sel est dissout dans l’eau, il va se dissocier en ions électropositif ou cations, ou
électronégatif (anions). En règle générale, on considère que dans les eaux souterraines tous les
sels se présentent sous forme ionique.
b- Réactions de dissolution
Opération ayant pour effet de modifier la cohésion des molécules des corps solides par
immersion dans un liquide séparation des parties du corps solide et mise en solution.
c- Précipitation
Réaction par laquelle un corps en solution se sépare de son solvant pour former un précipité
solide.

Hydraulique souterraine Mme TAKORABT.M
3
d- Réactions d’oxydo-réduction
Réaction chimique au cours de laquelle se produit un échange d'électrons. L’espèce chimique
qui capte les électrons est appelée « oxydant » ; celle qui les cède, « réducteur ».
e- Réactions d’échanges d’ions
Remplacement stœchiométrique des ions sur une surface de charge fixe par des ions de la
solution.
1.3. Paramètres influençant la chimie de l’eau souterraine
➢ La température du milieu (plus la T° augmente et plus la solubilité cinétique augmente
aussi);
➢ La pression (si la pression partielle en en CO2 augmente, la dissolution diminue);
➢ La nature des roches traversées (minéraux rencontrés au cours de l'infiltration) et
notamment celui de la roche mère;
➢ La surface de contact : l’existence d’une porosité élevée favorise les échanges (surface de
contact plus grande entre la roche et l’eau);
➢ Le temps de contact de l'eau avec le réservoir (les eaux anciennes sont souvent très
minéralisées);
➢ La vitesse d’écoulement de l'eau dans le sous-sol;
➢ Le temps de renouvellement de l'eau de la nappe.
1.4. La composition de l’eau
a- Éléments majeurs (ions majeurs)
- Cations : calcium (Ca++), magnésium (Mg++), sodium (Na+), potassium (K+)
- Anions : carbonates (HCO3-, CO3- -), chlorures (Cl -), sulfates (SO4- 2), nitrates (NO3-).
b- Eléments traces
Contrairement aux éléments majeurs, les éléments traces sont peu abondants dans la croute
terrestre. Certains éléments traces sont indispensables au déroulement des processus
biologiques : ils sont alors nommés "oligoéléments".
L'expression "métaux lourds" est aussi souvent employée, néanmoins certains éléments traces
ne sont pas des métaux (arsenic, sélénium).
1.5. Origine des éléments majeurs
- Ca :
Cation le plus abondant dans les eaux continentales. Présent dans tous les types de lithologie,
mais prédomine dans les aquifères carbonatés (calcaires et craies). Concentration centaine

Hydraulique souterraine Mme TAKORABT.M
4
de mg/l. Le calcium est également très abondant dans les aquifères gypsifères. Concentration
centaines de mg/L voir > 1 g/l.
- Mg :
Libéré par interaction avec des roches ignées (minéraux ferromagnésiens comme l’olivine, le
pyroxène, l’amphibole, et les micas noirs), roches d’altération (chlorite, serpentine),
carbonates (dizaines de mg/l voir plus), évaporites (centaines de mg/l à quelques g/l).
Comportement très similaire au Ca.
- Na :
Principalement présent dans les roches ignées (feldspaths…) Roches sédimentaires :
évaporites. Concentration dans les eaux naturelles très variable : de < 1 mg/l dans certaines
eaux de pluie à > 100 000 mg/l dans des saumures.
- K :
Principalement présent dans les roches ignées et dans les argiles (orthose, micas,
feldspathoïdes), certains dépôts évaporitiques très solubles comme la potasse [KCl].
Abondant mais peu concentré dans les eaux naturelles (difficulté de mobilisation de l’ion K+).
Dans les eaux souterraines, généralement < 10 mg/l.
- Sources anthropiques : sels de route, saumures riches en alcalins et alcalino-terreux
(résidus de mines de sel), indirectement : intrusions marines dues à une surexploitation de la
nappe (surtout Na, Cl)
- C :
Atmosphère et atmosphère du sol : dissolution du CO2 et interaction avec les carbonates
produisant de l’acide carbonique (H2CO3)
Le CO2 profond : dans des régions tectoniquement actives, des flux important de CO2
profonds donnent lieu à des eaux très riches en carbone inorganique (concentrations en
HCO3- jusqu' ’à 10 000 mg/l).
Aquifères carbonatés : l'acide carbonique réagit avec les carbonates (calcite, dolomie…) qui
se dissolvent (50% du C inorganique provient du CO2 du sol, 50% de la roche).
Aquifères silicatés : l'acide carbonique réagit avec les silicates. Des échanges de cations et la
dissolution de feldspaths donnent lieu à des eaux de faciès Na+HCO3- (bicarbonaté sodique)
- Dans une gamme de pH de 6,4 à 10,3 les bicarbonates (HCO3-) sont l'espèce carbonatée
prédominante.
- SO4 :
Aquifères contenant des évaporites : dissolution de gypse, anhydrite, (Mg- K-sulfates). Les
concentrations peuvent atteindre quelques g/l.
Aquifères cristallins ou sédimentaires contenant des sulfures (pyrite, arsénopyrite, marcassite,
etc.). L'oxydation et dissolution de sulfures produit des sulfates. Concentrations dans ce
contexte : quelques mg/l à quelques dizaines de mg/l.

Hydraulique souterraine Mme TAKORABT.M
5
Saumures marines conservées dans les aquifères sédimentaires ou cristallines profondes
Aérosols marins proche de la côte.
Lorsque le milieu est réducteur (nappe captive), le soufre est également représenté par ses
formes réduites (H2S, HS-). La teneur en sulfates est donc intimement liée aux propriétés
redox du milieu.
Sources anthropiques : pollution atmosphérique par des Sox (oxydes de soufre) H2SO4,
drainage minier.
- NO3 :
Pas de source dans la matrice des aquifères.
Sources naturelles : pluies, activité biologique, azote dans les sols. A l'état naturel, les
concentrations en nitrate dans les eaux souterraines sont faibles (quelques mg/l au maximum).
Saumures marines conservées dans les aquifères sédimentaires ou cristallines profondes.
Importance des réactions d'oxydo-réduction qui conduit à une oxydation des espèces réduites
(nitrification d'ammonium) ou une réduction des espèces oxydées (dénitrification).
Sources anthropiques nombreuses et essentiellement liées au lessivage des engrais, et aux
rejets domestiques et industriels, à la pollution de l'air.
On admet généralement qu'une teneur supérieure à 10 mg/l traduit un apport anthropique.
Equivalent chimique : par définition, l’équivalent chimique d’un est égal au rapport de la
masse atomique de cet élément sur sa valence :
Exemple :
,
=39,
,
,
- Quantité en réaction, elles expriment le nombre d’équivalent chimique de chaqu’un de ces
éléments entrant en combinaison. Pour obtenir ce nombre on divise le poids de l’élément par
son équivalent chimique. Les quantités en réaction sont désignés depuis les travaux de Stabler
par la lettre r placé devant le symbole des éléments chimiques rNa, rSO4, rMg.
,
,
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
1
/
11
100%