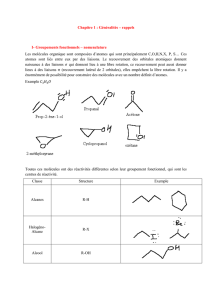
Mol
Molé
écules et g
cules et gé
éom
omé
étrie
trie
Molécules et géométrie

La g
La gé
éom
omé
étrie mol
trie molé
éculaire
culaire
C’est le domaine de la stéréochimie
Comment décrire la géométrie des molécules? Au moyen de :
Distances de liaison. {R}
Angles de valence. {α}
Angles de torsion. {φ}
O O
R
ROO
OO
La géométrie moléculaire

La g
La gé
éom
omé
étrie mol
trie molé
éculaire
culaire
C’est le domaine de la stéréochimie
Comment décrire la géométrie des molécules? Au moyen de :
H
O O
R
ROO
OO
R
ROH
OH α
αOOH
OOH
Distances de liaison. {R}
Angles de valence. {α}
Angles de torsion. {φ}
La géométrie moléculaire

Distances de liaison. {R}
Angles de valence. {α}
Angles de torsion. {φ}
La g
La gé
éom
omé
étrie mol
trie molé
éculaire
culaire
C’est le domaine de la stéréochimie
Comment décrire la géométrie des molécules? Au moyen de :
O
H
O
R
ROO
OO
R
ROH
OH α
αOOH
OOH
R
ROH
OH
α
αOOH
OOH
H
φ
La géométrie moléculaire

Le mod
Le modè
èle de la r
le de la ré
épulsion des paires
pulsion des paires
Les paires d
Les paires d’é
’électrons se distribuent autour des noyaux
lectrons se distribuent autour des noyaux «!
«!porteurs
porteurs!»
!»
A
A
et d
et dé
éterminent la g
terminent la gé
éom
omé
étrie mol
trie molé
éculaire.
culaire.
Ces paires se repoussent et m
Ces paires se repoussent et mè
ènent au mod
nent au modè
èle de r
le de ré
épulsion des
pulsion des
paires.
paires.
2 paires s
2 paires s’
’alignent sur la sph
alignent sur la sphè
ère
re
Cons
Consé
équence: Mol
quence: Molé
écules lin
cules liné
éaires
airesAX
AX2
2
∠
∠ 180
180°
°
Exemple:
Exemple: Be
BeCl
Cl2
2
(Octet non respect
(Octet non respecté
é)
)
Cl Be Cl
Répulsion des paires (2 paires)
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
1
/
43
100%