Université d’Oran 1, Faculté de Médecine, Service d’Histologie-Embryologie
Travaux Dirigés de Cytologie des Etudiants en Première Année de Médecine
Melle BENSAADA, Mr MEDDAH
Année universitaire : 2016-2017
1
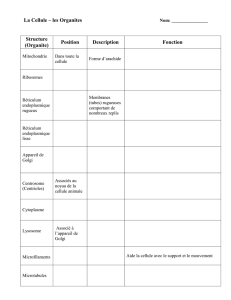
1. Réticulum endoplasmique :
le RE est un système de la membrane qui s’étend à
travers tout le cytoplasme. Ces membrane sont en continuité avec la membrane nucléaire et
délimitent un espace important à l’intérieur de la cellule. Le réticulum endoplasmique est
impliqué dans la synthèse et le transport des protéines membranaires et des lipides. Il participe
aussi à la signalisation cellulaire via les lipides à inositol du feuillet interne de la membrane
plasmique. Dans les cellules musculaires, le réticulum endoplasmique est appelé réticulum
sarcoplasmique.
Les ribosomes libres flottent librement dans le cytoplasme. Iles fabriquent les protéines
solubles dont l’activité se déroulera dans le cytosol ou dans certains organistes, comme celles
qui sont importés dans les mitochondries.
Les points qui s’alignent dans le prolongement du réticulum endoplasmique rugueux
(RER, REG) représentent les ribosomes, formation où se déroule la synthèse des protéines
destinées aux membranes cellulaires et aux lysosomes ou devant sortir de la cellule.
Les protéines membranaires néo synthétisées
restent associées à la membrane des RER et les
protéines qui doivent être secrétées s’accumulent dans la lumière de l’organite.
Le réticulum endoplasmique lisse (REL), abondant dans les hépatocytes, ne contient pas
de ribosomes et est habituellement situé près de dépôts de glycogène et de lipides
intracytoplasmiques. Le REL est un lieu de synthèse des hormones stéroïdes dans les cellules
endocrines des gonades et du cortex surrénale, la synthèse des acides gras et des
phospholipides. Il joue un rôle important dans les réactions de détoxification nécessaires à la
transformation des substances nocives liposolubles ou insolubles dans l’eau en composés
hydrosolubles plus adaptés à une élimination rénale. Et enfin la séquestration des ions calcium
dans le cytoplasme des cellules des muscles lisses et cardiaques. La libération contrôlée du
Ca
2+
par le REL déclenche la contraction.
TD n°5 : Le Système endomembranaire

Université d’Oran 1, Faculté de Médecine, Service d’Histologie-Embryologie
Travaux Dirigés de Cytologie des Etudiants en Première Année de Médecine
Melle BENSAADA, Mr MEDDAH
Année universitaire : 2016-2017
2
Représentation schématique du réticulum endoplasmique rugueux et de réticulum
endoplasmique lisse
Représentation schématique de l’appareil de Golgi

Université d’Oran 1, Faculté de Médecine, Service d’Histologie-Embryologie
Travaux Dirigés de Cytologie des Etudiants en Première Année de Médecine
Melle BENSAADA, Mr MEDDAH
Année universitaire : 2016-2017
3
2. Appareil de Golgi
: L’appareil de Golgi est un système de sacs membranaires
aplatis (dictyosomes) impliqué dans la modification et la préparation impliqué dans la
modification et la préparation des matériels de sécrétion. Bien que l’appareil de Golgi soit une
extension du réticulum endoplasmique, il n’est pas en continuité directe avec lui. En fait de
petites vésicules (appelés vésicules de transport) se détachent du réticulum endoplasmique et
migrent vers l’appareil de Golgi, avec lequel elles fusionnent. L’appareil de Golgi lui-même
donne naissance à des vésicules de sécrétion spécifiques qui migrent vers la membrane
plasmique.
La face de l’appareil Golgi située près du réticulum endoplasmique est appelée face cis.
Du coté opposé on trouve la face trans ou face de sortie, appelée réseau trans- golgien,
donnant naissance à des vésicules qui quittent l’empilement sacculaire pour des destinations
variées. Un compartiment intermédiaire de saccules sépare les compartiments cis et trans.
Les différences fonctionnelles entre les compartiments cis, médian et trans de l’appareil de
Golgi se caractérisent par la présence de glycosyltransférases spécifiques dans chacun des
trois compartiments, les glycosyltransférases sont des enzymes qui transfèrent des sucres vers
les portions terminales des chaînes oligosaccharidiques des glycoprotéines et des glycolipides.
En résumé l’appareil de Golgi est un centre de triage et d’affinage des produits du
réticulum endoplasmique, avant leur sécrétion vers d’autres compartiments cellulaires.
La glycosylation d'une protéine est l'ensemble des phénomènes qui assurent la
transformation d'une protéine en une glycoprotéine.
N-glycosylation dans le réticulum endoplasmique
La N-glycosylation débute par le branchement en-bloc d’un groupement riche en
mannoses sur les résidus d’asparagine (Asn) présents dans les séquences
spécifiques Asn-X-sérine ou thréonine.

Université d’Oran 1, Faculté de Médecine, Service d’Histologie-Embryologie
Travaux Dirigés de Cytologie des Etudiants en Première Année de Médecine
Melle BENSAADA, Mr MEDDAH
Année universitaire : 2016-2017
4
Figure : N- glycosylation
La N-glycosylation s'effectue en deux étapes. Dans un premier temps, une chaine ramifiée
de quelques oses est ajoutée cotraductionnellement sur la protéine à modifier via
l'établissement d'une liaison covalente entre un hydroxyl (-OH) d'un N-acétylglucosamine
situé à une extrémité de la chaine glucidique et l'amide (-CO-NH
2
) de la chaine latérale d'un
résidu asparagine appartenant à la protéine. La liaison ainsi formée est une liaison dite N-
glycosidique, d'où le nom de N-glycosylation. La réaction établissant cette liaison covalente
est contrôlée par une enzyme, une glycosyltransférase qui est localisée dans la lumière du
reticulum endoplasmique. En effet, l'arbre glucidique est initialement porté par un dolichol,
un lipide spécifiquement présent à la face interne de la membrane du reticulum
endoplasmique. Il est alors transféré par la glycosyl-transférase sur la chaîne polypeptidique
en cours de synthèse. Les ribosomes, responsables de la biosynthèse des protéines, se trouvant

Université d’Oran 1, Faculté de Médecine, Service d’Histologie-Embryologie
Travaux Dirigés de Cytologie des Etudiants en Première Année de Médecine
Melle BENSAADA, Mr MEDDAH
Année universitaire : 2016-2017
5
dans le cytoplasme, cela suppose que la chaîne polypeptidique a traversé la membrane du
réticulum endoplasmique pour être accessible à l'enzyme. C'est pourquoi la N-glycosylation
ne concerne que les protéines membranaires ou secrétées qui ont en commun de devoir
franchir cette membrane, au moins pour une partie de la protéine.
La chaîne glucidique initialement greffée est composée de 14 oses au total. Cet arbre
glucidique initial est ensuite remanié lors du passage de la protéine par l'appareil de Golgi.
Les modifications se font séquentiellement dans les compartiments successifs de l'appareil de
Golgi (cis, médian, trans, et enfin réseau trans-golgien).
La O-glycosylation :
Il s'agit de la fixation de sucres sur le groupement OH des chaines latérales de certaines
sérines et thréonines (O-glycosylation). Elle concerne le domaine luminal des protéines
transmembranaires et les protéines solubles dans le Golgi. Elle a lieu dans les compartiments
médian et trans de l’appareil de Golgi : i) les sucres sont synthétisés dans le cytosol et
pénètrent dans le Golgi par une perméase spécifique ; ii) ils sont accrochés aux protéines par
une O-glycosyl-protéine transférase.
L'appareil de Golgi participe en particulier à la synthèse des protéoglycannes. Un
protéoglycanne est formé d’une chaîne protéique sur laquelle est (sont) fixé(s) un ou plusieurs
glycosaminoglycanne(s). Les glycosaminoglycannes sont des chaînes linéaires sucrées
constituées d'unités disaccharidiques répétitives fixées à la protéine par O-glycosylation d'un
résidu sérine ; ils se forment par addition successive de résidus glucidiques. Dans le
compartiment trans, les résidus sucrés des glycosaminoglycannes sont abondamment sulfatés.
De nombreux protéoglycannes sont sécrétés dans le milieu extracellulaire où ils sont des
composants de la matrice extracellulaire. D'autres restent fixés à la face externe de la
membrane plasmique.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%