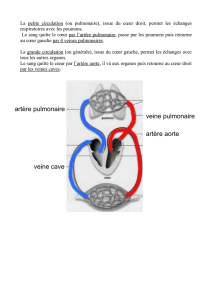
Encyclopédie Médico-Chirurgicale 43-008 43-008 Substituts vasculaires N Chakfé F Dieval F Thaveau S Rinckenbach O Hassani G Camelot B Durand JG Kretz Résumé. – Avec leur introduction dans les années 1950, les substituts vasculaires ont inauguré la chirurgie vasculaire moderne. De nombreux concepts ont été proposés par les fabricants avec des succès variables. À l’heure actuelle, la greffe veineuse autologue reste le substitut vasculaire de choix pour les revascularisations des artères de petit calibre. Les substituts vasculaires synthétiques sont principalement construits à partir de deux biomatériaux : le polytétrafluoroéthylène sous forme microporeuse et le polyéthylène téréphtalate sous forme textile. Les substituts synthétiques sont performants pour les revascularisations des artères de moyen et gros calibres, mais offrent encore des résultats médiocres pour les revascularisations des artères de petit calibre. Il est important de connaître les différents concepts de substituts vasculaires et leurs évolutions pour permettre un choix optimal en pratique clinique. © 2003 Editions Scientifiques et Médicales Elsevier SAS. Tous droits réservés. Mots-clés : prothèses vasculaires, chirurgie vasculaire. Introduction La première utilisation d’un substitut artériel en chirurgie vasculaire réalisée en 1951 par Oudot consistait en l’implantation d’une allogreffe artérielle chez l’homme [115]. En 1952, Voorhees et al [158] ont réalisé le premier pontage vasculaire synthétique en implantant une prothèse textile poreuse. Ces premières étapes inaugurèrent la chirurgie vasculaire moderne, basée sur la technique du pontage. De très nombreux substituts vasculaires ont été ensuite développés à partir des années 1950 pour répondre aux besoins des chirurgiens, principalement pour le traitement des pathologies athéromateuses occlusives et anévrismales. Ces substituts ont utilisé des matériaux et des concepts divers, avec des fortunes diverses. En effet, le substitut vasculaire idéal devait répondre simultanément à trois impératifs : une faible thrombogénicité, une bonne cicatrisation et une bonne stabilité à long terme. En 1991, Parodi et al [116] proposaient un nouveau type de substitut vasculaire pour le traitement des lésions anévrismales de l’aorte abdominale sousrénale. Ce substitut, appelé endoprothèse, avait pour but d’exclure les anévrismes par voie endovasculaire en réalisant un endopontage. Malgré les développements technologiques permanents dont sont l’objet les prothèses et endoprothèses, ces substituts vasculaires n’offrent pas encore toujours des performances cliniques idéales dans certaines applications. Nous proposons dans le présent article Nabil Chakfé : Professeur des Universités, faculté de médecine, Strasbourg. Florence Dieval : Maître de conférences, Université de Haute-Alsace, Mulhouse. Fabien Thaveau : Interne, faculté de médecine, Strasbourg. Simon Rinckenbach : Chef de clinique, faculté de médecine, Strasbourg. Othman Hassani : Praticien hospitalier, faculté de médecine, Strasbourg. Gabriel Camelot : Professeur des Universités, faculté de médecine, Besançon. Bernard Durand : Professeur des Universités, Université de Haute-Alsace, Mulhouse. Jean-Georges Kretz : Professeur des Universités, faculté de médecine, Strasbourg. Groupe européen de recherche sur les prothèses appliquées à la chirurgie vasculaire, service de chirurgie vasculaire, Hôpitaux universitaires de Strasbourg et Faculté des sciences et techniques, Université de HauteAlsace, Mulhouse, Hôpital civil, 1, place de l’Hôpital, BP 426, 67091 Strasbourg cedex, France. de décrire les différents types de prothèses vasculaires qui ont été ou qui sont encore actuellement disponibles sur le marché en analysant leurs performances, et d’en préciser les principales indications. Substituts vasculaires SUBSTITUTS BIOLOGIQUES Deux types de substituts biologiques peuvent être distingués selon qu’ils aient été l’objet d’un traitement ou non : les substituts biologiques vrais et les substituts biologiques traités. ¶ Substituts biologiques vrais Il s’agit de matériel vivant et viable qui n’a subi aucun traitement susceptible de le rendre inerte. Ces substituts incluent les autogreffes artérielles ou veineuses et les homogreffes. Autogreffe veineuse L’autogreffe veineuse a été utilisée par Kunlin dès 1949 [90] pour réaliser le premier pontage en veine saphène autologue. À l’heure actuelle, ce substitut est toujours le meilleur substitut pour la réalisation des pontages sur les artères de petit calibre. La veine grande saphène est la veine la plus utilisée, que ce soit sous la forme d’un greffon inversé ou d’un greffon in situ. Le greffon inversé est prélevé dans le tissu sous-cutané après ligature et section de toutes ses branches collatérales. Avant d’être anastomosé, il est inversé pour supprimer le jeu des valvules. Ce greffon peut être ainsi utilisé dans une multiplicité de sites d’implantation. À l’inverse, le greffon veineux saphène in situ est laissé en place dans le tissu sous-cutané sans être disséqué sur l’ensemble de son trajet. La crosse de la grande veine saphène est disséquée et sectionnée au ras de la veine fémorale, puis anastomosée sur une des artères du trépied fémoral. Toute référence à cet article doit porter la mention : Chakfé N, Dieval F, Thaveau F, Rinckenbach S, Hassani O, Camelot G, Durand B et Kretz JG. Substituts vasculaires. Encycl Méd Chir (Editions Scientifiques et Médicales Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales - Chirurgie vasculaire, 43-008, 2003, 12 p. 43-008 Substituts vasculaires Son extrémité distale est ensuite disséquée et libérée des tissus environnants pour pouvoir être anastomosée sur l’artère receveuse en distalité. Le jeu des valvules doit alors obligatoirement être supprimé par l’utilisation d’un instrument spécifique qui va sectionner toutes les valvules par voie endoveineuse : le valvulotome. Le greffon veineux in situ ne peut donc être utilisé que pour la réalisation de pontages fémoropoplités ou fémorojambiers, mais a pour avantage d’offrir une meilleure congruence de calibre, ainsi qu’une meilleure trophicité pariétale par le respect des adhérences tissulaires périveineuses. La supériorité du greffon veineux autologue sur les autres matériaux est principalement attribuée à sa surface luminale endothélialisée. Les échecs de ces greffons peuvent être secondaires au développement d’une sténose hyperplasique au niveau d’une anastomose ou du corps sur des zones traumatisées par les clamps ou le dévalvuleur. La technique de prélèvement des greffons veineux doit être la plus atraumatique possible pour réduire le risque d’ischémie pariétale et de souffrance endothéliale [ 1 2 6 ] . Les thromboses plus tardives sont le plus souvent secondaires à la progression de la maladie athéromateuse sur le greffon ou sur le réseau artériel d’aval. La dégénérescence anévrismale des greffes veineuses autologues est très rare en l’absence de lésion athéromateuse [148] . Ces dilatations sembleraient survenir plus fréquemment lorsque le greffon veineux est utilisé en tant que patch d’angioplastie [145]. Les greffons veineux utilisés pour la réalisation de pontages aortorénaux présenteraient des dilatations précoces et importantes dans près d’un tiers des cas [143], avec une fréquence accrue chez l’enfant [144] . Les veines du membre supérieur ne semblent pas présenter de tendance plus marquée à la dilatation malgré leurs parois plus fines [7, 151]. Des anévrismes athéroscléreux sont décrits sur les greffons veineux autologues après de longues périodes d’implantation, avec une incidence comprise entre 1 et 12,5 % à 10 ans [5, 42, 45, 148, 156]. L’utilisation des veines fémoropoplitées autologues a été proposée, à la fois en chirurgie de revascularisation et en chirurgie des infections de pontage avec des résultats superposables à ceux de la veine saphène interne [137]. Autogreffe artérielle L’autogreffe artérielle constitue théoriquement le substitut artériel idéal du fait de ses capacités de cicatrisation et de ses caractéristiques mécaniques [169]. Cependant, son utilisation est limitée par le nombre réduit des sites de prélèvement. Ses principales indications sont la reconstruction des artères rénales pour hypertension rénovasculaire et pour anévrismes périphériques, et plus exceptionnellement les reconstructions artérielles en milieu infecté. Homogreffe veineuse L’homogreffe veineuse a été utilisée comme voie d’abord pour hémodialyse [73], pour la réalisation de pontages fémoropoplités [139] et aortocoronariens [13] avec des résultats variables. Les résultats en termes de perméabilité ont été décevants dans certaines séries de pontages sous-inguinaux [41, 161]. Ces taux de perméabilité pourraient être améliorés par la mise en œuvre de protocoles thérapeutiques associant une anticoagulation au long cours et des traitements antiagrégants plaquettaires [18]. Leur principale complication à distance est leur manque de stabilité structurelle. En effet, l’homogreffe veineuse est le plus souvent obtenue lors d’un stripping pour cure de varices ou, plus rarement, lors d’un prélèvement sur un cadavre. La veine étant ainsi souvent le siège d’une pathologie variqueuse au moment du prélèvement, celle-ci évolue fréquemment vers la dilatation anévrismale. L’incidence des anévrismes développés sur les homogreffes veineuses varie entre 5,2 et 12 % [41, 97] et a pu atteindre un maximum de 58 % à 5 ans dans une série [155]. Homogreffe artérielle L’homogreffe artérielle a été développée au début des années 1950. Elle a permis la première implantation en position aortique [115] et a suscité de nombreux travaux sur ses méthodes de conservation 2 Techniques chirurgicales . Elle a été abandonnée après l’introduction des premières prothèses textiles synthétiques et la constatation de leur évolution quasi constante vers la dégradation à long terme [149, 150]. Leur détérioration est probablement secondaire aux phénomènes de rejet chronique survenant après leur implantation et aux techniques de conservation qui sont encore vraisemblablement perfectibles. À l’heure actuelle, la technique de conservation utilisée est la cryopréservation [62], car elle permet notamment de respecter un délai de quarantaine protégeant le receveur d’une éventuelle infection virale. Le suivi régulier des homogreffes artérielles est encore indispensable pour dépister les complications dégénératives, comme en témoignent les premiers cas de dilatations anévrismales rapportés, certains dès 22 mois d’implantation [10]. À l’inverse, cette dégénérescence ne semble pas être un phénomène obligatoire puisqu’un cas d’homogreffe artérielle fonctionnelle après 40 ans d’implantation a été décrit [70]. À l’heure actuelle, leur principale indication est le traitement des infections de prothèse avec rétablissement immédiat de la continuité vasculaire in situ [10] et les revascularisations distales pour sauvetage de membre en l’absence de matériel autologue disponible [4]. [52, 98] ¶ Substituts biologiques traités Il s’agit de conduits sanguins traités pour garantir leur inertie sur le plan biologique et qui ne sont donc pas viables. Il s’agit de bioprothèses. Hétérogreffe bovine Ce substitut a d’abord été préparé à partir d’artères carotides de bœuf et de veau selon une méthode décrite par Rosenberg et al [130] (fig 1). L’artère était traitée à la ficine, puis le squelette de collagène était réticulé. Des méthodes de préparation associant des traitements tels que la réticulation au glutaraldéhyde et l’addition de charges de surface ont été proposées pour prévenir les faiblesses structurelles de ces substituts qui généraient des dilatations [103, 134]. Pour la réalisation de pontages sous-inguinaux, leurs performances cliniques semblent se situer entre celles des prothèses en polytétrafluoroéthylène expansé (ePTFE) et celles des veines autologues inversées [78] . Leur utilisation pour la réalisation de fistules d’hémodialyse n’a pas été non plus convaincante [75] . L’artère mammaire interne a également été utilisée, de même que le péricarde, sous une forme tubulée [111] ou sous forme de patch [12]. Veine ombilicale humaine traitée La veine ombilicale humaine traitée était obtenue à partir de la veine du cordon ombilical de nouveau-nés. Un mandrin était introduit dans sa lumière pour la redresser, puis elle était réticulée par un traitement au glutaraldéhyde [38] ou au dialdéhyde d’amidon [101]. La veine ombilicale ainsi traitée était ensuite insérée dans une mantille de polyéthylène téréphtalate (téréphtalate de polyéthylène glycol) (PET) afin de tenter d’en augmenter la résistance mécanique intrinsèque et de favoriser l’encapsulation fibreuse. Les meilleurs résultats cliniques ont été obtenus par Dardik, le concepteur de la prothèse Dardik-Biograftt. Ce substitut artériel a été cependant décevant du fait de son évolution fréquente vers la dilatation ou le développement d’anévrismes. La fréquence de cette complication se situait entre 3 et 65 % dans les différentes séries [15, 16, 39, 40, 54, 72, 85, 102, 108, 141, 146] , même si Dardik, le promoteur de la prothèse, estimait que cette fréquence était largement surestimée, notamment en ce qui concernait les résultats de la deuxième partie de son expérience [37]. La majorité des chirurgiens a abandonné ce substitut du fait de ses résultats cliniques. Prothèses hybrides L’idée de leur concepteur, Sparks, était de créer une néoartère autogène par l’infiltration tissulaire de deux filets de PET placés autour d’un mandrin de silicone et enfouis dans le tissu sous-cutané de la zone du pontage. Après un délai de maturation de quelques Techniques chirurgicales Substituts vasculaires 43-008 SUBSTITUTS SYNTHÉTIQUES * A Depuis leur apparition au début des années 1950, peu de matériaux ont été utilisés pour leur construction. Le polytétrafluoroéthylène et le PET se sont largement imposés comme matériaux pour leur construction, du fait de leur résistance à la dégradation dans l’organisme. De nombreux concepts ont été élaborés pour proposer un substitut artériel idéal. La multiplicité actuelle des modèles prouve que ce but n’est pas encore atteint. ¶ Prothèses en polytétrafluoroéthylène Le polytétrafluoroéthylène a été développé sous forme textile et microporeuse. Polytétrafluoroéthylène textile Il a été proposé en 1963 par Edwards [48] sous forme de prothèses tissées ou tricotées. Ces prothèses ont été abandonnées suite à l’observation d’effilochages sur les lignes d’anastomose. Polytétrafluoroéthylène microporeux * B * C 1 Hétérogreffe bovine traitée. A. Macroscopie. B. Microscopie électronique à balayage (grossissement original × 30) : face externe. C. Microscopie électronique à balayage (grossissement original × 30) : surface luminale. semaines, le mandrin était retiré et le pontage était réalisé en anastomosant les deux extrémités du néoconduit ainsi formé sur les artères en amont et en aval de l’obstacle artériel [142]. Ce concept a dû cependant être très rapidement abandonné du fait de sa très mauvaise stabilité mécanique à long terme, responsable de dilatations et de ruptures. En effet, l’infiltration tissulaire du PET étant constituée essentiellement de collagène en l’absence de tissu élastique et de cellules musculaires lisses, ce néoconduit ne possédait aucune des propriétés élastiques de l’artère normale lui permettant de résister mécaniquement au débit sanguin pulsé. Plus tard, ce concept a été reproposé en réalisant une maturation chez le mouton pour réaliser la prothèse Cordis Omniflow [87]. Ce substitut a été proposé pour réaliser des pontages artériels périphériques [88], des fistules d’hémodialyse [ 1 6 2 ] ou des patchs d’angioplastie carotidiens [123]. Le ePTFE a été commercialisé dans les années 1970 [99]. Il a connu un succès croissant comme substitut des artères de petit calibre, notamment pour les pontages fémoropoplités et axillofémoraux. Ce matériau se présente sous forme de nodules transversaux reliés entre eux par des microfibrilles longitudinales. Le ePTFE est fabriqué à partir de poudre de polytétrafluoroéthylène mélangée à un solvant, le naphtalène. Ce mélange est ensuite compacté sous de très hautes pressions, puis extrudé à travers une filière produisant un tube droit compact. La structure microporeuse est obtenue par l’exposition du polytétrafluoroéthylène extrudé à une température supérieure à celle du point de fusion (au minimum 327 °C) pour que les cristallites s’organisent en une structure microporeuse. Ce procédé, le frittage, accroît fortement la résistance mécanique. Cette structure microporeuse de base a pu être modifiée pour permettre de proposer différents types de modèles. Certains modèles se caractérisent par la présence d’une fine couche de ePTFE enroulée sur la surface externe pour en augmenter la résistance mécanique (fig 2). Dans certains cas, la surface interne du substitut est recouverte de carbone pour en diminuer la thrombogénicité [2, 9] (fig 3). Ces prothèses sont disponibles avec un support externe annelé ou spiralé afin d’augmenter leur résistance à la plicature et à la compression externe. La réalisation de modèles sous différentes formes géométriques, telles que les diamètres dégressifs pour la réalisation des fistules d’hémodialyse ou la réalisation d’une collerette distale générant un effet vortex au niveau des anastomoses, a été proposée pour créer des conditions hémodynamiques optimales dans des indications d’utilisation particulières. Ces substituts se sont imposés comme les meilleurs pour le remplacement des vaisseaux de petit calibre en l’absence de greffon veineux autologue, malgré leur faible compliance et leur faible infiltration cellulaire [30, 66]. En effet, chez l’homme, contrairement à ce qui est observé chez l’animal, l’infiltration cicatricielle n’intéresse que la partie la plus externe de la paroi et la surface luminale n’est recouverte que par un fin film de fibrine organisée, même après de longues durées d’implantation. Certaines équipes ont proposé d’améliorer la cicatrisation de ces prothèses par leur endothélialisation. Les premières études chez l’homme ont semblé encourageantes [74] mais n’ont pour l’instant pas permis de proposer cette application à grande échelle. Cependant, des résultats cliniques plus récents devraient permettre de déboucher sur la réalisation de premiers essais comparatifs contrôlés [43] . Les autres voies de recherche pour permettre d’améliorer la cicatrisation de ces prothèses portent sur l’infiltration peropératoire de différents types cellulaires [53]. Certains travaux ont démontré une moindre infectabilité des prothèses en ePTFE par rapport aux prothèses en PET [131, 135, 152] et aux veines ombilicales humaines traitées [ 1 3 1 ] . Des essais d’immobilisation d’antibiotiques à la surface de prothèses en ePTFE par l’intermédiaire de benzalkonium ont été réalisés pour en diminuer l’infectabilité [71, 122]. Ces travaux n’ont cependant jamais débouché sur des applications cliniques. 3 43-008 Substituts vasculaires Techniques chirurgicales * A * A * B * B * C * C 2 Prothèse en polytétrafluoroéthylène expansé comportant un enrubannage externe et bifurquée. A. Macroscopie. B. Microscopie électronique à balayage (grossissement original × 250) : face externe. C. Microscopie électronique à balayage (grossissement original × 250) : surface luminale. Des cas de dilatations anévrismales, compliquées de rupture dans un cas, ont été rencontrés sur les premiers modèles qui ont été commercialisés [21, 104, 128]. Les deux fabricants de l’époque ont alors amélioré les caractéristiques physiques des prothèses en augmentant l’épaisseur de leur paroi pour l’un et en ajoutant un enrubannage externe en ePTFE pour l’autre [21]. Plus récemment, nous avons rapporté un cas de dilatation précoce d’une telle prothèse sans que son analyse physicochimique nous ait permis de conclure quant à son mécanisme [26]. Des déchirures prothétiques sur des lignes d’anastomose, notamment sur les anastomoses proximales des pontages axillofémoraux, ont également été décrites [65] . Ces 4 3 Prothèse en polytétrafluoroéthylène expansé ne comportant pas d’enrubannage externe, droite. A. Macroscopie. B. Microscopie électronique à balayage (grossissement original × 250) : face externe. C. Microscopie électronique à balayage (grossissement original × 250) : surface luminale. déchirures pouvaient être secondaires à des lésions créées par la fabrication (lignes de faiblesse longitudinales créées lors du processus d’extrusion) ou par les manipulations (lésions de clamps artériels). L’analyse chimique d’explants de prothèses en ePTFE implantées chez l’homme a conclu à la bonne biostabilité de ce matériau [68]. ¶ Prothèses en polyéthylène téréphtalate Les prothèses textiles en PET représentent actuellement le substitut le plus utilisé pour les artères de gros et moyen calibre. Les structures textiles ont été introduites par Voorhees et al [158] . Cependant, ces premières structures utilisaient des polymères peu stables jusqu’à l’utilisation du PET. Les prothèses actuellement Techniques chirurgicales Substituts vasculaires 43-008 * A * C 4 Prothèse en polyester tricotée incorporant des fibres texturées. A. Macroscopie. B. Vue en microscopie électronique à balayage de la surface externe. C. Vue en microscopie électronique à balayage de la surface interne. La structure de tricot chaîne incorpore des fibres texturées sur la face externe (effet de velours externe). * B utilisées représentent l’évolution de différents concepts qui se sont succédés dans le temps. Le premier concept était d’augmenter la porosité des prothèses pour en favoriser la cicatrisation et l’encapsulation. Ces premières prothèses étaient construites sous forme de tricots trame et ont été abandonnées du fait de leur mauvaise stabilité, responsable de dilatations et de ruptures. Le deuxième concept était d’incorporer des fibres texturées à la structure pour promouvoir la cicatrisation et la réendothélialisation de la surface luminale de la prothèse. Il s’agit de l’effet velours. Les prothèses à velours externe présentaient une meilleure encapsulation externe et un meilleur ancrage tissulaire. En revanche, les prothèses qui ont été produites grâce à des fibres cylindriques et trilobées pour créer un effet velours sur les faces interne et externe (structure appelée « double velours ») étaient instables mécaniquement et sensibles à la dégradation chimique. Le troisième concept a été d’augmenter la résistance mécanique des prothèses par la généralisation des tricots chaîne et des structures tissées [24]. Ces prothèses à tricot chaîne comportant des fibres texturées ont montré une excellente capacité de cicatrisation et une grande stabilité mécanique (fig 4). Les étapes de la fabrication des structures textiles sont les suivantes. Le fil est formé par l’association de monofilaments de masse linéique et de géométrie variables obtenus par passage de polymère fondu dans une filière. Ces fils sont ensuite étirés et éventuellement texturés par l’application d’un traitement thermique ou chimique qui va donner un effet de bouclettes aux filaments. La structure textile est ensuite obtenue par tissage ou tricotage (fig 5). Les techniques de tissage et de tricotage sont multiples. Elles peuvent utiliser plusieurs fils, et ainsi procurer un aspect plus ou moins compact ou plus ou moins duveteux à la prothèse. La structure est alors compactée par un traitement chimique qui va réduire la porosité de la structure en créant un gonflement des fils. La prothèse est ensuite gaufrée par un traitement le plus souvent thermique pour donner une compliance longitudinale et radiale à la prothèse. Le résultat de ce traitement va créer le cosselage. Enfin, la prothèse est nettoyée de tous les agents chimiques intervenant dans les différentes étapes de la fabrication, puis stérilisée. Les prothèses en PET peuvent être construites sous forme de tubes ou sous forme bifurquée. Il est également possible de disposer sur leur face externe un support spiralé qui a pour but de prévenir les plicatures et la compression externe (fig 6). Le développement le plus récent qui a été apporté à ces prothèses a consisté à les imprégner d’une matrice biodégradable pour les rendre immédiatement étanches au moment de leur implantation et ainsi éviter leur précoagulation. Des prothèses imprégnées de collagène [67], d’albumine [94] ou de gélatine [29, 95] sont actuellement commercialisées (fig 7). Il n’a cependant pas été prouvé que cette imprégnation diminuait la thrombogénicité et améliorait la cicatrisation des prothèses [29, 67, 94, 95]. La vitesse de dégradation des matrices protéiques n’est pas reproductible entre les modèles animaux et humains, ce qui doit rendre prudent pour transférer à l’homme les résultats des études de cicatrisation obtenus chez l’animal [27]. Ces prothèses n’ont pas prouvé leur supériorité clinique sur les prothèses précoagulées en termes de perméabilité, de réduction des pertes sanguines et des transfusions périopératoires, et d’infectibilité [23, 25, 28] . L’utilisation de matrices résorbables synthétiques pourrait représenter une voie d’avenir pour le concept d’imprégnation, compte tenu des réticences de plus en plus importantes liées aux risques d’infection des produits biologiques. Les matrices d’imprégnation ont également été proposées pour conférer un rôle anti-infectieux à la prothèse en y permettant la fixation peropératoire d’antibiotiques, notamment la rifampicine [56, 57, 93] . Les résultats expérimentaux ont fait proposer d’utiliser ces prothèses en clinique en milieu infecté [69]. Une autre alternative de traitement anti-infectieux des prothèses en PET a consisté à proposer un recouvrement à l’argent du PET [81] (fig 8). Ce traitement n’a pas encore prouvé son efficacité et serait expérimentalement moins efficace que l’imprégnation à la rifampicine [59] . La fixation d’héparine sur une matrice d’imprégnation a également été proposée pour réduire la thrombogénicité de la surface luminale, avec des résultats encourageants [44]. Une autre voie de recherche pour réduire la thrombogénicité du PET a consisté à réaliser un traitement de surface par du carbone (fig 9) ou des dérivés fluorés [34]. 5 Substituts vasculaires 43-008 Techniques chirurgicales * A * A * B * B * C 7 * C 5 Prothèse en polyester tissée. A. Macroscopie. B. Vue en microscopie électronique à balayage de la surface externe. C. Vue en microscopie électronique à balayage de la surface interne. Il s’agit d’une toile uniquement constituée de filaments plats. 6 Prothèse en polyester tricotée comportant un support externe. Des complications dégénératives telles que des dilatations, des ruptures ou des faux anévrismes ont été rapportées et analysées 6 Prothèse en polyester tricotée imprégnée de collagène. A. Macroscopie. B. Vue en microscopie électronique à balayage de la surface externe. C. Vue en microscopie électronique à balayage de la surface face interne. dans la littérature, avec des manifestations et des fréquences variables selon le type de construction des prothèses. Les prothèses tissées présentent la meilleure stabilité à long terme, ce qui fait que leurs cas d’explantation pour dilatation ou rupture sont rares. Cette stabilité est liée à leurs bonnes caractéristiques observées lors de la réalisation des tests mécaniques. La tendance à s’effilocher aux anastomoses des premiers modèles n’est pas retrouvée sur les nouvelles générations. Les premiers tricots trame, qui étaient réalisés par un tricotage ne faisant intervenir qu’une seule fibre de liage, présentaient une mauvaise stabilité dimensionnelle qui s’est manifestée par des élongations, des dilatations, des ruptures et des faux anévrismes anastomotiques [11, 80, 92, 113, 114]. Les tricots chaîne font appel à une technique de tricotage faisant intervenir plusieurs fils. Ces fils forment des boucles qui sont entrelacées les unes avec les autres de sorte que chaque fil présente un trajet en zigzag dans la Techniques chirurgicales Substituts vasculaires 43-008 * A 8 Prothèse en polyester tricotée recouverte de sels d’argent. 9 Prothèse en polyester tricotée recouverte de carbone. structure textile. Les structures le plus souvent utilisées sont les structures locknit et reverse locknit. Ces structures offrent une très bonne stabilité dimensionnelle, n’ont pas de tendance à l’effilochage aux anastomoses et présentent une résistance élevée à l’arrachement des sutures. Cependant, des cas sporadiques de rupture de prothèses en tricot chaîné ont été rapportés dans la littérature, sous la forme d’un phénomène dégénératif global de leur structure avec dégradation des fibres et présence de nombreuses déchirures et ruptures [11] ou sous la forme de ruptures longitudinales survenant sans processus dégénératif diffus de la structure textile [14, 31, 36, 109, 153, 159, 163, 167, 170] . Nous avons pu montrer que ces ruptures longitudinales survenaient sur deux zones spécifiques de la structure textile qui pouvaient être considérées comme des zones de faiblesse, la ligne de remaillage et la ligne guide, et que ces ruptures étaient prévisibles sur la base de tests in vitro réalisés sur des prothèses vierges [47]. Cette fragilité des premières prothèses velours était également liée à la présence de filaments trilobaires dans leur structure [154]. Ces filaments s’étant avérés très sensibles à la dégradation, ils ont alors été remplacés par des filaments cylindriques qui présentaient une meilleure biostabilité dans le temps [110]. Des cas de déchirures avec la formation de faux anévrismes ont été rapportés avec la première génération de prothèse construite à base de tricots trame comportant un support externe [ 11 2 ] . Ces ruptures étaient probablement secondaires à des irrégularités de mise en place du support externe générant des contraintes mécaniques exagérées sur la structure textile. Les causes de ces échecs font probablement intervenir des facteurs favorisants de la dégradation des structures textiles à plusieurs niveaux. Ces facteurs de détérioration peuvent survenir lors des différentes étapes de la fabrication de la prothèse, mais peuvent être aussi liés au concept même de la structure textile ou à des facteurs généraux de dégradation du polymère in vivo [121]. ¶ Prothèses en polyuréthane Les chercheurs ont porté un grand intérêt au polyuréthane du fait de leur espoir de pouvoir fabriquer des prothèses présentant des propriétés mécaniques, et notamment une compliance, plus proches de celles des artères, contrairement à ce qui était obtenu avec le ePTFE et le PET. Cependant, les résultats des études expérimentales réalisées pour étudier l’intérêt de ce matériau pour réduire l’hyperplasie néo-intimale ont été contradictoires [17, 82]. Les premières prothèses en polyuréthane qui ont été réalisées sous la forme d’une structure à pores fermés ont été retirées de la commercialisation au vu des résultats d’études expérimentales et cliniques non concluantes [96, 171]. À l’heure actuelle, une prothèse composite de * B * C 10 Prothèse en polyuréthane. A. Macroscopie de la surface externe. B. Vue en microscopie électronique à balayage de la surface externe. C. Vue en microscopie électronique à balayage de la surface interne. La structure de la prothèse est constituée d’un enroulement de fils de polyuréthane renforcé par une mantille externe de polyéthylène téréphtalate tricoté. polyuréthane et de silicone est commercialisée. Elle est réalisée par l’enroulement de filaments de polyuréthane sur un mandrin, avec un comblement de ses interstices par de la gélatine et un renforcement par une mantille externe de PET (fig 10). Les études expérimentales de cette prothèse implantée comme pontage artériel [ 3 ] ou comme fistule d’hémodialyse [ 1 6 6 ] ont été encourageantes. Cette prothèse a été étudiée en clinique comme fistule d’hémodialyse où elle se montrait supérieure au ePTFE en termes de facilité d’hémostase et de formation de séromes, mais avait un taux de perméabilité moindre [107]. D’autres types de prothèses en polyuréthane ont été étudiés en clinique avec des résultats inconstants [6, 55]. 7 43-008 Substituts vasculaires Choix d’un substitut vasculaire La chirurgie de revascularisation s’applique schématiquement à deux types d’artères : des artères de gros et moyen calibre pour la chirurgie de l’ensemble de l’aorte et du carrefour aortique, et des artères de petit calibre pour la chirurgie de revascularisation sousinguinale, des artères viscérales et des troncs supra-aortiques. Ces deux types de chirurgie requièrent des substituts artériels dont nous pouvons présenter les principaux critères de choix de la façon suivante. CRITÈRES DE CHOIX D’UNE PROTHÈSE VASCULAIRE ¶ Thrombogénicité La thrombogénicité d’une prothèse doit être la plus faible possible lorsqu’elle est utilisée pour des revascularisations nécessitant des substituts de diamètre inférieur ou égal à 6 mm et qui présentent de surcroît un faible débit intraluminal du fait du lit d’aval le plus souvent réduit. Fiore et al [51] ont comparé la perméabilité à 30 jours de différents types de prothèses implantées en remplacement de la veine cave supérieure ou de la veine cave inférieure chez le chien et ont conclu à une thrombogénicité des tubes en PET plus grande que celle des prothèses en ePTFE. Goldman et al [60] ont comparé la thrombogénicité de pontages fémoropoplités en PET, en ePTFE et en veine saphène autologue réalisés chez l’homme, par la mesure de la rétention de plaquettes marquées après 1, 3 et 7 jours d’implantation. L’indice moyen de thrombogénicité des prothèses en ePTFE était significativement inférieur à celui des prothèses en PET, ces deux indices étant significativement supérieurs à celui des veines autologues. Shoenfeld et al [ 1 4 0 ] ont comparé la thrombogénicité de prothèses en PET, en ePTFE et en veine ombilicale humaine traitée, par l’évaluation de la fixation plaquettaire sur un modèle de shunt ex vivo. Ils ont conclu à une thrombogénicité du PET plus importante que celle du ePTFE, ainsi qu’à une majoration de l’activation plaquettaire dans le circuit en présence de PET. Eldrup-Jorgensen et al [ 4 9 ] ont évalué la thrombogénicité de prothèses de 4 mm de diamètre en PET, en ePTFE et en veine ombilicale humaine traitée, par l’étude de l’activation plaquettaire sur des shunts ex vivo de différents débits. Ils ont également montré que le PET activait l’agrégation plaquettaire de manière bien plus importante que le ePTFE et la veine ombilicale humaine, quel que soit le débit du shunt. Callow et al [20] ont également conclu à la thrombogénicité du PET plus importante que celle du ePTFE sur un shunt ex vivo. Cependant, une réduction de la thrombogénicité des prothèses en PET imprégnées peut être obtenue par la fixation directe d’agents antithrombotiques, soit directement [106], soit par l’intermédiaire d’une matrice d’imprégnation résorbable [125]. Ces techniques n’ont pas réellement encore fait la preuve de leur efficacité en clinique. Il est donc clair qu’aucun substitut artériel synthétique ne présente les qualités d’antithrombogénicité des substituts autologues, encore faut-il que ces derniers soient traités, conservés et manipulés de la manière la moins traumatisante pour en préserver l’endothélium. En l’absence de substitut biologique autologue pour les pontages de petits calibres, il est habituel de privilégier l’utilisation des substituts en ePTFE. ¶ Cicatrisation La cicatrisation et l’incorporation des prothèses vasculaires sont un phénomène complexe et encore incomplètement connu. L’un des principaux facteurs favorisants de la cicatrisation des prothèses est leur porosité, ce facteur étant déterminant pour permettre la recolonisation tissulaire. L’importance de la porosité a été rapidement mise en évidence avec les travaux de Wesolowski et al [165], ce facteur étant toujours pris en compte pour la construction des nouveaux substituts vasculaires. Sur les modèles expérimentaux, la cicatrisation et l’incorporation tissulaire des prothèses vasculaires sont satisfaisantes puisqu’elles génèrent une capsule interne 8 Techniques chirurgicales constituée de collagène et couverte d’un néoendothélium biologiquement fonctionnel. Cependant, ce résultat n’est jamais observé chez l’homme, chez qui la cicatrisation se résume à l’incorporation de la partie externe de la prothèse dans la capsule externe sans recolonisation complète de la structure prothétique et de la capsule interne. La surface luminale ne possède donc jamais les propriétés antithrombotiques de l’endothélium vasculaire [27, 32, 66, 165] . Il ne semble pas exister de différences notables en matière de cicatrisation entre les différents types de prothèses synthétiques. Ainsi, le potentiel de cicatrisation ne nous semble pas pouvoir être pris en compte comme critère de choix entre les substituts vasculaires. ¶ Infectabilité L’infectabilité et la résistance à l’infection du biomatériau constituant une prothèse vasculaire sont deux éléments importants dans des indications à haut risque infectieux telles que les pontages infrainguinaux, pontages qui sont le plus souvent réalisés pour une indication de sauvetage de membre dans un contexte d’ulcérations ou de nécroses distales surinfectées. Les principales études qui ont comparé l’infectabilité des prothèses en PET à celle des prothèses en ePTFE ont conclu à une meilleure résistance à la colonisation bactérienne des prothèses en ePTFE. Rosenman et al [131] ont étudié l’adhésion in vitro de staphylocoques dorés marqués à l’indium sur des prothèses en PET, en ePTFE et en veine ombilicale humaine interposées dans un circuit pulsé. L’adhésion bactérienne était la plus faible sur les prothèses en ePTFE, celle-ci étant respectivement cinq et 50 fois supérieure sur les veines ombilicales humaines et les prothèses en PET. Schmitt et al [136] ont étudié in vitro l’adhésion de plusieurs souches de bactéries sur des échantillons de prothèses en PET et en ePTFE. L’adhésion bactérienne était la plus importante sur les prothèses en PET, quelle que soit la souche bactérienne étudiée. Sugarman [147] a également montré que l’adhérence bactérienne in vitro était dix à 100 fois plus importante sur les prothèses en PET que sur les prothèses en ePTFE, l’adhésion étant la plus importante sur les prothèses en PET tricoté velours. Des études expérimentales in vivo ont conclu à une moindre infectabilité des prothèses en ePTFE [133], parfois à une moindre infectabilité des prothèses en PET [105], voire à une infectabilité variant avec la durée d’implantation de la prothèse [58]. Il n’existe donc pas de consensus clair sur le choix de tel ou tel type de biomatériau dans un contexte à haut risque infectieux. Cependant, nous pouvons retenir que, en cas d’implantation d’une prothèse en milieu infecté, il est recommandé d’utiliser systématiquement une homogreffe artérielle, même si des cas sporadiques de succès d’implantation de prothèses en PET imprégnées de matrices résorbables et d’antibiotiques ont été rapportés. Nous pouvons également recommander d’utiliser des prothèses en ePTFE pour la réalisation de pontages prothétiques en milieu non infecté, mais chez des patients à haut risque infectieux du fait de lésions trophiques distales. ¶ Biostabilité La biostabilité du matériau constituant une prothèse vasculaire est une propriété importante pour limiter les risques tardifs de dégénérescence pouvant conduire à des complications telles que la dilatation et les ruptures prothétiques. Cette propriété est très importante pour les pontages soumis à de fortes contraintes tels que les pontages sus-inguinaux. Cette complication est beaucoup plus rare sur les pontages sous-inguinaux du fait des moindres sollicitations mécaniques et des taux de perméabilité plus réduits dans cette localisation. La biostabilité d’une prothèse n’est pas seulement le fait du biomatériau en lui-même mais aussi du concept sous lequel il est utilisé. L’analyse de la littérature nous montre que la biostabilité d’un modèle de prothèse n’est pas toujours prédictible. En effet, les tests qui sont appliqués aux prothèses vasculaires avant leur mise sur le marché sont essentiellement descriptifs et non prédictifs [46]. Il est donc important de suivre tout nouveau modèle de prothèse vasculaire pour détecter précocement une tendance à la dégradation. Cette attitude entre dans le cadre général de la matériovigilance. Nous avons pu montrer avec nos travaux qu’il est Techniques chirurgicales Substituts vasculaires non seulement primordial de déclarer tous les incidents ou accidents survenant sur des implants, mais également de les analyser pour pouvoir déterminer les causes de leurs échecs. Cependant, malgré l’existence de lois européennes bien définies dans le cadre de la matériovigilance, le nombre de déclarations rapportant des incidents ou des accidents est très largement inférieur à la réalité. La première directive européenne sur la matériovigilance dans le domaine du matériel médical a été prise le 20 juin 1990 (90/385/CEE, JOCE n° L189/17) et a été modifiée le 14 juin 1993 (93/42/CEE, JOCE n° C172, 12 juillet 1993). Cette directive établit clairement l’obligation de déclarer tout défaut dans les caractéristiques ou les performances d’un dispositif médical qui soit potentiellement susceptible de conduire à la mort ou à une altération majeure de la santé des patients. Tous ces incidents doivent être déclarés à une autorité compétente qui devra prendre les mesures nécessaires afin d’informer le fabricant du dispositif incriminé ou son représentant au sein de la Communauté Européenne. Une évaluation du dispositif est demandée, si possible en impliquant le fabricant, afin de permettre aux autorités sanitaires d’établir les mesures de précaution nécessaires. Les chirurgiens ont par conséquent l’obligation de déclarer tous les incidents et de conserver les prothèses explantées afin de permettre les investigations, qui doivent idéalement être réalisées par un laboratoire indépendant. Il est important de diffuser l’information sur la matériovigilance à la communauté médicale pour permettre une augmentation du nombre de cas déclarés. En effet, seule la collecte d’un grand nombre d’explants permettra de fournir des données épidémiologiques interprétables permettant de différencier des échecs sporadiques de comportements dégénératifs plus endémiques. L’analyse structurelle des explants médicaux doit répondre à notre sens à des impératifs stricts de qualité et de confidentialité. L’évolution des prothèses vasculaires s’est faite par l’introduction permanente de nouveaux concepts (cf supra). Certains concepts ont fait la preuve de leur efficacité, d’autres ont été abandonnés du fait de l’insuffisance de certaines de leurs propriétés, et tout particulièrement de leur biostabilité. Il serait idéal de pouvoir prédire la stabilité à long terme d’une nouvelle prothèse avant l’utilisation clinique par la réalisation de tests mécaniques, in vitro, les plus représentatifs possibles des conditions physiologiques auxquelles elles seront soumises après leur implantation. De telles prédictions nécessiteront également une meilleure connaissance des conditions physicochimiques et hémodynamiques auxquelles sont soumis les différents matériaux utilisés pour la construction d’une prothèse vasculaire. Chaque fois qu’un nouveau modèle ou concept de prothèse vasculaire est utilisé en clinique humaine, celui-ci devrait être l’objet d’une surveillance répondant à une organisation similaire à celle des centres de pharmacovigilance. Seule cette attitude peut permettre de dépister précocement des échecs et d’en évaluer l’incidence et éventuellement les causes. En effet, toutes les complications ne sont pas rapportées dans la littérature et, lorsqu’elles le sont, c’est avec un délai moyen de 1 à 2 années. De plus, l’analyse physicochimique systématique d’explants humains, quelle qu’en soit la cause d’explantation, permettrait également de dépister une évolution marquée d’un concept vers la dégradation avant même que surviennent les premières complications cliniques. CRITÈRES DE CHOIX D’UNE PROTHÈSE VASCULAIRE EN FONCTION DE SON INDICATION ¶ Choix d’une prothèse dans les revascularisations sous-inguinales Il est admis que la veine saphène interne utilisée comme greffon inversé ou in situ est le meilleur substitut des artères de petit calibre. La veine saphène est donc utilisée chaque fois que possible pour les revascularisations sous-inguinales, notamment quand l’anastomose distale se fait sous l’articulation du genou [168]. L’utilisation première d’une prothèse synthétique pour un pontage sus-articulaire afin de préserver le capital veineux pour une chirurgie sous-articulaire ultérieure est encore une option discutée. Certaines équipes n’ont 43-008 pas observé de différences de résultats entre les pontages utilisant une greffe veineuse et ceux utilisant une prothèse en ePTFE et préconisent le choix préférentiel du ePTFE [19], alors que d’autres équipes recommandent celui de la veine saphène qui offrirait de meilleurs résultats [83, 157]. Le choix du type de prothèse synthétique en l’absence de greffon veineux utilisable pose plus de problèmes. Les performances des prothèses en ePTFE ont été étudiées dans des études non comparatives. Les principales études ont rapporté les taux de perméabilité primaire suivants pour les pontages sous-inguinaux en ePTFE : 38 % pour tous les pontages sous-inguinaux et 54 % pour les pontages sus-articulaires à 5 ans dans la série de Veith et al [157] ; 48 % à 4 ans pour Evans et al [50] ; 40 % à 5 ans pour McAuley et al [100] ; 30 % à 5 ans pour Charlesworth et al [33] ; 57 % pour tous les pontages sous-inguinaux et 63 % pour les pontages sus-articulaires à 5 ans pour Quinones-Baldrich et al [124] ; 37 % à 4 ans pour des revascularisations distales pour sauvetage de membre pour Ascer et al [8]. Les études non comparatives qui ont étudié les taux de perméabilité des prothèses en PET implantées comme pontages sous-inguinaux ont principalement été réalisées sur des séries de prothèses comportant un support externe. Sauvage, le promoteur de ce concept, a obtenu les meilleurs résultats [86, 138] avec des taux de perméabilité primaire de 78 % à 7 ans pour les prothèses de 6 mm de diamètre implantées sur l’artère poplitée sus-articulaire, ce taux passant à 47 % pour les pontages sous-articulaires. Kremen et al [89] observaient une perméabilité primaire de 80 % à 1 an, comme Clifford et al [35], le taux de perméabilité à 2 ans étant de 56 % pour ces derniers auteurs. Reichle [127] a observé plus de 50 % de perméabilité à 7 ans avec des prothèses en PET ne comportant pas de support externe, ce taux étant supérieur à 50 % à 6 ans pour les pontages sous-articulaires. Les premières études qui ont comparé les résultats cliniques des prothèses en ePTFE à ceux des prothèses en PET étaient rétrospectives. Rosenthal et al [132] ont obtenu les mêmes résultats dans une comparaison d’une série de 100 prothèses en ePTFE avec une série de 100 prothèses en PET implantées comme pontages fémoropoplités sus-articulaires pour une indication de claudication intermittente. Les taux de perméabilité primaire pour les prothèses en PET et en ePTFE étaient respectivement de 57 et 65 % à 5 ans et de 32 et 31 % à 10 ans, et n’étaient pas statistiquement différents. Pevec et al [119] ont comparé de manière rétrospective les résultats de 38 prothèses en PET à ceux de 85 prothèses en ePTFE implantées comme pontages fémoropoplités, 50 % des pontages de chaque groupe étant des pontages sus-articulaires. Les taux de perméabilité primaire pour les prothèses en PET et en ePTFE étaient respectivement de 55 et 34 % à 3 ans et de 48 et 27 % à 6 ans, cette différence en faveur du PET étant statistiquement significative. Les études prospectives randomisées qui ont été réalisées plus récemment n’ont pas montré de différence statistiquement significative entre les pontages fémoropoplités en PET et en ePTFE [1, 63, 120, 129] . L’utilisation de l’un ou l’autre de ces deux matériaux peut donc être proposée indifféremment. Devine et al [44] ont obtenu de meilleurs résultats avec une prothèse en PET incorporant de l’héparine dans sa matrice d’imprégnation qu’avec une prothèse en ePTFE. Enfin, dans les indications de pontages fémorojambiers, les meilleurs résultats sont incontestablement obtenus avec la veine autologue. Les résultats des pontages prothétiques sont décevants, même en cas d’utilisation de techniques d’interposition veineuse anastomotique telles que les collerettes de Miller [84, 117]. L’utilisation d’une homogreffe artérielle représente une alternative. Cependant, ses résultats sont plus proches de ceux des prothèses que de ceux de la veine saphène autologue [4]. ¶ Choix d’une prothèse dans les revascularisations sus-inguinales Les prothèses textiles tissées ou tricots chaîne en PET se sont largement imposées pour ce type de chirurgie. Actuellement, la 9 43-008 Substituts vasculaires majorité des chirurgiens les utilisent sous leur forme imprégnée, avec de bons résultats cliniques [23, 25, 28]. L’utilisation de prothèses de gros calibre en ePTFE est plus marginale, avec cependant de bons résultats cliniques [118]. L’utilisation de matériaux biologiques pour ce type de chirurgie se limite au traitement des infections par des homogreffes artérielles conservées [10]. Perspectives d’avenir Les perspectives d’avenir des substituts incluront tout d’abord l’amélioration des produits actuellement disponibles. Ces améliorations devront porter sur leurs trois propriétés principales que sont la biocompatibilité, l’antithrombogénicité et la stabilité. L’amélioration de la biocompatibilité et de l’antithrombogénicité des prothèses vasculaires pourrait être obtenue par des traitements de Techniques chirurgicales surface tels que le greffage de polymères par plasma, le greffage de charges électriques négatives ou de carbone [76, 77, 79]. Ces propriétés pourront être également modulées en incorporant à la prothèse au moment de son implantation des produits actifs tels que des éléments cellulaires ou des facteurs de croissance [22, 53, 61, 64, 164]. La phase ultime de l’ingénierie tissulaire permettrait de produire in vitro de véritables artères différenciées à partir d’éléments cellulaires humains qui pourraient être réimplantées chez le patient donneur [91]. L’amélioration de la stabilité des substituts vasculaires passera par des meilleures connaissances des phénomènes de vieillissement des structures polymériques à long terme, ainsi que par une optimisation des processus de fabrication. Les programmes de matériovigilance seront également très importants pour surveiller la stabilité de tout nouveau concept de substitut vasculaire qui sera introduit sur le marché. Références [1] Abbott WM, Green RM, Matsumoto T, Wheeler JR, Miller N, Veith FJ et al. Prosthetic above-knee femoropopliteal bypass grafting: results of a multicenter randomized prospective trial. Above-knee femoropopliteal study group. J Vasc Surg 1998 ; 27 : 191-192 [2] Akers DL, Du YH, Kempczinski RF. The effect of carbon coating and porosity on early patency of expanded polytetrafluoroethylene grafts. An experimental study. J Vasc Surg 1993 ; 18 : 10-15 [3] Akiyama N, Esato K, Fujioka K, Zempo N. A comparison of CORVITA and expanded polytetrafluoroethylene vascular grafts implanted in the abdominal aortas of dogs. Surg Today 1997 ; 27 : 840-845 [4] Albertini JN, Barral X, Branchereau A, Favre JP, Guidicelli H, Magne JL et al. Long-term results of arterial allograft belowknee bypass grafts for limb salvage: a retrospective multicenter study. J Vasc Surg 2000 ; 31 : 426-435 [5] Alexander JJ, Liu YC. Atherosclerotic aneurysm formation in an in situ vein graft. J Vasc Surg 1994 ; 20 : 660-664 [6] Allen RD, Yuill E, Nankivell BJ, Francis DM. Australian multicentre evaluation of a new polyurethane vascular access graft. Aust N Z J Surg 1996 ; 66 : 738-742 [7] Andros G, Harris RW, Salles-Cunha SX. Arm veins as arterial autografts. In : Rutherford RB ed. Vascular surgery. Philadelphia : WB Saunders, 1989 : 434-449 [8] Ascer E, Veith FJ, Gupta SK, Krasowski G, Samson RH, Scher LA et al. Six-year experience with expanded polytetrafluoroethylene arterial grafts for limb salvage. J Cardiovasc Surg 1985 ; 26 : 468-472 [9] Bacourt F. Prospective randomized study of carbonimpregnated polytetrafluoroethylene grafts for belowknee popliteal and distal bypass: results at 2 years. The Association Universitaire de Recherche en Chirurgie. Ann Vasc Surg 1997 ; 11 : 596-603 [10] Bahnini A, Plissonnier D, Koskas F, Kieffer E. Traitement des infections artérielles par allogreffes artérielles in situ. In : Kieffer E éd. Le remplacement artériel : principes et applications. 1992 : 209-219 [11] Berger K, Sauvage LR. Late fiber deterioration in Dacront arterial grafts. Ann Surg 1981 ; 193 : 477-491 [12] Biasi GM, Mingazzini P, Baronio L, Sampaolo A. Processed bovine pericardium as patch angioplasty for carotid endarterectomy: a preliminary report. Cardiovasc Surg 1996 ; 4 : 591-595 [13] Bical O, Bachet J, Laurian C, Camilleri JP, Goudot P, Menu P, Guiomet D. Aorto-coronary bypass with homologous saphenous vein: long-term results. Ann Thorac Surg 1980 ; 30 : 550-551 [14] Blumenberg RM, Gelfand ML. Failure of knitted Dacron as an arterial prosthesis. Surgery 1977 ; 81 : 493-496 [15] Boontje AH. Aneurysm formation in human umbilical vein used as arterial substitutes. J Vasc Surg 1985 ; 2 : 524-529 [16] Boontje AH. Angiographic assessment of Biografts for femoropopliteal bypass. J Cardiovasc Surg 1986, 27 : 136-140 [17] Brothers TE, Stanley JC, Burckel WE, Graham LM. Smallcaliber polyurethane and polytetrafluoroethylene grafts: a comparative study in canine aortoiliac model. J Biomed Mater Res 1990 ; 24 : 761-771 [18] Buckley CJ, Abernathy S, Lee SD, Arko FR, Patterson DE, Manning LG. Suggested treatment protocol for improving patency of femoro-infrapopliteal cryopreserved saphenous vein allografts. J Vasc Surg 2000 ; 32 : 731-738 [19] Burger DH, Kappetein AP, van Bockel JH, Breslau PJ. A prospective randomized trial comparing vein with polytetrafluoroethylene in above-knee femoropopliteal bypass grafting. J Vasc Surg 2000 ; 32 : 278-285 10 [20] Callow AD, Connolly R, O’Donnell TF, Gembarowitz R, Keough E, Ramberg-Laskaris K et al. Platelet-arterial synthetic graft interaction and its modification. Arch Surg 1982 ; 117 : 1447-1455 [21] Campbell CD, Brooks DH, Webster MH, Bondi RP, Lloyd JC, Hynes MF et al. Aneurysm formation in expanded polytetrafluoroethylene prostheses. Surgery 1976 ; 79 : 491-493 [22] Cardon A, Chakfé N, Thaveau F, Gagnon E, Hartung O, Gourdon J et al. Sealing of polyester prostheses with autologous fibrin glue and bone marrow. Ann Vasc Surg 2000 ; 14 : 543-552 [23] Chakfé N, Beaufigeau M, Nicolini PH, Epailly E, Levy F, Thiranos JC et al. Albumin-impregnated prosthetic graft for infrarenal aortic replacement: Effects on the incidence and volume of perioperative blood transfusion. Ann Vasc Surg 1997 ; 11 : 588-295 [24] Chakfé N, Chaput C, Douville Y, Boyer D, Marois Y, Roy PE et al. Woven velour polyester arterial grafts with polypropylene wrap: in vivo evaluation. In : Szycher M ed. High performance biomaterials: a comprehensive guide to medical/pharmaceutical applications. New York : Technomic Publishing Co, 1991 : 405-424 [25] Chakfé N, Cottin-Bizonne S, Beaufigeau M, Urban E, Cardon A, Doillon CJ et al. Impregnated polyester arterial prostheses: performances and prospects. Ann Vasc Surg 1999 ; 13 : 509-523 [37] Dardik H. The second decade of experience with the umbilical vein graft for lower limb revascularization. Cardiovasc Surg 1995 : 3 : 265-269 [38] Dardik H, Ibrahim IM, Jarrah M, Sussman BC, Dardik II. Three year experience with glutaraldehyde stabilized umbilical vein for limb salvage. Br J Surg 1980 ; 67 : 229-232 [39] Dardik H, Ibrahim IM, Sussmann B, Kahn M, Sanchez M, Klausner S et al. Biodegradation and aneurysm formation in umbilical vein grafts. Observation and a realistic strategy. Ann Surg 1984 ; 199 : 61-68 [40] Dardik H, Miller N, Dardik A, Ibrahim IM, Sussman B, Berry SM et al. A decade of experience with the glutaraldehydetanned human umbilical cord vein graft for revascularization of the lower limb. J Vasc Surg 1988 ; 7 : 336-346 [41] De Leersnijder D, Willcocx P, Van Marck E, Vanmaele R. Venous homografts in infra-inguinal procedures: an eightyears experience. J Cardiovasc Surg 1992 ; 33 : 633-640 [42] Delarocha AG, Peixoto RS, Baird RS. Arteriosclerosis and aneurysm formation in a saphenous vein graft. Br J Surg 1973 ; 60 : 72-73 [43] Deutsch M, Meinhart J, Fischlein T, Preiss P, Zilla P. Clinical autologous in vitro endothelialization of infrainguinal ePTFE grafts in 100 patients: a 9-year experience. Surgery 1999 ; 126 : 847-855 [44] Devine C, Hons B, McCollum C. Heparin-bonded Dacron or polytetrafluoroethylene for femoropopliteal bypass grafting: a multicenter trial. J Vasc Surg 2001 ; 33 : 533-539 [26] Chakfé N, Diéval F, Thaveau F, Taghavi I, Le Magnen JF, Laroche Get al. Aneurysm of expanded polyetrafluoroethylene vascular graft. An ultrastructural evaluation. Eur J Vasc Endovasc Surg 2002 (in press) [45] Deweese JA, Rob CG. Autogenous venous grafts ten years later. Surgery 1977 ; 82 : 775-784 [27] Chakfé N, Gasser B, Lindner V, Rouyer N, Rooke R, Kretz JG et al. Albumin as a sealant for a polyester vascular prosthesis: Its impact on the healing sequence in humans. J Cardiovasc Surg 1996 ; 37 : 431-440 [46] Diéval F, Chakfé N, Cottin-Bizonne S, Le Magnen JF, Beaufigeau M, Mahieu D et al. Les tests mécaniques d’évaluation des prothèses vasculaires. Rev Eur Biotechnol 2001 ; 22 : 70-87 [28] Chakfé N, Kretz JG, Petit H, Epailly E, Nicolini PH, Levy F et al. Albumin-impregnated polyester vascular prosthesis for abdominal aortic surgery: an improvement? Eur J Vasc Endovasc Surg 1996 ; 12 : 346-353 [29] Chakfé N, Marois Y, Guidoin R, Deng X, Marois M, Roy R et al. Biocompatibility and biofonctionality of a gelatin impregnated polyester arterial prosthesis. Polym Comp Polym 1993 ; 1 : 229-251 [30] Chakfé N, Maurel S, Guidoin R. Les prothèses artérielles en Téflont microporeux : caractéristiques et performances. Rev Eur Biotechnol 1991 ; 13 : 291-296, 335-341 [31] Chakfé N, Riepe G, Diéval F, Wang L, Beaufigeau M, Urban E et al. Longitudinal ruptures of polyester knitted vascular prostheses. J Vasc Surg 2001 ; 33 : 1015-1021 [32] Chakfé N, Thaveau F, Riepe G, Hassani O, Célérien J, Durand B et al. Graft healing and graft incorporation. In : Branchereau A, Jacobs M, Jausseran JM eds. Complications in vascular and endovascular techniques. Marseille : Arnette/Blackwell, 2001 : 23-33 [47] Diéval F, Chakfé N, Wang L, Riepe G, Thaveau F, Heinz C et al. Mechanisms of the longitudinal ruptures of knitted polyester vascular prostheses: in vitro analysis of virgin prostheses. Eur J Vasc Endovasc Surg 2002 [48] Edwards WS. Clinical experience with teflon grafts. In : Wesolowski SA, Dennis C eds. Fundamentals of vascular grafting. New York : McGraw-Hill, 1963 [49] Eldrup-Jorgensen J, Mackey WC, Connolly RJ, McCullough JL, Ramberg K, Gravis V et al. Evaluation of arterial prostheses in a baboon ex vivo shunt. The effect of graft material and flow on platelet deposition. Am J Surg 1985 ; 150 : 185-190 [50] Evans LE, Webster MW, Brooks DH, Bahnson HT. Expanded polytetrafluoroethylene femoropopliteal grafts: fortyeight-month follow-up. Surgery 1981 ; 89 : 16-22 [51] Fiore AC, Brown JW, Cromartie RS, Ofstein LC, Peigh PS, Sears NS et al. Prosthetic replacement for the thoracic vena cava. J Thorac Cardiovasc Surg 1982 ; 84 : 560-568 [33] Charlesworth PM, Brewster DC, Darling RC, Robison JG, Hallet JW. The fate of polytetrafluoroethylene grafts in lower limb bypass surgery: a six year follow-up. Br J Surg 1985 ; 72 : 896-899 [52] Fontaine R, Kim M, Kieny R. Contribution expérimentale à l’étude biologique des greffes vasculaires : essai de production d’un autogreffon conjonctif tubulaire. Presse Méd 1953 ; 61 : 1791-1793 [34] Chinn JA, Sauter JA, Phillips RE Jr, Kao WJ, Anderson JM, Hanson SR et al. Blood and tissue compatibility of modified polyester: thrombosis, inflammation, and healing. J Biomed Mater Res 1998 ; 39 : 130-140 [53] Fréchette E, Dion YM, Cardon A, Chakfé N, Doillon C. Fatand bone marrow-impregnated small diameter ePTFE grafts. Eur J Vasc Endovasc Surg 1999 ; 18 : 308-314 [35] Clifford PC, Gazzard V, Lawrance RJ, Clyne CA, Webster JH. Below knee femoropopliteal bypass in severe ischaemia: results using EXS Dacron and human umbilical vein. Ann R Coll Surg Engl 1986 ; 68 : 319-321 [36] Cooke PA, Nobis RA, Stoney JR. Dacron aortic graft failure. Arch Surg 1974 ; 103 : 101-103 [54] Giordano JM, Keshishian JM. Aneurysm formation in human umbilical vein gafts. Surgery 1982 ; 91 : 343-345 [55] Gloor B, Wehrli E, Rotzer A, Brunner D, Wilms C, Largiader J. Prothèses artérielles de petit calibre en polyuréthane : suivi clinique et angio-morphologique de 20 patients d’une étude prospective. Swiss Surg 1996 ; 1 : 13-18 Techniques chirurgicales [56] Goëau-Brissonnière O, Leport C, Bacourt F, Lebrault C, Comte R, Péchère JC. Prévention des infections de prothèses artérielles par fixation de rifampicine sur une prothèse en Dacron imprégnée de gélatine. Ann Vasc Surg 1991 ; 5 : 408-412 [57] Goëau-Brissonnière O, Mercier F, Nicolas MH, Bacourt F, Coggia M, Lebrault C et al. Treatment of vascular graft infection by in situ replacement with a rifampin-bonded gelatin-sealed Dacron graft. J Vasc Surg 1994 ; 19 : 739-741 [58] Goëau-Brissonnière O, Péchère JC, Guidoin R, Noël HP, Couture J. Experimental colonization of vascular grafts with Staphylococcus aureus. Can J Surg 1983 ; 26 : 540-545 [59] Goëau-Brissonnière OA, Fabre D, Leflon-Guibout V, Di Centa I, Nicolas-Chanoine MH, Coggia M. Comparison of the resistance to infection of rifampin-bonded gelatinsealed and silver/collagen-coated polyester prostheses. J Vasc Surg 2002 ; 35 : 1260-1263 [60] Goldman M, Norcott HC, Hawker RJ, Hail C, Drolc Z, McCollum CN. Femoropopliteal bypass grafts. An isotope technique allowing in vivo comparison of thrombogenicity. Br J Surg 1982 ; 69 : 380-382 [61] Gosselin C, Vorp DA, Warty V, Severyn DA, Dick EK, Borovetz HS et al. ePTFE coating with fibrin glue, FGF-1, and heparin: effect on retention of seeded endotheliel calls. J Surg Res 1996 ; 60 : 327-332 [62] Gournier JP, Adham M, Fabre JP, Barral X, Rabda M, Acquart S et al. Allogreffes artérielles cryopréservées: Étude expérimentale. In : Kieffer E éd. Le remplacement artériel : principes et applications. Paris : éditions AERCV, 1992 : 195-208 [63] Green RM, Abbott WM, Matsumoto T, Wheeler JR, Veith FJ, Money S et al. Prosthetic above-knee femoropopliteal bypass grafting : a five year results of a randomized trial. J Vasc Surg 2000 ; 31 : 417-425 [64] Greisler HP, Gosselin C, Ren D, Kang SS, Kim DU. Biointeractive polymers and tissue engineered blood vessels. Biomaterials 1996 ; 17 : 329-336 [65] Guidoin R, Chakfé N. Aneurysmal deterioration of arterial substitutes. In : Ernst CB, Stanley JC eds. Current therapy in vascular surgery. Toronto : BC Decker, 1990 : 324-328 [66] Guidoin R, Chakfé N, Maurel S, How T, Batt M, Marois M et al. Expanded polytetrafluoroethylene arterial prostheses in humans: histopathological study of 298 surgically excised grafts. Biomaterials 1993 ; 14 : 678-693 [67] Guidoin R, Marois Y, Deng X, Chakfé N, Marois M, Roy R et al. Can collagen-impregnated polyester arterial prostheses be recommended as blood conduits of small diameter? ASAIO J 1996 ; 42 : 974-983 [68] Guidoin R, Maurel S, Chakfé N, How T, Zhang Z, Therrien M et al. Expanded polytetrafluoroethylene arterial prostheses in humans: Chemical analysis of 79 explanted grafts. Biomaterials 1993 ; 14 : 694-704 [69] Gupta AK, Bandyk DF, Johnson BL. In situ repair of mycotic abdominal aortic aneurysms with rifampin-bonded gelatin-impregnated Dacron grafts: a preliminary case report. J Vasc Surg 1996 ; 24 : 472-476 [70] Hardaway RM. A long-term follow-up of one of the first arterial homografts. J Cardiovasc Surg 1995 ; 36 : 491-492 [71] Harvey RA, Greco RS. The noncovalent bonding of antibiotics to a polytetrafluoroethylene-benzalkonium graft. Ann Surg 1981 ; 194 : 642-647 [72] Hasson JE, Nexton WD, Waltman AC, Fallon JT, Brewster DC, Abbott WM et al. Mural degeneration in the glutaraldehyde-tanned umbilical vein graft. Incidence and complications. J Vasc Surg 1986 ; 4 : 243-250 [73] Heintjes RJ, Eikelboom BC, Steijling JJ, van Reedt Dortland RW, van der Heijden FH, Bastini M et al. The results of denatured homologous vein grafts as conduits for secondary haemodialysis access surgery. Eur J Vasc Endovasc Surg 1995 ; 9 : 58-63 [74] Herring MB, Compton RS, Legrand DR, Gardner AL, Madison DL, Glover JL. Endothelial seeding of polytetrafluoroethylene popliteal bypasses. A preliminary report. J Vasc Surg 198 7; 6 : 114-118 [75] Hertzer NR, Beven EG. Venous access using the bovine carotid heterograft: techniques, results and complications in 75 patients. Arch Surg 1970 ; 113 : 696-700 [76] Hoffman AS, Ratner BD, Garfinkle A, Horbett TA, Reynolds LO, Hanson SR. The small diameter graft: a challenging biomaterials problem. Mater Res Soc Symp 1986 ; 55 : 3-17 [77] Hoffman AS, Ratner BD, Garfinkle A, Reynolds LO, Horbett TA, Hanson SR. The importance of vascular graft surface composition as demonstrated by a new gas discharge treatment for small diameter grafts. In : Kambic HE, Kantrowitz A, Sung P eds. Vascular graft update: safety and performance. Philadelphia : ASTM STP 898, 1986 : 137-155 [78] Holdsworth RJ, Naidu S, Gervaz P, McCollum PT. Glutaraldehyde-tanned bovine carotid artery graft for infrainguinal vascular reconstruction: 5-year follow-up. Eur J Vasc Endovasc Surg 1997 ; 14 : 208-211 [79] Hunt JA, Flanagan BF, McLaughlin PJ, Strickland I, Williams DF. Effect of biomaterial surface charge on the inflammatory response: evaluation of cellular infiltration and TNF alpha production. J Biomed Mater Res 1996 ; 31 : 139-144 [80] Hussey HH. Arterial replacement: failure of synthetic prostheses. JAMA 1976 ; 235 : 848 [81] Illingworth B, Bianco RW, Weisberg S. In vivo efficacy of silver-coated fabric against Staphylococcus epidermidis. J Heart Valve Dis 2000 ; 9 : 135-141 Substituts vasculaires [82] Jeschke MG, Hermanutz V, Wolf SE, Koveker GB. Polyurethane vascular prostheses devreases neointimel formation compared with expanded polytetrafluoroethylene. J Vasc Surg 1999 ; 29 : 168-176 [83] Johnson WC, Lee KK. A comparative evaluation of polytetrafluoroethylene, umbilical vein and saphenous vein bypass grafts for femoro-popliteal above-knee revascularization: a prospective randomized Department of Veteran Affairs cooperative study. J Vasc Surg 2000 ; 32 : 268-277 [84] Kansal N, Pappas PJ, Gwertzman GA, Silva MB Jr, Jamil Z, Lee BC et al. Patency and limb salvage for polytetrafluoroethylene bypasses with vein interposition cuffs. Ann Vasc Surg 1999 ; 13 : 386-392 [85] Karkow WS, Cranley JJ, Cranley RD, Hafner CD, Ruoff BA. Extended study of aneurysm formation in umbilical vein grafts. J Vasc Surg 1986 ; 4 : 486-849 [86] Kenney DA, Sauvage LR, Wod SJ, Berger K, Davis CC, Smith JC et al. Comparison of noncrimped, externally supported (EXS) and crimped, non supported Dacron prostheses for axillofemoral and above-knee femoropopliteal bypass. Surgery 1982 ; 92 : 931-946 [87] Ketharanathan V, Christie BA. Glutaraldehyde tanned ovine conduits as vascular xenografts in dogs. A preliminary report. Arch Surg 1980 ; 144 : 967-969 [88] Koch G, Gutschi S, Pascher O, Fruhwirth H, Glanzer H. Analysis of 274 Omniflow vascular prostheses implanted over an eight-year period. Aust N Z J Surg 1997 ; 67 : 637-639 [89] Kremen AF, Mendez-Fernandez MA, Geis RC, Henly WS. The Dacron EXS graft: Patency in femoropopliteal and femorotibial surgery. J Cardiovasc Surg 1986 ; 27: 125-130 [90] Kunlin J. Le traitement de l’artérite oblitérante par la greffe veineuse. Arch Mal Cœur 1949 ; 42 : 371-372 [91] L’Heureux N, Paquet S, Labbe R, Germain L, Auger FA. A completely biological tissue-engineered human blood vessel. FASEB J 1998 ; 12 : 47-56 [92] Lynn RB. Knitted Dacron ultralight weight grafts: a warning. Can J Surg 1979 ; 22 : 593 [93] Magnan PE, Seyral PH, Raoult D, Branchereau A. Activité antistaphylococcique in vitro de prothèses vasculaires en Dacron collagéné traitées par la rifampicine, la vancomycine ou l’amikacine. Ann Vasc Surg 1994 ; 8 : 243-247 [94] Marois Y, Chakfé N, Guidoin R, Duhamel R, Roy R, Marois M et al. An albumin coated polyester arterial graft: In vivo assessment of biocompatibility and healing characteristics. Biomaterials 1996 ; 17 : 3-14 [95] Marois Y, Chakfé N, How T, Deng X, Marois M, King MW et al. Carbodiimide cross-linked gelatin, a new coating for polyester arterial prostheses. Biomaterials 1995 ; 16 : 1131-1139 [96] Marois Y, Paris E, Zhang Z, Doillon CJ, King MW, Guidoin RG. Vascugraft microporous polyesterurethane arterial prosthesis as a thoraco-abdominal bypass in dogs. Biomaterials 1996 ; 17 : 1289-1300 [97] Martin RS, Edwards WH, Mulherin JL, Edwards WH Jr, Jenkins JM. Cryopreserved saphenous vein allografts for below-knee lower extremity revascularization. Ann Surg 1994 ; 21 : 664-670 [98] Masse L, Tingaud R, Masse CL, Carles J. Les greffes des artères conservées. Bordeaux Chir 1953 ; 2 : 105-112 [99] Matsumoto H, Hasegawa T, Fuse K, Yamamoto M, Saigusa M. A new vascular prosthesis for a small caliber artery. Surgery 1973 ; 74 : 519-523 [100] McAuley CE, Steed DL, Webster MW. Seven-year follow-up of expanded polytetrafluoroethylene (PTFE) femoropopliteal bypass grafts. Ann Surg 1984 ; 199 : 57-60 [101] Mindich B, Silverman M, Elguezabel A, Flores L, Sheka RP, Levowitz BS. Human umbilical cord vein for vascular replacements: preliminary report and observation. Surgery 1977 ; 81 : 152-160 [102] Miyata T, Tada Y, Takagi A, Sato O, Oshima A, Idezuki Y et al. A clinicopathologic study of aneurysm formation of glutaraldehyde-tanned human umbilical vein grafts. J Vasc Surg 1989 ; 10 : 605-611 [103] Moazami N, Argenziano M, Williams M, Cabreriza SB, Oz MC, Nowygrod R. Photo-oxidized bovine arterial grafts: short-term results. ASAIO J 1998 ; 44 : 89-93 [104] Mohr LL, Smith LL. Polytetrafluoroethylene graft aneurysms. A report of five aneurysms. Arch Surg 1980 ; 115 : 1467-1470 [105] Moore WS, Malone JM, Keown K. Prosthetic arterial graft material. Influence of neointimal healing and bacteriemic infectability. Arch Surg 1980 ; 115 : 1379-1383 [106] Najjar FB, Gott VL. The use of small diameter Dacron grafts with wall-bonded heparin for venous and arterial replacement: canine studies and preliminary clinical experience. Surgery 1970 ; 68 : 1053-1063 [107] Nakagawa Y, Ota K, Sato Y, Teraoka S, Agishi T. Clinical trial of new polyurethane vascular grafts for hemodialysis: compared with expanded polytetrafluoroethylene grafts. Artif Org 1995 ; 19 : 1227-1232 [108] Nevelsteen A, Smet G, Wilms G, Marchal G, Suy R. Intravenous digital substraction angiography and duplex scanning in the detection of late human umbilical vein degeneration. Br J Surg 1988 ; 75 : 668-670 43-008 [109] Nucho RC, Gryborski WA. Aneurysms of a double velours aortic graft. Arch Surg 1984 ; 119 : 1182-1184 [110] Nunn DB. Structural failure of Dacron arterial grafts. Semin Vasc Surg 1999 ; 12 : 83-91 [111] Odero A, Argenteri A, Cugnasca M, Pirrelli S. The crimped bovine pericardium bioprosthesis in graft infection: preliminary experience. Eur J Vasc Endovasc Surg 1997 ; 14 (suppl A) : 99-101 [112] Ohta T, Kato R, Kazui H, Kondo M, Hosaka M, Hida K et al. Disruption of externally supported knitted Dacron graft three years after implantation. A case report. J Vasc Surg 1990 ; 12 : 65-69 [113] Ottinger LW, Darling C, Wirthlin LS, Linton RR. Failure of ultralightweight knitted Dacron grafts in arterial reconstructions. Arch Surg 1976 ; 111 : 146-149 [114] Ottinger MB, Rutherford RB, Skinner DB. An unusual complication of axillo-femoral bypass. Surgery 1972 ; 72 : 769-771 [115] Oudot J. La greffe vasculaire dans les thromboses du carrefour aortique. Presse Méd 1951 ; 59 : 234-236 [116] Parodi J, Palinaz J, Barone H. Transfemoral intraluminal graft implantation for abdominal aortic aneurysm. Ann Vasc Surg 1991 ; 5 : 491-499 [117] Parsons RE, Suggs WD, Veith FJ, Sanchez LA, Lyon RT, Marin ML et al. Polytetrafluoroethylene bypasses to infrapopliteal arteries without cuffs or patches: a better option than amputation in patients without autologous vein. J Vasc Surg 1996 ; 23 : 347-354 [118] Petrovic P, Lotina S, Djordjevic M, Avramov S, Pfau J, Velimirovic D et al. Results of 132 PTFE (Gore-Tex) bifurcated graft implantation. J Cardiovasc Surg 1989 ; 30 : 987-901 [119] Pevec WC, Darling RC, L’Italien GJ, Abbott WM. Femoropopliteal reconstruction with knitted, nonvelour Dacron versus expanded polytetrafluoroethylene. J Vasc Surg 1992 ; 16 : 60-65 [120] Post S, Kraus T, Muller-Reinartz U, Weiss C, Kortmann H, Quentmeier A et al. Dacron vs polytetrafluoroethylene grafts for femoropopliteal bypass: a prospective randomized multicenter trial. Eur J Vasc Endovasc Surg 2001 ; 22 : 226-231 [121] Pourdeyhimi B, Wagner D. On the correlation between the failure of vascular grafts and their structural and material properties: a critical analysis. J Biomed Mater Res 1986 ; 20 : 375-409 [122] Prahlad A, Harvey RA, Greco RS. Diffusion of antibiotics from a polytetrafluoroethylene-benzalkonium surface. Am Surg 1981 ; 47 : 515-518 [123] Pratesi C, Pulli R, Ferlaino E, Michelagnoli S, Bernacchi R, Borgioloi F et al. Routine ultrasound surveillance after carotid endarterectomy. J Cardiovasc Surg 1996 ; 37 : 7-12 [124] Quinones-Baldrich WJ, Busuttil RW, Baker JD, Vescera CL, Ahn SS, Macheleder HJ et al. Is the preferential use of polytetrafluoroethylene grafts for femoropopliteal bypass justified? J Vasc Surg 1988 ; 8 : 219-228 [125] Raghunath K, Biswas G, Panduranga Rao K, Joseph KT, Chvapil M. Some characteristics of collagen-heparin complex. J Biomed Mater Res 1983 ; 17 : 613-621 [126] Ramos JR, Berger K, Mansfield PB, Sauvage LR. Histologic fate and endothelial changes of distended and nondistended vein grafts. Ann Surg 1976 ; 183 : 205-228 [127] Reichle FA. Criteria for evaluation of new arterial prostheses by comparing vein with Dacron femoropopliteal bypasses. Surg Gynecol Obstet 1978 ; 146 : 715-720 [128] Roberts AK, Johnson N. Aneurysm formation in an expanded microporous polytetrafluoroethylene graft. Arch Surg 1978 ; 113 : 211-213 [129] Robinson BI, Fletcher JP, Tomlinson P, Allen RD, Hazelton SJ, Richardson AJ et al. A prospective randomized multicenter comparison of expanded polytetrafluoroethylene and gelatin-sealed knitted Dacron grafts for femoropopliteal bypass. Cardiovasc Surg 1999 ; 7 : 214-218 [130] Rosenberg DM, Glass BA, Rosenberg N, Lewis MR, Dale WA. Experience with modified bovine carotid arteries in arterial surgery. Surgery 1970 ; 68 : 1064-1072 [131] Rosenman JE, Pearce WH, Kempczinski RF. Bacterial adherence to vascular grafts after in-vivo bacteremia. J Surg Res 1985 ; 38 : 648-655 [132] Rosenthal D, Evans RD, McKinsey J, Seagraves A, Lamis PA, Clark MD et al. Prosthetic above-knee femoropopliteal bypass for intermittent claudication. J Cardiovasc Surg 1990 ; 31 : 462-468 [133] Russel WL, Bard RM, Krahwinkel DJ, Burns RP. A comparison of infectability of Dacron versus PTFE in the canine model. In : Recent advances in vascular grafting. Proceeding of international symposium in Netherlands. British library Cataloguing in publication data, 1984 [134] Sawyer PN, Fitzgerald J, Kaplitt MJ, Sanders RJ, Williams GM, Leather RP et al. Ten-year experience with the negatively charged glutaraldehyde-tanned vascular graft in peripheral vascular surgery. Initial multicenter trial. Am J Surg 1987 ; 154 : 533-537 11 43-008 [135] Schmitt DD, Bandyk DF, Pequet AJ, Malangoni MA, Towne JB. Muccin production by Staphylococcus epidermidis. Virulence factor promoting adherence to vascular grafts. Arch Surg 1986 ; 121 : 89-95 [136] Schmitt DD, Bandyk DF, Pequet AJ, Towne JB. Bacterial adherence to vascular prostheses. J Vasc Surg 1986 ; 3 : 732-740 [137] Schulman ML, Badhey MR, Yatco R. Superficial femoropopliteal veins and reversed saphenous veins as femoropopliteal bypass grafts : a randomized comparative study. J Vasc Surg 1987 ; 6 : 1-10 [138] Schultz GA, Sauvage LR, Mathisen SR, Mansfield PB, Smith JC, Davis CC et al. Résultats de cinq à sept ans des pontages axillo-fémoraux et fémoro-poplités en Dacron à renforcement externe (EXS). Ann Vasc Surg 1986 ; 1 : 214-224 [139] Shah RM, Faggioli GL, Mangione S, Harris LM, Kane J, Taheri SA et al. Early results with cryopreserved saphenous vein allografts for infrainguinal bypass. J Vasc Surg 1993 ; 18 : 965-969 [140] Shoenfeld NA, Connolly R, Ramberg K, Valeri CR, EldrupJorgensen J, Callow AD. The systemic activation of platelets by grafts. Surg Gynecol Obst 1988 ; 166 : 454-457 [141] Sommeling CA, Buth J, Jakimowicz JJ. Long-term behavior of modified human umbilical vein grafts; late aneurysmal degeneration established by colour duplex scanning. Eur J Vasc Surg 1990 ; 4 : 89-94 [142] Sparks CH. Autogenous grafts made to order. Ann Thorac Surg 1969 ; 8 : 104-113 [143] Stanley JC, Ernst CB, Fry WJ. Fate of 100 aortorenal vein grafts: Characteristics of late graft expansion, aneurysmal dilatation and stenosis. Surgery 1973 ; 74 : 931-944 [144] Stanley JC, Fry WJ. Pediatric renal artery occlusive disease and renovascular hypertension: Etiology, diagnosis, and operative treatment. Arch Surg 1981 ; 116 : 669-676 [145] Steenaert B, Troost FA, Kuypers PJ. Aneurysms in autogenous venous patches used for arterial reconstruction: A late complication. J Cardiovasc Surg 1970 ; 11 : 183-187 [146] Strobel H, Boontje AH, vanden Dungen JJ. Aneurysm formation in modified human umbilical vein grafts. Eur J Vasc Endovasc Surg 1996 ; 11 : 417-420 [147] Sugarman B. In vitro adherence of bacteria to prosthetic vascular grafts. Eur J Clin Stud Treat Inf 1982 ; 10 : 1-9 12 Substituts vasculaires [148] Szilagyi DE, Eliott JP, Hageman JE, Smith RF, Dall’Olmo CA. Biologic fate of autogenous vein implants as arterial substitutes: Clinical, angiographic and histopathologic observations in femoropopliteal operations for atherosclerosis. Ann Surg 1973 ; 178 : 232-246 [149] Szilagyi DE, McDonald RT, Smith RF, Whitcomb JG. Biologic fate of human arterial homografts. Arch Surg 1957 ; 75 : 506-529 [150] Szilagyi DE, Rodriguez FT, Smith RF, Elliot JP. Late fate of arterial homografts: Observations 6 to 15 years after implantation. Arch Surg 1970 ; 101 : 721-733 [151] Taylor LM, Edwards JM, Porter JM, Phinney ES. Reversed vein bypass to infrapopliteal arteries. Modern results are superior to or equivalent to in-situ bypass for patency and for vein utilization. Ann Surg 1987 ; 205 : 90-97 [152] Tollefson DF, Bandyk DF, Kaebnick HW, Seabrook GR, Towne JB. Surface biofilm disruption. Enhanced recovery of microorganisms from vascular prostheses. Arch Surg 1987 ; 122 : 38-43 [153] Trippestad A. Late rupture of knitted Dacron double velour arterial prostheses. Acta Chir Scand 1985 ; 151 : 391-395 [154] Turner RJ, Hoffman HL, Weinberg SL. Knitted Dacron double velour grafts. In : Stanley JC ed. Biologic and synthetic vascular prostheses. New York : Grune and Stratton, 1982 : 509-522 [155] Van Reedt Dortland RW, Schurrman HJ, Slootweg PJ, Steijling JJ, Dimitroff A, Theodorides T. Three-years experience with denaturated venous homografts as an arterial sustitute : a clinical, pathological and immunological study. Eur J Vasc Surg 1988 ; 2 : 233-239 [156] Vanttinen E. Postoperative changes in pypass vein grafts and collateral arteries after femoropopliteal arterial reconstructive surgery. Acta Chir Scand 1975 ; 141 : 731-738 [157] Veith FJ, Gupta SK, Ascer E, White-Flores S, Samson RH, Scher LA et al. Six-year prospective multicenter randomized comparison of autologous saphenous vein and expanded polytetrafluoroethylne grafts in infrainguinal arterial reconstructions. J Vasc Surg 1986 ; 3 : 104-114 [158] Voorhees AB, JaretzkiIii A, Blakemore AH. The use of tubes constructed from Vinyon N cloth in bridging arterial defects. Ann Surg 1952 ; 135 : 332-336 [159] Vrancken Peeters MT, Voorwinde A, MacKaay AJ, Butzelaar RM. Late rupture of femoropopliteal Dacron grafts: a rare complication. Eur J Vasc Endovasc Surg 1996 ; 11 : 243-246 Techniques chirurgicales [160] Wagstaff SA, Grigg MJ. Arterial homografts: a possible solution to an infective dilemma. Cardiovasc Surg 1996 ; 4 : 796-800 [161] Walker PJ, Mitchell RS, McFadden PM, James DR, Mehigan JT. Early experience with cryopreserved saphenous vein allografts as a conduit for complex limbsalvage procedures. J Vasc Surg 1993 ; 18 : 561-568 [162] Wang SS, Chu SH. Clinical use of omniflow vascular graft as arteriovenous bridging graft for hemodialysis. Artif Org 1996 ; 20 : 1278-1281 [163] Watanabe T, Kusaba A, Kuma H, Kina M, Okadome K, Inokuchi K. Failure of Dacron arterial prostheses caused by structural defects. J Cardiovasc Surg 1983 ; 24 : 95-100 [164] Weatherford DA, Sackman JE, Reddick TT, Freeman MB, Stevens SL, Goldman MH. Vascular endothelial growth factor and heparin in a biologic glue promotes human aortic endothelial cell proliferation with aortic smooth muscle cell inhibition. Surgery 1996 ; 120 : 433-439 [165] Wesolowski SA, Fries CC, Karlson KE, Debakey MC, Sawyer PN. Porosity: primary determinant of ultimate fate of synthetic vascular grafts. Surgery 1961 ; 50 : 91-96 [166] Wilson GJ, MacGregor DC, Bridgeman J, Weber BA, Binnington AG, Pinchuk L. A Corethane/polyester composite vascular prosthesis for vascular access. Comparison with expanded polytetrafluoroethylene grafts in a canine model. ASAIO J1995 ; 41 : M728-M734 [167] Wilson SE, Krug R, Mueller G, Wilson L. Late disruption of Dacron aortic grafts. Ann Vasc Surg 1997 ; 11 : 383-386 [168] Woratyl SP, Darling RC, Chang BB, Paty PS, Kreienberg PB, Leather RP et al. The performance of femoropopliteal bypasses using polytetrafluoroethylene above the knee versus autogenous vein below the knee. Am J Surg 1997 ; 174 : 169-172 [169] Wylie EJ. Vascular replacement with arterial autografts. Surgery 1965 ; 57 : 14-21 [170] Yashar JJ, Richman MH, Dyckman J, Witoszka M, Burnard RJ, Weyman AK et al. Failure of Dacron prosthesis caused by structural defect. Surgery 1978 ; 84 : 659-663 [171] Zhang Z, Marois Y, Guidoin RG, Bull P, Marois M, How T et al. Vascugraft polyurethane arterial prosthesis as femoro-popliteal and femoro-peroneal bypasses in humans: pathological, structural and chemical analyses of four excised grafts. Biomaterials 1997 ; 18 : 113-124 Encyclopédie Médico-Chirurgicale 43-225 - 26-570-A-10 43-225 26-570-A-10 Prise en charge des lymphœdèmes des membres S Vignes Résumé. – La prise en charge des lymphœdèmes des membres est basée sur la physiothérapie décongestive qui comprend le rappel des conseils d’hygiène de vie, la réalisation de drainages lymphatiques manuels, la pose de bandages peu élastiques, l’apprentissage des autotechniques, le port de contention élastique, les soins de peau pour éviter les portes d’entrée infectieuses, et la gymnastique spécifique. La physiothérapie décongestive peut être réalisée lors de traitements intensifs hospitaliers avec une diminution importante de volume, puis poursuivie en ambulatoire. On peut y associer, si nécessaire, un amaigrissement ou un suivi psychologique. La chirurgie de résection ou de reconstruction est peu utilisée dans les lymphœdèmes des membres en raison d’une efficacité variable, mais peut être nécessaire lors des atteintes génitales. Les objectifs de la prise en charge sont d’obtenir, non seulement la diminution du volume du lymphœdème, mais aussi la motivation nécessaire au suivi médical régulier et prolongé indispensable au traitement de cette maladie chronique. © 2003 Editions Scientifiques et Médicales Elsevier SAS. Tous droits réservés. Mots-clés : lymphœdème, physiothérapie décongestive, drainage lymphatique manuel, bandages peu élastiques, contention élastique, chirurgie lymphatique. Introduction Les lymphœdèmes (LO) sont la conséquence d’un dysfonctionnement du système lymphatique. On définit les LO secondaires à des lésions des ganglions lymphatiques, soit dans un but diagnostique (biopsies), soit à visée thérapeutique (évidement, radiothérapie). Ces LO se rencontrent essentiellement au membre supérieur après traitements des cancers du sein, mais peuvent aussi toucher les membres inférieurs après traitements de différents cancers (col utérin, ovaire, prostate, vulve, verge, mélanome, lymphome de Hodgkin…) [77]. À l’inverse, les LO primitifs touchent presque exclusivement les membres inférieurs, et surviennent préférentiellement chez le sujet jeune en dehors de toute intervention sur les aires ganglionnaires. Les LO sont des maladies chroniques dont la prise en charge reste symptomatique, mais qui repose cependant sur des consensus internationaux. Conseils pratiques et éducation OBJECTIFS Il s’agit de la première étape de la prise en charge des LO [28]. Elle est indispensable pour obtenir une bonne compliance aux traitements, et est adaptée à chaque patient. Elle débute lors de la première consultation et est approfondie lors d’éventuelles hospitalisations. Les objectifs sont d’expliquer la maladie et son Stéphane Vignes : Chef de service, unité de lymphologie, hôpital Cognacq-Jay, site Broussais, 102, rue Didot, 75014 Paris, France. caractère chronique, de prévenir de son absence de gravité (par comparaison aux cancers dont ont souffert la plupart des patients, et notamment le cancer du sein), de connaître les mesures pour éviter les complications ou l’aggravation du LO. Les différents intervenants prenant en charge les LO peuvent y participer : médecins, kinésithérapeutes et pédicures. SURVENUE ET CHRONICITÉ DU LO La survenue du LO est un événement très mal vécu, que ce soit dans les formes primitives des membres inférieurs, notamment chez la jeune femme où le préjudice esthétique est très important, ou dans les formes secondaires (la plupart du temps à un cancer : sein, col utérin, prostate…) où le LO rappelle en permanence la maladie parfois ancienne, et que l’entourage ne connaissait pas toujours. Le sentiment de culpabilité est souvent présent avec la recherche d’une cause déclenchante dont le patient n’aurait pas été prévenu des conséquences néfastes éventuelles : geste sur le membre atteint, effort important avec le membre supérieur après le traitement d’un cancer du sein. Dans ces situations, il faut rappeler la fréquence d’environ 15-20 % de survenue d’un LO du membre supérieur après cancer du sein [59] qui, une fois apparu, a une faible probabilité de disparaître spontanément. L’acceptabilité n’en est que plus difficile, même si les perspectives d’amélioration parfois non négligeables sont réelles. L’adhésion et la compliance aux traitements sont nettement dépendantes de l’acceptabilité du LO. MESURES DE PRÉVENTION Les mesures de prévention visent à éviter l’aggravation et les complications du LO [33]. Les mesures classiques de préservation du membre atteint de LO, notamment au membre supérieur après traitement d’un cancer du sein, sont rappelées : éviter les blessures Toute référence à cet article doit porter la mention : Vignes S. Prise en charge des lymphœdèmes des membres. Encycl Méd Chir (Editions Scientifiques et Médicales Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales Chirurgie vasculaire, 43-225, Kinésithérapie-Médecine physique-Réadaptation, 26-570-A-10, 2003, 9 p. 150 620 EMC [204] Prise en charge des lymphœdèmes des membres 43-225 26-570-A-10 même minimes, portes d’entrée infectieuses potentielles (griffures, morsures, brûlures, piqûres d’insecte ou d’aiguille à coudre, acupuncture), le port de charge lourde, les vêtements serrés sur le membre atteint, les prélèvements sanguins, la prise de la pression artérielle du côté du LO. Tous ces gestes qui comportent un risque d’effraction cutanée doivent faire porter une protection, en particulier des gants. Toutes ces recommandations, bien que consensuelles, sont empiriques, et ne sont pas étayées par des études bibliographiques [28, 42]. Par ailleurs, il est nécessaire de prévenir que les voyages en avion peuvent déclencher ou aggraver un LO du membre supérieur ou inférieur, en raison de la diminution de la pression et de la réduction de l’activité musculaire. La prévention de ces complications est basée sur le port d’une compression élastique plus forte, ou de bandages peu élastiques [22]. L’exposition à la chaleur est également déconseillée (pays chauds, saunas, bains chauds) en raison du risque d’augmentation du volume du LO. RESTRICTION D’ACTIVITÉ Les activités physiques violentes (squash, tennis, ski) ou comprenant des mouvements répétitifs (step, rameur, aviron) sont déconseillées. Là encore, cette notion, bien que classique, ne repose sur aucune certitude. En effet, dans une étude comprenant 20 femmes, l’entraînement intensif prolongé pour une course de dragon-boat (sorte de canoë de grande taille), n’augmentait pas le risque de survenue de LO du membre supérieur chez des femmes traitées pour cancer du sein par chirurgie, curage axillaire et radiothérapie pour 65 % d’entre elles, avec un recul de 8 mois [43] . Il est probablement nécessaire de déconseiller certains sports, mais de ne pas totalement supprimer toute activité physique. En effet, la prise de poids qui en découlerait serait un facteur d’aggravation du LO. D’autre part, l’activité physique modérée permet de diminuer les symptômes d’anxiété ou de dépression chez les femmes ayant eu un cancer du sein, et améliore aussi la qualité de vie [56, 78]. La plupart des auteurs recommandent donc le port de contention élastique lors d’exercices physiques [15]. Dans une étude cas-témoins comparant deux populations de femmes ayant subi le même traitement pour un cancer du sein, l’une avec LO, la seconde sans LO, Johansson et al avaient montré qu’il n’y avait pas de différence entre les deux groupes pour des types et des intensités d’activité comparables. Ainsi, il serait souhaitable de ne pas nécessairement diminuer l’activité mais de la personnaliser [47]. SURVEILLANCE DU POIDS Ce paramètre a une importance particulière dans les LO, notamment du membre supérieur après cancer du sein [95]. L’existence d’un surpoids en préopératoire est un facteur de risque pour l’apparition d’un LO secondaire au traitement d’un cancer du sein. Les hypothèses physiopathologiques comprendraient une hypersensibilité des tissus à la radiothérapie du fait de l’épaisseur du panicule adipeux, ou encore une très forte hausse de la pression lymphatique après le curage ganglionnaire en raison de l’importance du volume de tissu à drainer [59]. Un indice de masse corporelle [IMC = poids (kg) / taille2 (m)] supérieur à 29,2 kg/m2 est associé à un taux de 36 % de LO à 5 ans contre 12 % chez les femmes ayant un IMC inférieur [53]. La prise de poids postopératoire pourrait être également un facteur prédictif de la survenue du LO [73]. La prise en charge nutritionnelle est donc fondamentale, pour favoriser un amaigrissement bénéfique pour le LO. Alors qu’un régime hypocalorique peut être utile, les tentatives de restriction des triglycérides à longues chaînes, proposée pour deux femmes ayant un LO primitif des membres inférieurs, n’ont pas abouti à des études bien conduites pour pouvoir apprécier l’effet de telles pratiques [81]. Mesures volumétriques Avant tout traitement, il est indispensable de mesurer le volume du LO. La technique de référence reste la volumétrie à eau, qui permet 2 Techniques chirurgicales Kinésithérapie d’apprécier le volume du membre en totalité main et pied compris. Sa mise en œuvre n’est pas simple car elle demande du matériel, du personnel, du temps et surtout une standardisation (définition de la hauteur mesurée, température constante de l’eau) [50]. Cette méthode, bien que considérée comme « idéale », est peu utilisée en recherche ou en pratique courante, au profit de mesures volumétriques estimées par calcul. En effet, les mesures périmétriques prises à intervalles réguliers (tous les 5 ou 10 cm) permettent de calculer un volume en millilitres par assimilation des segments de membres à des troncs de cônes selon la formule suivante : h(C2 + Cc + c2) / 12 p où C est la grande circonférence du cône, c la petite et h l’intervalle entre deux mesures. Cette méthode est très fiable, et reproductible aux membres supérieurs [37, 58] et inférieurs [10]. Il existe également des techniques automatisées et fiables de mesures de volume, mais dont le coût reste élevé [82]. Drainages lymphatiques manuels (DLM) Dès 1892, Winiwarter avait suggéré que les drainages lymphatiques et les bandages pouvaient réduire le volume d’un LO [96]. Puis Vodder [48] précisa les techniques de DLM qui furent reprises en 1950 par Stillwell à la Mayo Clinic [83] puis par Leduc et Földi dans les années 1970 [ 3 5 ] . Les DLM s’intègrent actuellement dans la physiothérapie décongestive complète (ou complexe) qui comprend les bandages peu élastiques, les soins de peau, les exercices sous bandages et le port de contention élastique. Malgré les différentes techniques de ces méthodes, les DLM ont les mêmes objectifs : stimuler le lymphangion, unité contractile lymphatique, dans une zone atteinte par le LO, et faire circuler la lymphe d’un territoire atteint par le LO vers un territoire sain en utilisant les voies de dérivation. Les DLM doivent être lents et non douloureux, exercer une pression faible (< 40 mmHg), débuter par la racine du membre atteint pour finir en distalité (main, pied) et alterner les manœuvres d’appel et de résorption, après avoir au préalable effectué des manœuvres de « pompages » sur les aires ganglionnaires (inguinale, sus-claviculaire, axillaire). La durée minimale requise est de 30 minutes. Les DLM doivent être pratiqués par des kinésithérapeutes formés à ces techniques, à un rythme de trois à cinq par semaine en phase d’attaque, et de deux à trois par semaine en phase d’entretien. Ils apportent une diminution de la tension cutanée et ont un effet relaxant. Utilisés seuls, les DLM ont peu d’effet sur le volume du LO. En effet, dans une série récente composée de 42 femmes ayant un LO après cancer du sein, les DLM n’apportaient pas de bénéfice comparativement au traitement « standard » comportant contention élastique, soins de peau, éducation et exercices [2]. En revanche, les DLM réalisés avant les bandages peu élastiques ont un effet synergique sur la réduction du volume du LO [45]. Bandages peu élastiques Les bandages représentent l’élément essentiel et fondamental de la physiothérapie décongestive destinée à réduire le volume du LO. Il s’agit de poser, sans les serrer, des bandes peu élastiques (c’est-àdire à étirement court) sur un capitonnage fait, soit de coton, soit de mousse ou des deux. Après la mise en place d’un jersey sur le membre à traiter, le coton en large bande (après avoir été dédoublé) ou la mousse également en bandes, est posé. Sur les zones particulièrement touchées par le LO (régions rétromalléollaires, face externe de l’avant-bras), on peut y adjoindre des morceaux de mousse préformée. L’étape suivante est la pose de bandes peu élastiques de type Somost en partant des extrémités jusqu’à la racine du membre (fig 1, 2, 3). En cas d’atteinte sous-gonale isolée, le bandage peut s’arrêter au genou (bandage en botte). Ces bandes sont posées en deux à quatre épaisseurs (multicouches). La technique doit être irréprochable, car ces bandages doivent pouvoir être maintenus 24 à 36 heures sans « glisser » ni serrer. La pression exercée au repos Techniques chirurgicales Kinésithérapie 1 Prise en charge des lymphœdèmes des membres Bandage de la main, avec mousse N/Nt sur l’avant-bras. est faible, ce qui permet de les supporter (à la différence des bandes élastiques), mais augmente nettement lors de la contraction musculaire puisqu’ils sont peu extensibles. Lors d’un traitement intensif en hospitalisation, ils sont renouvelés tous les jours, mais en traitement ambulatoire, ils peuvent être faits trois fois par semaine pendant 14 à 21 jours. Les bandages succédant aux DLM vont permettre de réduire significativement le volume du LO. Les différentes séries de la littérature confirment cette efficacité. Ces études concernaient essentiellement les LO du membre supérieur après cancer du sein. La durée de traitement variait de 2 à 4 semaines, et l’appréciation volumétrique était faite par des mesures périmétriques. La durée d’évolution du LO était variable, allant de moins de 1 ans à plus de 5 ans. Dans toutes les situations, il y avait, en fin de traitement, une réduction de volume du LO variant de 25 à 73 %, notamment en raison des méthodes de calcul différentes [13, 23, 29, 34, 45, 52, 90]. Les non-répondeurs au traitement semblent très peu nombreux (5 %) [34]. Un autre élément important est le maintien à distance, 6 mois, 1 an voire 3 ans, du bénéfice obtenu après le traitement intensif [12, 34, 52]. Plus la compliance au traitement d’entretien (pratiques d’autobandages, DLM, port de contention élastique) est importante, plus le bénéfice se maintient. Des traitements plus courts sont également efficaces. Ainsi, dans une série de 79 patients, un traitement durant en moyenne 8 jours, avait entraîné une diminution de 44 % de l’excès de volume des LO secondaires du membre supérieur, et de 42 % des LO du membre inférieur [87]. L’efficacité clinique de ces techniques a également été confirmée par la diminution in vivo de la pression capillaire lymphatique [36] . La physiothérapie décongestive permet non seulement de diminuer le volume du LO, mais entraîne également une amélioration de la qualité de vie [93]. Apprentissage des autotechniques Il est indispensable d’apprendre les techniques d’autobandages (voire d’autodrainage), notamment en cas d’absence (ou en cas d’éloignement géographique) de kinésithérapeutes compétents ou d’horaires incompatibles avec des soins. Cet apprentissage s’adresse à des personnes motivées, surtout lorsque les atteintes sont distales (main). L’aide de l’entourage est parfois nécessaire. Les techniques sont adaptées en fonction de la compliance espérée, car il s’agit d’un traitement au long cours. Les techniques peuvent être simplifiées avec la pose, par exemple, d’un bandage sur une ancienne contention, ou au contraire réalisées dans les règles de l’art. Il est utile, de temps à autre, de remontrer les gestes lors de séances de réapprentissage. La pratique de ces autotechniques, associée au port d’une contention élastique et à l’éducation permet, après un traitement intensif pour LO secondaire à un cancer du sein, de 43-225 26-570-A-10 2 Lissage sans traction de la bande peu élastique de type Somost d’un membre inférieur. 3 Bandage peu élastique complet d’un membre inférieur. maintenir la réduction volumétrique du LO de 6 à 12 mois [18]. Parallèlement, cette prise en charge favorise l’autonomie et améliore la qualité de vie des femmes [61]. Exercices sous bandages Ils font partie à part entière de la physiothérapie décongestive, et participent ainsi à la réduction de volume du LO. En effet, la contraction musculaire permet d’augmenter le débit lymphatique et la résorption des protéines par ouverture-fermeture des collecteurs lymphatiques initiaux [54, 63]. Les exercices sont brefs mais répétés dans la journée sans jamais être fatigants. Certains auteurs proposent un travail des muscles proximaux et des territoires exempts de LO avant les régions lymphœdémateuses, et d’autres, des exercices contre résistance [60] . Il n’existe aucun consensus sur le type d’exercice à pratiquer. L’exercice physique (en dehors des bandages) est indiqué, en évitant les sports violents, car il entraîne 3 43-225 26-570-A-10 Prise en charge des lymphœdèmes des membres 4 Lymphœdème primitif du membre inférieur droit : papillomatose floride des orteils. fréquemment une sensation d’allègement du membre atteint. Cependant, il est préférable de porter une contention élastique pour le pratiquer [15]. Séances de repos en position surélevée Elles sont toujours proposées en complément des DLM et des bandages peu élastiques. Même si elles diminuent l’impression de lourdeur du membre atteint, utilisées seules, elles ne semblent pas apporter de bénéfice volumétrique [85]. Malgré ces résultats, elles sont conseillées et pratiquées de préférence, sous bandages, à intervalle régulier, et en association avec les autres éléments du traitement [15]. Soins de peau, pédicurie Les LO représentent le facteur de risque le plus important de survenue d’érysipèles des membres inférieurs, avec un risque relatif estimé à 71,2 [32]. La recherche et le traitement des intertrigos interorteils sont indispensables à la prise en charge. La prévention est également importante, par séchage soigneux des espaces interorteils après un bain ou une douche. Toutes les autres portes d’entrée infectieuse sont à traiter : ulcères, plaies traumatiques, brûlures, ainsi que les vésicules lymphatiques siégeant sur les orteils, la cheville ou dans le creux poplité, et qui peuvent se rompre. Ces vésicules doivent parfois être détruites par laser, mais leur réapparition à distance est fréquente. Les soins de pédicurie sont nécessaires pour l’entretien des ongles, souvent incarnés, ou pour la réduction des hyperkératoses responsables de fissures, et dues à des troubles de la statique du pied (fig 4). Au membre supérieur, toute plaie même minime peut se compliquer d’érysipèle : soins de manucure, griffures d’animaux, brûlures, piqûres d’aiguille à coudre. Les érysipèles peuvent être récidivants (plus de trois épisodes) et aggraver le volume du LO. Dans cette situation, il est parfois utile d’instaurer une antibioprophylaxie, qu’il existe un LO du membre inférieur ou supérieur [66, 91]. Un traitement par pénicilline à la libération prolongée comme l’Extencillinet, à la dose de 2,4 MUI toutes les 2-3 semaines (ou par pénicilline par voie orale), en l’absence d’allergie à la pénicilline, est proposée par la Conférence de Consensus sur la prise en charge des érysipèles et fasciite nécrosante [9]. La durée de la prophylaxie n’est pas définie, mais une durée prolongée (plus de 1-2 ans) semble nécessaire. Contention élastique Le terme de contention élastique est toujours utilisé, alors qu’il s’agit en fait de compression élastique. En effet, la pression s’exerce en permanence sur le membre à traiter en raison de la présence des fibres élastiques, alors que l’on devrait réserver le terme de contention aux seuls bandages peu élastiques qui exercent une pression faible au repos mais élevée à l’effort. Après la réduction du volume du LO obtenue par l’association DLM-bandages peu élastiques, le port d’une contention est obligatoire. Il faut parfois être convaincant pour la faire accepter (et porter) quotidiennement 4 Techniques chirurgicales Kinésithérapie par les patients. Il n’est généralement pas nécessaire de la garder la nuit. Le type de contention doit être adapté au LO : manchon avec ou sans mitaine (couvrant la main) pour les membres supérieurs, bas jarret, bas cuisse, collant, hémicollant ou panty pour les membres inférieurs. Les forces de pressions sont définies, en France, en classe I (10-15 mmHg), II (15-20 mmHg), III (20-36 mmHg) et IV (> 36 mmHg) ; à classes identiques, elles sont inférieures à celles des autres pays européens. Au membre supérieur, les contentions de classe II ou III peuvent être proposées, alors qu’au membre inférieur, il faut privilégier une classe III ou IV (avec une éventuelle superposition). Dans la plupart des cas, les contentions sont réalisées sur mesure et sont changées tous les 3 à 4 mois, en raison de leur perte d’efficacité. Les contentions élastiques seules entraînent une diminution modeste du volume du LO, mais surtout permettent de maintenir le résultat et d’éviter la reprise volumétrique [11, 98]. En effet, Badger et al avaient comparé, dans une étude randomisée comprenant 83 patients avec un LO du membre supérieur ou inférieur, le traitement intensif de physiothérapie décongestive pendant 18 jours suivi du port d’une contention élastique, à la contention seule. Les résultats étaient appréciés par volumétrie à la 24e semaine. Le pourcentage de diminution d’excès de volume était de 31 % dans le groupe physiothérapie puis contention, et de 15,2 % dans le groupe contention seule [4]. Ce résultats confirmaient ceux d’une étude ouverte précédente, portant sur 120 femmes ayant un LO secondaire du membre supérieur, dans laquelle la diminution de volume était de 14,7 % à 6 mois [11]. Dans une autre étude, la diminution volumétrique due à la contention seule était estimée à seulement 7 % [46]. Prise en charge psychologique Le LO est une pathologie chronique qui est toujours mal vécue, qu’il s’agisse des formes primitives de l’adolescent et notamment des jeunes filles avec un problème esthétique majeur, ou des formes secondaires en particulier du membre supérieur après cancer du sein. Dans cette dernière situation, plusieurs sentiments différents sont intriqués : le reproche envers le chirurgien de ne pas avoir prévenu du risque de LO, le manque de conseils de prévention du LO, l’impression souvent très négative de la radiothérapie, la culpabilité d’avoir effectué un geste « interdit » comme le port de charge lourde, et surtout l’impression de n’être pas prise en charge. Ainsi, on retrouve plus fréquemment une anxiété, un syndrome dépressif chez les femmes ayant un LO secondaire du membre supérieur, comparativement aux femmes ayant eu un cancer du sein sans LO [69, 88]. D’autres traits de personnalité ont été également mis en évidence par le « test du Bonhomme » et le test de Rorschach : sentiment d’infériorité, de frustration face à leur image sexuelle, de problèmes relationnels dus à une certaine psychorigidité et une difficulté pour exprimer leur sentiments [1]. Une prise en charge spécifique, psychologique voire psychanalytique et/ou médicamenteuse, peut être utile chez certains patients. Pressothérapie Il s’agit essentiellement de la pressothérapie pneumatique multichambre, car la pressothérapie au mercure, développée en France par Cartier, n’est presque plus utilisée [ 2 1 , 6 7 ] . Les recommandations canadiennes et américaines mentionnent cette technique, qui reste controversée et dont les indications sont difficiles à poser en raison des résultats discordants des différentes études [28, 42]. Dans l’étude de Swedborg, la réduction volumétrique du LO secondaire du membre supérieur était supérieure de 18 % à celle induite par la compression élastique seule [84]. Au contraire, dans l’étude de Dini et al, la pressothérapie n’apportait aucun bénéfice. Cette étude randomisée avait comparé la pressothérapie pneumatique chez 80 femmes avec un LO secondaire du membre supérieur qui avaient cinq séances par semaine pendant 2 heures 2 semaines consécutives, suivies de 5 semaines d’arrêt puis d’un Prise en charge des lymphœdèmes des membres 43-225 Techniques chirurgicales 26-570-A-10 Kinésithérapie nouveau cycle. On notait seulement une tendance non significative une autorisation de mise sur le marché (AMM) dans le traitement à la diminution du volume du LO [ 3 1 ] . Plus récemment, la du LO du membre supérieur après traitement radiochirurgical du pressothérapie multichambre a été utilisée, dans une étude cancer du sein, en complément des méthodes physiques et surtout randomisée, en association avec la physiothérapie décongestive de la contention élastique adaptée ou utilisée seule chez des intensive dans le traitement de LO du membre supérieur après patientes ne pouvant bénéficier du traitement physique qui est le cancer du sein. La réduction volumétrique était supérieure à la traitement princeps du LO. physiothérapie seule, mais le bénéfice ne se maintenait pas à j40. En D’autres molécules ont aussi été testées dans les LO. Les O-(btraitement d’entretien, elle permettait une réduction modeste, hydroxyéthyl)-rutosides, utilisés dans les LO primitifs des membres comparativement aux femmes recevant des DLM et portant une inférieurs et les LO des membres supérieurs après traitement de contention élastique [86]. Par ailleurs, il est nécessaire de prendre en cancer du sein, apportaient une amélioration du volume du LO, de compte le risque d’extension du LO aux organes génitaux externes la souplesse de la peau, une diminution de la sensation de lourdeurs lors de la pressothérapie pour un LO des membres inférieurs [14]. La et de tension cutanée [64, 74] . Ils réduisent l’hyperperméabilité prudence est donc de mise ; si la pressothérapie est utilisée, elle le capillaire uniquement des vaisseaux inflammatoires, car ils sont sans sera avec des pressions inférieures à 40 voire 30 mmHg (des effet sur des vaisseaux dont la perméabilité est normale [74]. Les tentatives de pressothérapie à forte pression, 80-130 mmHg, ayant flavonoïdes (Daflont) ou l’extrait hydroalcoolique de Ruscus été insuffisamment évaluées [68, 76]), d’autant que les appareils tendent aculeatus associé à des flavonoïdes (Cyclo 3t fort), dont les essais ne à afficher des pressions inférieures à celles effectivement reçues [79]. permettent pas une évaluation précise dans le traitement des LO [27, 71] , n’ont pas d’AMM dans le traitement du LO. Traitement médicamenteux AUTRES ALTERNATIVES THÉRAPEUTIQUES Les premiers produits utilisés ont été les diurétiques , mais ils ne sont plus recommandés ni utilisés actuellement [28, 42] en raison de leur faible efficacité et de leurs effets secondaires potentiels. [25] Le zinc a été proposé dans le syndrome des ongles jaunes associé au LO avec, dans un cas, disparition du LO en quelques mois sans récidive après 4 ans [3], et le sélénium oral en complément de la physiothérapie décongestive [49]. BENZOPYRONES C’est la principale classe thérapeutique utilisée, qui comprend les coumariniques (a-benzopyrones) et les flavonoïdes (cbenzopyrones). Ces molécules ont les propriétés pharmacologiques communes suivantes : – augmentation de la contractilité des capillaires lymphatiques ; – réduction de la perméabilité des vaisseaux ; – stabilisation de la membrane lysosomiale ; – diminution des effets de certains médiateurs de l’inflammation, tels les radicaux libres. En 1993, la 5,6-benzo-[a]-pyrone, commercialisée sous le nom de Lysedemt, avait montré un effet bénéfique sur la volumétrie et la tension cutanée dans un essai randomisé, en double-aveugle contre placebo, en cross-over pendant 6 mois chez 31 patientes ayant un LO secondaire du membre supérieur après cancer du sein, et 21 patientes ayant un LO des membres inférieurs d’étiologies variées [24]. Cependant, un autre essai avec cette même molécule prise pendant 12 mois, ne retrouvait pas les effets précédents [19]. Une dernière étude en 1999 comparant 400 mg de 5,6-benzo-[a]-pyrone à un placebo pendant 12 mois, en cross-over, chez 140 femmes ayant un LO d’un membre supérieur postmammectomie, ne mettait pas en évidence de différence par rapport au placebo [55]. Cette molécule avait également une toxicité hépatique potentiellement grave qui entraîna le retrait du marché du Lysedemt en 1999. FLAVONOÏDES Les oligomères procyanidoliques (Endotélont) sont des composés d’origine végétale extraits de pépins de raisins, qui renforcent le tissu conjonctif en particulier veineux et capillaire. Leurs effets comportent un effet lymphokinétique en accélérant la vitesse de circulation lymphatique, une augmentation de l’activité macrophagique et de la captation interstitielle (effet lymphagogue). Ces effets permettent de diminuer la perméabilité capillaire et d’augmenter la résistance vasculaire. Dans un essai en double aveugle contre placebo comportant 63 femmes ayant un LO unilatéral d’un membre supérieur après traitement radiochirurgical d’un cancer du sein, les oligomères procyanidoliques à la dose de 300 mg/j pendant 6 mois amélioraient le score clinique (douleur, tension, mobilité, paresthésies, différence périmétrique), le volume du membre, la demi-vie et la vitesse circulatoire du colloïde en lymphoscintigraphie [70]. L’Endotélont est le seul médicament à avoir Traitement chirurgical Le traitement du LO repose sur la physiothérapie décongestive. La chirurgie lymphatique s’inscrit comme un traitement « curatif » qui pourrait faire envisager une « guérison » du LO. Malheureusement, malgré les différentes techniques utilisées, les indications, bien que rares, sont difficiles à poser, et la chirurgie ne représente qu’un outil supplémentaire dans la prise en charge [28, 92]. Il existe deux grands types de chirurgie : la chirurgie de résection et la chirurgie de reconstruction. CHIRURGIE DE RÉSECTION Ce type de chirurgie a pour objectif l’ablation de tout ou partie du tissu atteint par le LO, ou des complications comme les papillomatoses ou les vésicules lymphatiques dont les écoulements peuvent être très invalidants. L’exérèse des tissus lymphœdémateux, des zones fibrosées et de la peau peut être plus ou moins complète. Ces techniques s’adressaient initialement aux LO d’un membre entier, surtout inférieur, avec des lymphangiectomies superficielles de type Servelle [80] (fig 5A, B, C). Il s’agissait de chirurgie lourde, puisque les réinterventions étaient souvent nécessaires, les complications fréquentes (infections, hypoesthésie) et la durée d’hospitalisation de plusieurs mois. De plus, il n’était pas possible de traiter le dos du pied ou le haut de la cuisse, qui restaient atteints par le LO et obligeaient à la poursuite de la kinésithérapie et au port de la contention élastique. Enfin, les séquelles esthétiques de ces interventions sont majeures (fig 5D, E). Après avoir été abandonnée dans ces indications, la chirurgie de résection reste un traitement utile des LO des organes génitaux externes (LO pénoscrotal ou vulvaire) [40, 62] . En effet, dans ces localisations, les drainages lymphatiques manuels sont peu efficaces et la contention difficile à supporter. La principale cause dans le monde est la filariose, mais il existe des formes primitives touchant l’enfant et l’adulte, et des formes secondaires (cancer de la marge anale, de la verge, de la vulve, du col utérin, lymphome de Hodgkin sous-diaphragmatique). Le préjudice est fonctionnel, avec parfois une gêne à la marche en raison d’un volumineux scrotum accompagné d’une hydrocèle ou du frottement des lèvres chez la femme. Des vésicules lymphatiques peuvent aussi compliquer ce type de LO, leur rupture entraînant des écoulements parfois très abondants et représentant une porte d’entrée infectieuse responsable d’érysipèles des organes génitaux externes et du pubis. La chirurgie d’exérèse-plastie large enlève 5 Prise en charge des lymphœdèmes des membres 43-225 26-570-A-10 Techniques chirurgicales Kinésithérapie * B * C * A 5 A, B, C. Lymphangiectomie totale superficielle. D, E. Lymphangiectomie totale superficielle 35 ans auparavant pour lymphœdème primitif bilatéral des membres inférieurs. * D toutes les zones touchées par le LO : grandes lèvres, petites lèvres, capuchon du clitoris chez la femme, réduction scrotale et/ou plastie de la verge chez l’homme. La circoncision peut être aussi pratiquée seule [75]. Les résultats sont très satisfaisants, avec peu de récidives, qui peuvent cependant bénéficier d’une nouvelle résection chirurgicale si nécessaire. La deuxième indication est la résection, après réduction volumétrique importante due à la physiothérapie décongestive, des excédents cutanés parfois invalidants (gêne pour l’habillement, esthétique…) et rendant difficiles les techniques de bandages et le port de contention élastique. La résection se fait alors hors des trajets lymphatiques, et toujours par exérèse-suture. Dans certaines formes de LO très volumineux, des excisions larges du tissus sous-cutané jusqu’au muscle ont pu être pratiquées avec de bons résultats [51]. CHIRURGIE DE RECONSTRUCTION LYMPHATIQUE L’objectif de ces chirurgies est soit de « réparer » les voies lymphatiques elles-mêmes, soit de transférer des ganglions à la place de ceux enlevés à but thérapeutique ou détruits par la radiothérapie. On définit ainsi les techniques de dérivation et les techniques de reconstruction microchirurgicale proprement dites. ¶ Techniques de dérivation : anastomose lymphoveineuse (ALV) La dérivation lymphatique entraîne un court-circuit de la circulation lymphatique, en amont d’un obstacle ou d’un blocage, dans une structure vasculaire adjacente et perméable. C’est en 1969 que 6 * E Yamada décrivit le premier cette technique chez l’homme, après l’avoir expérimenté chez l’animal [97]. Actuellement, l’ALV représente la technique la plus communément utilisée. En effet, le rationnel de cette intervention est l’existence au cours des LO, d’ALV spontanées visualisées par lymphangiographie. Idéalement, l’ALV devrait être pratiquée tôt dans l’évolution du LO avec des vaisseaux lymphatiques fonctionnels pour l’anastomose, c’est-à-dire avant le développement de la fibrose cutanée, de la sclérose des vaisseaux lymphatiques, la survenue d’infections (érysipèles) ou en l’absence d’anomalies lymphatiques étendues comme on peut les rencontrer dans certains LO primitifs [38]. L’ALV est indiquée préférentiellement, mais non exclusivement, aux membres inférieurs. Elle est pratiquée sous microscope, après repérage de vaisseaux lymphatiques de bon calibre. En général, trois à cinq (voire plus dans certaines équipes) vaisseaux lymphatiques sont anastomosés en terminolatéral dans une branche de la grande veine saphène selon la technique de Degni [30] (fig 6). Les vaisseaux lymphatiques sont éventuellement repérés par l’injection sous-cutanée d’un colorant, en aval de 10 à 15 cm de l’incision [44]. Le bénéfice de l’ALV est diversement apprécié suivant les équipes. Pour certains auteurs, il est excellent [20, 44], pour d’autres inconstant [39, 41, 65] voire totalement négatif [89]. Bien que dans toutes ces études, les techniques chirurgicales soient comparables, il existe des différences concernant la localisation du LO opéré (membres inférieurs ou supérieurs), le caractère (primitif ou secondaire), l’ancienneté et le stade du LO, qui rendent difficile l’évaluation de cette technique. La décision de pratiquer une ALV est donc difficile, et dépend de la demande du patient, de la survenue de complications notamment infectieuses (érysipèles), de l’expérience du chirurgien, de l’évolutivité de la maladie, du volume Prise en charge des lymphœdèmes des membres Techniques chirurgicales Kinésithérapie * A * D 6 Anastomose lymphoveineuse terminolatérale selon la technique de Degni du LO, de la réponse à la physiothérapie, et de l’état lymphatique sous-jacent apprécié par une lymphoscintigraphie distale voire proximale [57, 72, 94]. Un échodoppler veineux est indispensable en préopératoire pour repérer la veine devant recevoir l’anastomose, et détecter une insuffisance veineuse associée. 43-225 26-570-A-10 * B * C * E * F [30] . 1. Vaisseau lymphatique ; 2. veine recevant le vaisseau lymphatique. 7 Greffe lymphatique par voie transpubienne pour lymphœdème du membre inférieur droit. 1. vaisseau lymphatique ; 2.ganglion. ¶ Greffe lymphatique Développée par Baumeister, elle a l’avantage par rapport à l’ALV de ne pas entraîner de reflux veineux dans le lymphatique anastomosé. Cette technique était initialement indiquée pour les LO secondaires du membre supérieur après cancer du sein, puis pour les LO secondaires des membres inférieurs. Les collecteurs lymphatiques « donneurs », au nombre de deux (voire trois) sont prélevés sur la cuisse, puis anastomosés à partir des vaisseaux lymphatiques superficiels en regard du muscle jusqu’à la base du cou, dans les LO secondaires du membre supérieur. Pour les LO unilatéraux du membre inférieur, les vaisseaux lymphatiques du membre sain sont anastomosés par voie transpubienne aux collecteurs ascendants du membre atteint (fig 7). La diminution de volume du LO par rapport au membre controlatéral atteignait en moyenne 65 % après 2 ans de recul pour les LO secondaires. Cependant, le bénéfice ne se maintenait à distance que pour les LO secondaires du membre supérieur [5, 7]. La greffe lymphatique entraînait également une diminution du nombre d’érysipèles comparativement à la période préopératoire [7]. Les indications de ce type de chirurgie semblent donc être les LO secondaires du membre supérieur, plutôt que les LO du membre inférieur. ¶ Transfert ganglionnaire Il s’agit de transférer des ganglions avec le pédicule vasculaire et le revêtement cutané dans une zone lésée (creux axillaire) dont le membre est atteint de LO. Plusieurs modèles expérimentaux ont montré l’efficacité de cette technique [8, 26], mais les résultats chez l’homme ont fait l’objet de peu de publications [7]. AUTRES TECHNIQUES CHIRURGICALES La liposuccion a pour objectif d’enlever les tissus lymphœdémateux sous-cutanés par aspiration. L’équipe suédoise de Brorson s’intéresse particulièrement à cette technique, pour traiter les LO du membre supérieur après cancer du sein. De multiples aspirations effectuées par 20 à 30 incisions permettent de réduire le volume du LO. Surtout, le port d’une contention élastique en postopératoire est indispensable pour maintenir le bénéfice. En cas de doute sur l’observance, la chirurgie n’est pas pratiquée. La force de pression de cette contention est de 32 à 40 mmHg, correspondant en France à une classe III forte ou IV, ce qui est très important pour un membre supérieur. De plus, elle doit être portée en continu, y compris la nuit, et enlevée seulement 15 minutes pour la toilette. Elle est régulièrement réadaptée au volume du bras, changée tous les 3 mois et portée au long cours pour maintenir le bénéfice chirurgical. Dans une revue du même auteur, les résultats obtenus étaient très bons, avec une diminution moyenne de l’excès de volume du LO de 106 % (soit un volume identique au membre supérieur controlatéral) [16]. Malgré son caractère invasif, la liposuccion ne semble pas altérer 7 43-225 26-570-A-10 Prise en charge des lymphœdèmes des membres davantage le transport lymphatique apprécié sur la lymphoscintigraphie [17]. En pratique, cette technique ne s’est pas largement répandue, notamment en raison de la contrainte majeure que représente le port permanent d’une contention élastique forte. Autres techniques Les autres techiques : cryothérapie, traitement par micro-ondes, électrothérapie, endermologie, n’ont pas prouvé leur efficacité dans Techniques chirurgicales Kinésithérapie les études cliniques, et ne font donc pas partie des recommandations du traitement des LO des membres [43]. Conclusion La prise en charge des LO doit être appréhendée sur le long terme. Elle repose sur un projet thérapeutique multidisciplinaire, dont l’élément essentiel est la physiothérapie décongestive. L’éducation et les conseils pratiques sont indispensables, afin d’obtenir la motivation des patients nécessaire à la prise en charge et au suivi médical régulier et prolongé de ces pathologies chroniques que représentent les LO. Références [1] Alliot F, Georger MA, Cluzan RV, Pascot M, Ghabboun S. Body image and the Rorschach test in secondary upper limb lymphoedema. Lymphology 1998 ; 31 (suppl) : 427-9 [2] Andersen L, Hojris I, Erlandsen M, Andersen J. Treatment of breast-cancer-related lymphedema with or without manual lymphatic drainage. Acta Oncol 2000 ; 39 : 399-405 [3] Arroyo JF, Cohen ML. Improvement of yellow nail syndrome with oral zinc supplementation. Clin Exp Dermatol 1993 ; 18 : 62-4 [4] Badger CM, Peacock JL, Mortimer PS. A randomized, controlled, parallel-group clinical trial comparing multilayer bandaging followed by hosiery versus hosiery alone in the treatment of patients with lymphedema of the limb. Cancer 2000 ; 88 : 2832-7 [5] Baumeister RG, Siuda S. Treatment of lymphedemas by microsurgical lymphatic grafting: what is proved? Plast Reconstr Surg 1990 ; 85 : 64-74 [6] Baumeister RG, Siuda S, Bohmert H, Moser E. A microsurgical method for reconstruction of interrupted lymphatic pathways: autologous lymph-vessel transplantation for treatment of lymphedema. Scand J Plast Reconstr Surg 1986 ; 20 : 141-6 [7] Becker C, Assouad J, Riquet M. Treatment of lymphoedema combined with reconstruction of the breast. Eur J Lymphol Relat Probl 2001 ; 34 : 58 [8] Becker C, Hidden G. Transfer of free lymphatic flaps. Microsurgery and anatomical study. J Mal Vasc 1988 ; 13 : 119-22 [9] Becq-Giraudon B. L’érysipèle: prévention primaire et secondaire. Ann Dermatol Venereol 2001 ; 128 : 368-75 [10] Bérard A, Zuccarelli F. Test-retest reliability study of a new improved leg-O-meter, the leg-O-meter II, in patients suffering from venous insufficiency of the lower limbs. Angiology 2000 ; 51 : 711-7 [11] Bertelli G, Venturini M, Forno G, Macchiavello F, Dini D. An analysis of prognostic factors in response to conservative treatment of postmastectomy lymphedema. Surg Gynecol Obstet 1992 ; 175 : 455-60 [12] Boris M, Weindorf S, Lasinski B. Persistence of lymphedema reduction after noninvasive complex lymphedema therapy. Oncology (Huntingt) 1997 ; 11 : 99-109 [13] Boris M, Weindorf S, Lasinski B, Boris G. Lymphedema reduction by noninvasive complex lymphedema therapy. Oncology (Huntingt) 1994 ; 8 : 95-106 [14] Boris M, Weindorf S, Lasinski BB. The risk of genital edema after external pump compression for lower limb lymphedema. Lymphology 1998 ; 31 : 15-20 [15] Brennan MJ, Miller LT. Overview of treatment options and review of the current role and use of compression garments, intermittent pumps, and exercise in the management of lymphedema. Cancer 1998 ; 83 (Suppl) : 2821-7 [16] Brorson H. Liposuction gives complete reduction of chronic large arm lymphedema after breast cancer. Acta Oncol 2000 ; 39 : 407-20 8 [17] Brorson H, Svensson H, Norrgren K, Thorsson O. Liposuction reduces arm lymphedema without significantly altering the already impaired lymph transport. Lymphology 1998 ; 31 : 156-72 [18] Bunce IH, Mirolo BR, Hennessy JM, Ward LC, Jones LC. Postmastectomy treatment and measurement. Med J Aust 1994 ; 161 : 125-8 [19] Burgos A, Alcaide A, Alcoba C, Azcona JM, Garrido J, Lorente C et al. Comparative study of the clinical efficacy of two different coumarin dosages in the management of arm lymphedema after treatment for breast cancer. Lymphology 1999 ; 32 : 3-10 [20] Campisi C, Boccardo F, Alitta P, Tacchella M. Derivative lymphatic microsurgery: indications, techniques, and results. Microsurgery 1995 ; 16 : 463-8 [21] Cartier CJ. Pressothérapie au mercure dans le traitement du lymphœdème. J Mal Vasc 1990 ; 15 : 277-81 [22] Casley-Smith JR, Casley-Smith JR. Lymphedema initiated by aircraft flights. Aviat Space Environ Med 1996 ; 67 : 52-6 [23] Casley-Smith JR, Casley-Smith JR. Modern treatment of lymphoedema I. Complex physical therapy : the first 200 Australian limbs. Australas J Dermatol 1992 ; 33 : 61-8 [24] Casley-Smith JR, Morgan RG, Piller NB. Treatment of lymphedema of the arms and legs with 5, 6-benzo-pyrone. N Engl J Med 1993 ; 329 : 1158-63 [25] Cattell WR. Diuretic treatment of primary lymphedema. Am J Heart 1966 ; 72 : 134-5 [26] Chen HC, O’Brien BM, Rogers IW, Pribaz JJ, Eaton CJ. Lymph node transfer for the treatment of obstructive lymphoedema in the canine model. Br J Plast Surg 1990 ; 43 : 578-86 [27] Cluzan RV, Alliot F, Ghabboun S, Pascot M. Treatment of secondary lymphedema of the upper limb with Cyclot 3 fort. Lymphology 1996 ; 29 : 29-35 [28] Cohen SR, Payne DK, Tunkel RS. Lymphedema. Strategies for management. Cancer 2001 ; 92 : 980-7 [29] Daane S, Poltoratszy P, Rockwell WB. Postmastectomy lymphedema management: evolution of the complex decongestive technique. Ann Plast Surg 1998 ; 40 : 128-34 [30] Degni M. New microsurgical technique of lymphaticovenous anastomosis for the treatment of lymphedema. Lymphology 1981 ; 14 : 61-3 [31] Dini D, Del Mastro L, Gozza A, Lionetto R, Garrone O, Forno G et al. The role of pneumatic compression in the treatment of postmastectomy lymphedema. A randomized phase III study. Ann Oncol 1998 ; 9 : 187-90 [32] Dupuy A, Benchikhi H, Roujeau JC, Bernard P, Vaillant L, Chosidow O et al. Risk factors for erysipelas of the leg (cellulitis): case-control study. BMJ 1999 ; 318 : 1591-4 [33] Erickson VS, Pearson ML, Ganz PA, Adams J, Kahn KL. Arm edema in breast cancer patients. J Natl Cancer Inst 2001 ; 93 : 96-111 [34] Foldi E, Foldi M, Clodius L. The lymphedema chaos: a lancet. Ann Plast Surg 1989 ; 22 : 505-15 [35] Földi E, Földi M, Weissleder H. Conservative treatment of lymphedema of the limbs. Angiology 1985 ; 36 : 171-80 [36] Franzeck UK, Spiegel I, Fischer M, Bortzler C, Stahel HU, Bollinger A. Combined physical therapy for lymphedema evaluated by fluorescence microlymphography and lymph capillary pressure measurements. J Vasc Res 1997 ; 34 : 306-11 [37] Galland C, Auvert JF, Flahault A, Vayssairat M. Why and how post-mastectomy edema should be quantified in patients with breast cancer. Breast Cancer Res Treat 2002 ; 75 : 87-9 [38] Gloviczki P. Principles of surgical treatment of chronic lymphedema. Int Angiol 1999 ; 18 : 42-6 [39] Gloviczki P, Fisher J, Hollier LH, Pairolero PC, Schirger A, Wahner HW. Microsurgical lymphovenous anastomosis for treatment of lymphedema: a critical review. J Vasc Surg 1988 ; 7 : 647-52 [40] Guedes Neto HJ. Surgical treatment of penile-scrotal lymphedema. Lymphology 1996 ; 29 : 132-3 [41] Guzman A, Deleveaux J, Rossi L. Lymphatic venous anastomosis in the treatment of lymphedem. Lymphology 1998 ; 3 : 599-604 [42] Harris SR, Hugi MR, Olivotto IA, Levine M. Steering Committee for Clinical Practice Guidelines for the Care and Treatment of Breast Cancer. Clinical practice guidelines for the care and treatment of breast cancer. 11. Lymphedema. CMAJ 2001 ; 164 : 191-9 [43] Harris SR, Niesen-Vertommen SL. Challenging the myth of exercise-induced lymphedema following breast cancer: a series of case reports. J Surg Oncol 2000 ; 74 : 95-9 [44] Huang GK, Hu RQ, Liu ZZ, Shen YL, Lan TD, Pan GP. Microlymphaticovenous anastomosis in the treatment of lower limb obstructive lymphedema: analysis of 91 cases. Plast Reconstr Surg 1985 ; 76 : 671-85 [45] Johansson K, Albertsson M, Ingvar C, Ekdahl C. Effects of compression bandaging with or without manual lymph drainage treatment in patients with postoperative arm lymphedema. Lymphology 1999 ; 32 : 103-10 [46] Johansson K, Lie E, Ekdahl C, Lindfeldt J. A randomized study comparing manual lymph drainage with sequential pneumatic compression for treatment of postoperative arm lymphedema. Lymphology 1998 ; 31 : 56-64 [47] Johansson K, Ohlsson K, Ingvar C, Albertsson M, Ekdahl C. Factors associated with the development of arm lymphedema following breast cancer treatment: a match pair casecontrol study. Lymphology 2002 ; 35 : 59-71 [48] Kasseroller RG. The Vodder School: the Vodder method. Cancer 1998 ; 83 : 2840-2 [49] Kasseroller RG, Schrauzer GN. Treatment of secondary lymphedema of the arm with physical decongestive therapy and sodium selenite: a review. Am J Ther 2000 ; 7 : 273-9 [50] Kaulesar Sukul DM, Den Hoed PT, Johannes EJ, Van Dolder R, Benda E. Direct and indirect methods for the quantification of leg volume: comparison between water displacement volumetry, the disk model method and the frustum sign model method, using the correlation coefficient and the limits of agreement. J Biomed Eng 1993 ; 15 : 477-80 Techniques chirurgicales Kinésithérapie Prise en charge des lymphœdèmes des membres [51] Kim DI, Huh S, Lee SJ, Hwang JH, Kim YI, Lee BB. Excision of subcutaneous tissue and deep muscle fascia for advanced lymphedema. Lymphology 1998 ; 31 : 190-4 [52] Ko DS, Lerner R, Klose G, Cosimi AB. Effective treatment of lymphedema of the extremities. Arch Surg 1998 ; 133 : 452-8 [53] Kocak Z, Overgaard J. Risk factors of arm lymphedema in breast cancer patients. Acta Oncologica 2000 ; 39 : 389-92 [54] Leduc O, Peeters A, Bourgeois P. Bandages: scintigraphic demonstration of its efficacy on colloidal protein reabsorption during muscle activity. In: Nishi M, Uchino S, Yabuki S ed. Progress in lymphology. Vol. XII. New York : Elsevier Science, 1990 : 421-3 [55] Loprinzi CL, Kugler JW, Sloan JA, Rooke TW, Quella SK, Novotny P et al. Lack of effect of coumarin in women with lymphedema after treatment for breast cancer. N Engl J Med 1999 ; 340 : 346-50 [56] McKenzie DC, Kalda AL. Effect of upper extremity exercise on secondary lymphedema in breast cancer patients: a pilot study. J Clin Oncol 2003 ; 21 : 463-6 [57] McNeill GC, Witte MH, Witte CL, Williams WH, Hall JN, Patton DD et al. Whole-body lymphangioscintigraphy: preferred method for initial assessment of the peripheral lymphatic system. Radiology 1989 ; 172 : 495-502 [58] Megens AM, Harris SR, Kim-Sing C, McKenzie DC. Measurement of upper extremity volume in women after axillary dissection for breast cancer. Arch Phys Med Rehabil 2001 ; 82 : 1639-44 [59] Meric F, Buchholz A, Mirza NQ, Vlastos G, Ames FC, Ross MI et al. Long-term complications associated with breastconservation surgery and radiotherapy. Ann Surg Oncol 2002 ; 9 : 543-9 [60] Miller LT. Lymphedema: unlocking the doors to successful treatment. Innov Oncol Nurs 1994 ; 10 : 58-62 [61] Mirolo BR, Bunce IH, Chapman M, Olsen T, Eliadis P, Hennessy JM et al. Psychosocial benefits of postmastectomy lymphedema therapy. Cancer Nurs 1995 ; 18 : 197-205 [62] Morey AF, Meng MV, McAninch JW. Skin graft reconstruction of chronic genital lymphedema. Urology 1997 ; 50 : 423-6 [63] Mortimer PS. Managing lymphoedema. Clin Exp Dermatol 1995 ; 20 : 98-106 [64] Mortimer PS, Badger C, Clarke I, Pallett J. A double-blind, randomized, parallel-group, placebo-controlled trial of O-(b-hydroxyéthyl)-rutosides in chronic arm oedema resulting from breast cancer treatment. Phlebology 1995 ; 10 : 51-5 [65] O’Brien BM, Mellow CG, Khazanchi RK, Dvir E, Kumar V, Pederson WC. Long-term results after microlymphaticovenous anastomoses for the treatment of obstructive lymphedema. Plast Reconstr Surg 1990 ; 85 : 562-72 [66] Olszewski WL. Episodic dermatolymphangioadenitis (DLA) in patients with lymphedema of lower extremities before and after administration of benzathine penicilline preliminary study. Lymphology 1996 ; 29 : 126-31 [67] Palmer A, Macchiaverna J, Braun A, Hendrix R, Miller AJ. Compression therapy of limb edema using hydrostatic pressure of mercury. Angiology 1991 ; 42 : 533-42 [68] Pappas CJ, O’Donnell TF. Long-term results of compression treatment for lymphedema. J Vasc Surg 1992 ; 16 : 555-64 [69] Passik SD, McDonald MV. Psychosocial aspects of upper extremity lymphedema in women treated for breast carcinoma. Cancer 1998 ; 83 (Suppl) : 2817-20 [70] Pecking A, Desprez-Curely JP, Megret G, Delaby M. Oligomères procyanidoliques : une alternative médicale dans le traitement du lymphœdème. Artères et Veines 1989 ; 8 : 1-6 [71] Pecking A, Février B, Wargon C, Pillion G. Efficacy of Daflont 500 mg in the treatment of lymphedema (secondary to conventional therapy of breast cancer). Angiology 1997 ; 48 : 93-8 [72] Pecking AP, Cluzan RV. Distal and proximal lymphoscintigraphy as a tool for the clinician in localized lymphatic insufficiency. Lymphology 1998 ; 31 (suppl) : 257-60 [73] Petrek JA, Senie RT, Peters M, Rosen PP. Lymphedema in a cohort of breast carcinoma survivors 20 years after diagnosis. Cancer 2001 ; 92 : 1368-77 [74] Piller NB, Morgan RG, Castley-Smith JR. A double-blind, cross-over trial of O-(b-hydroxyéthyl)-rutosides (benzopyrones) in the treatment of lymphedema of the arms and legs. Br J Plast Surg 1988 ; 41 : 20-7 [75] Porter W, Dinneen M, Bunker C. Chronic penile lymphedema: a report of 6 cases. Arch Dermatol 2001 ; 137 : 1108-10 [76] Richmand DM, O’Donnell TF, Zelikovski A. Sequential pneumatic compression for lymphedema. A controlled trial. Arch Surg 1985 ; 120 : 1116-9 [77] Rockson SG. Lymphedema. Am J Med 2001 ; 110 : 288-95 [78] Segar ML, Katch VL, Roth RS, Garcia AW, Portner TI, Glickman SG et al. The effect of aerobic exercise on self-esteem and depressive and anxiety symptoms among breast cancer survivors. Oncol Nurs Forum 1998 ; 25 : 107-13 [79] Segers P, Belgrado JP, Leduc A, Leduc O, Verdonck P. Excessive pressure in multichambered cuffs used for sequential compression therapy. Phys Ther 2002 ; 82 : 1000-8 [80] Servelle M. Surgical treatment of lymphedema. Surgery 1987 ; 101 : 485-95 [81] Soria P, Cuesta A, Romero H, Martinez FJ, Sastre A. Dietary treatment of lymphedema by restriction of long-chain triglycerides. Angiology 1994 ; 45 : 703-7 [82] Stanton AW, Northfield JW, Holroyd B, Mortimer PS, Levick JR. Validation of an optoelectronic limb volumeter (Perometer). Lymphology 1997 ; 30 : 77-97 43-225 26-570-A-10 [83] Stillwell GK. Physical medicine in management of patients with postmastectomy lymphedema. JAMA 1959 ; 171 : 2285-91 [84] Swedborg I. Effects of treatment with an elastic sleeve and intermittent pneumatic compression in post-mastectomy patients with lymphoedema of the arm. Scand J Rehabil Med 1984 ; 16 : 35-41 [85] Swedborg I, Norrefalk JR, Piller NB, Asard C. Lymphoedema post-mastectomy: is elevation alone an effective treatment? Scand J Rehabil Med 1993 ; 25 : 79-82 [86] Szuba A, Achalu R, Rockson SG. Decongestive lymphatic therapy for patients with breast carcinoma-associated lymphedema. A randomized, prospective study of a role for adjunctive intermittent pneumatic compression. Cancer 2002 ; 95 : 2260-7 [87] Szuba A, Cooke JP, Yousouf S, Rockson SG. Decongestive lymphatic therapy for patients with cancer-related or primary lymphedema. Am J Med 2000 ; 109 : 296-300 [88] Tobin MB, Lacey HJ, Meyer L, Mortimer PS. The psychological morbidity of breast cancer-related arm swelling. Psychological morbidity of lymphoedema. Cancer 1993 ; 72 : 3248-52 [89] Vignes S, Boursier V, Priollet P, Miserey G, Trévidic P. Evaluations quantitative et qualitative des résultats de l’anastomose chirurgicale dans les lymphœdèmes des membres inférieurs. J Mal Vasc 2003 ; 28 : 30-5 [90] Vignes S, Champagne A, Poisson O. Prise en charge des lymphœdèmes : l’expérience de l’hôpital Cognacq-Jay. Rev Méd Interne 2002 ; 23 (suppl) : 414-20 [91] Vignes S, Pascot M, Cluzan RV, Poisson O, Priollet P. Traitement prophylactique des érysipèles récidivants au cours des lymphœdèmes du membre supérieur secondaires au traitement d’un cancer du sein. J Mal Vasc 2001 ; 26 (Suppl 1) : 1S61 [92] Vignes S, Trévidic P. Place de la chirurgie dans le traitement des lymphœdèmes. Rev Méd Interne 2002 ; 23 (suppl) : 426-30 [93] Weiss JM, Spray BJ. The effect of complete decongestive therapy on the quality of life of patients with peripheral lymphedema. Lymphology 2002 ; 35 : 46-58 [94] Weissleder H, Weissleder R. Lymphedema: evaluation of qualitative and quantitative lymphoscintigraphy in 238 patients. Radiology 1988 ; 167 : 729-35 [95] Werner RS, McCormick B, Petrek J, Cox L, Cirrincione C, Gray JR, Yahalom J. Arm edema in conservatively managed breast cancer: obesity is a major predictive factor. Radiology 1991 ; 180 : 177-84 [96] Winiwarter F. Die chirurgischen Krankheiten der Haut und des Zellgewebes. Stuttgart : Ferdinand Enke, 1892 [97] Yamada Y. The studies of lymphatic venous anastomosis in lymphedema. Nagoya J Med Sci 1969 ; 32 : 1-21 [98] Yasuhara H, Shigematsu H, Muto T. A study of the advantages of elastic stockings for leg lymphedema. Int Angiol 1996 ; 15 : 272 9 Encyclopédie Médico-Chirurgicale 43-029-P 43-029-P Revascularisation artérielle des membres inférieurs à partir de l’aorte sous-rénale : voies d’abord mini-invasives et laparoscopiques X Chaufour J Cau JP Bossavy A Barret Résumé. – La chirurgie vasculaire mini-invasive et la chirurgie laparoscopique se développent depuis quelques années et semblent, comme pour les autres spécialités chirurgicales, être une évolution inéluctable. L’avantage de ces techniques mini-invasives est de diminuer la durée de séjour en soins intensifs et la durée d’hospitalisation. Elles permettent d’obtenir une reprise précoce du transit, une diminution de la douleur et de la fréquence des complications secondaires. L’apprentissage de ces méthodes nécessite un entraînement spécifique rigoureux de la dissection vasculaire vidéoscopique et des techniques de sutures laparoscopiques (« endoanastomose »). © 2003 Editions Scientifiques et Médicales Elsevier SAS. Tous droits réservés. Mots-clés : voies d’abord mini-invasives, chirurgie aortique vidéoassistée, laparoscopie, pontage aorto-bifémoral, endoanastomose. Principes Depuis quelques années se sont développées la chirurgie aortique par voie mini-invasive, la chirurgie aortique par voie vidéoassistée et la chirurgie aortique laparoscopique. L’apprentissage de ces techniques moins invasives nécessite un entraînement spécifique que nous décrivons. La chirurgie aortique par voie mini-invasive dérive directement de la chirurgie classique, elle se limite à une voie d’abord courte, utilisant des écarteurs autostatiques et des clamps aortiques positionnés en dehors de la voie d’abord. L’anastomose s’effectue comme en chirurgie conventionnelle. La chirurgie aortique par voie vidéoassistée consiste à réaliser toute la dissection de l’aorte sous-rénale de façon laparoscopique, jusqu’au temps de la suture aortique où est associée une courte laparotomie. Elle nécessite un apprentissage spécifique et une instrumentation adaptée à la chirurgie vasculaire. Le premier temps consiste à réaliser une open cœlioscopie : par une courte laparotomie de 15 mm, on introduit, sous le contrôle de la vue, un trocart de 10 mm avec un ballonnet d’étanchéité dans la cavité péritonéale ou dans la cavité rétropéritonéale. Le câble d’insufflation est branché sur ce même trocart. L’optique est alors introduite dans le trocart pour positionner sous contrôle vidéoscopique tous les autres trocarts supplémentaires, qui sont introduits de façon percutanée. La mise en place d’écarteurs spécifiques ou de clamps aortiques s’effectue par les trocarts de 10 mm supplémentaires. Xavier Chaufour : Chef de clinique-assistant des Hôpitaux. Jérôme Cau : Chef de clinique-assistant des Hôpitaux. Jean-Pierre Bossavy : Professeur agrégé de chirurgie vasculaire. André Barret : Professeur de chirurgie vasculaire. Hôpital Purpan, place du Docteur-Baylac, 31059 Toulouse cedex, France. La chirurgie aortique totalement laparoscopique utilise les mêmes principes que la chirurgie aortique par voie vidéoassistée, mais aucune laparotomie n’est associée. Toute la dissection aortique et l’anastomose vasculaire aortique sont effectuées par voie laparoscopique, réalisant une véritable « endoanastomose ». L’endoanastomose est effectuée par deux hémisurjets de polypropylène 3/0 qui sont noués en intracorporel à l’aide d’un porte-aiguille et d’une pince fenêtrée (cf infra). Des points séparés sont réalisés de la même manière, tous les nœuds sont liés avec les instruments endoscopiques. L’apprentissage des techniques des endoanastomoses est indispensable. Elle doit débuter sur pelvitrainer, sur animaux et sur cadavres frais, afin d’acquérir une gestuelle endoscopique pour la réalisation d’anastomose vasculaire. Techniques VOIES MINI-INVASIVES ¶ Voie rétropéritonéale Le patient, sous anesthésie générale, est installé en décubitus latéral droit incomplet (décubitus latéral avec le bassin presque à plat, genou gauche légèrement fléchi et en adduction pour détendre le muscle psoas iliaque). Un billot, placé sous la fosse lombaire, permet d’ouvrir l’angle entre le rebord costal et l’aile iliaque. L’opérateur principal est du côté dorsal, l’aide opératoire est du côté ventral, l’instrumentiste est du même côté que l’opérateur. Le moniteur est situé à la tête du patient. Une table à pont est installée au-dessus des cuisses du patient (fig 1A). On réalise une incision oblique en bas et en dedans dans le prolongement de la dixième côte vers l’ombilic. Cette incision est étendue sur 8 à 12 cm. Les fibres du muscle grand oblique sont dissociées et écartées sans section, de même pour le deuxième plan Toute référence à cet article doit porter la mention : Chaufour X, Cau J, Bossavy JP et Barret A. Revascularisation artérielle des membres inférieurs à partir de l’aorte sous-rénale : voies d’abord mini-invasives et laparoscopiques. Encycl Méd Chir (Editions Scientifiques et Médicales Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales - Chirurgie vasculaire, 43-029-P, 2003, 11 p. 43-029-P Revascularisation artérielle des membres inférieurs à partir de l’aorte sous-rénale : Techniques chirurgicales voies d’abord mini-invasives et laparoscopiques * A 2 Patient installé en décubitus pour abord mini-invasif de l’aorte sous-rénale par voie transpéritonéale. Schéma de l’installation des valves autostatiques maintenant l’exposition. Le clamp aortique proximal est positionné en amont de la valve supérieure. vasculaire (fig 1B). Les jambages prothétiques sont tunnellisés en position anatomique, afin d’être anastomosés sur les artères fémorales, abordées de façon conventionnelle. ¶ Voie transpéritonéale * B 1 A. Patient installé en décubitus latéral droit pour abord de l’aorte sous-rénale par voie rétropéritonéale. Incision cutanée de 8 cm entre l’extrémité de la dixième côte et l’ombilic. B. Schéma de l’installation des valves autostatiques maintenant l’exposition. Le clamp aortique proximal est positionné en arrière de la valve supérieure. Une optique permet d’éclairer le champ opératoire et de guider les aides. du petit oblique. L’aponévrose du muscle transverse est incisée transversalement jusqu’à la gaine postérieure du grand droit. Le décollement de l’espace rétropéritonéal se fait au doigt et progresse vers la fosse iliaque. Le décollement est débuté en haut et en dehors et progresse de haut en bas pour récliner en avant le rein et le sac péritonéal. En profondeur, le repère est constitué par le muscle psoas ; les doigts passent sur sa face antérieure et refoulent en dedans le sac péritonéal. Le rein et le sac péritonéal sont maintenus par deux valves autostatiques (mécanique ou pneumatique) (fig 1B). L’uretère est laissé au contact du péritoine et est refoulé en dedans avec le sac péritonéal. Certaines équipes introduisent une optique de cœlioscopie par un trocart de 10 mm positionné au contact de l’aile iliaque, permettant d’éclairer le champ opératoire, qui est ainsi visualisé par toute l’équipe opératoire [26]. Le clamp aortique sera positionné par un autre orifice en dehors de l’incision afin de ne pas gêner l’exposition. Cette voie d’abord et cette installation permettent d’obtenir un espace suffisant pour clamper l’aorte et réaliser une anastomose terminoterminale ou latéroterminale avec les instruments classiques de chirurgie 2 Sous anesthésie générale, le patient est installé en décubitus dorsal, avec mise en place d’un billot au niveau des lombes. L’opérateur principal est du côté gauche, l’aide opératoire est en face, l’instrumentiste est du même côté que l’opérateur. Une table à pont est installée au-dessus des cuisses du patient. Une incision médiane de 8 à 12 cm sous-xiphoïdienne respectant l’ombilic permet d’inspecter la cavité péritonéale dans un premier temps. L’abord de l’aorte sous-rénale reste conventionnel, mais est effectué sans éviscération. Le grand épiploon est récliné vers le haut avec le côlon transverse sous un champ humide ; ils sont maintenus par une valve orthostatique. Les anses grêles sont maintenues à l’intérieur de la cavité péritonéale, réclinées en dehors à la droite du patient, maintenues par deux valves orthostatiques sous un champ humide ; si le côlon gauche ou le sigmoïde sont volumineux, ils sont réclinés en dehors par une autre valve orthostatique (fig 2). Le péritoine pariétal postérieur est incisé juste en dedans de la veine mésentérique inférieure, l’aorte sous-rénale est disséquée jusqu’à la veine rénale gauche et est contrôlée sur une hauteur de 7 cm (fig 2). Les clamps aortiques sont introduits par des orifices de 10 mm audessus et au-dessous de l’incision pour ne pas encombrer le champ opératoire. Cette installation et cette voie d’abord permettent d’obtenir un espace suffisant pour clamper l’aorte et réaliser une anastomose terminoterminale ou latéroterminale avec les instruments classiques de chirurgie vasculaire [6, 7, 10, 30]. Les jambages prothétiques sont tunnellisés en position anatomique, afin d’être anastomosés sur les artères fémorales, abordées de façon conventionnelle. VOIES LAPAROSCOPIQUES AVEC RÉALISATION DES SUTURES VASCULAIRES PAR VOIE MINI-INVASIVE La difficulté première de la voie laparoscopique est l’exposition durable de l’aorte dans un champ opératoire stable. Du fait de l’envahissement par les anses digestives lors de l’approche péritonéale, les différentes équipes ont développé des écarteurs spécifiques [1, 3]. Techniques chirurgicales Revascularisation artérielle des membres inférieurs à partir de l’aorte sous-rénale : voies d’abord mini-invasives et laparoscopiques 43-029-P Les jambages prothétiques sont tunnellisés en position anatomique, afin d’être anastomosés sur les artères fémorales, abordées de façon conventionnelle. Voie transpéritonéale selon Kolvenbach [20, 21] 3 Schéma de l’écarteur d’Alimi permettant la dissection de l’aorte sous-rénale par abord cœlioscopique transpéritonéal. Patient installé en décubitus dorsal. Les anses grêles sont réclinées et maintenues par le filet écarteur. ¶ Voie transpéritonéale Voie transpéritonéale selon Alimi [2] Le patient est installé en décubitus dorsal avec un billot sous la région lombaire. L’opérateur et le premier aide sont du côté gauche du patient, le second aide est en face. L’intervention débute par une incision périombilicale de 10 mm pour la mise en place de l’optique par open-cœlioscopie. Les trocarts opérateurs sont positionnés sur une même ligne pararectale, en triangulation avec l’optique. Deux autres trocarts sont introduits, l’un sous le rebord costal gauche, l’autre en fosse iliaque gauche pour mettre un aspirateur et une pince fenêtrée complémentaire. Le patient est alors mis en position de Trendelenburg de 30°, associée à une rotation de la table à droite de 20° afin de faire tomber les anses grêles en haut et à droite. L’écarteur spécifique est mis en place pour récliner et maintenir les viscères à droite. La dissection de l’aorte se fait par voie laparoscopique. Le péritoine pariétal postérieur est ouvert en regard de l’angle duodénojéjunal en dedans de la veine mésentérique inférieure. L’angle duodénojéjunal est libéré par la section du muscle de Treitz. La veine rénale gauche est repérée. La section au ciseau coagulateur du tissu celluloganglionnaire périaortique permet d’exposer l’hémicirconférence antérieure de l’aorte sous-rénale. Le bras longitudinal de l’écarteur (fig 3) peut être alors abaissé, pour exposer au mieux le bord antérodroit aortique. La dissection se poursuit vers le bas jusqu’à l’artère mésentérique inférieure qui est contrôlée. La bifurcation aortique ainsi que les 4 premiers centimètres des artères iliaques primitives sont disséqués à gauche comme à droite pour amorcer la tunnellisation. Après héparinisation par voie générale, le clampage proximal aortique est obtenu par un clamp spécifique (De Bakey Atraumatic Clamp, Aesculap) introduit sous la xiphoïde à travers un trocart souple de 10 mm. Le clampage distal est soit aortique, soit au niveau des artères iliaques primitives si l’aorte distale est trop calcifiée. Une minilaparotomie de 6 à 8 cm, sus-ombilicale, est réalisée après dissection complète de l’aorte sous-rénale et clampage, l’exposition restant la même (trocarts, écarteur et clamps restent en place). L’anastomose est effectuée de manière conventionnelle sous contrôle de la vue [2, 9, 10, 11, 19]. L’anastomose est soit terminoterminale après ligature du moignon aortique, soit latéroterminale entre le niveau des artères rénales et l’ostium de l’artère mésentérique inférieure. Kolvenbach a développé une procédure vidéoassistée dite handassisted laparoscopic surgery (HALS), qui permet au chirurgien d’introduire sa main non dominante dans l’abdomen pour faciliter l’exposition et la dissection sous vidéoscopie [20, 29]. Après la création du pneumopéritoine, on pratique une incision sus-ombilicale de 6 cm qui permet la mise en place d’un gant étanche Handport (Handport, Smith & Nephew Surgical) [3]. L’optique est mise en position ombilicale, les deux trocarts opérateurs sont positionnés en triangulation en pararectal droit. La dissection de l’aorte est abordée de la même manière que celle décrite (cf supra), mais la main intrapéritonéale aide à la dissection et à l’exposition aortique [22, 23]. Le dispositif est ensuite retiré, un écarteur bivalvé expose l’aorte, et l’anastomose est confectionnée par minilaparotomie, déjà décrite (cf supra) (fig 2). La voie d’abord transpéritonéale a l’avantage de permettre une dissection plus aisée de la bifurcation aortique et de l’artère iliaque commune droite que la voie rétropéritonéale ou la voie rétrocolique transpéritonéale. Mais elle nécessite un système efficace pour maintenir les anses digestives en dehors du champ aortique ; sinon l’exposition ne peut être maintenue et il faut se repositionner en permanence. ¶ Voie rétropéritonéale Nous rapportons l’approche rétropéritonéale décrite par Edoga [8, 18]. Le patient est installé en décubitus dorsal avec un billot au niveau de la charnière dorsolombaire et une rotation du tronc de 30° du côté droit. L’opérateur principal est installé du côté gauche du patient, l’aide opératoire est en face, l’instrumentiste est du même côté que l’opérateur. Les genoux sont fléchis afin de relâcher le muscle psoas. Le champ opératoire comprend l’abdomen, le flanc gauche jusqu’aux muscles paravertébraux et les deux triangles de Scarpa. L’intervention débute par une incision cutanée verticale de 15 mm dans le flanc gauche, entre l’épine iliaque antérosupérieure et la douzième côte. L’aponévrose du grand oblique est incisée sur 30 mm, les trois plans musculaires sont dissociés, puis le décollement rétropéritonéal est débuté au doigt. Un trocart à ballonnet de 10 mm (trocart avec ballon d’étanchéité) est mis en place dans cette incision et permet d’introduire l’optique à 30°. Un ballon dissecteur (Preperitoneal Distension Balloon, OMS-PDBS2 Origin Medsystems) peut aider à débuter l’espace de décollement rétropéritonéal. On insuffle progressivement du CO2 afin d’obtenir un rétropneumopéritoine à une pression de 13-15 mmHg. Le décollement est complété à l’aide de l’optique, puis on positionne, sous contrôle de la vue, les deux autres trocarts opérateurs de 10 mm afin de travailler en triangulation (fig 4). La réclinaison de la cavité rétropéritonéale doit être prudente, car le péritoine reste accolé au bord externe des droits : il existe donc un risque de brèche péritonéale et donc de pneumopéritoine. La dissection s’effectue de proche en proche au tampon monté et à la pince fenêtrée en refoulant en dedans le sac péritonéal. Deux trocarts supplémentaires de 10 mm sont introduits, le premier sur la ligne médioclaviculaire, à 5 cm du ligament inguinal pour introduire un endorétracteur intestinal (fig 4), le second sous le rebord costal sur la ligne axillaire postérieure pour une canule d’aspiration, et ultérieurement pour le clamp aortique supérieur. Lors de la première partie de la dissection, Edoga cesse l’insufflation de CO2, après la mise en place d’un suspenseur de paroi (Laparolift, Origin Medsystems) pour diminuer ainsi le risque de pneumopéritoine par diffusion [8]. 3 43-029-P Revascularisation artérielle des membres inférieurs à partir de l’aorte sous-rénale : Techniques chirurgicales voies d’abord mini-invasives et laparoscopiques 4 Schéma de l’écarteur d’Edoga permettant la dissection de l’aorte sous-rénale par abord cœlioscopique rétropéritonéal. Patient installé en décubitus dorsal avec rotation du thorax de 30° sur la droite. Le sac péritonéal est refoulé en dedans après décollement rétropéritonéal par un écarteur à cinq branches. En cas de pneumopéritoine important, l’espace de dissection rétropéritonéal est diminué ; il faut alors l’exsuffler en introduisant une aiguille de Palmer en transpéritonéal au niveau de l’ombilic. La dissection vasculaire, débute par l’abord de l’artère iliaque primitive gauche, après repérage de l’uretère. La dissection est continuée jusqu’au repérage de l’artère rénale gauche après section sur clip de la veine hémiazygos lombaire. Le clampage aortique proximal se fait par l’intermédiaire du trocart sous-costal gauche. Le clampage distal se fait par le trocart inférieur, au-dessus du ligament inguinal gauche. Une minilaparotomie de 4 cm est centrée sur le trocart d’open cœlioscopie entre l’aile iliaque antérosupérieure et la douzième côte. L’anastomose proximale est effectuée sous contrôle de la vue, l’exposition restant la même que sous laparoscopie. L’anastomose peut être soit terminale, soit latérale. Les branches de la prothèse sont tunnellisées, en position anatomique, et sont anastomosées au niveau des artères fémorales communes de manière conventionnelle. La voie d’abord rétropéritonéale a l’avantage d’éviter tout contact avec les anses digestives, mais l’espace opératoire rétropéritonéal est plus réduit que l’espace opératoire de la cavité péritonéale, rendant la dissection plus difficile. De plus, l’espace de dissection rétropéritonéal a tendance à se réduire avec le temps de l’intervention, par diffusion du CO2 dans la cavité péritonéale, venant majorer la difficulté opératoire (l’exsufflation du pneumopéritoine par aiguille de Palmer n’est pas toujours efficace). VOIE TOTALEMENT LAPAROSCOPIQUE Actuellement, trois voies d’abord différentes sont décrites pour la revascularisation des membres inférieurs à partir de l’aorte sousrénale par voie totalement laparoscopique. L’anastomose proximale aortique est effectuée de façon totalement laparoscopique (endoanastomose) [5, 12, 14, 27] : – la voie transpéritonéale avec abord de l’aorte par décollement colique gauche prérénal ; – la voie mixte : transpéritonéale et rétropéritonéale ; – la voie rétropéritonéale exclusive. L’abord transpéritonéal direct, en décubitus dorsal, avec décollement duodénojéjunal a été abandonné par les partisans de l’abord totalement laparoscopique, en raison de la difficulté à obtenir une exposition stable (envahissement du champ opératoire par les anses grêles) [4, 5]. ¶ Voie transpéritonéale Il s’agit d’une voie transpéritonéale avec abord de l’aorte par décollement colique gauche prérénal. Cette voie d’abord 4 5 Schéma de l’installation du patient pour abord aortique rétrocolique transpéritonéal cœlioscopique. Patient installé en décubitus latéral droit, avec le bassin vrillé en dehors pour que les deux triangles de Scarpa soient accessibles. 1. Opérateur ; 2. aide 1 ; 3. aide 2. cœlioscopique, étudiée par Said [27, 28] sur le cadavre humain et développée par Coggia [12] , est similaire à celle décrite par laparotomie. Le patient est placé en décubitus dorsal avec un billot gonflable sous le flanc gauche. Le bras gauche est laissé libre, le bras droit est sur un appui-bras. Les membres inférieurs sont fléchis de 30° et fixés parallèlement. La mise en place de deux contre-appuis, au niveau du bord droit du thorax et du flanc, est indispensable pour maintenir le patient qui sera soumis à une inclinaison de 45° à droite avec la table, puis majorée de 35° par insufflation du billot gonflable (le patient est alors en décubitus latéral droit complet) (fig 5). Cette installation permet, grâce aux mouvements d’inclinaison de la table opératoire, de positionner le patient, soit en décubitus latéral droit pour l’abord de l’aorte, soit en décubitus dorsal pour les abords fémoraux. L’opérateur et l’aide principal sont face à l’abdomen, le deuxième aide est en face de l’opérateur (fig 5). La mise en place du trocart optique de 10 mm se fait par open cœlioscopie, au niveau de la ligne médioaxillaire gauche, à 3-4 cm en dessous du rebord chondrocostal. Les cinq autres trocarts sont introduits sous contrôle de la vue, après insufflation du pneumopéritoine à 15 mmHg. Les deux trocarts opérateurs sont espacés de 6 à 7 cm sur une ligne transrectale gauche parallèle à la ligne médiane, les deux trocarts du premier aide sont introduits respectivement : le premier en fosse iliaque gauche, le second sur la ligne médiane 5 cm au-dessus du pubis. Le dernier trocart est positionné sur la ligne médiane 2 cm sous la xiphoïde (fig 6). La voie latérocolique gauche comporte un décollement colique gauche avec abord prérénal de l’aorte. La table est inclinée à droite au maximum (soit 45°) et le billot gonflable est insufflé pour majorer le décubitus latéral droit de 30°. Le fascia de Toldt gauche est incisé de l’angle colique gauche jusqu’au mésosigmoïde, permettant de décoller tout le mésocôlon gauche. La veine génitale est repérée, la poursuite de la dissection prérénale permet de visualiser la veine rénale gauche qui est totalement libérée. La position du patient, en décubitus latéral droit, permet, par gravité, de récliner des anses intestinales sur la partie droite de la cavité abdominale (fig 7). La mise en place de points transpariétaux permet de fixer le mésocôlon à la paroi abdominale, réalisant ainsi un « néotablier péritonéal » qui permet une exposition stable de l’aorte. En cas de rein volumineux, Techniques chirurgicales Revascularisation artérielle des membres inférieurs à partir de l’aorte sous-rénale : voies d’abord mini-invasives et laparoscopiques 43-029-P Le jambage gauche, préalablement lié, est laissé en place dans l’abdomen car cette deuxième tunnellisation serait source de fuite du pneumopéritoine. 6 Schéma du positionnement des trocarts lors de l’abord aortique rétrocolique transpéritonéal cœlioscopique. 1. Optique 30° ; 2. Ciseaux-porte-aiguille ; 3. pince fenêtrée ; 4. aspirateur ; 5. pince fenêtrée-clamp distal ; 6. écarteur-clamp proximal. Le clampage aortique proximal et distal est effectué par des clamps laparoscopiques (B/Braun-Aesculap ou Storz-France) (cf fig 13) introduits par les trocarts 5 et 6 (fig 6). L’endoanastomose aortoprothétique est effectuée par voie totalement laparoscopique par deux hémisurjets de fil de polypropylène 3/0. Les endoanastomoses exigent un apprentissage régulier sur pelvitrainer, afin d’acquérir une dextérité suffisante avec les instruments endoscopiques (manipulations de l’aiguille avec l’endo-porteaiguille, réalisation d’endoanastomose, etc). On utilise des fils polypropylène de 3/0 de 18 cm de longueur dont l’extrémité est nouée sur un pledget (cf fig 15) ; ceci évite la confection du nœud initial, diminue le temps de suture et le traumatisme mécanique du fil. Pour des lésions occlusives, Coggia réalise une endoanastomose aortique terminolatérale. Après une artériotomie longitudinale aux ciseaux de Potts endovasculaire, l’endoanastomose débute par la confection d’un point de fixation, réalisé au niveau du talon de la prothèse. L’endoanastomose est débutée par l’hémisurjet latéral gauche avec un fil de suture de polypropylène noué sur un pledget. La confection du surjet est arrêtée au-delà de la pointe de la prothèse. On réalise de même l’hémisurjet latéral droit, et les deux hémisurjets sont alors noués en intracorporel. Nous avons, pour notre part, comme en chirurgie conventionnelle, pris le parti de réaliser une endoanastomose terminoterminale. Après une transsection aortique transversale sous-rénale, une collerette aortique de 3 cm est excisée afin de fermer le moignon aortique distal par un surjet aller-retour de polypropylène 3/0 (fig 8A, B). La suture vasculaire proximale est débutée sur le bord gauche de l’aorte par un point de fixation, qui se poursuit par l’hémisurjet postérieur (fig 8C, D). Le fil est tendu après chaque passage de points. L’hémisurjet postérieur est arrêté au niveau du bord latéral droit de l’aorte (fig 8E, F). L’hémisurjet antérieur complète l’anastomose ; les deux hémisurjets sont noués en intracorporel. 7 Coupe transversale montrant l’installation du patient en décubitus droit, avec billot gonflé majorant le décubitus droit. Le pneumopéritoine permet d’élargir l’espace de travail dans la grande cavité péritonéale. Le mésocôlon gauche a été décollé, il tombe à droite par gravité, réclinant les anses grêles dans le même temps. L’optique à 30° montre le champ de vision. un point d’écartement transpariétal de fixation de la loge rénale gauche permet de le maintenir en dehors du champ opératoire. Le feutrage celluloganglionnaire préaortique est incisé aux ciseaux coagulateurs afin de contrôler l’aorte sous-rénale. La visualisation de l’aorte est facilitée par l’utilisation d’une optique à 30° ; elle doit être circonférentielle pour en permettre le clampage proximal. La mobilisation de la veine rénale est nécessaire pour exposer l’aorte dans sa portion interrénale. Cette voie d’abord peut être étendue à l’aorte sus-rénale, en réalisant un décollement rétropancréatique. La dissection se poursuit aux artères iliaques primitives, après avoir contrôlé l’artère mésentérique inférieure. La dissection de l’artère iliaque primitive gauche est aisée, celle de l’artère iliaque droite est plus délicate ; en effet, celle-ci est vue en fuite et la racine de mésocôlon gauche limite son contrôle sur 4-5 cm au maximum. Pour effectuer l’abord des artères fémorales, la table est remise à plat et le billot est dégonflé. Après le temps fémoral, la table est réinclinée sur la droite pour introduire la prothèse bifurquée par l’un des trocarts. Le jambage droit prothétique est tunnellisé en position anatomique avant la réalisation de l’anastomose proximale. Le jambage gauche est ensuite tunnellisé. La table est remise à plat. Les anastomoses distales sur les artères fémorales communes sont réalisées de façon conventionnelle. Après déclampage, on vérifie l’hémostase du moignon aortique distal et l’anastomose proximale sous laparoscopie. Le mésocôlon est repositionné sous contrôle vidéoscopique, pour isoler la prothèse. Il n’est pas nécessaire de fixer le mésocôlon à la paroi. Le pneumopéritoine est exsufflé sur un drain de Redon (fig 9). Cette voie d’abord transpéritonéale rétrocolique résout les deux problèmes essentiels que sont l’exposition et l’espace opératoire. Au lieu d’écarteurs spécifiques, c’est la position du patient, en décubitus latéral, qui permet, par gravité, de récliner le mésocôlon gauche et les anses digestives hors du champ opératoire. Les anses digestives sont ainsi exclues du champ opératoire par le mésocôlon qui tient lieu de tablier péritonéal [12]. Le volume opératoire est important et stable dans le temps, permettant la réalisation d’endoanastomose de qualité. ¶ Voie mixte (transpéritonéale et rétropéritonéale) (fig 9) Cette voie d’abord transpéritonéale et rétropéritonéale est décrite par Dion [14, 15, 16, 17]. Elle est caractérisée par la création d’un tablier péritonéal, qui permet d’isoler les anses intestinales de la cavité opératoire sans diminuer le volume de cette dernière. Le patient est installé en décubitus dorsal avec un billot sous le flanc gauche. On introduit un trocart de 10 mm, au niveau de l’ombilic, pour créer un pneumopéritoine maintenu à une pression intra5 43-029-P Revascularisation artérielle des membres inférieurs à partir de l’aorte sous-rénale : Techniques chirurgicales voies d’abord mini-invasives et laparoscopiques * A * B * C * D * E 8 6 A. Vue opératoire de la suture du moignon aortique distal juste en amont de la naissance de l’artère mésentérique inférieure. Le moignon aortique proximal est clampé et est bien individualisé. B. Schéma de la vue opératoire de la figure 8A. Suture à l’aide d’un porte-aiguille et d’une pince fenêtrée. L’aspirateur sert d’écarteur. C. Vue opératoire de l’endoanastomose aortoprothétique terminoterminale : début de l’hémisurjet postérieur. D. Schéma de la vue opératoire de la figure 8C. Endoanastomose aortoprothétique terminoterminale laparoscopique : début de l’hémisurjet postérieur. * F E. Vue opératoire de l’endoanastomose aortoprothétique terminoterminale : fin de l’hémisurjet postérieur. F. Schéma de la vue opératoire de la figure 8E. Endoanastomose aortoprothétique terminoterminale : fin de l’hémisurjet postérieur. Techniques chirurgicales Revascularisation artérielle des membres inférieurs à partir de l’aorte sous-rénale : voies d’abord mini-invasives et laparoscopiques 43-029-P 9 Schéma des incisions après pontage aortobifémoral par voie transpéritonéale rétrocolique cœlioscopique. abdominale de 15 mmHg. Le patient est ensuite placé en position de Trendelenburg à 10°, avec la table inclinée à droite de 20°. Une incision verticale de 15 mm est réalisée au-dessus et en dedans de l’épine iliaque antérosupérieure ; on dicise les trois plans musculaires afin d’amorcer le plan du décollement rétropéritonéal au doigt. On introduit un trocart de 10 mm, avec une optique à 0° pour poursuivre la dissection. Un rétropneumopéritoine est créé avec une pression d’insufflation de 15 mmHg ; puis le pneumopéritoine est diminué à 8 mmHg pendant le temps rétropéritonéal. Deux autres trocarts opérateurs de 5 cm sont introduits de part et d’autre de l’optique pour la dissection rétropéritonéale (fig 10). Les progrès de la dissection sont suivis en parallèle par les deux laparoscopes afin de permettre une vue simultanée de la cavité péritonéale et du rétropéritoine. Dans l’espace rétropéritonéal, on repère le muscle psoas dans le plan postérieur, l’aorte en avant du muscle psoas et le bord latéral du muscle grand droit gauche dans le plan antérieur. Deux autres trocarts médians sont mis en place, un au-dessus de la symphyse pubienne, et l’autre en sus-ombilical. La création du « tablier » péritonéal débute par une incision du péritoine pariétal à 3 cm au-dessus de l’anneau inguinal interne gauche ; la dissection se poursuit le long du bord gauche du muscle grand droit gauche. Le bord libre du péritoine est transposé sur le côté droit de la ligne médiane, et est fixé à la paroi par trois points transpariétaux, réalisant ainsi un véritable « tablier » péritonéal (fig 10). L’exposition est complétée par la mise en place de deux rétracteurs abdominaux. La dissection de l’aorte s’effectue, après contrôle de l’artère iliaque gauche, jusque dans sa portion sous-rénale. La prothèse vasculaire est introduite dans la cavité rétropéritonéale et chaque branche est tunnellisée en position anatomique aux deux triangles de Scarpa avant la réalisation de l’anastomose proximale afin de maintenir la prothèse en place. La partie distale de l’aorte est occluse au niveau de l’artère mésentérique inférieure avec une pince GIA-60 cœlioscopique (USSC Norwalk CTUSA). L’aorte est ensuite sectionnée transversalement 15 mm en dessous du clamp proximal et une anastomose terminoterminale est réalisée par voie totalement laparoscopique par deux hémisurjets de fils Prolène 3-0, avec confection du nœud en intracorporel. Les anastomoses distales sont effectuées de manière conventionnelle sur les artères fémorales communes. 10 Coupe en perspective du champ opératoire selon Dion. Le tablier péritonéal a été fixé à la peau par trois points et maintient les anses digestives à droite en dehors de l’aorte. ¶ Voie rétropéritonéale La voie rétropéritonéale exclusive a été décrite par Said [27, 28], puis développée par Edoga [18] (qui associe une minilaparotomie pour la réalisation de l’anastomose vasculaire). La voie rétropéritonéale est une alternative lorsque la voie transpéritonéale est contre-indiquée (ventre hostile, adhérences péritonéales...) ou pour réaliser un abord électif de l’artère iliaque primitive (pontage iliofémoral). Le patient est placé en décubitus latéral droit comme pour l’abord transpéritonéal rétrocolique (cf supra). L’introduction de l’optique est réalisée par une incision de 15 mm au-dessus et en dedans de l’épine iliaque antérosupérieure en open rétropéritonéoscopie, avec au préalable une dissection de l’espace rétropéritonéal « au doigt » (cf supra). Le temps essentiel est la dissection du rétropéritoine sous vidéoscopie, jusqu’au niveau de la ligne médiane, pour éviter les brèches péritonéales. Les autres trocarts sont positionnés au bord externe du muscle grand droit gauche en triangulation. L’abord de l’aorte se fait selon la procédure décrite par Edoga (cf supra). Mais pour réaliser l’anastomose totalement laparoscopique (endoanastomose), il est nécessaire de repositionner l’optique au niveau du trocart transrectal sous le rebord chondrocostal, afin d’obtenir une vue complète de l’aorte. L’avantage majeur de la voie rétropéritonéale est l’exclusion des viscères du champ opératoire, au détriment de la diminution du volume de travail. Le risque de brèche péritonéale est important si la dissection n’est pas menée pas à pas, ce qui va entraîner une réduction de la cavité opératoire du fait du pneumopéritoine concurrentiel, source de conversion chirurgicale quasi systématique. Même si la voie rétropéritonéale exclusive a été abandonnée actuellement par la plupart des équipes, elle conserve des indications particulières à ne pas méconnaître. Matériels Les progrès de l’instrumentation, tels les bras-rétracteurs autostatiques, les colonnes vidéo, les instruments cœlioscopiques vasculaires spécifiques, ont permis le développement de la chirurgie vasculaire mini-invasive et laparoscopique. 7 Revascularisation artérielle des membres inférieurs à partir de l’aorte sous-rénale : Techniques chirurgicales voies d’abord mini-invasives et laparoscopiques 43-029-P 11 12 Instruments vasculaires endoscopiques : ciseaux coagulateurs, ciseaux de Potts, dissecteur angle droit, pinces fenêtrées. Clamps largables (B/Braun-Aesculap) servant pour l’occlusion des artères iliaques et de l’artère mésentérique inférieure. INSTRUMENTS LAPAROSCOPIQUES La réalisation de restauration aortique par voie laparoscopique nécessite une instrumentation standard de cœlioscopie, et des instruments spécifiques à la chirurgie vasculaire. ¶ Instrumentation de base Elle comprend (fig 11) : – une optique de 0°-10 mm ; – une optique de 30°-10 mm ; – une source de lumière froide ; – une colonne vidéo avec moniteur TriCDD (pour avoir une image de qualité optimale) ; – un insufflateur électronique ; – un trocart de 10 mm open cœlioscopique ; – six trocarts de 10 mm, avec pas de vis pour éviter les fuites de CO2 ; 13 Clamp aortique à mors de type De Bakey et à crémaillère sécurisée (B/BraunAesculap) utilisé pour le clampage aortique proximal et distal. – trois pinces à préhension fenêtrées de 5 mm, atraumatiques qui permettent de saisir les structures digestives lors de la dissection. Ces pinces doivent aussi être performantes pour la manipulation des aiguilles lors de la confection de l’endoanastomose ; – un ciseau coagulateur ; – un crochet droit coagulateur ou une pince à coagulation bipolaire ; – un aspirateur laveur. ¶ Instrumentation spécifique de laparoscopie vasculaire 14 Porte-aiguille à mors courbes (Microfrance-Xomed) et à poignée axiale utilisé pour la réalisation des endoanastomoses. utilisé pour la réalisation des endoanastomoses, mais aussi des fils de polypropylène de taille 3/0 sur un pledget libre utilisés pour la réalisation d’endopoints d’hémostase (fig 15). Elle comprend : – ciseaux de Potts laparoscopiques ; – clamps largables (Clamps B/Braun) pour l’occlusion de l’artère mésentérique et/ou des artères iliaques primitives (fig 12) ; – deux clamps droits aortiques avec mors de type De Bakey, à crémaillère sécurisée, de 10 mm de diamètre utilisés pour le clampage aortique proximal et distal (clamps laparoscopiques B/Braun-Aesculap ou Storz-France) (fig 13) ; Complications COMPLICATIONS PEROPÉRATOIRES ¶ Plaie des veines lombaires [2, 14] – un porte-aiguille à mors courbes (Microfrance-Xomed) et à poignée axiale utilisé pour la confection des endoanastomoses (fig 14) ; C’est la complication la plus fréquente ; l’hémostase en est parfois délicate car ces veines se rétractent rapidement en arrière vers le rachis. Le saignement peut être minimisé en vidéoscopie, lorsque l’on travaille en pression d’insufflation élevée, ce qui nécessite une approche particulièrement méticuleuse de ces veines dans cette technique. – deux écarteurs endoscopiques 10 mm (Endoretract ; Ethicon-France) ; ¶ Plaie des veines iliaques – fil de polypropylène de taille 3/0, d’une longueur de 18 cm, chacun fixé sur un pledget afin d’éviter la confection du nœud initial, Elle est réalisée généralement, comme par voie classique, lors de la dissection circonférentielle des artères iliaques. En cas de plaie 8 [2, 14] Techniques chirurgicales Revascularisation artérielle des membres inférieurs à partir de l’aorte sous-rénale : voies d’abord mini-invasives et laparoscopiques 15 Fils de polypropylène de taille 3/0 fixés sur un pledget afin d’éviter la confection du nœud initial, utilisés pour la réalisation des endoanastomoses (B/BraunAesculap). 43-029-P ¶ Hématome intrapéritonéal Il peut être observé après décollement rétrocolique gauche traumatique ou après manœuvres de tunnellisation sans contrôle visuel. Un drainage, au contact de la prothèse, doit être systématique [12]. ¶ Occlusion d’un jambage prothétique Elle est rapportée dans la plupart des séries [2, 18, 23] ; elle est en rapport avec la durée de clampage, la difficulté de purge et de lavage des jambages. Le contrôle de la tunnellisation des jambages prothétiques est souvent plus difficile et peut être responsable d’un certain nombre d’occlusions. Indications actuelles et résultats importante, l’hémostase est très difficile sous laparoscopie et impose une conversion chirurgicale dans la plupart des cas. Afin de limiter le saignement pendant la conversion, la plaie peut être contrôlée à l’aide d’une pince fenêtrée, ou par tamponnement. ¶ Pneumopéritoine L’apparition d’un pneumopéritoine après abord rétropéritonéal sous vidéoscopie [18, 27, 28] (par brèche péritonéale ou par diffusion), va venir fermer la zone de décollement rétropéritonéal et donc la cavité opératoire. Il n’y a pas d’intérêt à refermer les brèches péritonéales, ceci est difficile et souvent inefficace. Il faut préférer le positionnement d’une aiguille de Palmer dans l’hypocondre gauche afin d’exsuffler le pneumopéritoine. Le taux de conversion est élevé. ¶ Plaie urétérale Elle peut survenir lors de la dissection ou lors de la tunnellisation. Dans les deux cas, un bon contrôle visuel permanent doit permettre d’éviter cette complication [2, 8, 17]. ¶ Plaie digestive Elle peut survenir lors de la préhension des anses digestives avec les pinces fenêtrées ou par lésions d’électrocoagulation. Elle doit être réparée immédiatement par endosuture [2, 8]. ¶ Conversion chirurgicale Elle varie de 4,5 à 39 % des cas dans la littérature [4, 12, 17]. La cause principale de conversion est un saignement non contrôlable. Lors de l’approche rétropéritonéale, l’apparition d’un pneumopéritoine est une cause fréquente de conversion, par fermeture de la cavité opératoire. L’obésité est aussi un facteur de conversion lors de la phase d’apprentissage. L’échec de la réalisation de l’anastomose totalement laparoscopique est, bien évidemment, un facteur de conversion. COMPLICATIONS POSTOPÉRATOIRES PRÉCOCES ¶ Hématome rétropéritonéal Il est fréquent et est dû, généralement, à un décollement excessif de l’espace rétropéritonéal et à un défaut d’hémostase qui a été minoré par le pneumorétropéritoine. Un drainage de la loge rétropéritonéale doit être systématique. Ces hématomes sont à l’origine d’une majoration des douleurs postopératoires et du temps de séjour hospitalier [18, 27, 28]. Les indications de revascularisation artérielle des membres inférieurs, à partir de l’aorte ou des artères iliaques primitives, sont les mêmes que celles de la chirurgie conventionnelle. Elles restent limitées aux lésions longues et multiples des axes artériels iliaques, et après échec des traitements endovasculaires. Un examen tomodensitométrique abdominopelvien sans injection est indispensable avant d’envisager une revascularisation par voie mini-invasive et/ou laparoscopique ; il étudie l’importance et la localisation des calcifications aortiques et iliaques. Des calcifications aortiques circulaires sont une contre-indication à ces techniques. Actuellement, les partisans du « tout » laparoscopique s’opposent aux adeptes de la chirurgie aortique vidéoassistée : la controverse porte sur les temps de clampage et sur la difficulté de réaliser des endoanastomoses vasculaires sous laparoscopie. Les résultats publiés sont peu homogènes, incluant des patients non comparables entre les différentes séries (pontage aortobifémoral, aortounifémoral, pontage iliofémoral pour des artériopathies des membres inférieurs de grades II à IV). De plus, aucune de ces séries ne présente de résultats de perméabilité à moyen terme. Il n’existe pour l’instant pas d’étude prospective randomisée comparant la voie mini-invasive, la voie vidéoassistée et la voie totalement laparoscopique. La voie mini-invasive s’appuie sur les bases de la chirurgie conventionnelle ; elle reprend les mêmes voies d’abord en respectant au maximum la paroi, en évitant l’éviscération pour l’approche péritonéale ; la dissection et l’anastomose sont effectuées sous contrôle de la vue en permanence. L’apprentissage dérive directement de la chirurgie conventionnelle. La voie d’abord est progressivement réduite avec l’expérience. De plus, cette chirurgie ne nécessite que l’acquisition d’écarteurs autostatiques spécifiques. Les résultats sont pour l’instant aussi satisfaisants que ceux obtenus avec la voie vidéoassistée ou la voie totalement laparoscopique (tableau I). Pour les interventions totalement laparoscopiques, le taux de conversion varie de 4,5 à 39 % selon les séries [4, 12, 17]. La durée opératoire est toujours supérieure à celle de l’intervention par voie conventionnelle. La durée de l’intervention décroît avec l’apprentissage et l’expérience de l’opérateur. Le temps de clampage varie de 43 à 286 minutes selon les séries, avec un temps de clampage maximal pour les interventions avec anastomose terminoterminale totalement laparoscopique. Ce temps de clampage diminue aussi avec l’expérience, mais reste, pour l’instant, quelle que soit la technique, supérieur à celui de la chirurgie conventionnelle. Pour la voie vidéoassistée, les temps de clampage sont proches de ceux de la chirurgie conventionnelle, mais les temps d’intervention sont nettement majorés du fait de la dissection laparoscopique (tableaux II, III). 9 Revascularisation artérielle des membres inférieurs à partir de l’aorte sous-rénale : Techniques chirurgicales voies d’abord mini-invasives et laparoscopiques 43-029-P Tableau I. – Résultats de chirurgie aortique par voies mini-invasives. AOMI (nombre) AAA (nombre) Clampage aortique (minute) Durée opératoire (heure) Conversion (nombre) Mortalité (nombre) Morbidité Ceirvera [10] 0 11 52,8 (35-66) 2 h 10 - 0 18.2 % Rollet [26] 12 78 70 (22-94) 3 h 15 (2 h 00-4 h 15) - 1 12 % AOMI : artériopathie oblitérante des membres inférieurs ; AAA : anévrisme de l’aorte abdominale. Tableau II. – Résultats de chirurgie aortique laparoscopique avec suture vasculaire par voies mini-invasives. AOM I (nombre) AAA (nombre) Clampage aortique (minute) Durée opératoire (heure) Conversion (nombre) Mortalité (nombre) Morbidité Kolvenbachk [22] 29 12 43 (22-110) 2 h 45 (1 h 40-4 h 40) 3 1 5% Alimi [2] 28 10 86 (18-70) 4 h 40 (3 h 40-6 h 40) 1 0 26 % Arous [3] 5 0 3 h 55 (2 h 40-5 h 30) 0 0 10 % Said [27] 0 19 4h (3 h 50-4 h 20) 0 1 15 % 60 (45-110) AOMI : artériopathie oblitérante des membres inférieurs ; AAA : anévrisme de l’aorte abdominale. Tableau III. – Résultats de chirurgie aortique laparoscopique avec endoanastomose. AOMI Clampage aortique (minute) Durée opératoire (heure) Conversion (nombre) Mortalité (nombre) Morbidité USIC (jour) Barbera [4] 43 70 (55-120) 5 h 00 5 1 6,6 % 4 Dion [7] 10 12 (40-160) 5 h 00 (4 h 00-8 h 50) 3 - 0 30 % - Coggia [12] 23 57 (34-90) 4 h 50 (3 h 15-7 h 50) 9 1 8,6 % - AOMI : artériopathie oblitérante des membres inférieurs ; AAA : anévrisme de l’aorte abdominale ; USIC : unité de soins intensifs en cardiologie. Edoga [ 1 8 ] a fait une comparaison rétrospective des suites postopératoires de patients opérés par voie laparoscopique avec celles d’une série de patients opérés par voie classique. Il observe dans le groupe « laparoscopique » une diminution significative des temps de ventilation mécanique et de séjour en unité de soins intensifs. Conformément aux autres études, il observe une reprise précoce du transit et une diminution de la prise d’antalgiques [18]. Les techniques laparoscopiques nécessitent un équipement adapté à la chirurgie vasculaire, mais surtout un apprentissage de la cœlioscopie, peu enseignée pour l’instant dans le cursus vasculaire. Un apprentissage de la cœlioscopie sur pelvitrainer et sur cadavre nous paraît indispensable afin d’acquérir une dextérité nécessaire. Cet entraînement doit conduire à réaliser des endoanastomoses terminoterminales ou latéroterminales en moins de 25 minutes. La plupart des équipes qui ont développé ces techniques miniinvasives ou laparoscopiques ont débuté leur expérience par la réalisation de pontages aortobifémoraux, puis les ont appliquées au traitement des anévrismes aortiques sous-rénaux. La mise à platgreffe aortoaortique laparoscopique reste une intervention qui nécessite une expérience considérable. Cerveira [10] a fait une étude rétrospective de 65 patients comparant la chirurgie conventionnelle (n = 37), la chirurgie mini-invasive (n = 11), et la chirurgie vidéoassistée (n = 17). Les 65 patients présentaient un anévrisme de l’aorte abdominale limité à l’aorte sous-rénale, traité par mise à platgreffe aortoaortique. Il ne montre pas de bénéfice de la chirurgie vidéoassistée qui a une morbidité et une durée opératoire plus importantes que la voie mini-invasive. Pour Cerveira [10], la voie mini-invasive est une technique applicable à la plupart des patients, 10 elle respecte les mêmes règles que la chirurgie conventionnelle et ne nécessite pas un entraînement spécifique comme la chirurgie laparoscopique. Elle permet de diminuer la morbidité des laparotomies majeures et donne les mêmes avantages que la voie vidéoassistée en postopératoire, avec un temps opératoire plus court [10]. Une autre application de la chirurgie aortique laparoscopique est le traitement des complications de l’exclusion endovasculaire des anévrismes aortiques sous-rénaux. L’abord aortique laparoscopique permet de traiter les endofuites de type II, en clippant des artères lombaires ou l’artère mésentérique inférieure ; un banding du collet aortique a aussi été proposé dans des cas d’endofuite de type I [13, 24]. Conclusion Actuellement, deux méthodes de revascularisation mini-invasive s’opposent : la voie mini-invasive et la voie vidéoassistée et/ou totalement laparoscopique. La voie vidéoassistée ne semble pas présenter d’intérêt par rapport à la chirurgie mini-invasive. Elle n’apporte aucun bénéfice postopératoire et le temps opératoire est plus long. Mais elle permet de se familiariser avec la technique du « tout laparoscopique ». La voie totalement laparoscopique nous semble être la véritable alternative à la chirurgie mini-invasive, car elle offre les bénéfices d’une cœlioscopie complète. Elle permet en effet, pour des opérateurs bien entraînés, un contrôle aortique étendu (aorte sus- et sous-rénale) ; le champ opératoire est beaucoup plus vaste que celui qu’offre la voie miniinvasive. La place de cette chirurgie vasculaire laparoscopique reste à définir par rapport aux techniques de chirurgie conventionnelle et de Techniques chirurgicales Revascularisation artérielle des membres inférieurs à partir de l’aorte sous-rénale : voies d’abord mini-invasives et laparoscopiques revascularisation endovasculaire. L’avenir de cette technique dépend essentiellement de son apprentissage par le plus grand nombre. Son application se développera, si elle peut être facilement et correctement apprise par une majorité de chirurgiens vasculaires, afin d’obtenir des 43-029-P temps de clampage aortique et des durées d’intervention acceptables. On peut penser que grâce aux progrès de l’instrumentation et à l’expérience des opérateurs, les revascularisations rénales ou digestives seront réalisables. Références [1] Alimi YS, Hartung O, Cavalero C, Brunet C, Bonnoit J, Juhan C. Intestinal retractor for transperitoneal laparoscopic aortoiliac reconstruction: experimental study on human cadavers and initial clinical experience. Surg Endosc 2000 ; 14 : 915-919 [2] Alimi YS, Hartung O, Valerio N, Juhan C. Laparoscopic aortoiliac surgery for aneurysm and occlusive disease: when a minilaparotomy should be performed? J Vasc Surg 2001 ; 33 : 469-475 [3] Arous EJ, Nelson PR, Yood SM, Kelly JJ, Sandor A, Litwin DE. Hand-assisted laparoscopic aortobifemoral bypass grafting. J Vasc Surg 2000 ; 31 : 1142-1148 [4] Barbera L, Ludemann R, Grossefeld M, Welch L, Mumme A, Swanstrom L. Newly designed retraction devices for intestine control during laparoscopic aortic surgery: a comparative study in an animal model. Surg Endosc 2000 ; 14 : 63-66 [5] Barbera L, Mumme A, Metin S, Zumtobel V, Kemen M. Operative results and outcome of twenty-four totally laparoscopic vascular* procedures for aortoiliac occlusive disease. J Vasc Surg 1998 ; 28 : 136-142 [6] Berens ES, Herde JR. Laparoscopic vascular surgery: four case reports. J Vasc Surg 1995 ; 22 : 73-79 [7] Brustia P, Porta C. Left sub costal minilaparotomy in aortic surgery. Minerva Cardioangiol 2001 ; 49 : 91-97 [8] Castronuovo JJ Jr, James KV, Resnikoff M, McLean ER, Edoga JK. Laparoscopic-assisted abdominal aortic aneurysmectomy. J Vasc Surg 2000 ; 32 : 224-233 [9] Cerveira JJ, Cohen JR. The current status of laparoscopic aortic aneurysm repair. Ann Vasc Surg 2000 ; 14 : 95-97 [10] Cerveira JJ, Halpern VJ, Faust G, Cohen JR. Minimal incision abdominal aortic aneurysm repair. J Vasc Surg 1999 ; 30 : 977-984 [11] Chen MH, Murphy EA, Halpern V, Faust GR, Cosgrove JM, Cohen JR. Laparoscopic-assisted abdominal aortic aneurysm repair. Surg Endosc 1995 ; 9 : 905-907 [12] Coggia M, Bourriez A, Javerliat I, Goeau-Brissonniere O. Totally laparoscopic aortobifemoral bypass: a new and simplified approach. Eur J Vasc Endovasc 2002 ; 24 : 274-275/ [13] Conner MS 3rd, Sternbergh WC 3rd, Carter G, Tonnessen BH, Yoselevitz M, Money SR. Secondary procedures after endovascular aortic aneurysm repair. J Vasc Surg 2002 ; 36 : 992-996 [14] Dion YM, Chin AK, Thompson TA. Experimental laparoscopic aortobifemoral bypass. Surg Endosc 1995 ; 9 : 894-897 [15] Dion YM, Gracia CR, Ben ElKadi HH. Totally laparoscopic abdominal aortic aneurysm repair. J Vasc Surg 2001 ; 33 : 181-185 [16] Dion YM, Gracia CR, Demalsy JC. Laparoscopic aortic surgery. J Vasc Surg 1996 ; 23 : 539 [17] Dion YM, Gracia CR, Estakhri M, Demalsy JC, Douville Y, Piccinini E et al. Totally laparoscopic aortobifemoral bypass: a review of 10 patients. Surg Laparosc Endosc 1998 ; 8 : 165-170 [18] Edoga JK, Asgarian K, Singh D, James KV, Romanelli J, Merchant S et al. Laparoscopic surgery for abdominal aortic aneurysms. Technical elements of the procedure and a preliminary report of the first 22 patients. Surg Endosc 1998 ; 12 : 1064-1072 [19] Kline RG, D’angelo AJ, Chen MH, Halpern VJ, Cohen JR. Laparoscopically assisted abdominal aortic aneurysm repair: first 20 cases. J Vasc Surg 1998 ; 27 : 81-88 [20] Kolvenbach R. Hand-assisted laparoscopic abdominal aortic aneurysm repair. Semin Laparosc Surg 2001 ; 8 : 168-177 [21] Kolvenbach R, Ceshire N, Pinter L, Da Silva L, Deling O, Kasper AS. Laparoscopy-assisted aneurysm resection as a minimal invasive alternative in patients unsuitable for endovascular surgery. J Vasc Surg 2001 ; 34 : 216-221 [22] Kolvenbach R, Da Silva L, Deling O, Schwierz E. Videoassisted aortic surgery. J Am Coll Surg 2000 ; 190 : 451-457 [23] Kolvenbach R, Deling O, Schwierz E, Landers B. Reducing the operative trauma in aortoiliac reconstructions: a prospective study to evaluate the role of video-assisted vascular surgery. Eur J Vasc Endovasc Surg 1998 ; 15 : 483-488 [24] Kolvenbach R, Pinter L, Raghunandan M, Cheshire N, Ramadan H, Dion YM. Laparoscopic remodeling of abdominal aortic aneurysms after endovascular exclusion: a technical description. J Vasc Surg 2002 ; 36 : 1267-1270 [25] Matsumoto Y, Nishimori H, Yamada H, Yamamoto A, Okazaki Y, Kusume K et al. Laparoscopy-assisted abdominal aortic aneurysm repair. Circ J 2003 ; 67 : 99-101 [26] Rollet G, Amicabile P, Piquet P. Video-assisted miniinvasive retroperitoneral approach for treatment of infrarenal aortic diseases. In : Controversies and update in vascular and cardiovascular surgery. 2003 : 283-289 [27] Said S. Endoscopic aortofemoral bypass reconstruction: experimental and clinical results. Zentralbl Chir 2001 ; 126 : 129-133 [28] Said S, Mall J, Peter F, Muller JM. Laparoscopic aortofemoral bypass grafting: human cadaveric and initial clinical experiences. J Vasc Surg 1999 ; 29 : 639-648 [29] Silva L, Kolvenbach R, Pinter L. The feasibility of handassisted laparoscopic aortic bypass using a low transverse incision. Surg Endosc 2002 ; 16 : 173-176 [30] Turnipseed WD. A less-invasive minilaparotomy technique for repair of aortic aneurysm and occlusive disease. J Vasc Surg 2001 ; 33 : 431-434 11 Encyclopédie Médico-Chirurgicale 43-161-C 43-161-C Traitement endovasculaire des varices des membres inférieurs M Perrin Résumé. – La chirurgie endoluminale des varices est une technique ancienne, mais les procédures nouvelles qui utilisent la radiofréquence et le laser ont considérablement relancé son intérêt. En effet, l’énergie thermique qu’elles fournissent et délivrent dans la paroi veineuse permet d’obtenir une rétraction fibreuse de la veine et son occlusion. La description du matériel et des différentes méthodes utilisées pour obtenir ce résultat sont détaillées, ainsi que les difficultés, les incidents et accidents qui peuvent survenir lors de leur réalisation. Les indications et contre -indications de ces interventions endoluminales restent encore sujettes à discussion. L’évaluation des résultats est difficile en particulier pour les méthodes laser, car le matériel et les techniques utilisées sont variables et les procédures non standardisées. © 2003 Editions Scientifiques et Médicales Elsevier SAS. Tous droits réservés. Mots-clés : varices, chirurgie veineuse, radiofréquence, laser, endolaser, chirurgie endoluminale, grande veine saphène, Closurey. Introduction Le terme varices mérite d’être précisé. Une varice est une veine souscutanée dilatée en permanence qui présente des altérations pariétales (fig 1) dont le diamètre est supérieur à 3 mm en position debout. Elle est le plus souvent tortueuse mais le fait qu’elle est le siège d’un reflux est rarement mentionné. Par traitement endovasculaire on entend tout procédé thérapeutique réalisé depuis la lumière veineuse sans exérèse de la veine pathologique au plan anatomique, mais qui aboutit à sa suppression au plan physiopathologique, la sclérothérapie étant de principe exclue. La tendance générale en matière de traitement chirurgical est nettement en faveur des techniques mini-invasives. En pathologie vasculaire, le traitement endoluminal a connu un important développement dans le domaine artériel ; en pathologie veineuse, il s’était cantonné à la mise en place de dispositifs dans les interruptions de la veine cave inférieure [25] et le traitement des syndromes obstructifs [19]. Le traitement endovasculaire des varices n’avait connu jusqu’à ces dernières années qu’un développement limité. Historique La destruction endoluminale de la veine pathologique peut être obtenue par abaissement thermique (cryochirurgie) ou par augmentation thermique. L’utilisation de la cryochirurgie dans le Michel Perrin : Chirurgien vasculaire, ancien interne, ancien chef de clinique des Universités, ancien assistant des hôpitaux de Lyon, 26, chemin de Décines, 69680 Chassieu, France. traitement des varices est réalisée en introduisant une sonde dans la lumière veineuse dont l’extrémité est réfrigérée par détente du protoxyde d’azote qui permet de congeler la paroi veineuse. Cette application du froid au niveau de l’intima se heurte à un obstacle qui empêche de délivrer le froid en continu. En effet au bout de quelques secondes, la veine adhère à la sonde et lors du retrait de celle-ci, la totalité de la veine est entraînée avec la sonde réalisant ainsi une exérèse du vaisseau qui est dénommée cryoéveinage [17]. Si l’on veut éviter ce phénomène, on doit appliquer le froid en discontinu et durant un laps de temps très court, c’est la technique de la cryosclérose dont les inconvénients ont bien été démontrés, à savoir la survenue d’une reperméation de la veine traitée [17]. Les propriétés du courant électrique pour obtenir une élévation thermique sont connues depuis fort longtemps. Le courant électrique continu a initialement été utilisé pour détruire la paroi des veines pathologiques, mais en fait il engendrait essentiellement une thrombose. Avec l’usage du courant alternatif et en particulier des courants à haute fréquence, le résultat recherché a été obtenu. Enfin, l’effet thermique peut également être transmis aux tissus en utilisant l’énergie lumineuse émise par une fibre laser. Principe et mode d’action des différentes techniques endoluminales RADIOFRÉQUENCE Elle fournit une énergie thermique contrôlée qui élève la température au niveau de la paroi vasculaire. Il en résulte d’une part une destruction de l’intima et d’autre part une contraction et un épaississement des fibres de collagène contenues dans l’adventice Toute référence à cet article doit porter la mention : Perrin M. Traitement endovasculaire des varices des membres inférieurs. Encycl Méd Chir (Editions Scientifiques et Médicales Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales - Chirurgie vasculaire, 43-161-C, 2003, 11 p. 43-161-C Traitement endovasculaire des varices des membres inférieurs 1 * A Histopathologie d’une veine variqueuse. A. L’endoveine est d’épaisseur inégale. La média est régulièrement épaissie avec un aspect de fibrose. Adventice normale. Coloration trichrome-vert lumière. B. Les fibres élastiques pathologiques sont colorées à l’orcéine. * B * A 2 Techniques chirurgicales * C * B Histopathologie de la veine saphène après Closurey. A. Nécrose de coagulation de l’intima et de la média. Coloration trichrome-vert lumière. B. Au sein du foyer de nécrose, les myocytes de la média sont étirés, aplatis. Coloration trichrome-vert lumière. C. Les fibres élastiques sont fragmentées. Orcéine. 3 Transformation fibreuse du tronc de la grande veine saphène. Contrôle à 4 ans après procédure Closurey par échodoppler. et surtout la média (fig 2). Ce dernier phénomène est bien connu et décrit dans la littérature. La contraction des fibres de collagène est secondaire à une déconnexion de la structure moléculaire hélicoïdale avec maintien des ponts intramoléculaires thermorésistants. Ainsi, le diamètre veineux est réduit de façon très importante par la contraction et l’épaississement des fibrilles de collagène mais également par le spasme induit par l’élévation de la température. Ces phénomènes induisent secondairement une évolution fibreuse, le plus souvent progressive, aboutissant à l’occlusion de la lumière veineuse (fig 3). La procédure étant réalisée sur une veine vide de sang, la formation de thrombus est réduite au minimum ce qui élimine le risque de recanalisation par thrombolyse. La radiofréquence produit cet effet thermique contrôlé à partir d’un générateur relié à un cathéter. Les cathéters utilisés présentent des électrodes bipolaires qui délivrent une température de 85 °C à leur extrémité (fig 4). Cette élévation thermique est obtenue sur une 2 4 Extrémité des cathéters Closurey 6 et 8 F. bague de 6 à 8 mm de long. La diffusion de la température est fonction de la distance qui la sépare de l’électrode, la température diminuant progressivement lorsque l’on s’éloigne du point de contact du cathéter avec la veine pour atteindre des valeurs de l’ordre de 43 °C à 2 mm de distance. C’est la raison pour laquelle l’énergie thermique est diffusée de manière continue. LASERS Le laser agit par action thermique en trois étapes complexes et successives : – Une conversion de la lumière laser en chaleur par diffusion optique. Le volume chauffé, ici le sang est dénommé « volume Techniques chirurgicales Traitement endovasculaire des varices des membres inférieurs * A 5 Histopathologie de la veine saphène après procédure laser. A. Coloration trichrome-vert lumière. B. Nécrose de coagulation intéressant l’endoveine. Orcéine * B * C C. Nécrose de coagulation localisée intéressant l’endoveine. Coloration trichrome-vert lumière. 6 7 Aspect atrophique à l’échodoppler de la veine traitée par laser à 6 mois. chauffé primaire ». La conversion de la lumière en chaleur varie en fonction du milieu dans lequel la lumière est délivrée. Comme l’a bien démontré Proebstle [21, 22] en étudiant les effets du laser diode (810 nm, 940 nm et 980 nm), l’action est différente lorsque la lumière est délivrée dans le sérum salé, le plasma ou le sang. L’énergie laser, lorsqu’elle est délivrée dans le sang par une fibre de 600 µm par pulsions successives d’une durée variable, provoque des bulles de vapeur générées par le sang hémolysé. En effet lors de la procédure, la veine traitée n’est pas exsanguinée. – Le transfert de chaleur par conduction dans les tissus avoisinants, c’est-à-dire la paroi veineuse. Ce sont les bulles qui transmettent l’énergie thermique à la totalité de la circonférence de la paroi interne veineuse, c’est le « volume chauffé secondaire ». La température moyenne mesurée à l’extrémité de la fibre laser est en moyenne de 729 °C [28]. L’effet thermique a une faible diffusion dans le milieu sanguin : sa capacité de pénétration dans les tissus est de 0,3 mm [22] ; – La troisième étape est thermochimique. Elle conduit à la destruction des tissus. L’aspect histopathologique [23, 28] (fig 5) et échographique (fig 6) de la veine traitée est bien renseigné. Appliqué en continu, le laser peut être à l’origine de perforation de la paroi veineuse [28]. Matériel et techniques MATÉRIEL SPÉCIFIQUE ¶ Radiofréquence Le matériel est actuellement commercialisé par une seule firme sous l’appellation Closurey. Pour réaliser cette procédure, il faut disposer : – d’un générateur de radiofréquence ; 43-161-C Fibre laser de 600 µm dans son cathéter. – de cathéters Closurey 6 et 8 french (F) (fig 4) ; – d’une boîte d’instruments chirurgicaux pour phlébectomie ; – d’un introducteur à valve et d’un guide ; – d’un prêt-à-monter de perfusion avec du sérum hépariné (sérum salé à 0, 9 % additionné de 10 000 UI d’héparine pour 1000 mL) ; – d’un système de repérage du cathéter : échographe adapté à l’analyse mode B des tissus superficiels (sonde de 7,5 MHz, doppler pulsé) ou équipement radiographique. Cette intervention est généralement réalisée en salle d’opération. ¶ Laser endoveineux Le matériel est actuellement commercialisé par plusieurs firmes qui proposent soit le laser diode, soit le laser YAG. Pour réaliser cette procédure, il faut disposer : – d’un générateur laser ; – d’une fibre laser (fig 7) ; – d’une boîte d’instruments chirurgicaux pour phlébectomie ; – d’un introducteur à valve et d’un guide ; – d’un système de repérage du cathéter : échographe adapté à l’analyse mode B des tissus superficiels (sonde de 7,5 MHz, doppler pulsé). Cette intervention est réalisée en salle d’opération ou en salle de consultation [7]. TECHNIQUE ¶ Points communs à la radiofréquence et au laser endoveineux La radiofréquence et le laser endoveineux ont un certain nombre de points communs dans leur réalisation. L’intervention, réalisée le plus souvent sous anesthésie locale (tumescente dans la plupart des cas) ou locorégionale, nécessite : 3 Traitement endovasculaire des varices des membres inférieurs 43-161-C 8 * A * B * C Techniques chirurgicales Procédure Closurey. A. Le cathéter a été introduit électrodes repliées dans la lumière de la veine à traiter. B. Le cathéter positionné, les électrodes sont déployées et au contact de la paroi veineuse. C. L’énergie thermique induite par la radiofréquence est délivrée. La paroi veineuse se contracte. D. Le cathéter est retiré lentement au-dessous de la veine traitée qui s’est rétractée. * D – soit un miniabord chirurgical par exposition limitée de la partie distale de la veine à traiter qui peut être extériorisée à l’aide d’un crochet de phlébectomie, puis ouverte par phlébotomie ; – soit une ponction percutanée. En pratique, la veine est abordée au-dessous du segment à traiter (la jarretière le plus souvent pour le tronc de la grande veine saphène) après repérage à l’échodoppler. Un fil-guide métallique ou mieux hydrophile droit ou en J est alors monté, sa position est contrôlée par échodoppler. Un introducteur est ensuite mis en place sur le fil-guide. En fin d’intervention, le cathéter (Closurey) ou l’ensemble fibrecathéter (laser) est retiré de la lumière veineuse. L’incision cutanée est fermée et une compression par bande ou par bas élastiques est mise en place immédiatement sur le membre traité. ¶ Procédure Closurey Procédure de base Le choix du type de cathéter est fonction du calibre de la veine à traiter : 6 F (1,7 mm) pour les veines d’un diamètre de 2 à 8 mm mesuré en décubitus et 8 F (2,7 mm) pour les veines de 4 à 12 mm. À noter que les deux cathéters admettent un guide de 0,25 pouce (inch) qui permet de cathétériser la veine lorsqu’elle est tortueuse. Le cathéter est connecté au générateur et à la perfusion de sérum hépariné qui sera maintenue pendant toute l’intervention afin de prévenir la formation de thrombus à l’intérieur du cathéter. Ce dernier est monté électrodes repliées (fig 8A) jusqu’au niveau supérieur du segment à traiter. Le membre est alors exsanguiné par mise en place d’une bande d’Esmarch complétée par une compression manuelle en regard de l’extrémité du cathéter et le malade basculé d’environ 20° tête en bas. Les électrodes sont déployées afin d’entrer en contact avec la paroi veineuse (fig 8B) ; on effectue alors un repérage précis (échographique ou fluoroscopique) du positionnement de la sonde et il importe de ne plus mobiliser le membre. Les différents paramètres s’affichent sur l’écran du générateur : puissance (6 watts), température (85 °C) et durée de la procédure (999 s). Avant de commencer la procédure, on procède à un test d’impédance. La valeur affichée doit être égale ou supérieure à 200 ohms confirmant le bon contact des électrodes avec la paroi veineuse. On démarre alors la procédure thérapeutique. Le cathéter dont les électrodes sont au contact de la paroi veineuse est alors lentement retiré de la proximalité à la distalité (fig 8C, D) à 4 9 Procédure Closurey. Contrôle peropératoire par échodoppler du positionnement de l’extrémité du cathéter. Ici, le cathéter est positionné entre 5-10 mm de la jonction saphénofémorale. une vitesse comprise entre 2 et 3 cm/min et les différents paramètres surveillés en permanence. Le respect de la température (85 +/- 3 °C) conditionne la vitesse de mobilisation du cathéter Closurey. Par ailleurs, l’impédance en cours de procédure doit être au minimum de 150 ohms avec le 6 F et de 100 ohms avec le 8 F. Variantes Bien que le protocole de la technique Closurey soit très codifié, quelques variantes ont été développées au plan technique par ses utilisateurs. Certains préfèrent engager le cathéter dans la lumière fémorale puis le retirer électrodes déployées pour le positionner avec précision au niveau de la terminaison du tronc saphène (fig 9). Comme il a été mentionné plus haut, deux techniques de repérage peuvent être utilisées, elles sont le plus souvent choisies en fonction des disponibilités locales en matière d’investigations. L’échodoppler [20] est utilisé lors de l’abord de la veine à cathétériser, pour suivre la progression du cathéter et son positionnement final avant que la radiofréquence soit délivrée et enfin pour contrôler l’efficacité de la procédure en fin d’intervention (absence de flux). L’usage de l’échodoppler nécessite la présence d’un opérateur rompu à cette investigation, mais il est plus rapide que le mapping radiologique et peut être répété aisément. Les techniques radiologiques ont fait l’objet d’une description et d’une évaluation détaillées [12]. La scopie permet de suivre la progression du cathéter car il est radioopaque. Elle n’est utilisée qu’en cas de difficulté de progression. Techniques chirurgicales Traitement endovasculaire des varices des membres inférieurs 43-161-C 10 Procédure laser. La distance entre le point d’introduction de la fibre et la partie supérieure de la veine à traiter est mesurée et reportée sur la fibre laser. 11 L’extrémité de la fibre laser est positionnée 2 cm au-dessous de la jonction saphénofémorale ; elle dépasse de 2 cm le cathéter. 12 Procédure laser. La fibre laser est facilement identifiée lorsqu’elle sort à l’extrémité proximale du cathéter. Complétée par l’injection de produit de contraste, elle permet de vérifier le positionnement du cathéter juste avant la mise en œuvre de la radiofréquence. En fin d’intervention, l’absence de flux dans la veine traitée est plus rarement contrôlée par angiographie. ¶ Procédure laser Dans un premier temps, on matérialise par un Steri-Stript sur le cathéter la longueur de la veine à traiter. Il correspond à la distance entre le point d’introduction et le point qui correspond à la limite supérieure de la veine à traiter (fig 10). De la même façon, on matérialise sur la fibre laser la longueur portée sur le cathéter augmentée de 2 cm. Le cathéter est alors introduit dans la lumière veineuse et monté sur le fil-guide par l’introducteur laissé en place après éventuelle vérification du reflux et rinçage au sérum salé. Son extrémité doit être positionnée 4 cm au-dessous de la limite supérieure de la veine à traiter (fig 11), sa position est aisément vérifiée par échodoppler alors que la fibre laser est difficile à identifier. Le fil-guide est alors retiré et la fibre laser connectée au générateur en position d’attente (stand-by). La fibre laser est alors introduite dans la lumière du cathéter et montée jusqu’à ce que son extrémité devienne visible (on parle de faisceau de visée), ce qui se produit dès qu’elle émerge du cathéter en raison de sa luminescence (fig 12). L’extrémité de la fibre est donc positionnée 2 cm au-dessous du niveau supérieur de la veine à traiter (fig 11). La fibre et le cathéter sont solidarisés. Si l’on utilise l’anesthésie locale qui n’avait été réalisée qu’au point d’introduction, elle est alors complétée tout le long du trajet de la veine à traiter. L’anesthésie par tumescence est la plus utilisée. Toutes les personnes présentes dans la salle mettent leurs lunettes de protection. L’ensemble fibre et cathéter est alors retiré conjointement et les impulsions laser délivrées de façon étagée et en discontinu (fig 13). Les différents paramètres (durée de l’impulsion, distance entre deux impulsions, etc) varient en fonction du type de laser utilisé. Ces différences sont regroupées dans le tableau I. Cependant, certains délivrent l’énergie laser en continu. La visualisation à travers la peau du faisceau de visée permet, dans la plupart des cas, de voir la progression de l’extrémité de la fibre laser durant la procédure. 13 Procédure laser. Le tir laser est réalisé en discontinu lors du retrait de la fibre. ¶ Procédures complémentaires Lorsque la veine traitée est le tronc de la grande ou de la petite veine saphène, un certain nombre de gestes peuvent être réalisés en complément. Crossectomie Elle n’est plus pratiquée dans la technique Closurey car une étude [3] a démontré que les résultats étaient équivalents avec ou sans crossectomie. Dans la procédure laser, elle peut être associée [4] ou non [7, 8, 14, 22]. Phlébectomie ou sclérothérapie des collatérales Dans la technique Closurey, la phlébectomie par mini-incisions étagées des collatérales est le plus souvent associée dans le même temps au traitement de l’insuffisance tronculaire ; la sclérothérapie est utilisée en règle en postopératoire. Dans les techniques laser, la phlébectomie peut être réalisée avec la fibre laser [4]. Dans les autres séries, les collatérales pathologiques ont été traitées dans le même temps opératoire par phlébectomie étagée [8] ou ultérieurement par sclérothérapie [14, 22]. 5 Traitement endovasculaire des varices des membres inférieurs 43-161-C Techniques chirurgicales Tableau I. – Différents lasers et leur mode d’utilisation. Auteur Type de laser Longueur d’onde en mm Durée de l’impulsion (s) Distance entre chaque impulsion (mm) Durée entre chaque impulsion (s) Vitesse de traction de la fibre : durée (s)/distance (cm) I Énergie délivrée (J) a à chaque impulsion b totale II Puissance délivrée (W) Chang [4] YAG 1 064 10 / Min [14] Diode 810 1 2 0,8-1 / I b = 15 240 moyenne II = 10-15 II = 10-12 Diode 810 1 / / / Ia=6 Diode 940 1 5-7 2 / Diode 980 1,5-3 3 1,5 / I a = 15 II = 15 II = 10-13 Guex [8] Navarro [15] Proebstle [22] Gérard [7] Difficultés, incidents et accidents peropératoires RADIOFRÉQUENCE 10/1 Exsanguination ? Compression manuelle Compression manuelle Non Non ¶ Échec immédiat Deux échecs peropératoires sur une série de 97 cas [15] qui ont consisté en deux non-occlusions immédiates dont l’une liée à une perforation. ¶ Cathétérisme impossible Bien que cette difficulté ait été rarement rapportée, elle est survenue dans quatre cas sur 170 [12] ; elle a pu être résolue par la montée d’un guide dans la moitié des cas. ¶ Fausse route Elle peut être due : – à l’engagement du cathéter Closurey dans une collatérale de la veine à traiter qui n’est pas toujours évidente, la surveillance de la progression par échodoppler se révèle ici précieuse ; – à une perforation : l’attention de l’opérateur est attirée par une augmentation importante du chiffre de l’impédance qui atteint des valeurs de 600 à 800. Quelle est la conduite à tenir ? On retire le cathéter Closurey puis on exerce une compression manuelle au niveau de la perforation pendant quelques minutes, on réintroduit le cathéter sur un filguide, on effectue un test d’impédance et l’on reprend la procédure. Bilan préopératoire – Le bilan général est superposable à celui qui est réalisé dans la chirurgie classique d’exérèse [17]. Il est fonction de l’âge de l’opéré et de la modalité anesthésique qui a été arrêtée. – Une investigation par échodoppler avec cartographie complète doit dans tous les cas précéder le traitement endoluminal des varices. Suites opératoires Le malade, quelle que soit la technique utilisée, quitte le service le jour même avec une prescription d’antalgique à la demande et une compression pour 2 à 3 semaines. La marche est autorisée dès le premier jour. Le traitement anticoagulant a été prescrit de principe dans deux séries [7, 22]. Le malade est revu en routine dans un délai de 4 à 8 jours. ¶ Thrombus au niveau des électrodes L’opérateur en est averti dans un premier temps par la modification du paramètre impédance (supérieur à 800 ohms) puis par l’arrêt du générateur. En effet, l’énergie délivrée est une énergie contrôlée et autorégulée par la thermosonde située sur une des électrodes du cathéter Closurey. Il convient alors de retirer le cathéter et d’enlever le coagulum qui s’est formé sur les électrodes, puis on reprend la procédure. Complications ¶ Échec immédiat par non-oblitération de la veine traitée Les complications postopératoires sont listées dans le tableau II. On peut soit recommencer immédiatement la procédure Closurey, soit avoir recours à la chirurgie d’exérèse classique. D’où l’intérêt d’un contrôle immédiat peropératoire. LASER ENDOVEINEUX Nous avons identifié dans la littérature deux séries où des problèmes peropératoires étaient signalés. ¶ Cathétérisme impossible Impossibilité de monter la fibre laser chez dix patients sur 149 [4] ; la difficulté a été tournée en cathétérisant le tronc saphène à partir de la crossectomie. 6 Elles ont été répertoriées de façon précise dans l’étude Closurey Pilote (cf infra). Elles sont parfois plus difficiles à cerner pour les procédures laser. CLOSUREy Les hématomes, l’infection et les thromboses veineuses superficielles n’ont pas donné lieu à réintervention. Les dysesthésies se situent essentiellement dans le territoire du nerf saphène et ont été beaucoup plus fréquentes chez les patients dont la procédure a été conduite jusqu’à la cheville. Deux autres types de complication ont été notés. Brûlures dermiques. Sur les 330 membres traités, les brûlures dermiques relevées dans l’étude Closurey Pilote concernent sept cas, soit 2,4 % du total. Toutes ces brûlures étaient de degré I. Six patients sur sept présentaient une brûlure dermique comprise entre 0,5 et 3 cm de longueur avec un diamètre inférieur à 0,2 mm. Cette complication est directement liée à la procédure et indirectement à la morphologie du patient (vitesse insuffisante de Traitement endovasculaire des varices des membres inférieurs Techniques chirurgicales 43-161-C Tableau II. – Complications et leurs séquelles après Closurey. Type de complications Hématome Infection Thrombose veineuse superficielle Dysesthésies 1 semaine 6 mois 1 an 2 ans 3 ans (n = 244) (n = 242) (n = 252) (n = 149) (n = 68) 14 (5 %) 0 6 (2 %) 1 (0,4 %) 0 1 (0,4 %) 0 0 0 0 0 0 0 0 0 42 (14 %) 24 (10 %) 9 (3,6 %) 8 (5,4 %) 0 Tableau III. – Complications et leurs séquelles après laser YAG. Type de complications Hématome Œdème Thrombose veineuse superficielle Dysesthésies Pigmentation Brûlures superficielles/cicatrices 1 semaine 6 mois 12-24 mois (n = 252) (n = 252) (n = 252) 2 (0,8 %) 252 (100 %) 4 (1,6 %) 92 (36,5 %) 58 (23 %) 12 (4,8 %) 0 0 0 7 (2,8 %) 2 (0,8 %) 6 (2,4 %) 0 0 0 0 0 0 (tableau IV) plus difficiles à identifier dans les autres séries [14, 22]. Un échodoppler de contrôle systématique du réseau veineux profond a été effectué dans deux séries [7, 14] (respectivement 20 et 33 patients), il n’a pas été identifié de thrombose veineuse profonde. Indications CONTRE-INDICATIONS GÉNÉRALES retrait du cathéter en fin de procédure et/ou veine superficielle à moins de 10 mm de la surface de la peau). Il faut rajouter que les cas de brûlures dermiques sont apparus au tout début de la série et que sur les 200 derniers patients inclus, aucune complication de ce type n’a été signalée. Actuellement, une évaluation par ultrasons de la profondeur des segments veineux à traiter est systématique et permet d’identifier les patients susceptibles de présenter une telle complication. Une infiltration de sérum physiologique ou une anesthésie tumescente sur le segment à traiter est alors effectuée. Cette amélioration technique a supprimé cette complication. Thrombose veineuse profonde. Sur les 330 membres traités, trois thromboses veineuses profondes ont été observées (0,9 %). Deux de ces thromboses étaient asymptomatiques, la dernière s’est manifestée par une embolie pulmonaire (0,3 %) de gravité moyenne qui a nécessité une hospitalisation et un traitement par anticoagulant. Ces trois complications thromboemboliques sont survenues précocement et ont été identifiées à l’échodoppler. Ces thromboses étaient localisées dans la veine fémorale commune en regard de la jonction saphénofémorale. Après avoir repris le dossier du patient qui avait présenté une embolie pulmonaire, il est apparu que le positionnement du cathéter n’avait pas respecté les consignes techniques. De surcroît, le patient n’avait pas pu suivre les conseils de déambulation précoce en raison de la survenue d’une entorse de cheville. LASER ENDOVEINEUX Trois études fournissent des informations inégales. Elles sont détaillées dans la série de Chang [4] (tableau III) et de Proebstle [21] Elles ne sont pas différentes des contre-indications retenues dans la chirurgie classique d’exérèse [17] : grossesse ou désir de grossesse à court terme, thrombose veineuse profonde récente, patient ne pouvant déambuler normalement, état général médiocre, etc.… CONTRE-INDICATIONS SELON LA MÉTHODE ¶ Closurey Un certain nombre de contre-indications sont retenues : veine dont le diamètre mesuré en décubitus est supérieur à 12 mm, présence de tortuosités trop importantes sur le vaisseau à traiter, artère fémorale très proche du tronc de la grande veine saphène [6]. La position très superficielle de la grande veine saphène n’est pas une contreindication car le risque de brûlure cutanée peut être évité comme nous l’avons indiqué dans le paragraphe traitant des complications. ¶ Laser endoveineux Aucune contre-indication spécifique liée à la morphologie ou au diamètre de la veine à traiter n’a été identifiée dans la littérature. INDICATIONS EN FONCTION DE LA LOCALISATION AU PLAN ANATOMIQUE OU TOPOGRAPHIQUE DES VARICES À TRAITER La grande veine saphène est la veine qui a été le plus fréquemment traitée par procédure endoluminale et on se limite le plus souvent à la portion située au-dessus de la jarretière en raison du risque de léser le nerf saphène dans le segment crural. Ce même risque neurologique fait que la petite veine saphène a été plus rarement traitée par procédure endoluminale mais on dispose néanmoins d’une série de petites veines saphènes traitées par laser diode [21]. Tableau IV. – Complications et leurs séquelles après laser diode dans la chirurgie de la petite veine saphène. Complications Membres Durée du suivi (semaine) Nombre % Moyenne Extrêmes Douleur 20 54 1 0,2-4 Douleur nécessitant un analgésique 18 49 1 0,2-4 Ecchymoses 17 46 2 1-4 Induration sur le trajet 14 38 4 1-4 Paresthésies 4 11 6,5 3-8 Thrombose veineuse superficielle 3 8 1,5 1,5-4 Thrombose veineuse profonde 1 3 / / 7 Traitement endovasculaire des varices des membres inférieurs 43-161-C Techniques chirurgicales Tableau V. – Résultats échodoppler après Closurey. Échodoppler Absence de flux Absence de reflux Résultat à 6 semaines Résultat à 1 an Résultat à 2 ans Résultat à 3 ans (n = 244) (n = 252) (n = 149) (n = 68) 227 (93 %) 235 (96 %) 213 (85 %) 226 (88 %) 128 (86 %) 130 (87 %) 60 (88 %) 60 (88 %) Les collatérales de la saphène variqueuses non associées à une insuffisance de crosse ou du tronc peuvent également être traitées par laser endoveineux [16]. INDICATIONS EN FONCTION DU CONTEXTE CLINIQUE Elles sont superposables en théorie à celles qui sont retenues dans le traitement conventionnel chirurgical des varices par exérèse [17] à quelques exceptions. En présence d’une thrombophlébite superficielle, la chirurgie endoluminale paraît contre-indiquée. Dans les récidives variqueuses, elle semble devoir être réservée au traitement du tronc de la grande saphène incontinent non traité lors de la chirurgie première et dont le reflux est alimenté par des veines périnéales ou par une néovascularisation au pli de l’aine, voire par une perforante du canal fémoral [6]. INDICATIONS AU PLAN TECHNIQUE Si le traitement du tronc saphène incontinent est une des bases du traitement, les collatérales de la saphène, siège d’un reflux, doivent également être traitées. On a le choix entre la phlébectomie par incisions étagées qui peut être réalisée dans le même temps opératoire que la chirurgie endoluminale du tronc, mais celle-ci peut également être entreprise dans un deuxième temps [ 11 ] . La sclérothérapie postopératoire est une autre alternative. Résultats Nous ne disposons pas actuellement de résultats au-delà de 3 ans pour ces techniques endoluminales. Il est classique d’apprécier d’une part ces résultats au plan clinique (symptômes, signes, score de sévérité, satisfaction du médecin et/ou du patient, questionnaire de qualité de vie) et d’autre part au plan échodoppler. La corrélation entre ces deux résultats n’a été faite que pour la technique Closurey [13]. Même s’il a été établi qu’il existe une corrélation relativement satisfaisante entre la mise en évidence d’un reflux au niveau du réseau veineux superficiel et la présence de varices et/ou d’une symptomatologie veineuse [1], une autre étude [26] a montré l’absence de corrélation entre symptomatologie et résultat cosmétique apprécié par le patient et la présence d’un reflux au doppler continu. RADIOFRÉQUENCE Le collectif que nous désignerons par groupe Closurey Pilote fait l’objet d’une étude multicentrique, prospective ; ses résultats sont rapportés régulièrement [10, 11, 13, 18] et réévalués en permanence. Deux cent quatre-vingt-quatorze patients (330 membres inférieurs traités), dont 77 % de femmes d’âge moyen 46,2 ans, ont été inclus dans 31 centres entre décembre 1998 et octobre 1999. La répartition topographique des veines traitées s’établit ainsi : grande veine saphène = 323, petite veine saphène = six, circonflexe postérieure de cuisse (terminologie ancienne : saphène postéromédiale de cuisse) = une. Ces patients ont été répertoriés suivant la classification CEAP [5] de 0 à 6, sachant qu’ils étaient tous symptomatiques : C0 = 2, C1 = 11, C2 = 236, C3 = 24, C4 = 47, C5 = 5, C6 = 4. 8 14 Procédure Closurey. Échodoppler postopératoire : type I ; oblitération complète de la terminaison de la grande veine saphène au ras de la veine fémorale commune. Aucune veine collatérale de la crosse n’est restée perméable. Une investigation par échodoppler a systématiquement complété l’examen clinique. L’échodoppler préopératoire a permis d’identifier les veines où siégeait un reflux (durée supérieure à 0,5 s) et d’en mesurer le diamètre. La mesure était effectuée au niveau du segment le plus dilaté. ¶ Résultats échodoppler L’occlusion immédiate de la veine traitée a été obtenue dans 98 % des cas (322/330) Les résultats à court, moyen et long terme du groupe Closurey Pilote sont présentés dans le tableau V. Il n’y a pas de différence significative entre les résultats à 6 semaines et à 3 ans. Mais le travail le plus intéressant est indiscutablement celui qui a expertisé l’aspect de jonction saphénofémorale sur 142 membres avec un suivi de 2 ans [20]. Trois types peuvent être identifiés : – type I : oblitération complète de la terminaison de la grande veine saphène au ras de la veine fémorale et des collatérales de la crosse (fig 14) ; – type II a : une ou plusieurs veines collatérales restent perméables et se drainent de façon physiologique dans la veine fémorale commune bien qu’il ne persiste aucun moignon de crosse ; – type II b : il persiste un court moignon de crosse (< 3 cm) dans lequel s’abouchent les collatérales de la crosse. Ces collatérales se drainent le plus souvent de façon physiologique dans la veine fémorale commune (fig 15), mais peuvent également refluer dans les collatérales « basses » de la cuisse (veines circonflexes antérieure et postérieure de cuisse qui remplacent dans la nouvelle nomenclature anatomique [2] les appellations veines saphènes antérolatérale et médiopostérieure de cuisse) ; ce reflux ne pouvant être alimenté en tout état de cause que si la valve ostiale est incontinente ou si la disposition anatomique des collatérales s’y prête, par le drainage physiologique d’une veine de la paroi abdominale ou d’une veine honteuse ; Techniques chirurgicales Traitement endovasculaire des varices des membres inférieurs 43-161-C été identifié que dans 16 membres (11, 3 %) et que seuls 14 d’entre eux (9,8 %) présentaient un reflux. ¶ Résultats au plan clinique Les résultats cliniques du groupe Closurey Pilote sont répertoriés tableau VI. L’analyse statistique révèle que la différence est significative pour tous les critères retenus entre les valeurs préopératoires et les valeurs postopératoires, quelle que soit la durée du suivi (p < 0,0001). À l’inverse, cette différence n’est pas significative entre les résultats au sixième mois, la première, la deuxième et la troisième année. ¶ Corrélation entre les résultats échodoppler et cliniques Une étude prospective [13] nous renseigne sur ce point (tableau VII). Les patients ont été classés en postopératoire en trois groupes en fonction des résultats de l’investigation échodoppler au niveau de la veine traitée : – OC (occlusion complète) : pas de flux ; 15 Procédure Closurey. Échodoppler postopératoire : type II b ; oblitération de la terminaison de la grande veine saphène avec persistance d’un moignon de crosse dans lequel s’abouche un affluent de la crosse. Cette collatérale restée perméable se draine de façon physiologique dans la veine fémorale commune. 16 Procédure Closurey. Type III ; non-oblitération de plus de 3 cm de la terminaison de la grande veine saphène avec flux physiologique. En Valsalva, pas de reflux. – type III : non-oblitération de la grande veine saphène de plus de 3 cm à la jonction saphénofémorale. Le flux à ce niveau peut être physiologique (fig 16) ou antiphysiologique (reflux). Dans ce dernier cas, le reflux se draine dans un réseau variqueux sous-jacent. Il doit être traité impérativement par radiofréquence ou sclérothérapie afin d’éviter une récidive. Une étude qui porte sur le collectif Closurey Pilote a révélé à 2 ans que sur les 142 grandes veines saphènes contrôlées, le type III n’a – OPC (occlusion presque complète) : persistance d’un flux sur moins de 5 cm ; – REC (recanalisation) : persistance d’un flux sur plus de 5 cm. Le résultat clinique (signes et symptômes) et la présence d’un reflux (identifié par échodoppler) ont également été appréciés dans chacun de ces trois groupes. Pour apprécier ce résultat clinique, un score de sévérité dérivé de celui qui avait été proposé en complément de la classification CEAP [15] a été utilisé. Au plan clinique, les résultats sont significativement meilleurs à 1 et 2 ans si l’on compare OC et REC : OC > REC (P 0,01), mais pas entre OC et OPC et entre OPC et REC. Au plan du reflux, la différence n’est pas significative entre OC et OPC, mais elle l’est entre OC et REC et entre OPC et REC. En résumé, la corrélation entre résultat clinique et échodoppler permet de conclure que la persistance d’un segment veineux resté perméable sur plus de 5 cm au niveau de la veine traitée s’accompagne d’un résultat clinique moins satisfaisant, ce qui milite en faveur d’un traitement complet. On peut cependant regretter d’une part que dans cette importante étude, le résultat clinique n’ait pas été corrélé avec le reflux plutôt qu’avec la persistance d’un flux et d’autre part que le niveau où la veine était restée perméable n’ait pas été pris en considération. Il est en effet probable qu’un segment de veine restée perméable au niveau des crosses n’a pas la même valeur qu’au niveau du tronc si l’on traite une veine saphène. LASER ENDOVEINEUX Les informations sur les patients traités et leurs résultats sont rassemblées dans le tableau VIII. Les veines traitées étaient des grandes veines saphènes avec reflux au niveau de la jonction saphénofémorale à l’exception d’une série où seules les collatérales saphènes ont été traitées [16]. ¶ Résultats échodoppler Trois études ont été analysées [14, 15, 16] ; les résultats sont excellents, mais le nombre de patients suivis au-delà de 1 an est peu important. Tableau VI. – Résultats cliniques après Closurey. Symptômes et signes Douleur Fatigue Œdème Varices En préopératoire 1 semaine 6 mois 1 an 2 ans 3 ans (n = 330) (n = 244) (n = 242) (n = 244) (n = 149) (n = 68) 82 % 72 % 31 % 96 % 26 % 9% 7% 9% 6% 1% 1% 10 % 4% 2% 1% 10 % 6% 4% 5% 13 % 2% 1% 3% 9% 9 Traitement endovasculaire des varices des membres inférieurs 43-161-C Techniques chirurgicales Tableau VII. – Résultats cliniques et échodoppler de l’étude Closurey Pilote. Nombre de membres évalués et résultat de l’ED Préopératoire : 286 Postopératoire 1 an : 232 OC 194 (83,6 %) OPC 12 (5,6 %) REC 25 (10,8 %) Postopératoire 2 ans : 142 OC 121 (85,2 %) OPC 5 (3,5 %) REC 16 (11,3 %) Signes exprimés en % Symptômes exprimés en % Absence de reflux en ED dans la veine Varices Œdèmes Pigmentation Hypodermite Douleur Fatigabilité à traiter ou traitée % 95 30,4 21,6 6,6 83,1 76,2 0 5,7 15,4 10 0,5 0 4 9,3 7,7 16 1,5 0 4 3,1 0 12 1 0 12 100 85 28 8,3 0 46,2 4,1 0 12,5 7,4 0 18,8 0,8 0 12,5 3,3 20 25 1,7 20 18,8 100 100 12,5 ED : échodoppler ; OC : occlusion complète, pas de flux en ED ; OPC : occlusion presque complète, persistance d’un flux sur moins de 5 cm dans la veine traitée : REC : recanalisation, persistance d’un flux sur plus de 5 cm dans la veine traitée. Tableau VIII. – Résultats cliniques et échodoppler après laser. Auteur Chang [4] Nombre de patients (membres) Sexe H/F 149 (252) 1/5 Stade clinique préopératoire Calibre en mm de la veine traitée (moyenne) Durée du suivi en mois (moyenne) C 2 minimum1 Score 2-4 : 95 %2 4,9-18 (10,5) 12-28 (19) Min [14] 84 (90) 1/6 ND 3-27 (11) 1-9 (6) Navarro [15] 79 (97) ND ND ND 0-20 (7) Résultats Cliniques Sy : ND S : récidive des varices 8/244 (3 %) AS P ≥ 0,052 ND ND ED Durée et nombre de malades % de veines oblitérées ND 3 mois 82/83 (99 %) 9 mois 26/27 (96 %) 12-20 mois 11/11 (100 %) N : nombre ; H : homme ; F : femme ; Sy : symptôme ; S : signe ; ED : échodoppler ; ND : non documenté ; 1 : classe C de la classification CEAP [5] ; 2 : score de sévérité clinique selon Hach [9] ; AS : amélioration significative. 17 Procédure laser. Échodoppler postopératoire. L’aspect est identique à celui obtenu après Closurey. Type II b. fournissant des preuves de niveau 1 ou 2 qui permettraient de formuler des recommandations de type A ou B [27] pour choisir entre chirurgie classique dite d’exérèse et traitement endoluminal. Il convient d’ailleurs de remarquer que nous ne disposons pas plus d’études de ce type pour comparer l’efficacité thérapeutique de la sclérothérapie échoguidée versus chirurgie précédée par un échodoppler. Cependant, un certain nombre d’éléments peuvent être relevés. ¶ Suites postopératoires Les suites postopératoires sont en règle moins douloureuses, la reprise des activités normales plus précoce et la convalescence raccourcie dans les procédures endoluminales. Nous disposons dans ce domaine d’une étude prospective randomisée monocentrique [24] comparant la radiofréquence à la chirurgie classique qui confirme ces données et met en évidence le coût moindre de la procédure Closurey si l’on prend en compte tous les éléments financiers. L’aspect à l’échodoppler le plus souvent identifié correspond au type II b décrit dans la procédure Closurey (fig 17). ¶ Résultats au plan clinique Une seule série rapporte les résultats au plan clinique de façon précise [4] (tableau VIII). ¶ Corrélation entre les résultats échodoppler et cliniques Aucune étude n’est disponible. COMPARAISON ENTRE CHIRURGIE CLASSIQUE ET PROCÉDURES ENDOLUMINALES Comparer les résultats des différents procédés dans le traitement des varices reste une tâche difficile. Notons d’emblée que nous ne disposons d’aucune étude prospective multicentrique randomisée 10 ¶ Complications postopératoires En l’absence d’étude randomisée, il est difficile de fournir des conclusions précises. Il semble cependant que les troubles neurologiques soient plus fréquents après traitement endoluminal mais ils disparaissent complètement entre 2 et 3 ans (tableaux II, III). À l’inverse, les hématomes sur le trajet de la veine traitée sont beaucoup moins importants dans les procédures endoluminales en l’absence d’avulsion des collatérales. Ce point est sans doute à l’origine de la plus grande simplicité des suites postopératoires, d’une reprise plus précoce des activités normales et de la réduction de la durée de la convalescence. Les complications engendrées par la ligature des crosses, infections, complications lymphatiques, ne sont plus à craindre en l’absence de crossectomie chirurgicale dans les procédures endoluminales. Techniques chirurgicales Traitement endovasculaire des varices des membres inférieurs ¶ Comparaison des résultats au plan clinique et ultrasonique On s’accorde généralement sur un délai minimal de 3 ans pour juger du traitement des varices. Nous ne disposons en conséquence pour les procédures endoluminales que du groupe Closurey Pilote (tableaux V et VI) et pour la chirurgie d’exérèse, de l’étude de Rutgers [26]. Résultat clinique Si l’on établit une comparaison entre les deux collectifs qui viennent d’être cités, on relève que dans le collectif chirurgie classique, la disparition de la symptomatologie est de 80 % contre 97 % dans le groupe Closurey Pilote. La présence de varices est plus difficile à juger dans la mesure où les critères d’appréciation dans les deux études sont différents. Résultats des investigations ultrasoniques Bien que les investigations aient été différentes (doppler continu [26] versus échodoppler dans le groupe Closurey Pilote), les résultats sont sensiblement équivalents en termes de reflux. Celui-ci n’est identifié respectivement que dans 15 % et 12 % des cas. COMPARAISON DE LA RADIOFRÉQUENCE ET DU LASER ENDOVEINEUX En termes de facilité d’exécution, les deux méthodes sont probablement équivalentes sachant que la procédure laser 43-161-C endoveineux est plus rapide. Mais l’élément le plus discriminant est sans aucun doute la standardisation de la procédure. Alors que le protocole radiofréquence est très codifié, il n’existe aucune standardisation des procédures lasers, même lorsque le même type de fibre laser est utilisé. Ce dernier point rend donc difficile l’appréciation des résultats de cette technique d’autant, comme nous l’avons souligné, que peu de résultats cliniques sont actuellement disponibles. Nous disposons par ailleurs d’une étude comparative animale [ 2 8 ] qui est en faveur de la radiofréquence. Conclusion La chirurgie endoluminale des varices comporte un certain nombre d’avantages par rapport à la chirurgie classique en termes d’amélioration des suites postopératoires. Au plan de l’appréciation des résultats, nous disposons de deux études à 3 ans qui permettent de comparer la chirurgie classique à Closurey. Elles ne montrent pas de différence significative. Mais seules des études prospectives randomisées incluant la chirurgie classique, la sclérothérapie échoguidée et les procédures endoluminales permettraient de fournir des recommandations de grade A ou B. Remerciements. – Nous remercions les docteurs JL Gérard, O Pichot et PN Vuong pour leur précieuse collaboration iconographique. Références [1] Bradbury AW. Venous symptoms and signs and the results of duplex ultrasound: do they agree. In : Ruckley CV, Fowkes FG, Bradbury AW eds. Venous disease. London : Springer-Verlag, 1999 : 98-116 [2] Caggiati A, Bergan JJ, Gloviczki P, Jantet G, Wendell-Smith CP, Partsch H. Nomenclature of the veins of the lower limbs: an international interdisciplinary consensus statement. J Vasc Surg 2002 ; 36 : 416-422 [3] Chandler JG, Pichot O, Sessa C, Schuller-Petrovic S, Osse FJ, Bergan JJ. Defining the role of extended saphenofemoral junction ligation: a prospective comparative study. J Vasc Surg 2000 ; 32 : 941-953 [4] Chang CJ, Chua JJ. Endovenous laser photo coagulation (EVLP) for varicose veins. Lasers Surg Med 2002 ; 31 : 257-262 [5] Classification et stades de sévérité dans les maladies veineuses chroniques des membres inférieurs. Un document de consensus 22-26 fevrier 1994, Maui, Hawaii. J Mal Vasc 1995 ; 2 : 77-83 [6] Creton D. Principe, technique et indications de l’oblitération endoveineuse par radiofréquence (Closurey). Phlébologie 2002 ; 55 : 127-132 [7] Gerard JL, Desgranges P, Becquemin JP, Desse G, Mellière D. Peut-on traiter les grandes saphènes variqueuses par laser endoveineux en ambulatoire? Résultats à 1 mois d’une étude de faisabilité sur 20 patients en salle de consultation. J Mal Vasc 2002 ; 27 : 222-225 [8] Guex JJ, Min RJ, Pittaluga P. Traitement de l’insuffisance de la grande veine saphène par photocoagulation laser endoveineuse : techniques et indications. Phlébologie 2002 ; 55 : 239-243 [9] Hach W, Hach-Wunderle V. Phlebography and sonography of the veins. Berlin : Springer-Verlag, 1996 [10] Kabnick LS, Merchant RF. Twelve and twenty-four months follow-up after endovascular obliteration of saphenous vein reflux-a report from the multi-center registre. JP 2001 ; 1 : 17-24 [11] Lebard C, Zucarelli F. Destruction de la grande veine saphène par le système Closurey. Phlébologie 2001 ; 54 : 28 [12] Lebard C, Zucarelli F. Intérêt de l’angiographie de la jonction saphéno-fémorale au cours de la destruction de la grande veine saphène par le système Closurey. Phlébologie 2002 ; 55 : 263-268 [13] Merchant RF, Depalma RG, Kabnick LS. Endovenous obliteration of saphenous reflux: a multicenter study. J Vasc Surg 2002 ; 35 : 1190-1196 [14] Min RJ, Zimmet SE, Isaacs MN, Forrestal MD. Endovenous treatment of the incompetent greater saphenous vein. J Vasc Interv Radiol 2001 ; 12 : 1167-1171 [15] Navarro L, Boné C. L’énergie laser intraveineuse dans le traitement des troncs veineux variqueux : rapport sur 97 cas. Phlébologie 2001 ; 54 : 293-300 [16] Navarro L, Min RJ, Boné C. Endovenous laser: a new minimally invasion method of treatment for varicose veinspreliminary observations using an 810 nm diode laser. Dermatol Surg 2002 ; 27 : 117-122 [17] Perrin M. Chirurgie de l’insuffisance veineuse superficielle. Encycl Méd Chir (Éditions Scientifiques et Médicales Elsevier SAS, Paris), Techniques chirurgicales-Chirurgie vasculaire, 43-161-A, 1995 : 1-26 [18] Perrin M. Un procédé nouveau dans le traitement des varices des membres inférieurs, la technique Closurey. Angéiologie 2000 ; 52 : 23-28 [19] Perrin M, Nicolini P. Traitement endovasculaire des syndromes obstructifs veineux profonds. Encycl Méd Chir (Éditions Scientifiques et Médicales Elsevier SAS, Paris), Techniques chirurgicales-Chirurgie vasculaire, 43-168, 2002 : 1-10 [20] Pichot O, Perrin M. Aspects échographiques de la jonction saphéno-fémorale après oblitération de la grande veine saphène par radiofréquence (Closurey). Phlébologie 2002 ; 55 : 329-334 [21] Proebstle TM, Doendue G, Kargl A, Knop J. Endovenous laser treatment of the lesser saphenous vein with a 940-nm diode laser: early results. Dermatol Surg 2003 ; 29 : 357-361 [22] Proebstle TM, Lehr HA, Kargl A, Espinosa-Klein C, Rother W, Behtge S et al. Endovenous treatment of the greater saphenous vein with a 940-nm diode laser: thrombotic occlusion after endoluminal thermal damage by lasergenerated steam bubbles. J Vasc Surg 2002 ; 35 : 729-736 [23] Proebstle TM, Sanhofer M, Kargl A, Gül D, Rother W, Knop J et al. Thermal damage of the inner vein wall during endovenous laser treatment: key role of energy absorption by intravascular blood. Dermatol Surg 2002 ; 28 : 596-600 [24] Rautio T, Ohinmaa A, Perala J, Ohtonen P, Heikkinen T, Wiik H et al. Endovenous obliteration versus conventional stripping operation in the treatment of primary varicose veins: a randomized controlled trial with comparison of the costs. J Vasc Surg 2002 ; 35 : 958-965 [25] Ricco JB, Camiade C. Interruption de la veine cave inférieure. Encycl Méd Chir (Éditions Scientifiques et Médicales Elsevier SAS, Paris), Techniques chirurgicales-Chirurgie vasculaire, 43-170, 2002 : 1-11 [26] Rutgers PH, Kistlaar P. Randomized trial of stripping versus high ligation combined with sclerotherapy in the treatment of the incompetent greater saphenous vein. Am J Surg 1994 ; 168 : 311-315 [27] Sackett DL, Straus SE, Richardson WS, Rosenberg W, Haynes RB. Evidence-based medicine (2d edition). Edinburgh : Churchill Livingstone, 2000 [28] Weiss RA. Comparison of endovenous radiofrequency versus 810 nm diode laser occlusion of large veins in an animal model. Dermatol Surg 2002 ; 28 : 56-61 11 Encyclopédie Médico-Chirurgicale 43-105 43-105 Chirurgie des artères digestives E Kieffer Résumé. – La chirurgie des artères digestives s’adresse à des lésions très diverses dominées par l’athérosclérose ostiale ou juxtaostiale du tronc cœliaque et de l’artère mésentérique supérieure. L’abord de ces artères profondément situées est difficile, ce qui explique la multiplicité des voies d’abord décrites. La revascularisation est faite par l’une des trois grandes méthodes : endartériectomie, pontage ou transposition. La discussion reste ouverte entre les partisans des pontages rétrogrades et ceux des pontages antérogrades et entre les partisans d’une revascularisation complète ou incomplète. Les indications de chirurgie des artères digestives peuvent être symptomatiques, préventives ou anatomiques. Les complications sont rares si la chirurgie est réalisée de façon adaptée. La possibilité d’occlusion tardive par hyperplasie intimale nécessite une surveillance à long terme par échographie-doppler. © 2003 Elsevier SAS. Tous droits réservés. Mots-clés : artères digestives, tronc cœliaque, artère mésentérique supérieure, artère mésentérique inférieure, endartériectomie transaortique, pontage antérograde, pontage rétrograde, transposition de l’artère mésentérique supérieure. Introduction La revascularisation des artères digestives a progressivement acquis droit de cité depuis les premières tentatives chirurgicales des années 1950 [100]. Bien qu’elle ne représente que moins de 1 % de l’ensemble des revascularisations artérielles [51] , la chirurgie des artères digestives est en effet une chirurgie vitale. Mais le petit nombre de cas et l’absence fréquente de suivi morphologique font cependant qu’il est difficile de choisir une technique de revascularisation plutôt qu’une autre. Après un bref rappel anatomique et physiopathologique, nous étudierons successivement les lésions anatomiques, les voies d’abord, les techniques de revascularisation et enfin les indications opératoires et les choix tactiques avant d’envisager les complications de cette chirurgie et certains cas particuliers comme le traitement du syndrome du ligament arqué du diaphragme, la chirurgie de l’artère mésentérique inférieure et le traitement des anévrismes des artères digestives. L’exposé sera centré sur les lésions occlusives athéroscléreuses, de loin les plus fréquentes. 1 1 Anatomie normale des artères digestives et leurs anastomoses longitudinales. 1. tronc cœliaque, 2. artère mésentérique supérieure ; 3. artère mésentérique inférieure ; 4. artères hypogastriques. 2 3 Rappel anatomique La vascularisation artérielle digestive est classiquement caractérisée par un système à trois étages naissant de l’aorte abdominale : tronc cœliaque, artère mésentérique supérieure (AMS) et artère mésentérique inférieure (AMI) [12, 21, 93]. On peut y adjoindre un Édouard Kieffer : Professeur de chirurgie vasculaire, chef de service. Service de chirurgie vasculaire, centre hospitalier universitaire Pitié-Salpêtrière, 47-83, boulevard de l’Hôpital, 75651 Paris cedex 13, France. 4 quatrième étage, celui des artères hypogastriques, naissant des artères iliaques. Toutes ces artères sont reliées par un ensemble de connexions longitudinales (fig 1) [76, 112]. Toute référence à cet article doit porter la mention : Kieffer E. Chirurgie des artères digestives. Encycl Méd Chir (Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales - Chirurgie vasculaire, 43-105, 2003, 17 p. Chirurgie des artères digestives 43-105 2 Cercle péripancréatique anastomosant l’artère hépatique à l’artère mésentérique supérieure. Techniques chirurgicales De très nombreuses variations anatomiques sont possibles. Elles portent sur : – les modalités d’origine du tronc cœliaque et de l’AMS, parmi lesquelles nous signalerons les deux variations les plus fréquentes, le tronc hépatosplénique, l’artère coronaire stomachique naissant directement de l’aorte (3 à 13 %), et le tronc gastrosplénique, l’artère hépatique naissant directement de l’aorte (0,5 à 12 %) ; – les variations des artères hépatiques. La disposition modale n’est retrouvée que dans 60 % des cas. Parmi les variations les plus fréquentes citons : – la coexistence d’une artère hépatique moyenne et d’une artère hépatique gauche naissant de la coronaire stomachique (8 %) ; – la coexistence d’une artère hépatique moyenne et d’une artère hépatique droite naissant de l’AMS et rejoignant le pédicule hépatique par son bord droit (11 %) ; Le tronc cœliaque naît de la face antérieure de l’aorte au niveau de D12, immédiatement sous l’orifice aortique du diaphragme, formé par les piliers diaphragmatiques droit et gauche. Il répond en avant à la région cœliaque, occupée principalement par les ganglions semilunaires du plexus cœliaque et par les ganglions lymphatiques lomboaortiques. Après avoir donné l’artère coronaire stomachique, le tronc cœliaque, court et sagittal, se divise en artère splénique et artère hépatique commune. Ses branches vascularisent l’ensemble de l’étage sus-mésocolique de l’abdomen. L’AMS naît de la face antérieure de l’aorte au niveau de L1, à hauteur ou un peu au-dessus des artères rénales. Ses 5 premiers centimètres sont situés devant la veine rénale gauche et derrière le corps du pancréas, où elle est entourée par un feutrage nerveux dense provenant du plexus mésentérique supérieur. Elle franchit le bord inférieur du corps du pancréas et se trouve alors en avant du processus unciné et de la troisième portion du duodénum. Elle s’engage alors dans la racine du mésentère, à gauche de la veine mésentérique supérieure, puis dans le mésentère et se termine au bord mésentérique d’une anse iléale située à environ 60 cm de la valvule iléocæcale. Sa longueur totale est comprise entre 15 et 30 cm. Elle donne de nombreuses branches destinées à l’ensemble du grêle, du côlon droit et du tiers droit du côlon transverse. L’AMI naît de la face antérogauche de l’aorte en regard de L3. Elle pénètre d’emblée dans le mésocôlon gauche où elle descend en bas et à gauche puis devient verticale pour passer devant les vaisseaux iliaques gauches et se terminer devant S3 en artère hémorroïdale supérieure. Elle vascularise les deux tiers gauches du côlon transverse et l’ensemble du côlon gauche. Les artères hypogastriques sont paires et symétriques. Elles naissent de l’axe iliaque principal en regard de la margelle du petit bassin et vascularisent la fesse et les organes pelviens, dont le rectum, par les artères hémorroïdales moyennes. De nombreuses anastomoses unissent ces artères entre elles [36, 112] : – entre tronc cœliaque et AMS, le cercle péripancréatique (fig 1, 2) est formé par les deux arcades pancréatiques, unissant les branches de l’artère gastroduodénale, elle-même branche terminale de l’artère hépatique commune, aux branches de l’artère pancréaticoduodénale gauche, branche de l’AMS ; – entre AMS et AMI, l’arcade de Riolan (fig 1) est la principale anastomose. Elle est située dans le mésocôlon entre la branche transverse de l’artère colique supérieure droite et celle de l’artère colique supérieure gauche. L’arcade de Villemin est plus rare. Il s’agit d’une connexion directe entre l’AMI et l’AMS. L’arcade de Drummond est périphérique. Elle a les mêmes origines que l’arcade de Riolan, longe la paroi colique et donne les vaisseaux droits ; – entre AMI et hypogastriques : c’est l’anastomose entre l’artère hémorroïdale supérieure et les deux artères hémorroïdales moyennes (fig 1). Ces anastomoses entre les différentes artères digestives atteignent parfois un développement considérable. 2 – la régression de l’artère hépatique moyenne (12 %), la vascularisation du foie étant alors assurée exclusivement par une artère hépatique droite (9 %) ou gauche (1 %) ou les deux (2 %). Physiopathologie Même si des phénomènes emboliques à partir de lésions artérielles proximales ont été décrits, les lésions occlusives des artères digestives ont avant tout un retentissement hémodynamique [28, 72, 77, 92, 110] . L’expression clinique dépend de la rapidité d’installation et de la topographie des lésions, en particulier par rapport à la naissance des artères collatérales critiques de l’AMS, c’est-à-dire des artères pancréaticoduodénale gauche et colique moyenne. Les lésions d’installation brutale (embolies) entraînent le plus souvent une ischémie aiguë, surtout si l’embole siège au niveau des collatérales critiques de l’AMS. Les lésions d’installation progressive (athérosclérose et autres atteintes pariétales des artères digestives), même multiples, sont souvent asymptomatiques en raison de leur caractère proximal et des très importantes possibilités de circulation collatérale [24, 28, 110]. Elles peuvent entraîner une ischémie intestinale chronique, caractérisée par le débordement des possibilités d’hyperhémie postprandiale. Elles peuvent également déterminer une ischémie intestinale aiguë si les lésions débordent sur l’origine des artères collatérales critiques de l’AMS ou si les trois troncs digestifs sont atteints. Le passage à l’ischémie intestinale aiguë, à partir de lésions asymptomatiques ou d’une ischémie intestinale chronique, se fait parfois à l’occasion d’une aortographie. Lésions anatomiques ATHÉROSCLÉROSE L’athérosclérose est la grande pourvoyeuse de lésions occlusives des artères digestives [18, 30, 47, 113]. Il s’agit généralement de lésions ostiales ou juxtaostiales, faisant partie d’une plaque d’athérome située à la face antérieure de l’aorte (fig 3). L’évolution naturelle se fait vers l’occlusion artérielle. Celle-ci est généralement très limitée pour le tronc cœliaque, en raison de la présence de collatérales (artère coronaire stomachique) et reste le plus souvent asymptomatique. Au niveau de l’AMS, le thrombus a généralement plusieurs centimètres, jusqu’aux artères pancréaticoduodénale gauche et colique moyenne. Si le thrombus s’étend au-delà de ces branches, en particulier du fait d’une occlusion associée du tronc cœliaque et/ou de l’AMI, peut survenir une ischémie intestinale aiguë. L’athérosclérose des artères digestives a certains caractères particuliers. Elle prédomine chez la femme dans la plupart des séries [25, 42, 60, 74, 109]. La greffe secondaire d’athérome sur des lésions intimales congénitales localisées, certains facteurs hormonaux (contraception orale, hormonothérapie substitutive) et le tabagisme auraient un rôle dans cette distribution Chirurgie des artères digestives Techniques chirurgicales 3 Aortographie de profil montrant une sténose ostiale du tronc cœliaque et de l’artère mésentérique supérieure. 43-105 5 Artériographie sélective de l’artère mésentérique supérieure montrant une dissection spontanée de l’artère mésentérique supérieure. l’AMS qui est la localisation de loin la plus fréquente. La localisation habituelle de l’embolie est le segment de l’artère donnant naissance aux artères iléales et iléocoliques, empêchant ainsi la circulation collatérale de se développer et déterminant une ischémie intestinale aiguë. L’origine de ces embolies est variable, le plus souvent cardiaque, parfois aortique, beaucoup plus rarement précardiaque. 4 Aortographie de profil montrant une compression extrinsèque du tronc cœliaque par le ligament arqué du diaphragme. DYSPLASIE FIBROMUSCULAIRE (DFM) Les formes occlusives de la DFM sont relativement fréquentes, représentant environ 5 % des lésions des artères digestives rencontrées lors des revascularisations pour ischémie intestinale chronique [29, 53, 62]. Elles affectent essentiellement l’AMS. Les DFM médiales ou périmédiales donnent un aspect typique en chapelet. Les DFM intimales sont responsables de lésions longues et régulières. DISSECTIONS SPONTANÉES Les dissections aortiques peuvent s’étendre à l’AMS et déterminer une ischémie intestinale aiguë, facteur de très mauvais pronostic car elle est souvent méconnue ou reconnue seulement tardivement [67]. Les dissections autonomes des artères digestives sont exceptionnelles [17, 62] (fig 5). Elles intéressent avant tout l’AMS. Parfois favorisées par une DFM, elles entraînent plus souvent une ischémie intestinale aiguë car intéressant la zone d’origine des branches collatérales critiques. MALADIE DE TAKAYASU atypique [104]. Une forme particulière mais rare d’athérosclérose des artères digestives, baptisée coral reef atherosclerosis [85], est représentée par des calcifications circulaires de l’aorte avec bourgeons exubérants faisant saillie dans l’aorte et ses branches viscérales, rénales et digestives. Les lésions des artères digestives sont relativement fréquentes au cours de la maladie de Takayasu et sont généralement associées à des lésions aortiques et des artères rénales [56]. La localisation préférentielle est l’AMS, souvent atteinte sur une grande longueur (fig 6). Mais la traduction clinique de ces lésions est souvent silencieuse, du fait de leur évolution lente. LIGAMENT ARQUÉ DU DIAPHRAGME Il s’agit d’une compression extrinsèque anatomiquement fréquente, réalisant un conflit entre le tronc cœliaque (et parfois l’AMS) et le ligament arqué du diaphragme (fig 4). Mais son expression clinique est très variable et discutée [5, 10, 52, 88]. Dans tous les cas existe un risque important de dilatation poststénotique. ARTÉRITE RADIQUE Les lésions radiques [66] intéressent les artères exposées dans le champ d’irradiation, ce qui explique l’absence habituelle de collatéralité et leur caractère le plus souvent symptomatique. MALADIE DE RECKLINGHAUSEN EMBOLIES Les embolies des artères digestives ne représentent que 10 % des embolies artérielles périphériques mais sont responsables de 50 % environ des ischémies intestinales aiguës [3, 34, 59, 73]. Sans doute en raison de son calibre et de sa naissance de l’aorte à angle aigu, c’est Les lésions des troncs des artères digestives liées à la présence dans l’adventice de l’artère de neurofibromes la comprimant sont rares au cours de la maladie de Recklinghausen. Elles sont généralement associées à une coarctation de l’aorte abdominale et à des sténoses des artères rénales [62]. 3 Chirurgie des artères digestives 43-105 Techniques chirurgicales 6 Aortographie de profil montrant une occlusion étendue de l’artère mésentérique supérieure au cours d’une maladie de Takayasu. 8 Voie d’abord interduodénopancréatique de l’artère mésentérique supérieure. Voies d’abord L’abord des artères digestives principales (tronc cœliaque et AMS) est rendu difficile par leur caractère central, entre deux structures fixes : le rachis en arrière et le pancréas en avant [14, 15, 48, 94, 111]. Le choix d’une voie d’abord adéquate est donc primordial. Il repose sur une bonne analyse artériographique des lésions et sur le choix a priori de la technique à utiliser. En cas de constatations peropératoires imprévues, il est important de pouvoir adapter la voie d’abord au nouveau geste prévu. Nous distinguerons les voies abdominales pures des voies thoracoabdominales. VOIES ABDOMINALES PURES La voie d’abord la plus utilisée est la laparotomie médiane susombilicale ; mais on peut également utiliser une laparotomie transversale ou bi-sous-costale [41, 42, 99]. ¶ Voie intramésentérique, pré- et sous-duodénale (fig 7) Le côlon est récliné vers le haut et le grêle vers le bas, ce qui fait apparaître comme une corde qui se tend le pédicule mésentérique supérieur. L’incision de la face antérieure du mésentère mène directement sur l’AMS, à l’endroit où elle croise le troisième duodénum. L’artère est à ce niveau superficielle, mais il faut prendre garde à une veine jéjunale qui la croise par en avant pour rejoindre la veine mésentérique supérieure située à droite d’elle, et surtout à la présence de plusieurs branches collatérales : premières artères jéjunales à gauche, branches coliques à droite. Cette voie d’abord est celle, élective, de l’embolectomie de l’AMS. Elle peut également être utilisée pour l’anastomose distale des pontages de l’AMS. ¶ Voie interduodénopancréatique (fig 8) Le côlon est récliné vers le haut, l’angle duodénojéjunal vers le bas. Celui-ci est décroché par section du muscle de Treitz, ce qui permet d’aborder l’AMS depuis le voisinage de son origine, juste au-dessus de la veine rénale gauche, jusqu’à la racine du mésentère, en soulevant le corps du pancréas. À ce niveau, l’artère est dépourvue de branches, sauf sur son bord droit d’où naissent l’artère pancréaticoduodénale gauche et éventuellement une artère hépatique droite. Cette voie d’abord peut être prolongée en continuité par un abord latéroduodénal médian de l’aorte sous- et inter-rénale et de l’origine des artères rénales. ¶ Voie interhépatogastrique (fig 9) [19, 79] Le lobe gauche du foie est mobilisé vers la droite après section du ligament triangulaire gauche. Le petit épiploon est effondré, 7 Voie d’abord intramésentérique, pré- et sous-duodénale de l’artère mésentérique supérieure. 4 Chirurgie des artères digestives Techniques chirurgicales 9 Voie d’abord interhépatogastrique du tronc cœliaque. 43-105 éventuellement avec ligature d’une artère hépatique gauche. L’œsophage, repéré par une sonde, est récliné vers la gauche. La terminaison du tronc cœliaque et l’origine de ses branches, entourées du plexus solaire, apparaissent au bord supérieur du pancréas. Si on se limite à un abord de l’artère hépatique commune (ou plus rarement de l’artère splénique), on peut inciser le plexus nerveux à son niveau et aborder directement l’artère. Si on a décidé d’aborder le tronc cœliaque lui-même, il n’est pas indiqué de le disséquer à partir de ses branches. Il est préférable d’inciser le pilier droit du diaphragme pour découvrir l’aorte supracœliaque puis de haut en bas, de sectionner le ligament arqué du diaphragme afin d’aborder l’origine du tronc cœliaque. Ce faisant, il faut se méfier des artères diaphragmatiques inférieures, dont l’origine est très variable, pouvant se faire aussi bien de l’aorte descendante, en arrière du ligament arqué, que du tronc cœliaque, au-delà de celui-ci. L’abord des 2 premiers centimètres de l’AMS est également possible par cette voie à condition de bien libérer l’origine de l’artère splénique et de l’artère hépatique commune du bord supérieur du pancréas, puis de récliner celui-ci vers le bas. 10 Voie d’abord des artères digestives principales par décollement de mésogastre postérieur. 5 Chirurgie des artères digestives 43-105 Techniques chirurgicales 30° 11 Voie d’abord de l’artère mésentérique supérieure par décollement duodénopancréatique. 30° 12 Voie d’abord des artères digestives principales par thoracophrénolaparotomie. L’exposition obtenue permet l’anastomose distale de pontages de l’artère hépatique commune, du tronc cœliaque, ou plus rarement de l’artère splénique. Surtout, associée à un abord de l’aorte supracœliaque par incision du pilier droit du diaphragme, elle 6 permet la réalisation de pontages antérogrades vers le tronc cœliaque ou l’artère hépatique commune, mais aussi, généralement associés à un pontage du tronc cœliaque, vers l’AMS, si les lésions ne dépassent pas les 2 premiers centimètres de l’artère. Chirurgie des artères digestives Techniques chirurgicales 43-105 80° 13 Voie d’abord des artères digestives principales par thoracophrénolombotomie. ¶ Décollement du mésogastre postérieur (ou rotation viscérale médiane des auteurs anglo-saxons) [80, 89] (fig 10) Ce décollement peut être fait par voie médiane (mais le risque de décapsulation splénique et de pancréatite aiguë postopératoire est important) ou mieux par voie sous-costale gauche, éventuellement élargie en lombotomie. En incisant le feuillet péritonéal en arrière de la rate, on pénètre dans un plan avasculaire qui permet de séparer en avant la rate et le corps du pancréas, en arrière la loge rénale, avec au premier plan la veine rénale gauche et la veine capsulaire moyenne. En poussant ce décollement jusqu’à la ligne médiane, on arrive ainsi sur l’aorte. Après section de l’artère diaphragmatique inférieure gauche, on sectionne le ligament arqué du diaphragme puis on dissèque de haut en bas le bord gauche et la face antérieure de l’aorte. La section d’une artère capsulaire moyenne donne un jour complet sur la face gauche de l’aorte viscérale, jusqu’à l’artère rénale gauche. La dissection des artères digestives est alors possible sur 2 à 3 cm pour le tronc cœliaque, sur 6 à 7 cm pour l’AMS. Cette voie d’abord est la seule à fournir un accès utile à l’origine des deux artères digestives principales et donc à permettre une endartériectomie transaortique. Elle permet également l’endartériectomie de l’aorte viscérale et des artères rénales. Mais, au prix d’une incision complémentaire du pilier gauche du diaphragme, elle peut également être utilisée pour réaliser un pontage à partir de l’aorte supracœliaque. Elle peut également être étendue à toute l’aorte abdominale en associant un décollement du mésocôlon gauche. ¶ Décollement duodénopancréatique [8, 9, 111] (fig 11) Le décollement du fascia de Treitz mène sur l’origine de l’AMS, mais sans possibilité d’extension distale. C’est la raison pour laquelle cette voie n’est utilisée que dans des cas particuliers (antécédents de chirurgie par voie gauche). ¶ Décollement du mésocôlon droit [87, 111] Il permet d’aborder la face postérieure de l’AMS dans sa portion intramésentérique. avant sur un appui-bras. Elle associe une thoracotomie antérieure par le septième espace, une courte phrénotomie (6 à 8 cm) radiée et une laparotomie sectionnant le muscle grand droit gauche dans l’axe de la thoracotomie jusqu’à la ligne médiane. Cette incision est poursuivie éventuellement en laparotomie médiane ou, plus rarement, prolongée dans l’axe de la thoracotomie jusqu’au niveau du muscle grand droit droit. Une fois les berges de la phrénotomie suspendues à celles de la thoracotomie, on dispose d’un excellent jour sur la région sous-phrénique, en particulier pour un décollement du mésogastre postérieur et une endartériectomie transaortique des artères digestives. ¶ Thoracophrénolombotomie ou lombotomie 102] Le malade est en décubitus latéral droit. L’incision est faite dans le onzième espace ou sur le relief de la onzième côte (lombotomie) ou dans le dizième espace ou sur le relief de la dizième côte, avec section périphérique plus ou moins complète du diaphragme (thoracophrénolombotomie). Le rein gauche est refoulé en avant, ce qui donne un jour limité sur le tronc cœliaque et surtout l’AMS (en pratique, les 2 ou 3 premiers centimètres). ¶ Sternolaparotomie médiane La sternotomie peut être partielle, pour agrandir un abord interhépatogastrique (en particulier chez les sujets maigres à angle xiphocostal aigu) [ 4 3 ] . Elle peut être complète, permettant l’implantation d’un pontage antérograde sur l’aorte ascendante (ou une prothèse remplaçant celle-ci). Mais dans ces cas on peut lui préférer une courte thoracotomie antérieure par le deuxième ou le troisième espace intercostal. Techniques de revascularisation Elles sont multiples. ENDARTÉRIECTOMIE VOIES THORACOABDOMINALES ¶ Thoracophrénolaparotomie [33, 40, 71, 108] (fig 12) Elle est faite sur un malade en position de trois quarts, un billot longitudinal placé sous le côté gauche, le bras gauche ramené en [27, 83, 91, 95, 101, (fig 13) [2, 25, 41, 63, 84, 86, 104, 106, 107] L’endartériectomie s’adresse essentiellement aux lésions athéroscléreuses, bien que certains l’aient appliquée aux formes chroniques de la maladie de Takayasu. L’endartériectomie transartérielle est abandonnée, de même que l’endartériectomie ostiale, par clampage latéral de l’aorte autour de l’origine de 7 43-105 Chirurgie des artères digestives Techniques chirurgicales 14 Endartériectomie transaortique des artères digestives principales. l’artère et artériotomie longitudinale. Seule s’est imposée l’endartériectomie transaortique, généralement indiquée pour des lésions ostiales des deux artères digestives principales (tronc cœliaque et AMS) (fig 14). La voie d’abord est soit abdominale pure (laparotomie médiane ou sous-costale, éventuellement étendue en lombotomie), soit mieux thoracoabdominale. Dans tous les cas est fait un décollement du mésogastre postérieur. Après contrôle de l’aorte de part et d’autre des artères digestives puis des artères digestives elles-mêmes audelà des lésions palpables, l’aorte est clampée. Une aortotomie en « crosse de hockey » est effectuée, permettant de réaliser un volet de paroi aortique à charnière droite. L’endartériectomie est débutée au niveau de la berge du volet, à la spatule. Elle détache l’ensemble du séquestre au niveau du tronc cœliaque, où celui-ci est généralement court (< 1 cm), puis l’intima aortique est sectionnée aux ciseaux de Potts de l’autre côté, de façon à pédiculiser le séquestre sur l’AMS, où il est généralement plus important (4 à 5 cm). L’artère est invaginée à l’intérieur de l’aorte jusqu’à ce que la fin du séquestre apparaisse, avec son aspect typique en « langue de chat ». Le passage d’un dilatateur s’assure de l’absence de ressaut distal de l’AMS. Puis l’aortotomie est fermée directement par un surjet de Prolènet 5×0. Après purge gazeuse, la circulation est rétablie, d’abord dans les artères digestives, puis dans les artères rénales et les artères des membres inférieurs. 8 Si cet aspect en « langue de chat » de l’intima distale n’est pas obtenu, l’aortotomie est fermée de la même façon et un clamp appliqué à l’origine de l’AMS. On peut alors ouvrir celle-ci, soit transversalement, soit mieux longitudinalement mais au prix d’un patch de fermeture, pour retirer la partie distale du séquestre sous contrôle de la vue [2, 106] (fig 14D). L’existence de lésions athéroscléreuses de l’aorte viscérale ou des artères rénales n’ajoute pas grand-chose à l’intervention (fig 15, 16). L’aortotomie est poursuivie en inter-rénal (en réclinant vers le bas la veine rénale gauche) et l’endartériectomie est faite circonférentiellement, intéressant l’aorte et les artères rénales à la demande. L’important est d’avoir bien disséqué l’artère rénale droite sur plusieurs centimètres, pour qu’elle puisse s’invaginer dans l’aorte jusqu’à la limite distale de l’endartériectomie, et de fixer éventuellement l’intima aortique distale par 3 ou 4 points de Prolènet 5×0. Les avantages de l’endartériectomie sont sa rapidité d’exécution : 15 à 20 minutes de clampage aortique, même si la voie d’abord prend du temps ; l’absence de matériel prothétique ; et la possibilité d’inclure les artères rénales et l’aorte viscérale dans l’intervention. Ses inconvénients sont sa lourdeur, due à la voie d’abord et au clampage de l’aorte viscérale, avec ses risques de retentissement hémodynamique et thromboembolique. Chirurgie des artères digestives Techniques chirurgicales 43-105 16 Endartériectomie transaortique des artères digestives et rénales par voie rétrorénale gauche. 15 Endartériectomie transaortique des artères digestives et rénales par décollement du mésogastre postérieur. Ses indications sont donc les lésions athéroscléreuses ostiales ou juxtaostiales des deux artères digestives principales, chez des malades en bon état général, surtout si une revascularisation associée aortique ou rénale est indiquée. PONTAGES ¶ Matériel Les pontages utilisent un matériel variable. – L’autogreffe veineuse saphène interne est la plus classique [45, 111]. Mais, outre les problèmes de disponibilité, elle a tendance à la dilatation tardive [77, 107]. Elle est cependant utile pour revasculariser les branches distales des artères (artère hépatique propre, AMS intramésentérique) et a l’avantage d’une bonne résistance à l’infection, qui la rend indispensable dans certaines indications (revascularisation pour ischémie intestinale aiguë) [42]. – Les prothèses sont de loin les plus utilisées, qu’il s’agisse de Dacront ou de polytétrafluoroéthylène (PTFE). Elles sont toujours disponibles en diamètre et configuration adaptés. Elles ont l’inconvénient d’être contre-indiquées en cas de chirurgie sur les branches distales et en cas d’infection. – L’autogreffe artérielle fémorale superficielle est le matériel idéal pour la chirurgie de la maladie de Takayasu [56], étant entendu que le prélévement de l’artère hypogastrique est contre-indiqué en cas de pathologie des artères digestives [107, 111]. En cas de lésions multiples des artères digestives, ces différents matériels peuvent être utilisés pour réaliser des pontages bifurqués, multiples et séquentiels. ¶ Pontages rétrogrades Les pontages rétrogrades, ou plus précisément à partir de l’aorte sous-rénale ou des artères iliaques, sont les plus classiques [4, 37, 39] (fig 17). Ils ne nécessitent qu’une laparotomie. Ils peuvent se faire vers le tronc cœliaque, ou plus précisément l’artère hépatique commune, où ils ne posent guère de problème de trajet, du fait de leur longueur et de l’orientation de l’artère hépatique. Nous décrirons le pontage veineux aortohépatique. L’aorte sousrénale est abordée par voie latéroduodénale médiane classique. L’artère hépatique commune est abordée après effondrement du petit épiploon, en la disséquant du plexus hépatique, qui réalise un feutrage nerveux dense. Cette dissection entraîne volontiers un spasme, que l’on peut lever par l’application locale de papavérine ou, une fois l’artère ouverte, par dilatation mécanique douce. Une fois la veine saphène prélevée et considérée comme correcte en aspect et en diamètre, et l’héparine administrée par voie générale (0,5 mg/kg), on clampe l’aorte complètement. Une pastille triangulaire à sommet supérieur ou ovalaire et à grand axe vertical est réséquée à son flanc antérogauche, immédiatement au-dessus de l’origine de l’AMI. Bien que l’aorte soit volontiers plus souple dans la région immédiatement sous-rénale, il est préférable de prévoir le siège d’implantation aortique du pontage un peu plus bas, pour 9 Chirurgie des artères digestives 43-105 * B * A 17 Techniques chirurgicales * C Différents types de pontages rétrogrades revascularisant les artères digestives principales. A. Pontage aortohépatique. B. Pontage aorto- ou iliomésentérique supérieur. C. Pontage bifurqué aorte-tronc cœliaque-artère mésentérique supérieure. D. Pontage séquentiel aorte-artère hépatique-artère mésentérique supérieure. * D éviter ensuite une coudure du pontage au bord inférieur du pancréas. La veine est anastomosée par deux hémisurjets ou un surjet circulaire de Prolènet 6×0, puis elle est passée en avant du pancréas, dans l’arrière-cavité des épiploons, jusqu’au pied du pédicule hépatique où elle est anastomosée en terminolatéral à une artériotomie longitudinale de l’artère hépatique commune, par deux hémisurjets de Prolènet 7×0. Si, par manque de matériel veineux, une prothèse doit être utilisée, on a le choix entre un trajet rétropancréatique (mais comportant un risque de blessure veineuse en arrière du pancréas et de trajet dysharmonieux) ou la couverture de la prothèse dans son trajet prépancréatique par une épiplooplastie, destinée à l’isoler de l’estomac. Les pontages rétrogrades destinés à l’AMS posent davantage de problèmes car ils sont plus courts et anastomosent deux vaisseaux de directions opposées. Deux tendances s’affrontent : 10 – raccourcir au maximum le trajet, en donnant au pontage un aspect en Z ou en T, ou même en lui donnant une configuration antérograde (entre l’aorte immédiatement sous-rénale et l’AMS distale) [23, 49] ; – ou au contraire l’allonger, pour lui faire décrire une courbure harmonieuse en C [18, 81, 109]. Les modalités pratiques diffèrent suivant que l’AMS est laissée en place ou sectionnée, que le pontage provient de l’artère iliaque droite et passe sous le mésocôlon droit, ou qu’il passe à gauche en arrière du hile rénal gauche [68]. Nous décrirons un pontage prothétique aorto- ou iliomésentérique supérieur en arceau. L’aorte ayant été abordée par voie latéroduodénale médiane et l’AMS par voie interduodénopancréatique, on administre l’héparine (0,5 mg/kg) par voie générale et on clampe complètement l’aorte sous l’AMI (ou l’artère Chirurgie des artères digestives Techniques chirurgicales ¶ Pontages antérogrades 18 Plicature d’un pontage rétrograde aortomésentérique supérieur. iliaque droite). On excise une pastille triangulaire à sommet supérieur ou ovalaire à grand axe oblique en haut et à gauche et on lui anastomose une prothèse de Dacront de calibre 7 ou 8 mm. Il est souvent indiqué, pour ne pas rétrécir l’anastomose, d’obtenir cette prothèse à partir d’une prothèse bifurquée au niveau du corps de laquelle on découpe une collerette. La prothèse est anastomosée par deux hémisurjets ou un surjet circulaire de Prolènet 4×0 ou 5×0. Après déclampage aortique et reclampage de l’origine de la prothèse, on fait décrire à celle-ci un trajet en arceau qui l’amène jusqu’au contact du mésocôlon transverse puis la fait repartir en sens inverse vers l’AMS. L’anastomose peut être faite en terminolatéral, à une artériotomie longitudinale de 2 cm de l’AMS ou en terminoterminal, après section de l’AMS et éventuellement de certaines de ses branches. L’anastomose est faite par deux hémisurjets ou un surjet circulaire de Prolènet 5×0 ou 6×0. La prothèse doit être isolée du duodénum et des anses grêles, soit par une épiplooplastie, soit si l’occlusion de l’AMI permet sa section à l’origine, par le mésocôlon gauche. Les avantages des pontages rétrogrades sont qu’ils ne nécessitent qu’un clampage de l’aorte sous-rénale (voire même d’une artère iliaque) et une laparotomie. Leurs inconvénients sont liés aux difficultés de positionnement, déjà évoquées (fig 18), mais il est rare qu’on ne parvienne pas à trouver une solution évitant la plicature ou la torsion du pontage ; au trajet antiphysiologique ; et au fait qu’ils utilisent une artère donneuse peu sûre, l’évolutivité de l’athérome étant plus grande à ce niveau qu’à celui de l’aorte supracœliaque. 43-105 [6, 19, 20, 35, 50, 69, 82, 86, 115] (fig 19) Ils tirent habituellement leur origine de l’aorte supracœliaque, exceptionnellement de l’aorte ascendante ou d’une artère sousclavière ou axillaire. Nous décrirons le pontage prothétique aortocœliaque à partir de l’aorte supracœliaque (fig 19A). Il ne nécessite habituellement qu’une laparotomie médiane et un abord de l’aorte supracœliaque par voie interhépatogastrique. Une fois l’aorte supracœliaque isolée sur 5 à 6 cm et sa bonne qualité reconnue par la palpation, elle est clampée, le plus souvent complètement. Une pastille triangulaire à sommet inférieur ou ovalaire, à grand axe oblique en bas et légèrement à droite, est excisée à son flanc antérogauche. Une prothèse de Dacront de 7 ou 8 mm de diamètre est anastomosée en palette latérale, par deux hémisurjets de Prolènet 4×0. Comme précédemment, il est généralement indiqué, pour ne pas rétrécir l’anastomose, d’obtenir cette prothèse à partir d’une prothèse bifurquée au niveau du corps de laquelle on découpe une collerette. L’aorte est alors déclampée et la prothèse clampée au voisinage de son origine. Après clampage de l’artère hépatique commune et de l’artère splénique, le tronc cœliaque est alors sectionné transversalement, en suturant son origine par un point en X de Prolènet 2×0, éventuellement appuyé sur des attelles de feutre de Téflont. L’artère coronaire stomachique est sectionnée peu après son origine et une artériotomie longitudinale faite pour réaliser une anastomose terminoterminale en palette de la prothèse au tronc cœliaque, par deux hémisurjets de Prolènet 6×0. Lorsque, cas relativement rare, une revascularisation de l’AMS isolée est faite, la prothèse est passée en rétropancréatique ou en prépancréatique (mais alors recouverte par une épiplooplastie) jusqu’à l’AMS abordée par voie interduodénopancréatique ou par voie intramésentérique (fig 19B). L’anastomose distale est faite le plus souvent en terminolatéral à une artériotomie longitudinale de 2 cm par deux hémisurjets ou un surjet circulaire de Prolènet 6×0. Lorsque, cas beaucoup plus fréquent, tronc cœliaque et AMS doivent être revascularisés, la solution la plus simple consiste à implanter sur l’aorte supracœliaque le corps coupé court d’une prothèse bifurquée (fig 19D). La branche courte, destinée au tronc cœliaque, peut être la gauche ou la droite. Une autre solution consiste à réaliser un pontage séquentiel (fig 19E) avec une prothèse de Dacront de 7 ou 8 mm de diamètre, anastomosée à l’aorte supracœliaque et destinée à l’AMS, au flanc antérieur de laquelle on anastomose le tronc cœliaque, directement [114] ou par l’intermédiaire d’une courte prothèse. On peut également revasculariser le tronc cœliaque avec cette prothèse et anastomoser au flanc de celle-ci une deuxième prothèse destinée à l’AMS [26, 96] (fig 19C). Enfin, on peut, en clampant l’aorte autour du tronc cœliaque, ouvrir celui-ci par une incision à cheval sur l’aorte et patcher cette incision à l’aide d’une prothèse destinée à l’AMS. Les avantages des pontages antérogrades sont qu’ils ne posent pas de problème de plicature ou de torsion, qu’ils ont un sens physiologique et qu’ils utilisent une artère donneuse le plus souvent saine et appelée à le rester. Leurs inconvénients sont un clampage aortique le plus souvent complet, qui comporte un risque hémodynamique de retentissement cardiaque et, dans une moindre mesure, un risque thromboembolique des artères viscérales, rénales et des membres inférieurs. Leurs indications sont donc les malades en bon état général, surtout si l’aorte sous-rénale est malade, mais insuffisamment pour justifier un remplacement qui n’aurait pas d’autre indication que de servir de point de départ à un pontage rétrograde. Leurs indications sont donc : – les malades fragiles, incapables de supporter un clampage de l’aorte supracœliaque et/ou une thoracotomie ; – les malades dont l’aorte (ou une artère iliaque) est satisfaisante, soit spontanément, soit après remplacement (le problème étant de savoir s’il est indiqué de remplacer l’aorte pour pouvoir faire le pontage, alors qu’il n’y aurait pas eu d’indication sans cela). TRANSPOSITIONS [44, 57, 61] (fig 20, 21) Elles intéressent essentiellement l’AMS. Celle-ci est abordée par voie interduodénopancréatique et largement libérée depuis son origine jusqu’à ses premières branches. La présence d’une artère hépatique droite constitue habituellement une contre-indication à la technique. L’aorte sous-rénale est abordée par voie 11 43-105 Chirurgie des artères digestives Techniques chirurgicales * B " A2 " A1 19 Différents types de pontages antérogrades revascularisant les artères digestives principales. A. Pontage aorte supracœliaque-tronc cœliaque. B. Pontage aorte supracœliaque-artère mésentérique supérieure (et éventuellement artère rénale gauche). C. Pontage tronc cœliaque-artère mésentérique supérieure. D. Pontage bifurqué aorte supracœliaque-tronc cœliaque-artère mésentérique supérieure. " C2 " C1 " D2 " D1 latéroduodénale médiane classique. Après ligature appuyée de l’AMS au voisinage de son origine (et éventuellement endartériectomie par éversion du moignon distal), l’AMS est amenée au contact de l’aorte, de façon à décrire un trajet harmonieux et sans tension. Ce point est en général assez proche 12 des artères rénales, au flanc antérodroit de l’aorte. L’aorte est alors clampée et une pastille quadrangulaire excisée à ce niveau. Puis l’AMS est anastomosée directement à l’aorte, par un surjet de Prolènet 5x0, en utilisant la technique du « parachute » pour faire le plan postérieur de l’anastomose. Techniques chirurgicales Chirurgie des artères digestives 43-105 " E2 " E3 19 (Suite) Différents types de pontages antérogrades revascularisant les artères digestives principales. E. Pontage séquentiel aorte supracœliaque-tronc cœliaque-artère mésentérique supérieure. " E1 20 Transposition aortique de l’artère mésentérique supérieure. A. Transposition directe. B. Transposition indirecte, par l’intermédiaire d’un court tube prothétique. * A * B Les avantages de cette technique sont sa simplicité et le fait qu’elle n’utilise pas de prothèse (si elle le fait, il s’agit d’une réimplantation indirecte, qui n’est qu’une variante de pontage rétrograde). Ses inconvénients sont le fait qu’elle exige des lésions strictement ostiales ou juxtaostiales de l’AMS et qu’elle utilise comme artère donneuse l’aorte sous-rénale, toujours susceptible d’évolution athéroscléreuse. 13 Chirurgie des artères digestives 43-105 Techniques chirurgicales – lésions aorto-iliaques nécessitant une intervention chirurgicale [1, , d’une part pour éviter les difficultés techniques d’une chirurgie secondaire des artères digestives, d’autre part et surtout en raison des variations volémiques, des pertes sanguines, des risques de lésions de la circulation collatérale et de l’utilisation de drogues ayant un effet néfaste sur la circulation splanchnique ; 16, 32, 58, 64, 111] – chirurgie nécessitant une ligature d’une artère collatérale, en général l’AMI dans la cure des anévrismes de l’aorte abdominale sous-rénale, parfois le cercle péripancréatique (duodénopancréatectomie céphalique, transplantation hépatique) [7, 11, 31] ; – chirurgie pour hypertension artérielle rénovasculaire [111] car il existe un risque de diminution de la pression artérielle de façon critique. Sauf cas particulier, les lésions asymptomatiques d’une seule artère digestive (tronc cœliaque ou AMS) ne nécessitent aucun traitement. 21 INDICATIONS ANATOMIQUES Transposition du tronc cœliaque dans l’artère mésentérique supérieure. Ses indications sont les revascularisations de l’AMS lorsqu’on a délibérément choisi de ne revasculariser que cette artère [57] et que les conditions anatomiques sont réunies (ou l’aorte sous-rénale remplacée). Indications opératoires Il existe trois types d’indication pour opérer les artères digestives : indications symptomatiques, indications préventives et indications anatomiques. INDICATIONS SYMPTOMATIQUES L’ischémie intestinale aiguë est une urgence chirurgicale absolue, pour laquelle chaque minute compte. L’ischémie intestinale chronique pose davantage de problèmes. Si l’indication opératoire ne fait guère de doute, son moment laisse le choix entre opérer d’emblée ou opérer après une préparation par nutrition parentérale. Les avis sont partagés et même fluctuants d’un moment à l’autre au sein d’une même équipe. Il peut en effet être tentant de renutrir une dizaine de jours par voie parentérale un malade cachectique, à condition que toute alimentation orale soit supprimée et à condition de le mettre sous anticoagulants [42, 99, 104, 109] . Encore faut-il savoir que l’on risque une décompensation des lésions occlusives, pouvant, en particulier à l’occasion de l’artériographie, déterminer la survenue de douleurs permanentes, voire d’une ischémie intestinale aiguë. Ces malades doivent donc être bien surveillés, en milieu chirurgical. D’un autre côté, la cachexie et la dénutrition sont à l’heure actuelle rarement telles que se pose le problème d’une renutrition. Le plus souvent celle-ci sera donc réservée à la période postopératoire [90], car ces malades ont perdu l’habitude de manger et mettent souvent des semaines, voire des mois à retrouver un appétit normal [55]. Il s’agit de lésions de l’aorte thoracoabdominale (anévrisme ou coarctation). La naissance des artères digestives du segment aortique remplacé ou ponté nécessite un geste de revascularisation, même si l’artère elle-même n’est pas le siège de lésions occlusives. Choix tactiques ISCHÉMIE AIGUË [54, 59, 70] Le premier temps de l’intervention chirurgicale est exploratoire, à la recherche de la viabilité intestinale. Celle-ci est parfois évidente (nécrose étendue du grêle et d’une partie plus ou moins importante du côlon ou au contraire aspect pâle, diffus, hyperpéristaltique mais viable). Plus souvent les lésions sont douteuses ou surtout variables. La revascularisation s’impose. La priorité absolue doit être donnée au geste ne faisant pas appel à une prothèse : embolectomie, autogreffe veineuse ou artérielle, transposition. Il faut négliger les lésions aortiques associées ou ne faire que ce qui est strictement nécessaire à l’implantation d’un pontage à point de départ sousrénal : endartériectomie limitée, patch autogène. La ou les résection(s) intestinale(s) doivent être faites en laissant en place les segments douteux. Il est préférable d’avoir recours aux stomies plutôt qu’à l’anastomose et de prévoir un second look. Un cas particulier est celui des malades opérés en urgence des lésions intestinales et adressés secondairement pour le traitement des lésions artérielles responsables. La revascularisation du seul tronc cœliaque peut être justifiée, évitant l’abord itératif de l’étage sous-mésocolique. Bien entendu elle doit se faire avec du matériel autogène (greffe veineuse/aorte supracœliaque-tronc cœliaque). ISCHÉMIE CHRONIQUE Le choix thérapeutique est beaucoup plus ouvert et dépend des lésions, de l’état général du malade, mais aussi beaucoup de choix personnels. ¶ Lésions isolées des artères digestives INDICATIONS PRÉVENTIVES La présence de lésions asymptomatiques des artères digestives pose le problème délicat de leur traitement préventif, car personne n’a jamais pu prouver que l’occlusion asymptomatique d’une artère digestive faisait courir un risque d’infarctus intestinal. Cependant, à condition que l’état général le permette, les indications opératoires suivantes peuvent êtres retenues : – sténose serrée ou occlusion du tronc cœliaque et de l’AMS [13, 18, 30, , car la vascularisation intestinale ne dépend plus que de l’AMI et le risque est une atteinte de cette circulation collatérale vitale par évolutivité de la maladie athéromateuse ou hypotension artérielle d’origine cardiaque ou au cours ou au décours d’une intervention chirurgicale, même non vasculaire ; 103] 14 – Tronc cœliaque : pontage antérograde à partir de l’aorte supracœliaque ; – AMS : transposition aortique en cas de lésions ostiales limitées et si l’aorte sous-rénale est satisfaisante, sinon pontage antérograde à partir de l’aorte supracœliaque, ou sinon pontage rétrograde ; – tronc cœliaque + AMS : endartériectomie transaortique si l’état général et les lésions le permettent ; sinon pontage antérograde bifurqué ou séquentiel à partir de l’aorte supracœliaque ; sinon pontage rétrograde. ¶ Lésions associées des artères digestives et rénales – Si les quatre artères sont atteintes, excellente indication d’endartériectomie transaortique si l’état général et les lésions le Techniques chirurgicales Chirurgie des artères digestives permettent ; sinon pontages multiples : les deux artères digestives à partir de l’aorte supracœliaque, les deux artères rénales à partir de l’aorte sous-rénale ; – si seulement deux artères (par exemple l’AMS et l’artère rénale gauche) sont atteintes : pontage antérograde bifurqué à partir de l’aorte supracœliaque. ¶ Lésions associées des artères digestives et de l’aorte sous-rénale – Endartériectomie transaortique, surtout en cas de lésions artérielles rénales associées et de lésions isolées de l’aorte sousrénale et des artères iliaques primitives, se prêtant à une endartériectomie complète ; – le plus souvent remplacement prothétique de l’aorte sous-rénale + pontage rétrograde ou transposition de l’AMS ; – parfois pontage antérograde à partir de l’aorte supracœliaque (surtout pour le tronc cœliaque) et remplacement prothétique de l’aorte sous-rénale. ¶ Lésions associées des artères digestives et de l’aorte thoracoabdominale – Lésions occlusives athéroscléreuses (coral reef) : endartériectomie transaortique ; – anévrismes thoracoabdominaux : opération de Crawford avec endartériectomie transaortique ou pontages séparés suivant l’extension distale des lésions ; – coarctation (congénitale ou dans le cadre d’une maladie de Takayasu) : résection-greffe aortique ou pontage aortique en Dacront, associé à des revascularisations des artères viscérales par autogreffe artérielle fémorale superficielle [56]. Il faut en effet éviter les réimplantations directes, source de traction et d’hyperplasie intimale. Revascularisation complète ou incomplète ? La présence de lésions chirurgicales des deux artères digestives principales (tronc cœliaque et AMS) pose le problème d’une revascularisation complète ou non. En faveur de la revascularisation incomplète plaident de nombreux arguments : elle suffit presque toujours à faire disparaître la symptomatologie ; elle est techniquement plus simple et mieux supportée ; les résultats à long terme ne semblent guère différents dans certaines séries de ceux des revascularisations complètes [39, 57, 66, 105] . En faveur de la revascularisation complète vient l’argument majeur que l’occlusion tardive d’une des deux revascularisations, qui n’est pas exceptionnelle, laisse persister le plus souvent un bon résultat clinique [22, 38, 46, 74, 75, 78, 99, 111]. En pratique, si l’état général le permet, nous sommes partisans d’une revascularisation complète. Si l’état général est médiocre, une chirurgie dirigée le plus souvent vers l’AMS est un compromis satisfaisant. Complications COMPLICATIONS VASCULAIRES L’occlusion artérielle est la grande complication des revascularisations intestinales. Précoce, elle est due à un échec technique. Elle entraîne généralement une ischémie intestinale aiguë dont le diagnostic est loin d’être toujours facile, chez un opéré récent 43-105 dont la réanimation a tendance à masquer la symptomatologie. En pratique, la moindre anomalie dans les suites d’une revascularisation digestive doit entraîner la réalisation d’une aortographie ou une réintervention [103]. Faute de quoi, on risque d’intervenir trop tardivement, pour ne découvrir que des lésions ischémiques dépassées. Ces occlusions précoces sont responsables d’environ la moitié des décès précoces [74]. Tardive, elle est généralement due à une hyperplasie intimale au niveau des zones opérées. Elle peut être asymptomatique, surtout si la revascularisation initiale avait porté sur plusieurs artères. Sinon elle se traduit généralement par une récidive des symptômes d’ischémie intestinale chronique, [65, 98] voire par une ischémie intestinale aiguë. Leur fréquence non négligeable impose une surveillance clinique et si possible par échographie-doppler régulière de ces malades. L’infection est heureusement exceptionnelle et complique exclusivement les interventions ayant comporté la mise en place d’une prothèse. Le syndrome de revascularisation est rare mais constitue une complication particulière de la chirurgie des ischémies intestinales chroniques sévères [ 8 9 , 11 5 ] . Immédiat, il se traduit par une transsudation de la paroi intestinale, responsable d’une ascite postopératoire, voire par une rupture spontanée de la rate ou, encore plus grave, du foie. Secondaire, quelques jours après l’intervention, il se manifeste par un vasospasme splanchnique à la reprise de l’alimentation. Il peut être prévenu par la reprise progressive de l’alimentation et l’administration de calcium-bloqueurs. COMPLICATIONS LIÉES À LA VOIE D’ABORD Les traumatismes iatrogènes de la rate et les pancréatites traumatiques ne sont pas rares après rotation viscérale médiane, surtout faite par laparotomie [18, 78, 89]. Un chylopéritoine peut s’observer après dissection de l’AMS au voisinage de son origine [57]. COMPLICATIONS GÉNÉRALES Essentiellement cardiaques et respiratoires, elles expliquent une partie de la mortalité postopératoire. Mais, lorsqu’on est en présence d’une ischémie intestinale chronique, on se trouve parfois forcé d’accepter un certain risque opératoire pour saisir la chance d’une guérison par la chirurgie. C’est ici que les techniques endovasculaires pourraient éventuellement avoir un rôle. Cas particuliers SYNDROME DU LIGAMENT ARQUÉ DU DIAPHRAGME La responsabilité du ligament arqué du diaphragme dans un tableau évoquant un angor intestinal est difficile à affirmer. Mais il existe certainement, une fois éliminées les autres causes de douleurs abdominales, d’excellentes indications. La décompression chirurgicale classique peut éventuellement être faite sous laparoscopie. Mais elle ne suffit pas toujours et il peut être nécessaire de pratiquer une dilatation, une angioplastie ou un pontage antérograde du tronc cœliaque. CHIRURGIE DE L’ARTÈRE MÉSENTÉRIQUE INFÉRIEURE Elle est rarement indiquée en cas de lésions associées des artères digestives principales (tronc cœliaque et AMS), que l’on préfère opérer directement. Ce n’est qu’en cas de lésions non reconstructibles de l’AMS et du tronc cœliaque que l’on pourrait se limiter à la chirurgie isolée d’une sténose ou d’une occlusion segmentaire de l’AMI [97]. Dans ces cas, plutôt qu’à la réimplantation aortique directe ou à l’endartériectomie, il semble plus sûr d’avoir recours à un court pontage veineux ou prothétique. 15 43-105 Chirurgie des artères digestives TRAITEMENT DES ANÉVRISMES DES ARTÈRES DIGESTIVES Le principal problème est d’apprécier la nécessité ou non du rétablissement de la continuité artérielle. Dans certains cas, la continuité artérielle doit être rétablie : c’est le cas pour les anévrismes du tronc cœliaque, de l’artère hépatique et de l’AMS. Il faut alors s’assurer d’une voie d’abord permettant un abord direct de la lésion, la mettre à plat (ou parfois la réséquer) et Techniques chirurgicales rétablir la continuité par une prothèse ou une greffe veineuse implantée soit sur un segment proximal sain de l’artère, soit sur l’aorte. Ailleurs, la continuité artérielle n’a pas besoin d’être rétablie : c’est le cas pour les anévrismes de l’artère splénique et pour les anévrismes des branches des artères digestives. On a alors le choix entre d’une part l’endoanévrismorraphie oblitérante ou la résection, et d’autre part et surtout, les techniques endovasculaires. Références [1] Atnip RG, Neumyer MM, Healy DA, Thiele BL. Combined aortic and visceral arterial reconstruction: risks and results. J Vasc Surg 1990 ; 12 : 705-715 [2] Bahnini A, Gomes D, Chiche L et al. Endartériectomie des artères digestives. In : Kieffer E, Parc R éd. Chirurgie des artères digestives. Paris : AERCV, 1999 : 113-132 [3] Batelier J, Kieny R. Embolie de l’artère mésentérique supérieure : 82 cas. Ann Chir Vasc 1990 ; 4 : 112-116 [4] Baur GM, Millay DJ, Taylor LM, Porter JM. Treatment of chronic visceral ischemia. Am J Surg 1984 ; 148 : 138-144 [5] Bech FR. Celiac artery compression syndromes. Surg Clin North Am 1997 ; 77:409-423 [6] Beebe HG, MacFarlane S, Raker EJ. Supraceliac aortomesenteric bypass for intestinal ischemia. J Vasc Surg 1987 ; 5 : 749-754 [7] Berney T, Prêtre R, Chassot G, Morel P. Le risque ischémique en cas d’obstruction du tronc cœliaque chez les patients devant subir une duodénopancréatectomie : enquête multicentrique et revue de la littérature. Ann Chir 1999 ; 53 : 273-279 [8] Bonnichon P, Rossat-Mignod JC, Corlieu P. Abord de l’artère mésentérique supérieure par décollement duodéno-pancréatique : étude anatomique et applications cliniques. Ann Chir Vasc 1986 ; 1 : 505-508 [9] Borrelly J. Abord sus-mésocolique droit de l’artère mésentérique supérieure à son origine. J Chir 1973 ; 105 : 167-170 [10] Boudjema K, Mounet F, Petit H et al. Compression du tronc cœliaque par le ligament arqué du diaphragme. In : Kieffer E, Godeau P éd. Maladies artérielles non athéroscléreuses de l’adulte. Paris : AERCV, 1994 : 125-133 [11] Bull DA, Hunter GC, Crabtree TG, Bernhard VM, Putnam CW. Hepatic ischemia, caused by celiac axis compression, complicating pancreaticoduodenectomy. Ann Surg 1993 ; 217 : 244-247 [12] Chevallier JM. Anatomie des artères digestives. In : Kieffer E, Parc R éd. Chirurgie des artères digestives. Paris : AERCV, 1999 : 3-22 [13] Christensen MG, Lorentzen JE, Schroeder TV. Revascularisation of atherosclerotic mesenteric arteries: experience in 90 consecutive patients. Eur J Vasc Surg 1994 ; 8 : 297-302 [14] Chuter TA, Messina LM, Stoney RJ. Exposure of the mesenteric vessels. In : Longo WE, Peterson GJ, Jacobs DL eds. Intestinal ischemia disorders: pathophysiology and management. St Louis : Quality Medical Publishing, 1999 : 155-166 [15] Coggia M, Goeau-Brissonnière O, Di Centa I, Gayet P. Voie d’abord des artères digestives. In : Kieffer E, Parc R éd. Chirurgie des artères digestives. Paris : AERCV, 1999 : 69-98 [16] Connolly JE, Kwaan JH. Prophylactic revascularization of the gut. Ann Surg 1979 ; 190 : 514-522 [17] Cormier F, Lekehal B, Al Ayoudi A et al Dissections spontanées des artères digestives. In : Kieffer E, Parc R éd. Chirurgie des artères digestives. Paris : AERCV, 1999 : 393-413 [18] Cormier JM, Fichelle JM, Vennin J, Laurian C, Gigou F. Résultats tardifs des revascularisations des occlusions athéroscléreuses de l’artère mésentérique supérieure. Ann Chir Vasc 1991 ; 5 : 510-518 [19] Cormier JM, Laurian C, Fichelle JM. Revascularisation antérograde supra-cœliaque des artères viscérales. J Chir 1983 ; 120 : 673-679 [20] Cormier JM, Uhl JF. Revascularisation antérograde des artères digestives par pontage implanté sur l’aorte susrénale. Nouv Presse Méd 1979 ; 8 : 2195-2197 [21] Couinaud C. Les artères digestives abdominales. In : Anatomie de l’abdomen (tome II). Paris : Doin, 1963 : 454-472 [22] Courbier R, Ferdani M, Jausseran JM, Bergeron P, Aboukhater R, Chbib A. Pontages artériels digestifs : résultats cliniques lointains. J Chir 1990 ; 127 : 129-135 [23] Courbier R, Jausseran JM. Les techniques de revascularisation de l’artère mésentérique supérieure : étude critique et résultats. Chirurgie 1983 ; 109 : 523-527 [24] Croft RJ, Menon GP, Marston A. Does intestinal angina exist? A critical study of obstructed visceral arteries. Br J Surg 1981 ; 68 : 316-318 [25] Cunningham CG, Reilly LM, Rapp JH, Schneider PA, Stoney RJ. Chronic visceral ischemia: three decades of progress. Ann Surg 1991 ; 214 : 276-288 16 [26] Daily PO, Fogarty TJ. Simplified revascularization of the coeliac and superior mesenteric arteries. Am J Surg 1976 ; 131 : 762-765 [27] Darling RC 3rd, Shah DM, Chang BB, Paty PS, Leather RP. Current status of the use of retroperitoneal approach for reconstructions of the aorta and its branches. Ann Surg 1996 ; 224 : 501-508 [28] Debray C, Leymarios J. L’artère mésentérique supérieure : physiologie et pathologie. Paris : Expansion Scientifique Française, 1965 [29] Debray C, Leymarios J. Les sténoses non athéromateuses des troncs artériels digestifs. Sem Hôp Paris 1968 ; 44 : 2455-2461 [30] Derrick JR, Pollard HS, Moore RM. The pattern of arteriosclerosis narrowing of the celiac and superior mesenteric arteries. Ann Surg 1959 ; 149 : 684-689 [31] Ducerf C, Rode A, de la Roche E, Beck F, Adham M, Berthoux N et al. Compression du tronc cœliaque par le ligament arqué du diaphragme au cours de la chirurgie de l’étage sus-mésocolique. Ann Chir 1998 ; 52 : 495-502 [32] Ede B, Rosset E, Magnan PE, Branchereau A. Revascularisation digestive au cours de la chirurgie de l’aorte sousrénale. In : Kieffer E, Parc R éd. Chirurgie des artères digestives. Paris : AERCV, 1999 : 471-481 [33] Elkins RC, Demeester TR, Brawley RK. Surgical exposure of the upper abdominal aorta and its branches. Surgery 1971 ; 70 : 622-627 [34] Endean ED, Barnes SL, Kwolek CJ, Minion DJ, Schwarcz TH, Mentzer RM Jr. Surgical management of thrombotic acute intestinal ischemia. Ann Surg 2001 ; 233 : 801-808 [35] Farber MA, Carlin RE, Marston WA, Owens LV, Burnham SJ, Keagy BA. Distal thoracic aorta as inflow for the treatment of chronic mesenteric ischemia. J Vasc Surg 2001 ; 33 : 281-288 [36] Fisher DF, Fry WJ. Collateral mesenteric circulation. Surg Gynecol Obstet 1987 ; 164 : 487-492 [37] Foley MI, Moneta GL, Abou-Zamzam AM Jr, Edwards JM, Taylor LM Jr, Yeager RA et al. Revascularization of the superior mesenteric artery alone for treatment of intestinal ischemia. J Vasc Surg 2000 ; 32 : 37-47 [38] Geelkerken RH, van Bockel JH, de Roos WK, Hermans J, Terpstra JL. Chronic mesenteric vascular syndrome: results of reconstructive surgery. Arch Surg 1991 ; 126 : 1101-1106 [39] Gentile AT, Moneta GL, Taylor LM Jr, Park TC, McConnell DB, Porter JM. Isolated bypass to the superior mesenteric artery for intestinal ischemia. Arch Surg 1994 ; 129 : 926-932 [40] Geroulakos G, Tober JC, Anderson L, Smead WL. Antegrade visceral revascularisation via a thoracoabdominal approach for chronic mesenteric ischaemia. Eur J Vasc Endovasc Surg 1999 ; 17 : 56-59 [41] Hansen KJ, Deitch JS. Transaortic mesenteric endarterectomy. Surg Clin North Am 1997 ; 77 : 397-407 [42] Harward TR, Brooks DL, Flynn TC, Seeger JM. Multiple organ dysfunction after mesenteric artery revascularization. J Vasc Surg 1993 ; 18 : 459-469 [43] Hermreck AS, Thomas JH, Iliopoulos JI, Pierce GE. Role of supraceliac aortic bypass in visceral artery reconstruction. Am J Surg 1991 ; 162 : 611-614 [44] Hivet M, Lagadec B, Poilleux J. Chirurgie des artères digestives. Paris : Expansion Scientifique Française, 1970 [45] Hollier LH. Revascularization of the visceral artery using the pantaloon vein graft. Surg Gynecol Obstet 1982 ; 155 : 415-416 [46] Hollier LH, Bernatz PE, Pairolero PC. Surgical management of chronic intestinal ischemia: a reappraisal. Surgery 1981 ; 90 : 940-946 [47] Jarvinen O, Laurikka J, Sisto T. Atherosclerosis of the visceral arteries. Vasa 1995 ; 24 : 9-14 [48] Jausseran JM, Ferdani M, Sbariglia E et al. Artères digestives. In : Branchereau A éd. Voies d’abord des vaisseaux. Paris : Arnette-Blackwell, 1995 : 205-217 [49] Jausseran JM, Gulino R, Ferdani M, Di Giulio L. Pontages des artères digestives. In : Kieffer E, Parc R éd. Chirurgie des artères digestives. Paris : AERCV, 1999 : 99-112 [50] Jimenez JG, Huber TS, Ozaki CK, Flynn TC, Berceli SA, Lee WA et al. Durability of anterograde synthetic aortomesenteric bypass for chronic mesenteric ischemia. J Vasc Surg 2002 ; 35 : 1078-1084 [51] Johnston KW, Lindsay TF, Walker PM, Kalman PG. Mesenteric arterial bypass grafts: early and late results and suggested surgical approach for chronic and acute mesenteric ischemia. Surgery 1995 ; 118 : 1-7 [52] Joyeux A. Compression du tronc cœliaque par le ligament arqué du diaphragme. In : Kieffer E, Parc R éd. Chirurgie des artères digestives. Paris : AERCV, 1999 : 449-459 [53] Jung MT, Jacobs DL. Unusual causes of mesenteric ischemia. In : Longo WE, Peterson GJ, Jacobs DL eds. Intestinal ischemia disorders: pathophysiology and management. St Louis : Quality Medical Publishing, 1999 : 243-258 [54] Kazmers A. Traitement chirurgical de l’ischémie intestinale aiguë. Ann Chir Vasc 1998 ; 12 : 187-197 [55] Kazmers A. Traitement chirurgical de l’ischémie intestinale chronique. Ann Chir Vasc 1998 ; 12 : 299-308 [56] Kieffer E, Piquois A, Bertal A, Bletry O, Godeau P. Chirurgie restauratrice des artères rénales au cours de la maladie de Takayasu. Ann Chir Vasc 1990 ; 4 : 156-165 [57] Kieny R, Batellier J, Kretz JG. La réimplantation aortique de l’artère mésentérique supérieure dans les lésions athéromateuses des artères digestives : 60 cas. Ann Chir Vasc 1990 ; 4 : 122-125 [58] Kieny R, Charpentier A, Petit H. Occlusions aorto-iliaques chroniques et lésions associées des artères digestives. In : Kieffer E éd. Les occlusions aorto-iliaques chroniques. Paris : AERCV, 1991 : 357-379 [59] Kieny R, Cinqualbre J, Wenger JJ, Tongio J. Les ischémies intestinales aiguës. Paris : Expansion Scientifique Française, 1979 [60] Kihara TK, Blebea J, Anderson KM. Revascularisation pour ischémie intestinale chronique : facteurs de risque et résultats. Ann Chir Vasc 1999 ; 13 : 37-44 [61] Kretz JG, Chakfe N, Beaufigeau M et al. Transposition de l’artère mésentérique supérieure. In : Kieffer E, Parc R éd. Chirurgie des artères digestives. Paris : AERCV, 1999 : 133-143 [62] Krupski WC, Selzman CH, Whitehill TA. Unusual causes of mesenteric ischemia. Surg Clin North Am 1997 ; 77 : 471-502 [63] Kustner LM, Murray SP, Stoney RJ. Endartériectomie transaortique des artères rénales et digestives. Ann Chir Vasc 1995 ; 9 : 302-310 [64] Kwaan JH, Connolly JE, Coutsoftides T. Concomitant revascularization of intestines during aortoiliac reconstruction: deterrent to catastrophic bowel infarction. Can J Surg 1980 ; 23 : 534-536 [65] Laurian C, Berthet JP, Saez de Ibarra J et al. Revascularisations itératives des artères digestives. In : Kieffer E, Parc R éd. Chirurgie des artères digestives. Paris : AERCV, 1999 : 267-278 [66] Laurian C, Gigou F, Saliou C. Ischémie mésentérique chronique : stratégie thérapeutique actuelle. In : Ducerf C, Laurian C éd. Pathologie vasculaire du tube digestif. Rapport au 98e congrès français de chirurgie. Paris : Arnette-Blackwell, 1996 : 103-120 [67] Lauterbach SR, Cambria RP, Brewster DC. Contemporary management of aortic branch compromise resulting from acute aortic dissection. J Vasc Surg 2001 ; 33 : 1185-1192 [68] Leschi JP, Coggia M, Goeau-Brissonnière O. Pontage rétrograde aorto-mésentérique supérieur : tunnellisation en arrière du pédicule rénal gauche. Ann Chir Vasc 2001 ; 15 : 503-506 [69] MacFarlane SD, Beebe HG. Progress in chronic mesenteric arterial ischemia. J Cardiovasc Surg 1989 ; 30 : 178-184 [70] Mansour AM. Management of acute mesenteric ischemia. Arch Surg 1999 ; 134 : 328-330 [71] Marston A. A color atlas of visceral artery reconstruction. London : Wolfe, 1984 [72] Marston A. Vascular diseases of the gut: pathophysiology, recognition and management. London : Arnold, 1986 [73] Marty-Ané CH, Alric P, Branchereau P et al. Embolies de l’artère mésentérique supérieure. In : Kieffer E, Parc R éd. Chirurgie des artères digestives. Paris : AERCV, 1999 : 187-198 [74] Mateo RB, O’Hara PJ, Hertzer NR, Mascha EJ, Beven EG, Krajewski LP. Elective surgical treatment of symptomatic chronic mesenteric occlusive disease: early results and late outcomes. J Vasc Surg 1999 ; 29 : 821-832 Techniques chirurgicales [75] McAfee MK, Cherry KJ, Naessens JM. Influence of complete revascularization on chronic mesenteric ischemia. Am J Surg 1992 ; 164 : 220-224 [76] Michels NA. Blood supply and anatomy of the upper abdominal organs with a descriptive atlas. Philadelphia : JB Lippincott, 1955 [77] Mikkelsen WP. Intestinal angina: its surgical significance. Am J Surg 1957 ; 94 : 262-269 [78] Moawad J, McKinsey JF, Wyble CW. Current results of surgical therapy for chronic mesenteric ischemia. Arch Surg 1997 ; 132 : 613-619 [79] Montete P, Bacourt F. L’abord trans-diaphragmatique de l’aorte sus-cœliaque. Anatomie chirurgicale et opératoire. J Chir 1986 ; 123 : 723-728 [80] Murray SP, Kuestner LM, Stoney RJ. Abord de l’aorte abdominale haute et de ses branches par décollement viscéral transpéritonéal. Ann Chir Vasc 1995 ; 9: 209-216 [81] Ouriel K, Rutherford RB. Mesenteric arterial bypass. In : Atlas of vascular surgery: operative procedures. Philadelphia : WB Saunders, 1998 : 162-180 [82] Park WM, Cherry KJ Jr, Chua HK, Clark RC, Jenkins G, Harmsen WS et al. Current results of open revascularization for chronic mesenteric ischemia: a standard for comparison. J Vasc Surg 2002 ; 35 : 853-859 [83] Pokrovsky AV, Karimov SI, Yermolyuk RS. Thoracophrenolumbotomy as an approach of choice in reconstruction of the proximal abdominal aorta and visceral branches. J Vasc Surg 1991 ; 13 : 892-896 [84] Pokrovsky AV, Kasantchjan PO. Surgical treatment of chronic occlusive disease of the enteric visceral branches of the abdominal aorta: experience with 119 operations. Ann Surg 1980 ; 191 : 51-56 [85] Qvarfordt PG, Reilly LM, Sedwitz MM, Ehrenfeld WK, Stoney RJ. Coral reef atherosclerosis of the suprarenal aorta: a unique clinical entity. J Vasc Surg 1984 ; 1 : 903-909 [86] Rapp JH, Reilly LM, Qvarfordt PG. Durability of endarterectomy and antegrade grafts in the treatment of chronic visceral ischemia. J Vasc Surg 1986 ; 3 : 799-806 [87] Reilly JM, Sicard GA. Abord rétropéritonéal de l’aorte abdominale et de ses branches. 2e partie : voie droite. Ann Chir Vasc 1994 ; 8 : 318-323 [88] Reilly LM, Ammar AD, Stoney RJ, Ehrenfeld WK. Late results following operative repair for celiac artery compression syndrome. J Vasc Surg 1985 ; 2 : 79-91 Chirurgie des artères digestives [89] Reilly LM, Ramos TK, Murray SP. Optimal exposure of the proximal abdominal aorta: a critical appraisal of transabdominal medial visceral rotation. J Vasc Surg 1994 ; 19 : 375-390 [90] Rheudasil JM, Stewart MT, Schellack JV, Smith RB 3rd, Salam AA, Perdue GD. Surgical treatment of chronic mesenteric arterial insufficiency. J Vasc Surg 1988 ; 8 : 495-500 [91] Ricotta JJ, Williams GM. Endarterectomy of the upper abdominal aorta and visceral arteries through an extraperitoneal approach. Ann Surg 1980 ; 192 : 633-638 [92] Rob C. Stenosis and thrombosis of the celiac and mesenteric arteries. Am J Surg 1967 ; 114 : 363-367 [93] Rosenblum JD, Boyle CM, Schwartz LB. The mesenteric circulation: anatomy and physiology. Surg Clin North Am 1997 ; 77 : 289-306 [94] Rutherford RB. Exposures of the suprarenal aorta and alternative exposures of upper abdominal visceral arteries. In : Atlas of vascular exposure: basic techniques and exposure. Philadelphia : WB Saunders, 1993 : 186-221 [95] Saifi J, Shah DM, Chang BB, Kaufman JL, Leather RP. Left retroperitoneal exposure for distal mesenteric artery repair. J Cardiovasc Surg 1990 ; 31 : 629-633 [96] Santoro TD, Cambria RA, Seabrook GR, Towne JB. Single celiac-superior mesenteric artery bypass: an alternative in mesenteric ischemia. Vasc Surg 1999 ; 33 : 529-535 [97] Schneider DB, Nelken NA, Messina LM, Ehrenfeld WK. Isolated inferior mesenteric artery revascularization for chronic visceral ischemia. J Vasc Surg 1999 ; 30 : 51-58 [98] Schneider DB, Schneider PA, Reilly LM, Ehrenfeld WK, Messina LM, Stoney RJ. Reoperation for recurrent chronic visceral ischemia. J Vasc Surg 1998 ; 27 : 276-286 [99] Shanley CJ, Ozaki CK, Zelenock GB. Bypass grafting for chronic mesenteric ischemia. Surg Clin North Am 1997 ; 77 : 381-395 [100] Shaw RS, Maynard EP. Acute and chronic thrombosis of the mesenteric arteries associated with malabsorption: a report of two cases successfully treated by thromboendarterectomy. N Engl J Med 1958 ; 258 : 874-878 [101] Shepard AD, Tollefson DF, Reddy DJ, Evans JR, Elliott JP Jr, Smith RF et al. Left flank retroperitoneal exposure: a technical aid to complex aortic reconstruction. J Vasc Surg 1991 ; 14 : 283-291 43-105 [102] Sicard GA, Reilly JM. Abord rétropéritonéal de l’aorte et de ses branches. 1re partie: voie gauche. Ann Chir Vasc 1994 ; 8 : 212-219 [103] Soury P, Laurian C. Lésions asymptomatiques des artères digestives ou ischémie mésentérique silencieuse. In : Ducerf C, Laurian C éd. Pathologie vasculaire du tube digestif. Rapport au 98e congrès français de chirurgie. Paris : Arnette-Blackwell, 1996 : 123-130 [104] Stanley JC. Chronic mesenteric ischemia. In : Longo WE, Peterson GJ, Jacobs DL eds. Intestinal ischemia disorders: pathophysiology and management. St Louis : Quality Medical Publishing, 1999 : 189-205 [105] Stanton PE Jr, Hollier PA, Seidel TW, Rosenthal D, Clark M, Lamis PA. Chronic intestinal ischemia: diagnosis and therapy. J Vasc Surg 1986 ; 4 : 338-344 [106] Stoney RJ, Effeney DJ. Procedures on the paravisceral aorta. In : Wylie’s atlas of vascular surgery: thoracoabdominal aorta and its branches. Philadelphia : JB Lippincott, 1992 : 188-223 [107] Stoney RJ, Ehrenfeld WK, Wylie EJ. Revascularization methods in chronic visceral ischemia caused by atherosclerosis. Ann Surg 1977 ; 186 : 468-476 [108] Stoney RJ, Wylie EJ. Surgical management of arterial lesions of the thoracoabdominal aorta. Am J Surg 1973 ; 126 : 157-164 [109] Taylor LM Jr, Porter JM. Treatment of chronic intestinal ischemia. Semin Vasc Surg 1990 ; 3 : 186-199 [110] Thomas JH, Blake K, Pierce GE, Hermreck AS, Seigel E. The clinical course of asymptomatic mesenteric arterial stenosis. J Vasc Surg 1998 ; 27 : 840-844 [111] Van Dongen RJ, Schwilden ED. Revascularization of the visceral arteries. In : Heberer G, Van Dongen RJ eds. Vascular surgery. Berlin : Springer-Verlag, 1987 : 589-607 [112] Vandamme JP, Bonte J. Vascular anatomy in abdominal surgery. Stuttgart : Georg Thieme, 1990 [113] Vasseur MA, Chiche L, Kieffer E. Lésions anatomiques des artères digestives. In : Kieffer E, Parc R éd. Chirurgie des artères digestives. Paris : AERCV, 1999 : 23-42 [114] Wolf YG, Berlatshy Y, Gewertz BL. Pontage séquentiel aorto-cœlio-mésentérique. Ann Chir Vasc 1997 ; 11 : 640-642 [115] Wolf YG, Verstandig A, Sasson T, Eidelman L, Anner H, Berlatzky Y. Mesenteric bypass for chronic mesenteric ischaemia. Cardiovasc Surg 1998 ; 6 : 34-41 17 Encyclopédie Médico-Chirurgicale 43-312 43-312 Reconstruction vasculaire et transplantation hépatique B Poussier PO Sarfati O Vignaux D Houssin B Dousset Résumé. – La technique initiale de la transplantation hépatique orthotopique s’est enrichie de variantes techniques telles que l’implantation du greffon avec préservation de la veine cave (piggy-back), la bipartition hépatique et la transplantation hépatique à partir de donneur vivant apparenté. Cela implique de reconnaître l’anatomie vasculaire du donneur et du receveur afin de rétablir l’intégralité vasculaire du greffon. La reconstruction vasculaire doit prendre en compte les variations anatomiques au cours du prélèvement, de l’implantation du greffon et permettre une prise en charge adaptée des complications vasculaires postopératoires. Elle associe des gestes de revascularisation, parfois complexes, et des procédures endovasculaires de radiologie interventionnelle. © 2003 Elsevier SAS. Tous droits réservés. Mots-clés : transplantation hépatique, piggy-back, revascularisation, greffon. Prélèvement du greffon Le prélèvement hépatique est le plus souvent réalisé lors d’un prélèvement multiorgane. Les variations anatomiques artérielles sont fréquentes. Leur reconnaissance a des conséquences directes sur le prélèvement, l’implantation du greffon et la technique de bipartition hépatique. ANATOMIE ARTÉRIELLE HÉPATIQUE Le foie est le plus souvent vascularisé par une artère hépatique unique, mais des variations anatomiques sont rencontrées dans 40 à 45 % des cas [36, 48, 52]. Elles doivent être repérées au cours du prélèvement et nécessitent une adaptation de la technique chirurgicale au cours de la transplantation. Les variations répertoriées dans le tableau I rapportent notre expérience portant sur 281 transplantations réalisées entre 1986 et 1992 ainsi que les données de la littérature [17, 52, 55]. Il existe aussi des variations dans la distribution artérielle intrahépatique susceptibles de modifier ou de contre-indiquer la réalisation d’une bipartition [16]. CONSÉQUENCES DES VARIATIONS ARTÉRIELLES SUR LE PRÉLÈVEMENT Une artère hépatique gauche est recherchée dans le petit épiploon. La palpation du pédicule hépatique localise les battements de l’artère hépatique moyenne et recherche à sa partie postérodroite les Bertrand Poussier : Interne des hôpitaux de Paris. Pierre-Olivier Sarfati : Praticien hospitalier. Olivier Vignaux : Professeur des Universités, praticien hospitalier. Didier Houssin : Professeur des Universités, praticien hospitalier. Bertrand Dousset : Professeur des Universités, praticien hospitalier. Service de chirurgie, hôpital Cochin, 27, rue du Faubourg-Saint-Jacques, 75014 Paris, France. Tableau I. – Répartition des anomalies artérielles hépatiques. Type de vascularisation artérielle hépatique Artère hépatique moyenne Cochin n = 281 Littérature [17, 35, 52, 55] 222 (78 %) 55 à 60 % Artères hépatiques moyenne et droite 23 (8 %) 8 à 11 % Artères hépatiques moyenne et gauche 27 (9 %) 12 à 32 % Artères hépatiques droite, moyenne et gauche 5 (2 %) 3,5 % Artères hépatiques droite et gauche 3 (1 %) 1% Artère hépatique droite isolée 5 (2 %) 3à5% Artère hépatique gauche isolée 0 0,5 % battements d’une artère hépatique droite. Ces vaisseaux seront préservés et prélevés avec le foie [52]. Après clampage aortique et refroidissement hépatique par voie aortique et portale, l’artère hépatique est prélevée avec le tronc cœliaque et un patch aortique. Une artère hépatique gauche est emportée avec l’artère coronaire stomachique et le tronc cœliaque. Une artère hépatique droite est prélevée avec l’artère mésentérique supérieure et le tronc cœliaque sur un patch aortique. Si l’anatomie artérielle n’a pu être déterminée avec certitude, le pancréas et un segment aortique centré sur le tronc cœliaque et l’artère mésentérique supérieure sont prélevés en continuité avec le foie. Il s’agit pour de nombreuses équipes d’une technique utilisée en routine dite de « prélèvement rapide », qui ménage toute possibilité de variation anatomique. En fin d’intervention, un axe artériel iliofémoral est prélevé dans l’éventualité d’un pontage aortohépatique chez le receveur. On y associe le prélèvement d’un axe iliaque veineux en cas de thrombose portale en vue d’un pontage mésentéricoportal. Ces allogreffes vasculaires sont stockées dans le liquide de préservation à 4 °C. Toute référence à cet article doit porter la mention : Poussier B, Sarfati PO, Vignaux O, Houssin D et Dousset B. Reconstruction vasculaire et transplantation hépatique. Encycl Méd Chir (Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales - Chirurgie vasculaire, 43-312, 2003, 9 p. 43-312 Reconstruction vasculaire et transplantation hépatique PRÉPARATION EX VIVO DES PÉDICULES VASCULAIRES Plusieurs situations anatomiques peuvent être retrouvées. Une artère hépatique unique ne nécessite aucune préparation particulière. S’il existe plusieurs artères hépatiques, l’objectif est de réaliser une reconstruction artérielle ex vivo afin d’obtenir un axe artériel unique côté greffon [52]. Une artère hépatique gauche ne nécessite pas de reconstruction, mais impose une reconstruction artérielle sur le tronc cœliaque du greffon, en amont de l’ostium de l’artère gastrique gauche. S’il existe une artère hépatique droite et une artère hépatique moyenne, on réalisera une anastomose terminoterminale entre les ostia du tronc cœliaque et de l’artère mésentérique supérieure [ 2 5 ] . On peut aussi réaliser une anastomose terminoterminale entre l’artère hépatique droite et l’ostium de l’artère splénique à la condition d’une artère hépatique droite de bon calibre, adapté à celui de l’ostium de l’artère splénique. En cas d’athérome des artères hépatiques, la recoupe distale d’une artère hépatique droite et d’une artère moyenne peut conduire à la réalisation d’une néobifurcation artérielle aboutissant à la constitution d’un ostium artériel commun. En cas de section accidentelle haute d’une artère hépatique droite au cours du prélèvement, on peut être amené, pour des raisons de longueur, à réimplanter l’artère hépatique droite sectionnée sur l’ostium de l’artère gastroduodénale (fig 1). PROBLÈMES VASCULAIRES POSÉS PAR LES GREFFONS RÉDUITS Pour les enfants, l’utilisation de greffons hépatiques réduits a diminué la mortalité lors de la période d’attente avec des résultats comparables à ceux des greffons entiers [5, 9, 26, 27] . Le greffon hépatique peut être réduit par hépatectomie droite ou par hépatectomie droite élargie aux segments I et IV. Aucune dissection pédiculaire n’est réalisée afin de ne pas dévasculariser les voies biliaires extrahépatiques. Il s’agit d’une hépatectomie droite ou droite élargie avec ligature-section des pédicules glissoniens droits en intraparenchymateux. En cas de greffon hyper-réduit aux segments II et III, la veine cave inférieure du receveur est conservée et la veine sus-hépatique gauche est prélevée avec un patch veineux cave [27]. Le développement de la bipartition et de la transplantation hépatique intrafamiliale a considérablement diminué l’usage des techniques de réduction hépatique. PROBLÈMES VASCULAIRES POUR LES GREFFONS PARTAGÉS Le partage d’un foie en deux unités anatomiques et fonctionnelles permet de greffer deux receveurs à partir du foie issu d’un seul donneur [28, 43]. Cette technique requiert la connaissance précise de la distribution artérielle et biliaire, obtenue par artériographie et cholangiographie du greffon réalisées ex vivo [26]. L’anatomie des veines hépatiques et de la veine porte est précisée par la dissection sur table. On recherche une absence de bifurcation portale (1 %) qui contre-indique le partage [16]. On recherche un tronc commun des veines hépatiques moyenne et gauche, la veine sus-hépatique moyenne étant attribuée au greffon droit pour le drainage des segments V et VIII. L’artériographie et la cholangiographie recherchent une duplication artérielle et/ou biliaire. La veine cave inférieure est attribuée au foie droit en raison de fréquentes veines hépatiques accessoires. La veine hépatique moyenne est séparée de la veine hépatique gauche en cas de tronc commun. La veine porte est prélevée avec la bifurcation pour le greffon gauche alors que le greffon droit n’emporte que la branche portale droite. Le canal hépatique commun sera attribué au greffon dont le pédicule présente une duplication biliaire, cas le plus fréquent à droite [16]. La bipartition foie droit-lobe gauche est impossible en cas de duplication biliaire de type (III + IV) et II. L’artère hépatique sera attribuée au greffon dont le pédicule présente une duplication ou une triplication artérielle, cas plus fréquents à gauche (fig 2). 2 Techniques chirurgicales Problèmes rencontrés au cours de la transplantation ARTÈRE HÉPATIQUE La vascularisation du foie cirrhotique est à prédominance artérielle, aboutissant au développement d’artères de gros calibre, fragiles, sujettes aux décollements de l’intima. Pour ces raisons, les anastomoses artérielles en transplantation hépatique sont le plus souvent réalisées selon des techniques issues de la microchirurgie. Il s’agit d’anastomoses terminoterminales non spatulées par points séparés ou surjet de monobrin non résorbable 7.0 réalisés sous loupes [58]. Le choix de la réimplantation tient compte, côté receveur, du nombre des artères, de leur calibre, de la présence d’un athérome, d’une thrombose (antécédents de chimioembolisation intra-artérielle, retransplantation) ou d’un ligament arqué significatif (vascularisation hépatique et cœliaque rétrograde par l’artère gastroduodénale) (fig 3). La prévalence de ce dernier est, dans notre expérience, de 6 %. En cas d’artères hépatiques multiples chez le receveur, l’anastomose artérielle sera réalisée sur la plus large. Le site d’implantation artérielle le plus souvent utilisé est l’artère hépatique propre au niveau de l’origine de l’artère gastroduodénale afin d’élargir l’anastomose [8, 56]. Plus rarement, une volumineuse artère hépatique droite ou l’artère splénique retournée peuvent être utilisées pour la revascularisation du greffon. Côté donneur, l’anastomose siège le plus souvent sur l’artère hépatique commune ou sur le tronc cœliaque, le choix du site d’implantation réalisant un compromis entre adéquation de calibre et absence d’excès de longueur. Si les vaisseaux du receveur sont de petit calibre (absence de cirrhose ou artères multiples), athéromateux, thrombosés, un pontage aortohépatique sur l’aorte abdominale sous-rénale peut être réalisé par l’interposition d’une allogreffe artérielle iliofémorale [24, 55] (fig 4). Dans cette éventualité, l’aorte abdominale sous-rénale est abordée en sous-mésocolique. La tunnellisation est effectuée le plus souvent en transmésocolique, prépancréatique, rétrogastrique [24]. L’allogreffe est anastomosée en terminolatéral à la face antérieure de l’aorte sous-rénale et à l’artère hépatique commune du donneur en terminoterminal par deux hémisurjets. L’athérome du donneur peut contre-indiquer le prélèvement d’un axe iliofémoral, conduisant à l’interposition d’une prothèse en polytétrafluoroéthylène (PTFE) annelé [29]. VEINE PORTE Les fautes techniques favorisent la survenue de la thrombose ou de la sténose portale. L’excédent de longueur est prévenu par le relâchement de la valve sous-costale droite et de la rétraction du bloc viscéral vers le bas, permettant d’ajuster au mieux la recoupe de la veine porte côté donneur et receveur. L’anastomose est réalisée par deux hémisurjets de monobrin non résorbable 5.0, maintenus en faible tension pour éviter un effet de fronce, et noués avec un facteur de croissance d’un quart pour permettre l’expansion veineuse [50]. L’existence d’un flux hépatofuge traduit la sévérité de l’hypertension portale et est constamment associée à l’existence de shunts portosystémiques spontanés, qu’il convient pour la plupart des auteurs de lier afin d’augmenter le flux porte lors de la remise en charge du greffon [7, 15, 54]. Il existe trois principaux types de shunts portosystémiques spontanés identifiés par l’artériographie ou l’angio-imagerie par résonance magnétique (IRM) : – la réperméation d’une veine paraombilicale dont la ligature est obligatoire au cours de l’hépatectomie lors de la section du ligament rond ; – le shunt coronaroazygos est fermé par la ligature de la veine coronaire stomachique au bord gauche de la veine porte ; – le shunt splénorénal sera oblitéré par la ligature de la terminaison de la veine rénale gauche, préservant le drainage veineux du rein gauche. Techniques chirurgicales Reconstruction vasculaire et transplantation hépatique 43-312 1 Reconstruction artérielle hépatique.TC : tronc cœliaque ; CS : artère coronaire stomachique ; S : artère splénique ; AMS : artère mésentérique supérieure ; AMS prox : artère mésentérique supérieure proximale ; AMS dist : artère mésentérique supérieure distale ; Hép C : artère hépatique commune ; Hép P : artère hépatique propre ; GD : artère gastroduodénale ; Hép D : artère hépatique droite ; Hép M : artère hépatique moyenne. A. Artère hépatique moyenne foie gauche et artère hépatique droite accessoire. Anastomose ex situ entre les ostia proximaux du tronc cœliaque et de l’artère mésentérique supérieure du greffon. Reconstruction artérielle entre l’artère hépatique propre du receveur et l’ostium distal de l’artère mésentérique supérieure. B. Artère hépatique moyenne foie gauche et artère hépatique droite accessoire avec carrefour viscéral athéromateux. Recoupe large des deux artères hépatiques. Confection d’un ostium commun par anastomose latérale des deux artères hépatiques. Reconstruction artérielle entre l’artère hépatique propre du greffon et l’ostium commun des deux artères hépatiques du greffon. C. Artère hépatique moyenne foie gauche et artère hépatique droite accessoire sectionnée accidentellement au cours du prélèvement. C1. anastomose de l’artère hépatique droite sur l’ostium de l’artère splénique du greffon ; C2. anastomose de l’artère hépatique droite sur l’ostium de l’artère gastroduodénale du greffon. D. Artère hépatique moyenne foie gauche, artère hépatique droite accessoire et ligament arqué significatif : anastomose ex situ entre les ostia proximaux du tronc cœliaque et de l’artère mésentérique supérieure du greffon (flèche en pointillés). Anastomose (flèche pleine) entre l’ostium distal de l’artère mésentérique supérieure et l’allogreffe iliofémorale (flèche blanche) implantée sur l’aorte du receveur. * A * B * D " C1 L’existence d’une dérivation portosystémique chirurgicale (portocave, mésentéricocave, splénorénale) perméable entraîne également une inversion du flux portal, justifiant pour les mêmes raisons la fermeture de ce shunt. Celle-ci nécessite l’abord direct et la ligature du shunt veineux ou prothétique pour une anastomose portocave ou mésentéricocave, alors qu’une dérivation splénorénale peut être facilement interrompue par ligature de la terminaison de " C2 la veine rénale gauche. La présence d’une anastomose portocave intrahépatique par voie transjugulaire (TIPS) est traitée par l’explantation du foie natif. La thrombose portale n’est actuellement plus une contre-indication à la transplantation hépatique. L’échodoppler permet son diagnostic dans la majorité des cas [37]. L’extension proximale de la thrombose 3 43-312 Reconstruction vasculaire et transplantation hépatique * A * B Techniques chirurgicales * C 2 Bipartition hépatique : l’artère hépatique sera attribuée au greffon gauche, la duplication ou la triplication artérielle étant la plus fréquente à gauche. A. 25 % cas : duplication artérielle gauche type (II + III) et IV. B. 15 % cas : artère hépatique gauche. C. 10 % cas : duplication artérielle gauche type (III + IV) et II. D. 1 % cas : triplication artérielle hépatique. * D 3 * A A. Ligament arqué : aspect sur l’artériographie de profil. B. Ligament arqué significatif : aspect sur l’artériographie mésentérique supérieure (flèche pleine). Vascularisation rétrograde du tronc cœliaque (flèche blanche) par l’artère gastroduodénale (flèche en pointillés). * B est au mieux précisée par l’artériographie ou l’angio-IRM. La thrombose est partielle dans deux tiers des cas (fig 5A) et méconnue au moment de la greffe dans plus de la moitié des cas [40]. La thrombectomie veineuse par éversion (fig 5B) permet de restaurer dans la très grande majorité des cas un flux porte satisfaisant avec des résultats à distance voisins de ceux observés en l’absence de thrombose porte [13, 19]. Dans de rares cas, la thrombectomie n’est pas réalisable car l’atrophie de la veine porte pédiculaire [32, 54] rend aléatoire la restauration d’un flux satisfaisant. La revascularisation portale peut se faire sur différents axes veineux du receveur et nécessiter l’interposition d’un greffon veineux iliaque (donneur) [30, 57] ou jugulaire interne (receveur) : – sur la veine mésentérique supérieure, en latéral, par l’interposition d’un greffon veineux tunnellisé en transmésocolique, prépancréatique ; – sur le confluent splénomésentérique, en situation anatomique [54] (fig 6) ; – sur la veine coronaire stomachique ; 4 4 Pontage aortohépatique par interposition d’un greffon iliofémoral. – sur une grosse veine de dérivation péricholédocienne ou paracolique. La thrombose diffuse du système porte a longtemps été considérée comme une contre-indication absolue à la transplantation hépatique. Des résultats encourageants ont été récemment rapportés dans cette situation grâce à la revascularisation cavoportale. Il s’agit, soit d’une anastomose cavoporte latéroterminale associée à une réduction du Techniques chirurgicales Reconstruction vasculaire et transplantation hépatique * A 5 A. Aspect artériographique d’une thrombose porte partielle. 43-312 * B B. Aspect artériographique chez le même malade après thrombectomie par éversion au cours de la greffe. jonction du confluent splénomésentérique et du tronc porte hypoplasique [36]. Dans les syndromes polymalformatifs associés à l’atrésie des voies biliaires, la veine porte hypoplasique peut être parfois en position préduodénale sans que cela ne modifie l’anastomose portale [22, 32]. En cas de greffon adulte issu de partage ou de don intrafamilial, il existe fréquemment une disparité de calibre (petit → large), sans frein au flux veineux, requérant une anastomose incongruente, et justifiant l’utilisation de fil monobrin résorbable autorisant la croissance veineuse. En cas de greffon droit issu de partage ou de don intrafamilial, on peut être amené à reconstruire deux branches portes sectorielles. Différents artifices techniques ont été proposés [38] : – division du tronc porte du receveur ; – anastomose des deux branches sectorielles sur les deux branches sectorielles droites du receveur ; – adossement des deux branches sectorielles par plastie veineuse. VEINES HÉPATIQUES 6 Hypoplasie de la veine porte. VPD : veine porte donneur ; VPR : veine porte receveur ; VS : veine splénique ; VMS : veine mésentérique supérieure. calibre de la veine cave supra-anastomotique, soit d’une anastomose rénoporte terminoterminale entre la veine porte et la veine rénale gauche [1, 2, 57, 59] (fig 7A, B). La transplantation hépatique pédiatrique utilise certains artifices techniques en raison du petit calibre de la veine porte, soit en raison de l’âge de l’enfant, soit en raison d’une hypoplasie de la veine porte (diamètre < 5 mm) fréquemment observée au cours de l’atrésie des voies biliaires. L’implantation directe sur la confluence de la veine mésentérique et du tronc splénomésaraïque en situation anatomique semble donner le meilleur flux et limiter les risques de thrombose et de sténose [44]. Certains y associent une spatule d’élargissement de la L’évolution de la technique de transplantation hépatique au cours des dix dernières années a surtout été marquée par l’abandon par la majorité des équipes de la circulation veinoveineuse extracorporelle et l’avènement de l’implantation du greffon hépatique en piggyback. En cas d’implantation du greffon hépatique en piggy-back, l’anastomose cave suprahépatique peut être cavocave terminolatérale, cavocave latérolatérale ou terminoterminale entre la veine cave suprahépatique du greffon et les ostia réunis des veines hépatiques moyennes et gauches. Ces différentes techniques ont pour principal intérêt de préserver le flux cave au cours de la phase d’anhépatie (fig 8A, B). La majorité des équipes y associent une anastomose portocave terminolatérale transitoire, afin de décomprimer le territoire splanchnique au cours de la phase d’anhépatie [14, 39, 57]. Cette technique exige la préservation de la veine cave rétrohépatique du receveur, qui peut être particulièrement difficile en cas de lobe de Spiegel recouvrant la veine cave inférieure. La veine cave inférieure peut être absente et associée à une continuation de la veine azygos chez les enfants porteurs d’une atrésie des voies biliaires associée à un syndrome de polysplénie. Dans cette configuration, les veines hépatiques se drainent dans un collecteur commun sur lequel portera l’anastomose suprahépatique [7, 22, 32] . 5 43-312 Reconstruction vasculaire et transplantation hépatique Techniques chirurgicales 7 Thrombose diffuse du système porte. I : Veine cave inférieure suprahépatique ; II : veine porte du greffon ; III : veine cave inférieure (VCI) infrahépatique ; IV : anastomose cavoporte latéroterminale ; V : fermeture partielle de la VCI infrahépatique par agrafage mécanique ; VI : anastomose rénoporte terminoterminale. A. Reconstruction cavoportale. B. Reconstruction rénoportale. * A * B * A * B 8 Reconstruction des veines hépatiques. VCI : veine cave inférieure. A. Anastomose latérolatérale terminalisée. Fermeture de l’ostium de la veine hépatique droite, réunion des ostia des veines hépatiques moyenne et gauche prolongée en cavotomie verticale côté receveur. Fermeture de l’ostium cave infrahépatique et cavoplastie triangulaire postérieure à base supérieure de l’ostium cave suprahépatique, côté greffon. Anastomose cavocave latérolatérale terminalisée. B. Anastomose terminoterminale (piggy-back). Fermeture de l’ostium de la veine hépatique droite, réunion des ostia des veines hépatiques moyenne et gauche côté receveur. Anastomose terminoterminale entre l’ostium cave suprahépatique du greffon et les ostia réunis des veines hépatiques moyenne et gauche du receveur. La veine cave inférieure suprahépatique doit être abordée en intrapéricardique [11] en cas de syndrome de Budd-Chiari, ou plus rarement devant l’existence d’une fibrose du confluent cavo-sushépatique chez les malades porteurs d’une échinococcose alvéolaire [32]. Dans la situation d’une transplantation intrafamiliale parent-enfant avec prélèvement du lobe gauche, la reconstruction suprahépatique est réalisée dans la majorité des cas entre la veine hépatique gauche du greffon et l’ostium réuni des veines hépatiques moyenne et gauche du receveur. Dans la situation d’une transplantation intrafamiliale entre adultes avec prélèvement du foie droit, la majorité des équipes prélèvent le foie droit sans la veine hépatique moyenne, ce qui entraîne de façon fréquente une stase veineuse dans le secteur antérieur du foie droit. Dans cette situation, la reconstruction veineuse hépatique est le plus souvent réalisée entre la veine hépatique droite du greffon prélevée avec un patch cave et l’ostium de la veine hépatique droite du receveur. Toute veine hépatique accessoire inférieure droite, toute veine hépatique issue 6 Techniques chirurgicales Reconstruction vasculaire et transplantation hépatique du segment V ou du segment VIII, de calibre conséquent, se drainant vers la veine hépatique moyenne, doit être réimplantée dans la veine cave inférieure, soit directement, soit par l’intermédiaire d’un greffon veineux interposé [54, 60]. 43-312 Les complications vasculaires les plus fréquentes après transplantation hépatique sont les complications artérielles, représentées principalement par les thromboses et les sténoses. Les thromboses artérielles requièrent une retransplantation dans 50 % [47] des cas. voie biliaire principale du greffon doit faire associer un geste de reconstruction biliaire par anastomose hépaticojéjunale sur la convergence, susceptible de réartérialiser les voies biliaires intrahépatiques par collatéralité issue du territoire mésentérique supérieur. La prévention de la thrombose repose avant tout sur la réalisation en urgence d’un échodoppler éventuellement complété d’une artériographie en cas de fièvre, d’une élévation brutale des transaminases, ou d’une complication biliaire précoce. La thrombose tardive compliquée de sténose(s) biliaire(s) aboutit le plus souvent à une reconstruction vasculaire et biliaire ou à une retransplantation élective. Elle survient après la quatrième semaine. Sa physiopathologie est mal connue. Elle est symptomatique dans 50 %, essentiellement sous la forme de sepsis ou de complications biliaires. Elle peut se révéler par des altérations isolées du bilan hépatique ou une dilatation des voies biliaires [4]. ¶ Thrombose ¶ Sténose Sa fréquence est de 4 à 8 % dans la transplantation hépatique orthotopique réalisée chez l’adulte [6, 33, 56] et de 9 à 15 % chez l’enfant [27, 45, 53]. Elle représente 65 % des complications vasculaires de la transplantation hépatique [33] et est associée à une mortalité de 50 %. Son évolution se fait le plus souvent vers la retransplantation, soit précoce pour nécrose hépatique ischémique, soit tardive pour cirrhose biliaire secondaire à une cholangite ischémique diffuse, la vascularisation biliaire étant exclusivement artérielle. Elle est favorisée par [34, 42, 53] : Elle se révèle dans la majorité des cas par la survenue de sténoses biliaires et/ou d’élévation fluctuante des transaminases, sans argument en faveur d’un rejet. Le doppler hépatique est peu contributif car la persistance d’un flux artériel subnormal ne préjuge pas de l’existence d’une sténose significative. Elle est située dans deux tiers des cas sur l’anastomose et est accessible à une angioplastie [12, 62] (fig 9A, B). – receveur < 15 kg ; – ischémie froide prolongée ; Les complications portales de la transplantation hépatique sont rencontrées dans 1 à 2 % des cas [23, 31, 51, 63]. Il s’agit essentiellement de thrombose portale et de sténose anastomotique. – sténose d’amont (ligament arqué ou athérome) souvent sous-évaluée ; ¶ Thrombose Complications postopératoires COMPLICATIONS ARTÉRIELLES – diamètre artère receveur < 3 mm ; – reconstruction artérielle complexe ; – mais aussi par les malfaçons techniques, un hématocrite élevé, les transfusions massives, l’utilisation d’antifibrinolytiques, le rejet. La prévalence de la thrombose artérielle chez l’enfant peut être diminuée par l’utilisation d’un greffon adulte obtenu par réduction ou bipartition, et cela vraisemblablement en raison d’un calibre plus élevé des artères du greffon issu d’un donneur adulte [26, 27]. Le diagnostic est le plus souvent évoqué précocement devant la disparition du signal artériel au doppler hépatique quotidien [41, 46], avant même toute manifestation clinique ou biologique. C’est dans ces conditions de diagnostic précoce qu’une tentative de thrombectomie chirurgicale peut être envisagée. Ce geste, s’il parvient à restaurer un flux artériel dans environ 50 % des cas, n’empêche le plus souvent pas la survenue de complications biliaires ischémiques tardives. L’intervention recherche d’abord une malfaçon technique : plicature par excès de longueur, sténose anastomotique, principalement. La face antérieure de l’anastomose est désunie. La désobstruction côté receveur est facilement obtenue sous la pression du flux artériel avec ou sans utilisation de sonde de Fogarty. Côté greffon, la thrombectomie d’aval, réalisée à la sonde de Fogarty, est complétée par une fibrinolyse in situ (30 min) afin de lyser les fragments de thrombus intrahépatique inaccessibles à une désobstruction mécanique. Ceux-ci sont en effet susceptibles d’engendrer une rethrombose précoce par augmentation des résistances artérielles intrahépatiques. Une artériographie de contrôle peropératoire est effectuée de manière systématique pour juger de la qualité du résultat obtenu. Si le flux d’amont est insuffisant, on discutera, soit un pontage aortohépatique, soit une ligature proximale de l’artère splénique susceptible d’augmenter le débit artériel hépatique, en particulier dans le cas d’une splénomégalie importante, soit une reconstruction artérielle sur l’artère splénique retournée du receveur. Toute plicature, excès de longueur, sténose, flap intimal, thrombus adhérent doit conduire à une résection et à la confection d’une nouvelle anastomose artérielle. L’existence d’une fistule biliaire ou d’une nécrose ischémique de la COMPLICATIONS PORTALES La thrombose portale survient dans 1 % des transplantations et sera suspectée en cas d’insuffisance hépatique aiguë postopératoire, d’ascite, d’hémorragie digestive, ou de douleurs abdominales diffuses. Elle est favorisée par une thrombectomie porte peropératoire, une contrainte technique (hypoplasie porte du receveur, disparité de calibre, plicature de l’anastomose par excédent de longueur, twist en rotation) ou une insuffisance de flux (flux porte hépatofuge [7] préopératoire en raison de shunts portosystémiques spontanés volumineux ou d’une dérivation portosystémique chirurgicale non fermée), un rejet aigu sévère. La thombectomie chirurgicale peut être proposée [49, 61]. Elle est le plus souvent vouée à l’échec, en raison d’un diagnostic tardif. Des observations de thrombolyse percutanée avec mise en place d’une endoprothèse ont été rapportées [3, 9, 10]. En cas de thrombose portale pédiculaire suspendue avec persistance d’une perméabilité des branches portales intrahépatiques, un pontage extra-intra-hépatique hépatopète entre la veine mésentérique supérieure et la terminaison de la branche portale gauche dans le récessus de Rex par greffon interposé permet de récupérer une vascularisation portale du greffon tout en traitant l’hypertension portale (pontage mésentérico-rex) [18]. Ce pontage est réalisé par l’interposition d’un greffon veineux jugulaire autologue. ¶ Sténose Les sténoses portales sont fréquemment dues à un défaut technique éventuellement lié à une incongruence. Elles sont le plus souvent de révélation tardive, au-delà du deuxième mois, sous forme d’ascite, de splénomégalie ou d’hémorragie digestive. La réparation chirurgicale nécessite le plus souvent une résection-anastomose de la veine porte. Cette intervention est difficile et peut nécessiter le démontage de l’anastomose biliaire pour des raisons d’exposition. L’angioplastie portale percutanée transhépatique a transformé la prise en charge de cette complication avec d’excellents résultats obtenus par simple dilatation et sans interposition d’endoprothèse vasculaire [23, 63]. Il est probable que dans les greffons réduits et les transplantations avec donneur vivant, une sténose différée puisse être due à une 7 Reconstruction vasculaire et transplantation hépatique 43-312 Techniques chirurgicales * A * B 9 Sténose hyperserrée de l’anastomose artérielle hépatique révélée par une cholangite ischémique. A. Vue artériographique. bascule de ce greffon liée à sa régénération [54]. Les symptômes dus à la congestion portale peuvent être retardés en raison d’une circulation collatérale portale développée par l’hypertension portale prétransplantation. B. Vue cholangiographique. Elles sont rencontrées dans 0,5 à 2,2 % des transplantations hépatiques. et des anastomoses cavocaves en piggy-back entre la veine cave suprahépatique du greffon et le tronc commun des veines hépatiques moyenne et gauche du receveur. Le diagnostic est suggéré par l’échodoppler en cas de perte du signal triphasique des veines hépatiques. La cavographie ou l’angio-IRM permet de confirmer le diagnostic. En cas de transplantation pour syndrome de Budd-Chiari associé à une hypercoagulabilité, un traitement anticoagulant ou antiagrégant est indiqué pour éviter la thrombose cave postopératoire. ¶ Thrombose ¶ Sténose La thrombose de la veine cave inférieure est observée dans 0,6 à 2 % des cas après transplantation. Ses manifestations cliniques sont un œdème des membres inférieurs, une oligurie avec insuffisance rénale en rapport avec un syndrome de Budd-Chiari lorsque la thrombose cave intéresse la veine cave suprahépatique ou les veines sushépatiques. Cette situation peut conduire à une indication de retransplantation. Ses facteurs étiologiques sont un greffon de petite taille par rapport au receveur, susceptible d’une bascule et d’une plicature de l’anastomose cave suprahépatique. En cas d’anastomose cavocave avec préservation de la veine cave inférieure du receveur, deux facteurs ont été identifiés comme pouvant favoriser l’obstruction cave suprahépatique : il s’agit des greffons volumineux Les sténoses se présentent essentiellement sous la forme d’une ascite réfractaire ou d’un syndrome de Budd-Chiari. Le diagnostic est suggéré par l’échodoppler en cas de perte du signal triphasique des veines hépatiques. La cavographie ou l’angio-IRM permet de confirmer le diagnostic. Le traitement le plus adapté est l’angioplastie cave percutanée par voie jugulaire ou fémorale. La survenue d’une sténose itérative après dilatation peut faire discuter, soit la mise en place d’une endoprothèse autoexpansive, soit la réalisation d’une cavoplastie chirurgicale d’élargissement. Il s’agit d’une intervention délicate requérant une exclusion vasculaire totale du greffon avec clampage suprahépatique intrapéricardique [20, 21, 54, 60, 63] . COMPLICATIONS VEINEUSES HÉPATIQUES 8 Techniques chirurgicales Reconstruction vasculaire et transplantation hépatique 43-312 Références [1] Azoulay D, Adam R, Castaing D, Muresan S, Essomba A, Vibert E et al. Liver transplantation with cavoportal or renoportal anastomosis: a solution in cases of diffuse portal thrombosis. Gastroentérol Clin Biol 2002 ; 26 : 225-230 [22] Falchetti D, de Carvalho FB, Clapuyt P, de Ville de Goyet J, de Hemptinne B, Claus D et al. Liver transplantation in children with biliary atresia and polyspenia syndrome. J Pediatr Surg 1991 ; 26 : 528-531 [2] Azoulay D, Hargreaves GM, Castaing D, Bismuth H. Caval inflow to the graft: a successful way to overcome diffuse portal system thrombosis in liver transplantation. J Am Coll Surg 2000 ; 190 : 493-496 [23] Funaki B, Rosenblum JD, Leef JA, Hackworth CA, Szymski GX, Alonso EM et al. Angioplasty treatment of portal vein stenosis in children with segmental liver transplants: midterm results. AJR Am J Roentgenol 1997 ; 169 : 551-554 [3] Baccarani U, Gasparini D, Risaliti A, Vianello V, Adani GL, Sainz M et al. Percutaneous mechanical fragmentation and stent placement for the treatment of early post transplantation portal vein thrombosis. Transplantation 2001 ; 72 : 1572-1574 [24] Goldstein RM, Secrest CL, Klintmalm GB, Husberg BS. Problematic vascular reconstruction in liver transplantation. Part I. Arterial. Surgery 1990 ; 107 : 540-543 [4] Bhattacharjya S, Gunson BK, Mirza DF, Mayer DA, Buckels JA, McMaster P et al. Delayed hepatic artery thrombosis in adult liver transplantation: a 12-year experience. Transplantation 2001 ; 71 : 1592-1596 [5] Bismuth H, Houssin D. Reduced-sized orthotopic liver graft in hepatic transplantation in children. Surgery 1984 ; 95 : 367-370 [6] Blumhardt G, Ringe B, Lauchart W, Burdelski M, Bechstein WO, Pichlmayr R. Vascular problems in liver transplantation. Transplant Proc 1987 ; 19 : 2412-2413 [7] Boillot O, Sarfati PO, Bringier J, Moncorge C, Houssin D, Chapuisy. Pathologie de la veine cave inférieure et transplantation hépatique. Ann Chir. 1990 ; 44 : 540-544 [8] Brems JJ, Millis JM, Hiatt JR, Klein AS, Quinones-Baldrich WJ, Ramming KP et al. Hepatic artery reconstruction during liver transplantation. Transplantation 1989 ; 47 : 403-406 [9] Broelsch CE, Emond JC, Thislethwaite JR, Whitington PF, Zucker AR, Baker AL et al. Liver transplantation, including the concept of reduced-sized liver transplants in children. Ann Surg 1988 ; 208 : 410-420 [10] Broelsch CE, Whitington PF, Emond JC, Heffron TG, Thislethwaite JR, Stevens L et al. Liver transplantationin children, fron living related donors. Ann Surg 1991 ; 214 : 428-439 [11] Burtch GD, Merion RM. Transdiaphragmatic exposure for direct atrial anastomosis in liver transplantation for BuddChiari syndrome. Transplantation 1989 ; 48 : 161-163 [12] Cardella JF, Castaneda-Zuniga WR, Hunter D, Amplatz K. Angiographic and interventional radiologic considerations in liver transplantation. AJR Am J Roentgenol 1986 ; 146 : 143-153 [13] Cherqui D, Duvoux C, Rahmouni A, Rotman N, Dhumeaux D, Julien M et al. Orthotopic liver transplantation in the presence of partial or total portal vein thrombosis: problems in diagnostic and management. World J Surg 1993 ; 17 : 669-674 [14] Cherqui D, Lauzet JY, Rotman N, Duvoux C, Dhumeaux D, Julien M et al. Orthotopic liver transplantation with preservation of the caval and portal flows. Transplantation 1994 ; 58 : 793-796 [15] Cherqui D, Panis Y, Gheung P, Duvoux C, Rotman N, Golli M et al. Spontaneous portosystemic shunts in cirrhotics: implications for orthotopic liver transplantation. Transplant Proc 1993 ; 25 : 1120-1121 [16] Couinaud C, Houssin D. Partition réglée du foie pour transplantation. Contraintes anatomiques. Paris : Couinaud C, Houssin D(à compte d’auteur), 1991 [17] Daseler EH, Anson BJ, Hamblay WC, Reimann AF. The cystic artery and constituents of the hepatic pedicle. A study of 500 specimens. Surg Gynecol Obstet 1947 ; 85 : 47-63 [18] de Ville de Goyet J, Alberti D, Falchetti D, Rigamonti W, Matricardi L, Clapuyt P et al. Treatment of extrahepatic hypertension in children by mesenteric-to-left portal vein bypass: a new physiological procedure. Eur J Surg 1999 ; 165 : 777-781 [19] Dumortier J, Czyglik O, Poncet G, Blanchet MC, Boucaud C, Henry L et al. Eversion thrombectomie for portal vein thrombosis during liver transplantation. Am J Transplant 2002 ; 2 : 934-938 [20] Egawa H, Tanaka K, Uemoto S, Someda H, Moriyasu F, Sano K et al. Relief of hepatic vein stenosis by balloon angioplasty after living-related donor liver transplantation. Clin Transplant 1993 ; 7 : 306-311 [21] Eid A, Lyass S, Venturero M, Ilan Y, Safadi R, Zamir G et al. Vascular complications post orthotopic liver transplantation. Transplant Proc 1999 ; 31 : 1903-1904 [25] Gordon RD, Shaw BW, Iwatsuki S, Todo S, Starzl TE. A simplified technique for vascularisation of homografts of the liver with a variant right hepatic artery from the superior mesenteric artery. Surg Gynecol Obstet 1985 ; 160 : 475-477 [26] Houssin D, Boillot O, Soubrane O, Couinaud C, Pitre J, Ozier Y et al. Controled hepatic splitting for transplantation in two patients: technique, results and perspective. Br J Surg 1993 ; 80 : 75-80 [27] Houssin D, Soubrane O, Boillot O, Dousset B, Ozier Y, Devictor D et al. Orthotopic liver transplantation with reduced-sized graft: an ideal compromise in pediatrics?Surgery 1992 ; 111 : 532-542 [28] Houssin D, Vigouroux C, Filipponi F, Rossat-Mignod JC, Dousset B, Hamaguchi M et al. One liver for two: an experimental study in primates. Transpl Int 1988 ; 1 : 201-204 [29] Jovine E, Mazziotti A, Ercolani G, Grazi GL, Masetti M, Pierangeli F et al. Prothesis jump graft. An unusual arterial reconstruction in liver transplantation. Transplantation 1998 ; 65 : 288-290 [30] Kirsch JP, Howard TK, Klintmalm GB, Husberg BS, Goldstein RM. Problematic vascular reconstruction in liver transplantation. Part II. Portovenous conduits. Surgery 1990 ; 107 : 544-548 [31] Langnas AN, Marujo W, Stratta RJ, Wood RP, Shaw BW. Vascular complications after orthotopic liver transplantation. Am J Surg 1991 ; 161 : 76-83 [32] Lerut J, Tzakis AG, Bron K, Gordon RD, Iwatsuki S, Esquivel CO et al. Complications of venous reconstruction in human reconstruction in human orthotopic liver transplantation. Ann Surg 1987 ; 205 : 404-414 [33] Marujo W, Langnas AN, Wood RP, Stratta RJ, Li S, Shaw BW. Vascular complications following orthotopic liver transplantation: outcome and the role of urgent revascularisation. Tranplant Proc 1991 ; 23 : 1484-1486 [34] Mazzaferro V, Esquivel CO, Makowka L, Kahn D, Belle S, Kahn D et al. Factors responsible for hepatic artery thrombosis after pediatric liver transplantation. Transplant Proc 1989 ; 21 : 2466-2467 [35] Michels NA. Newer anatomy of the liver and its variant blood supply and collateral circulation. Am J Surg 1966 ; 112 : 337-347 [36] Mitchell A, John PR, Mayer DA, Mirza DF, Buckels JA, de Ville de Goyet J. Improved technique of portal vein reconstruction in pediatric liver transplant recipients with portal vein hypoplasia. Transplantation 2002 ; 73 : 1244-1247 [37] Molinier N. Explorations vasculaires avant transplantation hépatique : l’artériographie est-elle une nécessité ? Résultats d’une étude prospective portant sur 100 malades. Paris : Université Broussais-Hôtel Dieu, 1967 [38] Nakamura T, Tanaka K, Kiuchi T, Kasahara M, Oike F, Ueda M et al. Anatomical variations and surgical strategies in right lobe living donor liver transplantation: lessons from 120 cases. Transplantation 2002 ; 73 : 1896-1903 [39] Navarro F, LeMoine MC, Fabre JM, Belghiti J, Cherqui D, Adam R et al. Specific vascular complications of orthotopic liver transplantation with preservation of the retrohepatic vena cava: review of 1361 cases. Transplantation 1999 ; 68 : 646-650 [40] Okuda K, Ohnishi K, Kimura K, Matsutani S, Sumida M, Goto N et al. Incidence of portal vein thrombosis in liver cirrhosis. An angiographic study in 708 patients. Gastroenterology 1985 ; 89 : 279-286 [41] Pariente D, Riou JY, Schmit P, Verlhar S, Bernard O, Devictor D et al. Variability of clinical presentation of hepatic artery thrombosis in pediatic liver transplantation: role of imaging modalities. Pediatr Radiol 1990 ; 20 : 253-257 [42] Payen DM, Fratacci MD, Dupuy P, Gatecel C, Vigouroux C, Ozier Y et al. Protal and hepatic arterial blood flow measurements of human transplanted liver by implanted doppler probes: interest for early complications and nutrition. Surgery 1990 ; 107 : 417-427 [43] Pilchmayr R, Ringe B, Gubernatis G, Hauss J, Bunzendahl H. Transplantation einer spenderleber auf zwei empfanger (splitting transplantation): eine neue methode in der weiterentwicklung der lebersegment-transplantation. Langenbecks Arch Chir 1988 ; 373 : 127-130 [44] Saad S, Tanaka K, Inomata Y, Uemoto S, Ozaki N, Okajima H et al. Portal vein reconstruction in pediatric liver transplantation from living donors. Ann Surg 1998 ; 227 : 275-281 [45] Sarfati PO, Boillot O, Baudin F, Laurent J, Houssin D, Chapuis Y. Thromboses aiguës de l’artère hépatique en transplantation hépatique pédiatrique : désobstruction chirurgicale et fibrinolyse in situ. Ann Chir 1992 ; 46 : 605-609 [46] Sayage LH, Husberg BS, Klintmalm GB, Goldstein RM, Gonwa TA. Vascular complications in adult liver transplantation. Value of postoperative doppler ultrasound screening and the surgical management of hepatic arterial thrombosis. Clin Transplant 1989 ; 3 : 343-348 [47] Settmacher U, Stange B, Haase R, Heise M, Steinmuller T, Bechstein WO et al. Arterial complications after liver transplantation. Tranpl Int 2000 ; 13 : 372-378 [48] Soin AS, Friend PJ, Rasmussen A, Saxena R, Tokat Y, Alexander GJ et al. Donor arterial variations in liver transplantation: management and outcome of 527 consecutives grafts. Br J Surg 1996 ; 83 : 637-641 [49] Someda H, Moriyasu F, Fujimoto M, Hamato N, Nabeshima M, Nishikawa K et al. Vascular complications in living related liver transplantation detected with intraoperative and postoperative doppler US. J Hepatol 1995 ; 22 : 623-632 [50] Starzl TE, Iwatsuki S, Shaw BW. A growth factor in fine vascular anastomoses. Surg Gynecol Obstet 1984 ; 159 : 164-165 [51] Stieber AC, Zetti G, Todo S, Tzakis AG, Fung JJ, Marino I et al. The spectrum of portal vein thrombosis in liver transplantation. Ann Surg 1991 ; 213 : 199-206 [52] Suzuki T, Nakayasu A, Kawabe K, Takeda H, Honjo I. Surgical significance of anatomic variations of the hepatic artery. Am J Surg 1971 ; 122 : 505-512 [53] Tan KC, Yandza T, de Hemptinne B, Clapuyt P, Claus D, Otte JB. Hepatic artery thrombosis in pediatric liver transplantation. J Pediatr Surg 1988 ; 23 : 927-930 [54] Tanaka K, Uemoto S, Tokunaga Y, Fujita S, Sano K, Nishizawa T et al. Surgical techniques and innovations in living related liver transplantation. Ann Surg 1993 ; 217 : 82-91 [55] Todo S, Makowka L, Tzakis AG, Marsh JW Jr, Karrer FM, Armany M et al. Hepatic artery in liver transplantation. Transplant Proc 1987 ; 19 (1 Pt 3) : 2406-2411 [56] Tzakis AG, Gordon RD, Shaw BW, Iwatsuki S, Starzl TE. Clinical presentation of hepatic artery thrombosis after liver transplantation in the cyclosporin era. Transplantation 1985 ; 40 : 667-671 [57] Tzakis AG, Todo S, Starzl TE. Orthotopic liver transplantation with preservation of the inferior vena cava. Ann Surg 1989 ; 210 : 649-652 [58] Uchiyama H, Hashimoto K, Hiroshige S, Harada N, Soejima Y, Nishizaki T et al. Hepatic artery reconstruction in livingdonor transplantation: a review of its techniques and complications. Surgery 2002 ; 131 (suppl 1) : S200-S204 [59] Varma CR, Mistry BM, Glockner JF, Solomon H, Garvin PJ. Cavoportal hemitransposition in liver transplantation. Transplantation 2001 ; 72 : 960-963 [60] Yamaguchi T, Yamaoka Y, Mori K, Shimahara Y, Nakano Y, Itoh K et al. Hepatic vein reconstruction of the graft in partial liver transplantation from living donor: surgical procedures relating to their anatomic variations. Surgery 1993 ; 114 : 976-983 [61] Yerdel MA, Gunson B, Mirza DF, Olliff S, Buckels JA, Mayer DA et al. Portal vein thrombosis in adults undergoing liver transplantation: risk factors, screening, management, and outcome. Transplantation 2000 ; 69 : 1873-1881 [62] Zajko AB, Bron KM, Starzl TE, Van Thiel DH, Gartner JC, Iwatsuki S et al. Angiography of the liver transplantation patients. Radiology 1985 ; 157 : 305-311 [63] Zajko AB, Sheng R, Bron KM, Reyes J, Nour B, Tzakis A. Percutaneous transluminal angioplasty of venous anastomotic stenosis complicating liver transplantation: Intermediate-term results. J Vasc Interv Radiol 1994 ; 5 : 121-126 9 Encyclopédie Médico-Chirurgicale 43-012 43-012 Techniques endovasculaires appliquées aux artères des membres inférieurs J Marzelle H Borie S Kovarsky JM Pernes D Hovasse JL Lasry E Aptecar N Bussy Principes et matériels Résumé. – Les techniques endoluminales de traitement de l’athérome au niveau des artères des membres peuvent être utilisées comme traitement de première intention ou en complément d’une chirurgie conventionnelle. La plupart de ces techniques sont maintenant validées, comme en témoignent les récentes conférences de consensus : la place et l’intérêt des endoprothèses, de la thrombolyse, par rapport au traitement médical, à l’angioplastie transluminale par ballonnets et à la chirurgie, sont maintenant codifiés. Une bonne connaissance des voies d’abord et des caractéristiques techniques des cathéters et des endoprothèses est fondamentale. Les indications de ces techniques doivent prendre en compte le stade clinique du patient, son profil lésionnel (atteinte segmentaire ou diffuse), les probabilités de complications ou de détérioration à long terme des résultats. © 2002 Editions Scientifiques et Médicales Elsevier SAS. Tous droits réservés. Mots-clés : athérome, sténose, occlusion artérielle, angioplastie, endoprothèse, cathéter, thrombolyse, embolectomie, complications, resténose. Introduction La place, dans un traité de techniques chirurgicales, d’un article sur les techniques endoluminales de traitement de l’athérome au niveau des artères des membres pose plusieurs problèmes : – ces techniques sont à la frontière de la radiologie interventionnelle, mais la collaboration maintenant bien établie entre chirurgiens et radiologues au sein d’une équipe pluridisciplinaire a relégué beaucoup de querelles de chapelle au rang de combats d’arrièregarde. Le chirurgien peut les utiliser en complément d’une chirurgie « classique » ; il est parfois confronté à leurs complications immédiates ou secondaires ; elles peuvent être tentées au cours du premier temps d’une chirurgie de sauvetage de membre : ce sont désormais des techniques chirurgicales à part entière ; – la plupart de ces techniques sont maintenant validées, comme en témoignent les récentes conférences de consensus [59] : la place et l’intérêt des endoprothèses, de la thrombolyse par rapport au traitement médical, à l’angioplastie transluminale par ballonnets et à la chirurgie, sont maintenant mieux codifiés ; – des améliorations technologiques des cathéters et des endoprothèses sont encore attendues, et cet article risque d’être rapidement obsolète : une bonne compréhension des techniques actuelles, leur pratique et la connaissance de leurs limites sont néanmoins indispensables au développement de la chirurgie endovasculaire de demain ; – la majorité de ces techniques ont été développées dans les pays anglo-saxons : dans la mesure où on continue à utiliser la plupart des termes techniques en anglais, nous nous sommes efforcés de les franciser en citant quand même le terme anglais « de référence ». Angioplastie transluminale Principes de l’angioplastie transluminale Bien que la technique d’angioplastie transluminale ait été décrite pour la première fois par Dotter [15] en 1964, celui-ci utilisait des Jean Marzelle : Chirurgien. Hervé Borie : Chirurgien. Stéphane Kovarsky : Chirurgien. Jean-Marc Pernes : Radiologue. Denis Hovasse : Radiologue. Jean-Louis Lasry : Radiologue. Eduardo Aptecar : Radiologue. Hôpital privé d’Antony, 25, rue de la Providence, 92160 Antony, France. Nicolas Bussy : Surveillant, pôle cardiovasculaire interventionnel, clinique Les Fontaines, 54, boulevard Aristide Briand, 77000 Melun, France. dilatateurs coaxiaux en Téflont de taille croissante passés dans la sténose à dilater : ce mode de recanalisation est souvent appelé « dottérisation ». Le véritable essor de l’angioplastie transluminale date de la description, en 1974, par Grüntzig [22] des cathéters à ballonnets à double lumière. Depuis lors, un certain nombre de modifications ont permis d’améliorer les résultats de cette technique, qui doit répondre à plusieurs objectifs [1] : – élargir la lumière artérielle pour rétablir un flux sanguin suffisant ; – permettre au vaisseau traité de rester perméable, sans resténose ; – laisser une interface régulière avec le sang circulant ; – éviter la production d’emboles distaux, athéromateux ou cruoriques ; – léser ou agresser le moins possible la paroi artérielle. Toute référence à cet article doit porter la mention : Marzelle J, Borie H, Kovarsky S, Pernes JM, Hovasse D, Lasry JL, Aptecar E et Bussy N. Techniques endovasculaires appliquées aux artères des membres inférieurs. Principes et matériels. Encycl Méd Chir (Editions Scientifiques et Médicales Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales - Chirurgie vasculaire, 43-012, 2002, 29 p. Techniques endovasculaires appliquées aux artères des membres inférieurs 43-012 Techniques chirurgicales " A1 " A2 1 Angioplastie transluminale percutanée. Matériel de ponction percutanée. A. Aiguilles de ponction. A1. Aiguille de ponction à mandrin ; A2. trocart de Seldinger. B. Introducteur. 1. Gaine à valve ; 2. dilatateur. * B * B * A 2 * C Angioplastie transluminale percutanée. Ponction fémorale sous l’arcade crurale. A. Ponction artérielle. B. Mise en place du guide. C. Passage de l’introducteur. D. Retrait du dilatateur, angiographie. * D Bien que certains aient défendu l’idée qu’il n’y avait pas de « bonne dilatation » sans fracture de la plaque, voire sans image de dissection, un consensus existe maintenant pour que le résultat de l’angioplastie soit une blessure limitée (controlled injury) de la paroi artérielle, suffisante pour maintenir le calibre du vaisseau, mais sans « surdilatation ». Les conséquences de cette surdilatation pourraient en effet être la réocclusion immédiate, la dissection circulante, la rupture artérielle, l’évolution anévrismale, ou la resténose à distance par un mécanisme de remodelage ou d’hyperplasie myo-intimale. Abords artériels VOIES D’ABORD ¶ Ponction percutanée (fig 1, 2) Ponction Elle est pratiquée avec les mêmes règles d’asepsie qu’un abord chirurgical (rasage, badigeonnage avec un antiseptique, mise en place de champs). Après repérage du pouls artériel entre deux doigts, on infiltre d’anesthésique local le derme et l’hypoderme. On 2 peut utiliser une aiguille de ponction 16 G avec mandrin métallique, ou un trocart de ponction type Seldinger. On ponctionne la peau à quelques centimètres du pouls que l’on perçoit, et l’on introduit l’aiguille à 45° jusqu’au contact de l’artère. Si on utilise la technique de Seldinger, on pousse l’aiguille jusqu’à traverser les deux parois (antérieure et postérieure) de l’artère, puis on retire doucement l’aiguille jusqu’à obtenir un reflux de sang artériel. Cette technique a comme inconvénient théorique d’exposer à un saignement au niveau de la sortie de l’aiguille à la face postérieure de l’artère, à une fistule artérioveineuse si on ponctionne la veine adjacente au contact de l’artère. Au niveau fémoral, une ponction trop profonde expose également à une lésion de l’artère fémorale profonde. Si l’on veut éviter ce type d’incident, on a intérêt à ne ponctionner que la paroi antérieure de l’artère : dès qu’on obtient un reflux de sang artériel, on arrête la progression de l’aiguille. L’inconvénient de cette dernière technique est de risquer de s’engager dans un faux chenal : le décollement d’une plaque par l’aiguille peut entraîner une dissection localisée circulante (avec parfois un reflux sanguin trompeur) ; on risque, en injectant dans ce plan, d’aggraver la dissection. Il est donc prudent, une fois le reflux obtenu, d’injecter quelques centimètres cubes de produit de contraste pour vérifier que l’aiguille est bien dans la vraie lumière et que le produit injecté ne stagne pas dans la paroi artérielle. Cette injection-test a, de plus, Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs Tableau I. – Équivalence d’unités french, inches et millimètres. Inches Millimètres French 0,013 0,014 0,015 0,016 0,018 0,021 0,025 0,026 0,032 0,035 0,038 0,039 0,053 0,066 0,078 0,33 0,36 0,38 0,41 0,46 0,54 0,64 0,67 0,82 0,90 0,97 1,00 1,35 1,67 2,00 1,00 1,08 1,15 1,23 1,38 1,62 1,92 2,00 2,46 2,69 2,92 3,00 4,00 5,00 6,00 l’intérêt de situer avec précision le point de ponction, en particulier au niveau du trépied fémoral, ce qui évite, dans les ponctions antérogrades de la fémorale commune, de s’engager dans la fémorale profonde. On retire alors le mandrin en maintenant l’aiguille en place, et l’on passe un guide à travers l’aiguille dans la lumière artérielle. Lorsque le guide est avancé suffisamment loin dans l’artère pour ne pas risquer de ressortir lors d’une fausse manœuvre, on retire l’aiguille et on élargit l’orifice de ponction cutanée d’une moucheture au bistouri, pour ne pas abîmer le bout des cathéters que l’on va introduire le long du guide. Introducteur Dans la plupart des cas, la taille des cathéters, la nécessité de changer de guide ou de cathéter, le fait qu’un ballonnet déflaté présente toujours quelques aspérités pouvant léser la paroi artérielle lors du retrait au point de ponction, justifient la mise en place d’un introducteur (sheath). Cet introducteur est une gaine de gros calibre, de longueur variable (15 à 100 cm), il est muni à son extrémité proximale d’une valve à diaphragme empêchant le reflux de sang, même lorsqu’un cathéter ou un guide de calibre moindre est passé à travers cette valve. Un orifice latéral au niveau de la valve autorise l’injection de produit de contraste ou de sérum hépariné. Avant la mise en place de l’introducteur, on glisse à travers la gaine un dilatateur effilé pour franchir les téguments sans abîmer l’extrémité de l’introducteur lui-même, et surtout pour permettre une dilatation progressive de l’orifice de ponction artériel. L’ensemble gainedilatateur est donc placé le long du guide dans l’artère, et le dilatateur est alors retiré. On a intérêt, en particulier lorsqu’on prévoit une procédure longue ou complexe (passage de plusieurs cathéters), à fixer l’introducteur à la peau par un fil enroulé autour de la valve. La taille nominale des introducteurs correspond à leur calibre interne (c’est-à-dire à la taille des cathéters qu’ils admettent), et est exprimée en french (F) (tableau I) : ainsi, un introducteur 6 F a un calibre interne de 2 mm et permet d’utiliser des cathéters d’angioplastie 5 F. En effet, le calibre en french des cathéters d’angioplastie étant le diamètre externe du cathéter à ballon totalement replié, il est préférable de choisir un introducteur d’une taille supérieure au calibre nominal du cathéter d’angioplastie. Il faut prévoir en début de procédure la taille des cathéters que l’on risque d’utiliser pour ne pas être obligé de changer d’introducteur en cours d’intervention. Cathéters d’angiographie Les cathéters d’angiographie 4 F ou 5 F peuvent être utilisés comme cathéters-guides pour assurer la progression d’un guide au niveau d’une courbure (passage du carrefour aortique lors du cathétérisme iliaque par voie controlatérale, orientation d’un guide vers l’artère tibiale antérieure), à travers une lésion longue et tortueuse (risque de fragilisation du guide) ou à travers une occlusion (perte de transmission des mouvements de poussée et de torsion imprimés au guide, si son extrémité distale est enchâssée sur une trop grande 43-012 longueur dans l’occlusion). On peut également utiliser les cathéters d’angiographie comme cathéters d’échange : une fois la lésion franchie par un premier guide, le cathéter d’angiographie franchit la lésion sur le guide ; ce guide est ensuite retiré et un deuxième guide est passé à travers le cathéter laissé en place. Ce procédé est utile quand le premier guide, choisi comme le plus adapté pour franchir la lésion, a été abîmé ou ne peut être utilisé, du fait de son calibre ou de son manque de rigidité, pour assurer la progression du cathéter d’angioplastie. ¶ Site de ponction Voie fémorale C’est la voie la plus utilisée. La ponction rétrograde permet l’accès à l’artère iliaque, la voie antérograde à la fémorale superficielle, à la poplitée et aux artères de jambe. La ponction doit toujours être effectuée sur la fémorale commune sous l’arcade crurale, de façon à limiter la diffusion de l’hématome. Une ponction au-dessus de l’arcade crurale expose à la constitution d’un hématome, qui peut diffuser dans l’espace rétropéritonéal et entraîner une déglobulisation importante. Ce type de complication se rencontre surtout après utilisation d’introducteurs de gros calibre, et lors de troubles de coagulation induits par une héparinisation systémique importante, par une thrombolyse, ou par des inhibiteurs puissants de l’agrégation plaquettaire. Des hématomes de cuisse volumineux peuvent être observés pour les mêmes raisons, ce qui justifie une compression d’au moins 10 minutes après retrait des cathéters et de l’introducteur, la surveillance prolongée du point d’introduction, parfois le recours à un brassard gonflable de contrepression, voire lorsqu’on prévoit un risque hémorragique, par un système de fermeture mis en place lors de l’ablation de l’introducteur. Voie fémorale controlatérale Cette voie est utile pour traiter des lésions iliaques complexes ou pour réaliser des angioplasties de la fémorale profonde. Elle suppose un matériel particulier pour franchir la bifurcation aortique (cathéter d’angiographie angulé), et un guide suffisamment rigide pour assurer la progression des cathéters en évitant une plicature (guides super-stiff). Une autre possibilité consiste à utiliser un introducteur long et courbe, qui protège la progression des cathéters en passant en pont sur la bifurcation aortique. L’inconvénient de cet abord est d’exposer aux complications de la ponction artérielle du côté asymptomatique. Voie humérale En cas d’impossibilité de cathétériser les trépieds fémoraux, l’accès artériel ne peut être assuré que par ponction des artères du membre supérieur. La voie axillaire expose à des complications neurologiques (compression plexique par hématome) et nombre d’auteurs préfèrent la voie humérale. Elle est facile, du fait du caractère superficiel de l’artère quelques centimètres au-dessus du pli du coude, mais présente plusieurs inconvénients : – la taille des introducteurs est limitée du fait du calibre de l’artère ; – la longueur du trajet jusqu’aux artères des membres inférieurs oblige à prévoir des guides et cathéters plus longs ; – enfin, le guidage de la procédure est plus difficile en raison de l’éloignement et des courbures artérielles franchies (origine des sousclavières, crosse aortique). On a souvent intérêt à s’aider, comme en angioplastie coronaire, d’un cathéter-guide long amené à proximité de la lésion, pour permettre aux mouvements de torsion et de poussée imprimés au guide d’être transmis de façon efficace. Voie poplitée La ponction de la poplitée basse sous-articulaire, sur un patient en décubitus ventral, est utilisée par certaines équipes. Elle permet le traitement par voie rétrograde des lésions ostiales de la fémorale 3 43-012 Techniques endovasculaires appliquées aux artères des membres inférieurs superficielle et des lésions de la jonction iliofémorale, inaccessibles par abord fémoral homolatéral. Si elle peut être mise en balance avec la voie fémorale controlatérale dans certains cas, les partisans de cette voie soulignent son intérêt dans le traitement des lésions occlusives de la fémorale superficielle dans son tiers supérieur : le passage du guide en droite ligne à partir de l’artère poplitée limiterait le risque de dissection, en particulier au passage de l’ostium de la fémorale superficielle. La ponction poplitée n’est pas toujours aisée, en raison de l’absence fréquente de pouls palpable, et de la crainte de léser les veines et les nerfs de voisinage. On peut s’aider, pour guider l’aiguille, d’une échographie ou de l’opacification poplitée par Seldinger controlatéral (ponction fémorale rétrograde et positionnement d’un cathéter d’angiographie dans la bifurcation aortique sur le patient encore en décubitus dorsal). L’inconvénient de cette méthode est double : risque de léser l’artère poplitée basse, souvent infiltrée, par un introducteur de gros calibre, et surtout risque d’un hématome compressif après retrait de l’introducteur. La loge poplitée étant bien limitée, l’hématome ne diffuse pas, mais peut rapidement réaliser une compression des structures nerveuses, dont les conséquences peuvent être dramatiques. Ce risque justifie une surveillance postopératoire rigoureuse, et une intervention chirurgicale d’hémostase et de décompression dès les premiers signes d’alarme. Techniques chirurgicales ¶ Abord chirurgical et des vaisseaux sous-jacents. Il peut également être utilisé en rétrograde pour les angioplasties des vaisseaux sus-jacents : en cas de lésion de la fémorale superficielle sur ses premiers centimètres, un abord de la fémorale superficielle basse peut être réalisé : encore faut-il se donner au moins 10 cm entre la lésion et le point de ponction, de façon à laisser une longueur suffisante d’introducteur dans l’artère avant le site d’angioplastie. Pour les lésions iliaques, l’abord de la fémorale superficielle à la pointe du Scarpa peut être utilisé, même en cas d’occlusion à son origine : on aborde la fémorale superficielle à quelques centimètres de son origine, en zone occluse, et on la ponctionne vers le haut, en créant un chenal avec l’aiguille ; l’angle de ponction doit être inférieur à 30° de façon à garder l’aiguille la plus centrée possible dans l’artère lorsqu’elle arrive dans la fémorale commune. Le franchissement de l’occlusion se traduit par un reflux de sang : il convient néanmoins de vérifier par injection de quelques millilitres de produit de contraste que l’on est bien parvenu dans la vraie lumière. On passe alors le guide, puis l’introducteur dans la fémorale commune à travers la fémorale superficielle occluse. Au retrait de l’introducteur, un ou deux points suffisent en règle pour éviter tout saignement. L’intérêt de la voie chirurgicale est d’éviter tout hématome postopératoire, et d’autoriser ainsi une héparinisation postopératoire identique à celle de la chirurgie conventionnelle. Il est néanmoins prudent de refermer l’incision sur un drain de Redon aspiratif laissé en place 24 heures pour éviter tout suintement postopératoire. Abord limité de la fémorale (fig 3) Angioplastie lors du suivi d’un pontage Moins esthétique que la ponction percutanée, l’abord chirurgical du point de ponction présente plusieurs avantages. Il permet de ponctionner l’artère en zone « saine », après palpation de celle-ci au besoin sur plusieurs centimètres. Il permet la mise en place d’un introducteur de taille importante, par une artériotomie ou par ponction sous contrôle de la vue, et d’assurer après retrait de l’introducteur une hémostase chirurgicale, soit par une bourse ne prenant que l’adventice autour du point de ponction, soit à points séparés de Prolènet chargeant toute l’épaisseur de la paroi artérielle, de façon à fixer le ressaut créé par la ponction au niveau d’une paroi souvent athéromateuse. Enfin, en cas de traitement de lésions à potentiel emboligène, il autorise un clampage transitoire de l’artère. Cet abord limité peut être réalisé sous anesthésie locale. Si un court abord dans le pli inguinal est parfois utilisé lorsqu’on veut ponctionner la fémorale commune, l’abord le plus fréquent est celui de la fémorale superficielle à la pointe du Scarpa, c’est-à-dire sous le niveau de la lame ganglionnaire : après une courte incision cutanée (deux à trois travers de doigts), suffisante pour mettre en place un petit écarteur de Beckmann, on incise l’aponévrose du couturier que l’on écarte en dehors en ayant soin de respecter les branches nerveuses, dont la contusion serait source de paresthésies postopératoires dans le territoire du nerf crural. On palpe la fémorale superficielle, qui est séparée de la veine adjacente sur 2 à 3 cm et mise sur lacs, sans exercer de traction à son niveau. L’aiguille de ponction artérielle est introduite par voie percutanée, le plus souvent à quelques centimètres de l’abord chirurgical de façon à percer l’artère avec un angle de 45° sous contrôle de la vue, pour éviter toute coudure de l’introducteur. La technique de mise en place de l’introducteur est dès lors la même que pour un abord percutané. Quand la taille de l’introducteur semble trop importante par rapport au calibre de l’artère et que l’on craint des complications de la ponction artérielle (fausse route en cas d’artère très infiltrée, suture sténosante d’un orifice de ponction trop large), on peut préférer la mise en place de l’introducteur à travers une véritable artériotomie : l’artère est contrôlée par deux lacs, en amont et en aval de l’artériotomie ; on réalise au ténotome une artériotomie transversale à la face antérieure de l’artère, car une artériotomie longitudinale exposerait à une suture sténosante ou à une fermeture par pièce ; le guide est introduit dans l’artère après avoir autorisé un certain reflux en relâchant le lacs, et l’introducteur est alors passé le long du guide. Le lacs est serré sur l’introducteur pour éviter tout reflux. Cet abord de la fémorale superficielle peut être utilisé en antérograde, pour les angioplasties de la fémorale superficielle basse La survenue d’une sténose d’amont ou d’aval, dépistée lors de la surveillance évolutive dans les mois ou les années qui suivent la réalisation d’un pontage, oblige à s’interroger sur la nature de la lésion à traiter, hyperplasie myo-intimale au niveau des anastomoses ou progression de l’athérome. Si un prolongement du pontage se discute devant des lésions étendues, le recours aux techniques endoluminales est de plus en plus fréquent devant des lésions segmentaires. Si l’abord percutané au niveau d’une artère native ou la ponction du pontage sont maintenant licites du fait de la miniaturisation des matériels, certains arguments militent pour un abord chirurgical limité du pontage : facilité de l’abord chirurgical du pontage à l’endroit où il est superficiel ; difficultés prévisibles d’hémostase en cas de ponction percutanée, après ablation de l’introducteur (risque d’occlusion en cas de compression prolongée, de surinfection, d’hématome ou de faux anévrisme). 4 Angioplastie au cours de la chirurgie vasculaire conventionnelle Une angioplastie peut être réalisée en complément d’un pontage lors du traitement de lésions « à double étage ». Par exemple, on peut coupler une angioplastie iliaque à un pontage fémorodistal, ou au contraire compléter une revascularisation aortofémorale par une angioplastie fémorale superficielle. Cette combinaison est licite lorsqu’on réalise une angioplastie à faible risque de complication (dissection ou thrombose), afin de ne pas compromettre le devenir du pontage. Dans les autres cas, un intervalle de quelques jours est préférable, afin de contrôler la pérennité du résultat. Il est également important d’établir avec soin la stratégie opératoire pour ne pas risquer, par un clampage total prolongé, la thrombose du pontage en charge ou du site d’angioplastie. Que l’on réalise l’angioplastie par l’artériotomie de l’anastomose fémorale ou par ponction du pontage, on a intérêt à mettre en place un introducteur évitant les traumatismes pariétaux inhérents aux passages répétés des guides et cathéters. Si l’on passe par le pontage, on peut préférer une courte prothétotomie que l’on ferme à points séparés, à une ponction dont la suture risque d’être sténosante. Si l’on veut éviter les complications thrombotiques d’un clampage prolongé, plusieurs solutions existent en fonction des cas de figure. • Angioplastie iliaque et pontage fémoropoplité – Si l’anastomose proximale porte sur la fémorale superficielle, on peut mettre en place l’introducteur par l’artériotomie proximale, et réaliser l’angioplastie iliaque dans un premier temps, puisque le Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs 43-012 * B * A * C * D * E 3 Angioplastie transluminale peropératoire. A. Abord de la fémorale superficielle à la pointe du Scarpa. B. Isolement de la fémorale superficielle dans le canal musculaire. C. Mise en place de l’introducteur antérograde. D. Mise en place de l’introducteur rétrograde : tunnellisation dans une occlusion fémorale superficielle. pour angioplastie iliaque. E. Suture du point de ponction. clampage de la fémorale superficielle pour le pontage n’empêche pas le flux iliaque de se drainer vers la fémorale profonde. Cette solution permet, en cas de mauvais résultat de l’angioplastie, de se tourner à temps vers une revascularisation conventionnelle du trépied fémoral (pontage aorto-, axillo-, ou fémorofémoral). – Si l’anastomose porte sur la fémorale commune, on a intérêt à réaliser l’anastomose fémorale dans un premier temps. Avant la fermeture, l’introducteur est mis en place par l’artériotomie laissée entrouverte et l’on réalise l’angioplastie. On retire alors l’introducteur et l’on ne clampe la fémorale commune que le temps de nouer le fil de l’anastomose, avant de remettre en charge l’axe iliaque et de terminer le pontage fémoropoplité. • Pontage aortofémoral et angioplastie fémoropoplitée Après réalisation du pontage et avant sa mise en charge, un introducteur est placé dans l’anastomose fémorale, avant fermeture 5 43-012 Techniques endovasculaires appliquées aux artères des membres inférieurs Techniques chirurgicales * A * B 4 Architecture des guides à âme fixe. A. Structure du guide : 1. gaine spiralée ; 2. ruban de sécurité ; 3. âme effilée. B. Formes de guides : 1. droit ; 2. angulé ; 3. guide en « J ». " A1 " A2 " B1 " B2 5 Architecture des guides à âme amovible. A. Âme amovible permettant de modifier la forme du bout distal. B. Âme amovible permettant l’infusion de thrombolytiques par le bout distal. de celle-ci ou par une courte prothétotomie ; on ne déclampe le pontage qu’après vérification de la qualité de l’angioplastie. • Pontage fémorodistal et angioplastie des axes de jambe C’est probablement la situation la plus complexe et la plus sujette à controverses, pour de multiples raisons, la principale étant que ce type de revascularisation s’adresse en règle à des patients en situation de sauvetage de membre présentant des lésions diffuses, fémoropoplitées et du trépied jambier. Les résultats des techniques endoluminales appliquées aux lésions diffuses et aux artères de petit calibre font qu’une revascularisation par pontage doit être préférée à chaque fois qu’elle est réalisable avec de bonnes chances de succès : matériau veineux de longueur et de qualité suffisantes, artère receveuse de qualité suffisante et bon lit d’aval. C’est dans les autres cas, quand un pontage ne peut être réalisé dans de bonnes conditions, que se discute le recours aux techniques endoluminales, isolées ou associées à un pontage court (pontage prothétique fémoropoplité haut en amont d’une recanalisation endoluminale, greffe veineuse courte poplitée-artère de jambe en aval d’une recanalisation fémorale). Tous les cas de figure sont possibles, depuis une recanalisation endoluminale à plusieurs étages à partir d’un abord fémoral haut, jusqu’à l’angioplastie à partir d’un pontage. Dans ce dernier cas, il faut garder à l’esprit que la mise en place de l’introducteur au niveau du pontage est souvent préférable à un abord par l’anastomose distale, trop proche des lésions à traiter, avec un risque de léser la paroi artérielle avec un introducteur trop épais et trop rigide. Une héparinisation par voie systémique et des rinçages fréquents au sérum hépariné par l’introducteur doivent permettre d’éviter une thrombose extensive en cas de clampage. 6 GUIDES Depuis le premier guide de 0,05 inches (1,27 mm) utilisé par Dotter et Judkins [15] pour franchir une sténose fémoropoplitée, des améliorations considérables [57] ont permis de mettre au point des guides fins, flexibles (floppy), effilés (tapered), orientables (steerable), faciles à diriger (torquable), dont le revêtement minimise les frictions avec la paroi vasculaire. Dans la majorité des angioplasties transluminales, la lésion est d’abord franchie par un guide laissé en place pendant toute la procédure, afin d’être sûr qu’une fois la sténose ou l’occlusion levée, la continuité de la vraie lumière artérielle sera préservée : en effet le franchissement itératif de la lésion, la fracture de plaque induite par la dilatation risquent de créer un faux chenal qui exposerait à une occlusion de l’artère en aval du site traité, ou risquerait d’entraîner des embolies distales. ¶ Architecture des guides (fig 4, 5, 6, 7) Guides à âme fixe (fig 4) Les guides à âme fixe sont généralement constitués d’une gaine externe spiralée enduite de Téflont qui entoure un mandrin interne : l’âme. L’âme est plus ou moins effilée à l’extrémité du guide, et peut s’arrêter avant celle-ci : dans ce cas, l’extrémité du guide est beaucoup plus souple (floppy), mais requiert un filament supplémentaire de sécurité pour éviter un déroulement de la spirale et un détachement du bout distal. Le bout du guide peut être droit, angulé, ou en « J ». Les guides en « J » sont censés être moins traumatisants pour la paroi : le J est mesuré en millimètres radius (rayon du J) de 1,5 à 3, 7, voire 15 mm de radius. Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs 6 7 Architecture du guide hydrophile. Guides à âme mobile (fig 5) Les guides à âme amovible (movable core) sont construits selon le même principe : revêtement spiralé couvert de Téflont, filament de sécurité et âme. Le retrait de l’âme sur une longueur variable est possible, pour donner de la souplesse à l’extrémité du guide ou lui permettre un certain degré d’angulation, si le revêtement externe est préformé. Enfin, le retrait complet de l’âme autorise, à travers certains guides, l’administration de thrombolytiques. Revêtement externe La spirale est en général constituée d’un fil métallique de section circulaire. L’utilisation d’un fil aplati, en limitant l’épaisseur de la gaine externe, laisse plus de place à l’âme pour rigidifier le guide (super stiff). Ce type de guide est particulièrement utile dans les lésions iliaques tortueuses, surtout en cas d’abord controlatéral, de façon à maintenir le guide en place lors de la progression du cathéter. Lorsqu’on utilise des guides en « J » rigides, on a intérêt, après angioplastie, à effacer le J en retirant le guide dans le cathéter pour éviter de s’accrocher aux aspérités de la paroi. Guides orientables (fig 6) Pour cathétériser les artères tortueuses ou les bifurcations artérielles, on a besoin de guides transmettant la torsion imprimée par l’opérateur depuis l’extrémité proximale jusqu’à l’extrémité distale (torque). L’extrémité distale de ces guides orientables, appelés steerable, est plus souple sur une longueur variable, et le bout peut être angulé, ce qui permet de bien orienter le trajet du guide. Le corps du guide est suffisamment rigide pour transmettre la torsion. Le maniement de tels guides peut être facilité par un « torquer », vis concentrique qui, serrée autour de l’extrémité proximale du guide, permet des gestes plus précis. Guides effilés L’accès aux vaisseaux de petite taille expose à la survenue plus fréquente d’un spasme artériel. Cette notion a conduit au développement de guides dont l’extrémité distale est de plus petit calibre (tapered) que le corps du guide. Guides hydrophiles (fig 7) Leur apparition a amélioré les possibilités de franchissement des sténoses très serrées et des occlusions. Ils sont construits en trois couches concentriques : une âme effilée très élastique en Nitinolt, enrobée d’une couche de polyuréthane et tungstène. Le revêtement est constitué d’un polymère hydrophile, qui devient très glissant dès qu’il est en contact avec un liquide. Cette hydrophilie, responsable de la facilité du guide à franchir les lésions tortueuses, présente plusieurs inconvénients : il faut d’emblée humidifier le guide si l’on veut profiter de son hydrophilie, en particulier pour le glisser dans un cathéter ; le guide devient alors très glissant : on a dès lors du mal à le pousser et à le tourner (l’utilisation d’un « torquer », ou à défaut d’une compresse sèche pour le manœuvrer est recommandée) ; comme on sent très mal sa progression, le guide peut emprunter un plan de dissection sans que l’opérateur ne perçoive de ressaut ; enfin lors de l’échange ou du retrait d’un 43-012 Architecture du guide orientable. cathéter, le guide a tendance à glisser (ou au contraire à rester accroché au cathéter si un segment du guide redevient sec), et il faut surveiller en scopie la position de l’extrémité distale du guide, afin d’éviter une migration qui obligerait à franchir de façon répétée la lésion. Les guides hydrophiles peuvent être droits, angulés ou en « J ». Guides d’injection Il s’agit de guides pourvus d’une âme amovible qui se poursuit jusqu’à l’extrémité distale (Sos ou Cragg). Une fois le guide en place, on retire l’âme et l’on peut perfuser des thrombolytiques par l’extrémité distale du guide. On rapproche de ces guides les cathéters fins de 3 F (T3 de Cook ou Tracker de Target Therapeutics) qui admettent des guides de 0,016 à 0,025 in. ¶ Taille des guides Longueur La longueur du guide varie de 75 cm à 260 cm, selon la longueur des cathéters que l’on veut faire glisser le long du guide. En choisissant la longueur du guide, on doit pouvoir assurer la progression et le retrait du cathéter sur le guide en place (c’est-àdire ayant traversé la lésion), sans avoir besoin de déplacer le guide. Les guides longs, « guides d’échange », sont surtout utilisés pour changer de cathéter lors d’abords très à distance de la lésion à traiter. Calibre Le calibre du guide doit être prévu en fonction du calibre de la lumière interne du cathéter d’angioplastie : 0,035 ou 0,038 in pour les cathéters habituels, 0,014 à 0,018 in pour les cathéters fins d’angioplastie pour artères de jambe. Le calibre du guide intervient également en partie dans ses qualités de progression à travers des lésions tortueuses. Les guides les plus fins peuvent être utiles pour franchir des lésions complexes, mais leur fragilité oblige parfois à les amener jusqu’à proximité de la lésion à traiter à l’intérieur d’un cathéter 4 ou 5 F. SYSTÈMES DE FERMETURE (fig 8) Nous avons vu que le retrait de l’introducteur de l’artère nécessite une compression prolongée de l’artère, en raison du risque d’hématome ou de faux anévrisme. Ce risque est d’autant plus important que la taille de l’introducteur est grande, et que l’on a utilisé pendant la procédure des médicaments antithrombotiques « puissants » ou des thrombolytiques. La persistance d’un saignement peut nécessiter le maintien d’une compression prolongée, manuelle ou par l’intermédiaire d’une ceinture munie d’un ballon transparent de pression (Femostopt). Des systèmes de fermeture de l’orifice artériel ont été développés pour pallier ces inconvénients. Certains permettent de fermer l’orifice de ponction soit par un bouchon de collagène (plug) : c’est le système Angiosealt ; d’autres (Percloset, Closuret) réalisent une véritable suture artérielle : le fil de suture est noué à l’extérieur de la plaie, et le nœud coulisse le long du trajet de ponction jusqu’au contact de la paroi artérielle. Le risque de sepsis local lié à l’utilisation de tels systèmes rend impératives des précautions d’asepsie rigoureuses lors de leur mise en place. Par ailleurs, l’efficacité de ces systèmes est souvent limitée aux introducteurs de taille inférieure à 8 F. 7 43-012 Techniques endovasculaires appliquées aux artères des membres inférieurs Techniques chirurgicales * B * A * C * E * D 8 Système de fermeture percutanée (Percloset). A. Positionnement du système Closery à la place de l’introducteur. B. Déploiement de l’aiguille. C. Extériorisation des fils de suture. D. Les deux fils sont placés dans une boîte (à gauche) dans laquelle le nœud est automatiquement préparé, et le système Closery est retiré de l’artère. E. Descente du nœud au contact de la paroi artérielle au moyen d’un poussoir. Angioplastie transluminale par ballonnet CARACTÉRISTIQUES DES CATHÉTERS D’ANGIOPLASTIE ¶ Profil des cathéters Il arrive, devant une sténose très serrée déjà franchie par le guide, de ne pas pouvoir franchir la lésion avec le cathéter à ballonnet. De nombreuses améliorations [39] de la forme de l’extrémité du cathéter (taper), de sa consistance, autorisent le franchissement de la lésion sans forcer, mais il n’existe pas de consensus sur le meilleur « profil » à adopter. La diminution du calibre des cathéters, qui sont passés de 9 à 7 F, et maintenant à 5 F et même 4,3 et 3,5 F pour les cathéters à ballonnets de petit calibre, permet de s’approcher le plus possible du calibre du guide. Enfin la longueur de l’extrémité distale du cathéter et le mode de pliage du ballon (fonction du matériau utilisé) jouent également. Même avec des cathéters très « profilés » (low profile) il est parfois nécessaire, plutôt que de pousser le cathéter en forçant la sténose (au risque de produire une embolie distale), de passer sur le guide des cathéters de calibre croissant pour « dottériser » la lésion jusqu’à un calibre suffisant, afin que le cathéter à ballonnet passe sans problème : par exemple, passage sur un guide 0,035 in d’un cathéter d’angiographie 4 F avant d’utiliser un cathéter à ballonnet 5 F. 8 ¶ Force de dilatation du ballon (fig 9) Cette force de dilatation est la résultante de plusieurs facteurs [1] : – la pression hydrostatique produite par le liquide d’inflation du ballon ; – le calibre du ballon : la tension radiale (T) exercée sur les parois du ballon qui se gonfle pour atteindre sa forme finale répond à la loi de Laplace (T = P × R), et est fonction de la pression (P) à l’intérieur du ballon, et du rayon R du ballon. À pression d’inflation égale, elle est donc plus grande dans les ballons de gros calibre, ce qui explique que la pression d’inflation nécessaire pour faire céder la sténose d’une artère de gros calibre (iliaque) soit moins importante que celle qui est nécessaire pour faire céder la sténose d’une artère de petit calibre (tibiale ou coronaire) dont la structure pariétale serait similaire. On comprend donc que les ballons de gros calibre requièrent une pression d’inflation moindre et que le risque de rupture artérielle, à pression d’inflation égale, soit plus important dans les artères de gros calibre, comme l’aorte et les iliaques ; – la compliance du ballon : c’est la mesure du degré d’élargissement du ballon au-delà de son calibre nominal pour une pression d’inflation donnée. Un ballon non compliant ne dépasse jamais son diamètre nominal, quelle que soit la pression d’inflation. Il garde sa forme, son calibre et son profil lors d’inflations répétées. Comme tous les ballons sont fabriqués avec un matériau élastique, chaque ballon a un certain degré de compliance. Pour les ballons les moins Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs 43-012 l’autre côté de la plaque, un ballon plus long prend appui sur toute la circonférence de l’artère pour pousser sur la plaque ; – la longueur de sténose : dans la mesure où une sténose longue a une surface de contact plus grande, la force totale de dilatation du ballon au niveau de la sténose est plus grande ; – le degré de sténose : plus la sténose est serrée, plus la force de dilatation du ballon, à pression d’inflation égale, est importante. Le vecteur de force est fonction de l’amplitude du rétrécissement du ballon au niveau de la zone sténosée. Alors qu’une pression d’inflation modérée entraîne un vecteur de force important sur une sténose très serrée, une sténose résiduelle modérée demande des pressions d’inflation beaucoup plus importantes, proches de la pression de rupture du ballon. Ce concept a conduit à développer des ballons résistant à de hautes pressions d’inflation, pour éviter une sténose résiduelle. Cette sténose résiduelle conduisait, lorsqu’on ne disposait que de ballons à faible pression, à discuter d’une angioplastie complémentaire avec un ballon de taille supérieure. * A * B CHOIX DU BALLON ¶ Matériau La plupart des ballons sont fabriqués à partir des cinq classes principales de polymères du plastique : chlorure de polyvinyle (PVC), polyéthylène (PE), polyéthylène téraphtalate (PET), Nylon, et polyuréthane (PU) renforcé. – PVC : ce matériau est de moins en moins employé. Le ballon a un certain degré de compliance, même aux pressions d’inflation habituelles. Cette compliance a tendance à augmenter lors d’inflations répétées. La pression de rupture du ballon est basse, comparée à celle des autres matériaux utilisés. Certains dérivés du PVC auraient de meilleures caractéristiques de compliance. * C 9 Principes de l’angioplastie. A. La force d’expansion (FE) suit la loi de Laplace : elle est fonction de la pression d’inflation du ballon (P) et de son calibre (D) [1]. B. Compliance du ballon. 1. Ballon compliant : augmentation de taille aux deux extrémités de la zone sténosée ; 2. ballon non compliant : maintien du calibre aux fortes pressions. C. Tableau de compliance en fonction de la pression d’inflation : ballon compliant, ballon peu compliant, ballon non compliant. compliants, la pression nécessaire à un élargissement du ballon audelà de son calibre nominal est très proche de la pression de rupture du ballon. Si un ballon est compliant, il dépasse son calibre nominal pour de faibles pressions d’inflation : quand le ballon est positionné à cheval sur une sténose, une augmentation de pression d’inflation entraîne une augmentation du calibre du ballon de part et d’autre de la sténose, alors que la pression sur la zone sténosée est moindre qu’avec un ballon non compliant. Ainsi, l’avantage des ballons peu compliants est d’assurer une force de dilatation plus importante au niveau de la sténose à dilater, de maintenir cette force de dilatation lors d’une inflation prolongée, de prévoir exactement le calibre de la zone dilatée, sans surdilatation, en particulier en amont et en aval de la lésion à traiter. Quand on utilise un ballon non compliant, toute baisse de la pression en cours d’inflation témoigne des modifications de la paroi de l’artère et non d’un élargissement du ballon, ce qui permet de suivre la progression de l’angioplastie ; – la longueur du ballon : elle a peu d’influence sur les ballons peu compliants. En revanche, la longueur des ballons compliants a une influence sur la force de dilatation au niveau de la zone à dilater : plus le ballon est long et dépasse de part et d’autre de la sténose, moins la force de dilatation au niveau de la sténose est importante. Si l’on veut exercer une force de dilatation importante au niveau d’une sténose avec un ballon compliant, il faut donc choisir le ballon le plus court possible. Les ballons longs non compliants ont un avantage théorique : alors qu’un ballon court, appliqué sur une sténose excentrée, a tendance à étirer la paroi, plus élastique, de – PE : les ballons en PE sont en règle moins compliants, et ont des pressions de rupture supérieures que ceux qui sont fabriqués en PVC. La compliance dépend néanmoins de l’épaisseur du ballon, et certains cathéters très profilés ont donc une compliance plus importante. Le PE a une résistance à la déchirure plus importante que le PET, ce qui expose moins aux perforations de ballons et aux ruptures sur des sténoses calcifiées ou irrégulières. – PET : ce matériau a permis d’élaborer des ballons plus fins et mieux profilés. Les ballons en PET sont beaucoup moins compliants que ceux qui sont en PVC ou en PE et peuvent supporter de hautes pressions d’inflation. – Dérivés du Nylon (Nydext, Duralynt) : ces ballons présentent des pressions d’inflation et des caractéristiques de compliance qui dépendent de leur composition, et semblent moins fragiles que le PET dans les sténoses calcifiées. – PU : ces ballons sont peu compliants, même après des inflations répétées. Les cathéters d’Olbert, en PU renforcé par une mèche de Nylon, ont une pression de rupture élevée. ¶ Architecture du cathéter (fig 10) – Cathéters coaxiaux : le premier cathéter de Grüntzig [22] était un cathéter coaxial entièrement en PVC. Ce type de cathéter a été abandonné à cause de sa compliance : à partir d’une certaine pression, la chemise externe avait tendance à se dilater et la chemise interne à se rétrécir autour du canal central. La plupart des cathéters actuellement sur le marché sont des cathéters à plusieurs lumières. Le corps du cathéter est composé de dérivés du polyester, du polyéthylène, du Nylon, ou du polyamide, et le ballon y est collé et/ou scellé par fusion. La lumière externe, qui communique avec l’entrée latérale (sideport) sert à l’inflation ou à la déflation du ballon : elle peut être circulaire ou semi-circulaire, ce qui influence la facilité d’inflation ou de déflation. – Cathéter d’Olbert : ce cathéter est composé de cathéters coaxiaux qui glissent l’un sur l’autre. Le cathéter interne est en PE et le 9 43-012 Techniques endovasculaires appliquées aux artères des membres inférieurs * A * B " C1 Techniques chirurgicales du cathéter, dont le calibre varie de 2,7 à 5,8 F. Ils autorisent des pressions d’inflation de 4 à 12 atmosphères. La flexibilité de ces cathéters améliore leur progression sur le guide. Malgré un faible calibre, ils transmettent de façon satisfaisante les forces axiales jusqu’à leur extrémité distale (pushability), ce qui permet leur progression dans le vaisseau sans plicature. Les tailles de ballons s’échelonnent de 1,5 à 6 mm, de 0,5 en 0,5 mm. Les ballons ont été construits de façon à se déchirer longitudinalement, ce qui minimise les risques de détachement de l’extrémité distale et de rupture vasculaire. Des efforts ont également été faits pour raccourcir l’extrémité distale du cathéter et pour adoucir l’angle du cathéter avec le ballon (« taper »), afin de limiter le traumatisme du vaisseau adjacent à la zone dilatée. Enfin, le revêtement du cathéter a été amélioré pour rendre l’interface avec le sang circulant le moins thrombogène possible. Cas particuliers • Cathéters de perfusion " C2 Ces cathéters présentent des orifices latéraux en amont et en aval du ballon pour éviter d’interrompre la circulation du sang en cas d’inflation prolongée, ce qui est surtout utile en pathologie coronaire. • Cathéters à larges ballons pour angioplastie aortique * D * E 10 Architecture des différents types de cathéters d’angioplastie. A. Cathéter coaxial. B. Cathéter à double lumière. C. Cathéter d’Olbert : 1. ballon dégonflé ; 2. ballon gonflé. D. Ballon-guide. E. Système Monoraily. cathéter externe en Téflont. Le ballon est en PU renforcé d’une mèche de Nylon : alors qu’il est solidaire du cathéter externe à son extrémité proximale, il est scellé au cathéter interne en distalité ; le cathéter interne glisse en arrière dans le cathéter externe lors de l’inflation et reprend sa position après déflation, ce qui permet au ballon de s’affaisser sans aucune irrégularité susceptible de léser la paroi artérielle lors du retrait. Pour certains, dans les angioplasties sur endoprothèses, ce type de ballonnet limite le risque de migration de l’endoprothèse lors du retrait du ballon. ¶ Autres développements Traitement des artères de jambe Les impératifs de taille et de flexibilité en pathologie coronaire et en neuroradiologie, ainsi que les améliorations technologiques de traitement des polymères, ont conduit au développement d’autres types de cathéters à ballonnets utiles dans le traitement des artères de jambe. • Système d’échange rapide ou Monoraily Ce système permet la sortie du guide à une distance variable (entre 5 et 35 cm selon le modèle) en amont du ballon. L’extrémité proximale du cathéter communique avec le ballon. L’avantage de ce système est de faciliter les échanges sur guide. En outre, dans le système Monoraily, l’extrémité du guide ne bouge pas lors du retrait du cathéter, ce qui évite de surveiller en scopie toute la procédure de retrait. En revanche, ce cathéter ne permet pas l’injection de produit de contraste. • Cathéters profilés (« low-profile ») Certains dérivés du PE sont utilisés pour construire des ballons très profilés, sans différence de calibre entre le ballon replié et le corps 10 Ils autorisent des angioplasties de vaisseaux de 20 ou 30 mm de diamètre et peuvent également être utilisés en pathologie veineuse (syndromes caves). Ils ont des pressions d’inflation faibles, compte tenu du risque de rupture vasculaire, et passent dans des introducteurs de grande taille (10 à 15 F). • Cathéters de prévention des embolies Ils ont été développés pour empêcher les migrations distales lors des angioplasties carotidiennes, et pourraient également être utiles dans les angioplasties d’artères viscérales. Une aspiration des débris avant déflation est nécessaire. • Cathéters permettant l’administration de drogues pendant l’angioplastie Des recherches sur le coating du ballonnet ou des ballonnets microporeux sont à l’étude, essentiellement dans les coronaires. • Cathéters à lame (« cutting balloon ») Utilisés en coronaire [19] et dans les artères de jambe, ils combinent un ballon d’angioplastie 3 F avec des lames réparties tous les 120° qui créent une zone de fragilité de la paroi lors de l’inflation (dissection contrôlée), de façon à couper la plaque d’athérome et à éviter que la force d’inflation ne s’exerce que sur le côté le plus fragile de la paroi. • Cathéters permettant une radiothérapie de contact pour prévenir la resténose Des systèmes de radiothérapie sont à l’étude en coronaire [54], mais également dans les artères périphériques [42]. MODALITÉS DE L’ANGIOPLASTIE Alors qu’elle est passée dans les mœurs depuis plus de deux décennies, en particulier à l’échelon iliaque, il n’existe toujours pas de consensus sur les modalités de réalisation de l’angioplastie. On ne dispose d’aucune étude comparant les effets de différents modes d’inflation du ballon sur les résultats à moyen et à long terme. Les recommandations sont fondées sur l’expérience des opérateurs et sur une certaine réflexion sur la physiopathologie du mécanisme d’action de l’angioplastie. ¶ Type de cathéter Calibre du ballon La prévision du calibre du ballonnet du cathéter d’angioplastie se fait en fonction de la taille de la lumière de l’artère en amont et en aval du segment à traiter. Les notions anatomiques sur la taille des Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs artères non athéromateuses conduisent à surestimer la taille du ballonnet, alors que les artères athéromateuses, même à distance des lésions sténosantes, sont le siège d’une endartérite diffuse. L’évaluation de la taille du ballonnet par l’angiographie impose la prise en compte d’un facteur de correction, lié à l’amplification de l’image. On peut la calculer en se référant à la taille de repères osseux comme les vertèbres, ou utiliser comme référence radioopaque le guide en place dans l’artère. Les mesures faites en doppler-échographie avant procédure peuvent également servir de référence. En cas de doute, il vaut toujours mieux débuter l’angioplastie avec un ballonnet sous-dimensionné, en particulier en cas de sténose très serrée et/ou d’artère calcifiée. En fait, avec la pratique, on choisit souvent d’instinct la taille du ballonnet : 7 à 10 mm pour une iliaque primitive, 6 à 8 mm pour une iliaque externe, 5 à 7 mm pour une fémorale superficielle, 4 à 6 mm pour une poplitée, 2 à 3,5 mm pour une artère de jambe. La question de la dimension idéale du ballon est loin d’être résolue : une surdilatation de la lésion pourrait prévenir le risque de resténose élastique, mais expose à une rupture artérielle, et à un moindre degré à une dissection artérielle (circulante ou thrombosée, elle expose à une occlusion précoce ou à une resténose) ou à des lésions pariétales susceptibles d’induire une agrégation rapide de thrombus, un remodelage par sclérose de la paroi, ou une hyperplasie myointimale secondaire. Une sous-dilatation expose théoriquement à une mauvaise impaction de la plaque d’athérome (plus le ballon est petit, moindre est la pression sur la lésion), au risque de voir la sténose se reproduire après déflation du ballonnet (elastic recoil). Le fait de laisser une sténose résiduelle n’est pas synonyme de mauvais résultat hémodynamique : une petite amélioration de calibre sur une sténose très serrée peut entraîner une amélioration considérable du flux sanguin. Selon la loi de Poiseuille, le débit à travers une sténose à 70 % est cinq fois supérieur au débit à travers une sténose à 80 %. Néanmoins, un résultat incomplet risque de se détériorer plus rapidement en cas de progression de l’athérome. Les modifications pariétales interviennent également : l’impaction d’une sténose irrégulière, ou au contraire la création d’une fracture de plaque à partir d’une sténose régulière, fait passer d’un flux turbulent à un flux laminaire, ou inversement. Une impaction progressive de la plaque par des ballonnets de calibre croissant pourrait limiter le traumatisme pariétal, mais rien ne permet d’affirmer le bien-fondé d’une telle attitude, qui en outre majore d’autant le coût de la procédure. Enfin, l’étude à long terme des résultats des angioplasties transluminales montre que le taux de resténose est significativement plus important lorsqu’on laisse une sténose résiduelle de plus de 30 %. Longueur du ballon Nous avons vu que l’influence de la longueur du ballon sur la pression au niveau de la zone sténosée était surtout significative pour les ballons compliants. Par ailleurs, les ballons longs ont sans doute un intérêt dans l’obtention d’une impaction plus homogène des sténoses excentrées. À l’opposé, le traumatisme imposé à la paroi à distance de la sténose peut être responsable d’hyperplasie intimale avec une resténose longue, là où n’existait qu’une sténose courte : il est donc déconseillé d’utiliser un ballon long surdimensionné par rapport à l’artère en amont et, surtout, en aval, de la sténose que l’on veut traiter. Devant des sténoses étagées sur une dizaine de centimètres, il peut être plus séduisant de réaliser une seule inflation avec un ballon long s’appuyant sur toute la zone d’endartérite, que de réaliser des inflations successives à l’aide d’un ballon court. Compliance Chaque type de ballon est caractérisé par une courbe de compliance exprimant le diamètre du ballon en fonction de la pression d’inflation. Les ballons non compliants ont une courbe plate jusqu’à la pression de rupture. L’intérêt des ballons peu compliants, outre le fait qu’ils assurent une force de dilatation plus importante, un calibre prévisible sans variations aux pressions élevées, est de se déformer moins, et donc de ne pas varier de calibre lors d’inflations 43-012 prolongées ou répétées. Les ballons assez compliants sont adaptés à des sténoses dont on préjuge qu’elles céderont à de faibles pressions d’inflation, et permettent de gagner quelques dixièmes de millimètres en augmentant la pression d’inflation si on juge que l’on a un peu sous-dimensionné le ballon. Choix du cathéter en fonction de l’artère Les lésions simples sur des artères de gros calibre comme les artères iliaques, admettent tous les types de cathéter, même des cathéters assez rigides, peu profilés, de gros calibre. Les artères de plus petit calibre, sinueuses, les lésions occlusives méritent des cathéters plus souples, mieux profilés, d’un calibre inférieur ou égal à 5 F. Les artères de jambe bénéficient des progrès de l’angioplastie coronaire et des cathéters adaptés existent, comme nous l’avons vu plus haut. ¶ Mise en place du cathéter Angioplastie classique Une fois le guide en place à travers la lésion, le cathéter est passé sur le guide après rinçage au sérum du chenal central pour éviter toute friction. Les cathéters 5 F admettent en règle des guides jusqu’à 0,035 in. Le recours à un guide de moindre calibre, 0,025 ou 0,28 in, qui n’est pas occlusif dans le cathéter, autorise des injections de produit de contraste par le cathéter, à condition de munir l’extrémité proximale d’un connecteur en Y à valve. Il faut en revanche se méfier des cathéters plus fins qui n’admettent souvent que des guides de 0,018, 0,016, voire 0,014 inches, car il vaut mieux choisir d’emblée la bonne taille si la lésion est facile à franchir, ou échanger les guides grâce à un cathéter d’échange si un guide plus gros a été utilisé pour franchir une lésion plus complexe. Le positionnement du ballon à travers la lésion est suivi en scopie, des marqueurs radio-opaques étant visibles au centre ou aux deux extrémités du ballon selon la marque du cathéter. Le repérage de la lésion se fait par une injection de produit de contraste à partir de l’introducteur. Pour éviter la répétition inutile des injections, le niveau de la lésion est repéré à l’aide de marqueurs radio-opaques ou d’une règle graduée radio-opaque glissée sous le patient. À condition de ne bouger ni le patient, ni la source, l’artériographie de repérage peut être utilisée comme masque, que l’on rappelle en arrière-fond pour suivre en scopie la progression du cathéter : c’est le roadmapping [38]. L’inflation du ballon est suivie en scopie, le liquide utilisé pour gonfler le ballon étant composé pour moitié de sérum et pour moitié de produit de contraste, afin que le ballon soit visible sans que toutefois la viscosité du produit de contraste ne gêne l’inflation ni la déflation, qui se font à partir de l’orifice latéral du cathéter, à travers un chenal assez fin. Angioplastie sous-intimale (fig 11) Alors que le passage sous-intimal du guide était considéré comme source d’échec ou de complications, l’Anglais Bolia [6] a décrit une technique de recanalisation des occlusions longues, où il place d’emblée son guide dans un plan sous-intimal, franchit la totalité de la lésion à traiter, le guide ne retrouvant la vraie lumière qu’après le pôle distal de la lésion. Un cathéter angulé (type Van Andel) est positionné au pôle supérieur de l’occlusion que l’on veut recanaliser. On pénètre dans l’occlusion au moyen d’un guide téfloné rigide dont on a légèrement angulé l’extrémité, en dirigeant cette angulation vers l’extérieur de la paroi artérielle, à l’opposé de collatérales éventuelles. On crée ainsi une dissection dans laquelle on pousse le cathéter : sa position est contrôlée par injection d’une petite quantité de produit de contraste. On assure ensuite la progression du cathéter à travers l’occlusion sur un guide en J de 1,5 mm de courbure. Quand le cathéter approche de la fin de l’occlusion, on le retire de 3 à 4 cm pour permettre au guide de former une large boucle en « U » que l’on pousse jusqu’à ce qu’elle retrouve la lumière en aval de l’occlusion : c’est cette boucle qui garantit la réentrée dans la vraie lumière artérielle, d’autant plus facilement que l’artère d’aval est peu pathologique. En cas d’artère pathologique, il est possible que la réentrée se fasse plus loin dans l’artère. 11 43-012 Techniques endovasculaires appliquées aux artères des membres inférieurs Techniques chirurgicales – les perforations (10 % des cas pour Bolia) : elles peuvent être traitées en trouvant un plan de dissection alternatif et en réalisant l’hémostase en impactant la paroi contre l’orifice de perforation, ce qui suffit le plus souvent à assurer l’hémostase ; – les embolies périphériques, assez fréquentes, de l’ordre de 5 %, et qui sont traitées le plus souvent par thromboaspiration, plus rarement par thrombolyse ou thrombectomie chirurgicale ; – la survenue d’une dissection extensive, complication la plus grave, heureusement rare, dont la gravité est liée à l’occlusion des collatérales sur son trajet. Elle entraîne une ischémie sévère, et nécessite un pontage en urgence pour restaurer le flux, éventuellement associé à une embolectomie distale ou à une thrombolyse. ¶ Inflation Mode d’inflation 11 Technique d’angioplastie sous-intimale [6]. A. Abord de l’occlusion par le couple cathéter-guide pour entrer dans la paroi le plus loin possible de la collatérale. B. Le cathéter précédé de son guide trouve le plan de moindre résistance, qui est un plan de dissection. La plus grande partie de l’occlusion est ainsi franchie par l’extrémité en « J » du guide qui sort à peine du cathéter. C. Vers la terminaison de l’occlusion, on pousse le guide de façon à former une boucle en « U ». D. Lorsque l’on pousse la boucle en « J » à travers la dissection, sa tendance naturelle est de retrouver la vraie lumière en aval de l’occlusion. Une fois l’occlusion franchie, on réalise une angioplastie par un ballonnet, de 5 mm à l’étage fémoropoplité, gonflé à 12 bars pendant 5 à 10 secondes, sur toute la hauteur de la zone recanalisée. En cas de succès, l’artériographie de contrôle montre une progression rapide du produit de contraste : tout ralentissement doit être dépisté et corrigé par angioplastie itérative. En cas d’occlusion de la fémorale superficielle dès son origine, on ponctionne assez haut la fémorale commune, et l’on commence par introduire un dilatateur de 4 F dans cette artère : on se sert de ce dilatateur comme d’un cathéter pour pénétrer dans la fémorale superficielle occluse, à l’aide d’un guide hydrophile angulé. La recanalisation se poursuit alors comme nous l’avons décrit précédemment. En cas de recanalisation d’artères de jambe, la technique est un peu différente, car la distance par rapport au point de ponction rend malaisée la progression du cathéter. La fréquence du spasme requiert une injection systématique d’antispasmodiques et éventuellement de dérivés nitrés. Au lieu d’un cathéter d’angiographie classique, on utilise un cathéter de diamètre 5 F à ballonnet de 3 mm de diamètre sur 2 cm de long, admettant un guide 0,035 in, contrairement aux cathéters plus fins habituellement utilisés dans les angioplasties jambières, qui passent sur des guides plus fins. Ce système de recanalisation est plus fort, et sa progression est plus aisée. Il permet en outre, en cas de difficulté de progression dans l’occlusion, d’effectuer une angioplastie de tout le segment déjà franchi, afin d’éliminer la résistance à la progression du cathéter. Le guide utilisé est un guide hydrophile de 0,035 in. En cas de difficulté, on peut utiliser un guide hydrophile plus rigide (stiff) en se méfiant de ne pas perforer l’artère. Une fois l’occlusion franchie, on la dilate sur toute sa hauteur, par courtes inflations de 3 à 5 secondes à 12 bars. Les complications propres à ce type de procédure sont : 12 Il n’y a toujours pas de consensus sur le meilleur mode d’inflation : inflation rapide de courte durée, inflations répétées ou inflation progressive et longue. La rapidité de l’inflation peut également jouer un rôle sur le remodelage de la plaque. Il est certain qu’une inflation rapide peut être dangereuse : risque de rupture artérielle en cas de sténose fibreuse dure, « expulsion » d’un bourgeon calcaire. Elle peut également favoriser une fracture de la plaque, avec risque de dissection circulante. En cas de lésion excentrée ne cédant pas à l’inflation, la rapidité d’inflation peut déterminer des lésions de déchirure sur le versant « sain » de l’artère : ces lésions sont incriminées dans le développement ultérieur d’une hyperplasie intimale. La plupart des auteurs s’accordent donc à prôner un gonflage progressif, par paliers, du ballon : la sténose met souvent plusieurs dizaines de secondes à céder. La progression de la dilatation peut être suivie en scopie (l’empreinte de la sténose sur le ballon s’efface) ou sur le manomètre de l’inflateur (une baisse de pression témoigne du fait que la sténose cède). Pression d’inflation Les considérations sur les pressions optimales d’inflation sont très théoriques. L’utilisation de pressions très supérieures à la pression nécessaire à faire céder la sténose aboutit à une meilleure impaction, mais a l’inconvénient d’augmenter le traumatisme pariétal, et donc le risque d’hyperplasie myo-intimale. Il est difficile de prévoir à quelle pression cédera telle ou telle lésion, selon son étendue, le degré de calcification pariétale, l’existence possible de thrombus. Une lésion iliaque simple cède à 2 bars, alors que les sténoses d’axes de jambe calcifiés demandent souvent des pressions supérieures à 10 bars. Devant un bourgeon irrégulier calcifié, le recours rapide à une pression d’inflation élevée peut avoir un effet néfaste : rupture du ballon sur les aspérités avant qu’un quelconque remodelage de la plaque ait eu lieu, ou au contraire rupture pariétale par « expulsion » de la plaque. C’est dans ce type de lésions qu’une inflation prolongée, par paliers successifs, a les meilleures chances de succès, en obtenant un remodelage progressif de la plaque d’athérome. Temps d’inflation Beaucoup d’auteurs s’accordent à considérer que l’effet de remodelage sur la paroi d’une inflation prolongée est meilleur que celui d’inflations de courte durée. Des inflations de 2 minutes sont habituelles. Des inflations plus longues (10 minutes, voire plus) ont été recommandées, de première intention ou devant des sténoses se reproduisant après déflation du ballon. En périphérie, ces inflations longues ne présentent pas tant un risque d’ischémie distale (l’occlusion artérielle étant compensée par la collatéralité), que de formation de thrombus en amont ou juste en aval du ballonnet. Ce risque peut être prévenu par une anticoagulation systémique, éventuellement complétée par injection de sérum hépariné, en amont par l’orifice latéral de l’introducteur, et en aval par le cathéter (il faut retirer le guide si celui-ci occupe toute la lumière interne, ou utiliser un raccord en « Y » à valve dans le cas contraire). Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs * A 43-012 * C * B 12 Analyse des résultats après angioplastie. A. Artériographie. Fracture de plaque (flèche) après recanalisation par angioplastie transluminale d’une occlusion de l’artère fémorale superficielle. B. Artériographie. Dissection circulante avec sténose résiduelle (flèche) après angioplastie transluminale. C. Artériographie. Contrôle d’une angioplastie transluminale de la jonction fémoropoplitée sans sténose résiduelle visible au temps précoce (gauche) ; la stagnation de produit de contraste au temps tardif (droite) traduit l’existence d’un faux chenal de dissection. D. Échographie endovasculaire. Fracture de plaque venant au contact de la sonde d’échographie. * D Mode de déflation • Anomalies pariétales ou endoluminales Le faible calibre de la lumière et la viscosité du produit de contraste rendent la déflation parfois longue et difficile : les seringues d’injection sont munies d’un système de verrou qui permet de maintenir l’aspiration sans effort. Il est impératif de s’assurer, en scopie, que le ballon est parfaitement déflaté avant de commencer le retrait du cathéter, afin d’éviter l’aggravation des lésions pariétales ou la création d’emboles. Le cathéter est le plus souvent retiré complètement pour vérifier le résultat de l’angioplastie, mais la position du guide à travers la lésion doit être maintenue lors du retrait, pour éviter tout traumatisme au cas où une procédure complémentaire serait indiquée. Lors du retrait du ballon de l’introducteur, la surface du ballon présente souvent quelques aspérités résiduelles, qui justifient, à la moindre sensation de résistance, un mouvement tournant afin de replier le mieux possible le ballon autour du corps du cathéter. Une dissection artérielle peut entraîner une sténose résiduelle, indication à une angioplastie répétée ou, en cas de persistance, à la mise en place d’une endoprothèse. Certaines images d’addition persistant dans la lumière peuvent être d’interprétation difficile (thrombus marginé, flap, déchirure pariétale localisée ou fracture de plaque), et seule une angioscopie permet de trancher de façon formelle. ¶ Analyse des résultats (fig 12) [38] Critères angiographiques L’interprétation du résultat après angioplastie prend en compte quatre facteurs. • Sténose résiduelle C’est le rapport du diamètre de l’artère traitée à celui de l’artère sus-jacente. Le calibre de l’artère traitée doit être calculé sur au moins deux incidences, car il n’est pas rare que l’absence de sténose résiduelle sur le cliché de face ne masque une sténose de plus de 50 % sur le cliché de profil. Une sténose de l’artère d’amont ou d’aval est parfois notée. À côté des complications pariétales que nous détaillons plus loin, il peut s’agir d’un spasme. Celui-ci se rencontre même après passage d’un simple guide, a fortiori après angioplastie avec un ballonnet surdimensionné. • Ralentissement du flux artériel Il doit faire suspecter une sténose ou une dissection non visible lors de la première opacification. • Lit d’aval L’étude du lit d’aval dépiste une dissection avec sténose en aval d’une occlusion recanalisée, le guide étant « réentré » dans la vraie lumière artérielle parfois plusieurs centimètres après la fin de l’occlusion. Elle peut également montrer des lésions pariétales à distance liées au passage du guide, ou des embolies distales. Critères hémodynamiques La prise des pressions en aval d’une sténose et le calcul de l’index de pression par rapport à la pression radiale sont un des moyens d’évaluer le caractère significatif de cette sténose. Si la persistance d’un gradient de pression indique une angioplastie complémentaire ou la mise en place d’une endoprothèse, l’absence de gradient de pression n’est pas un élément suffisant pour affirmer l’absence de complications pariétales. La manométrie est surtout réalisée à l’étage iliaque [58]. À l’étage fémoral, la manométrie est beaucoup moins fiable, puisque l’introducteur, en amont de la sténose, constitue un obstacle au flux. 13 Techniques endovasculaires appliquées aux artères des membres inférieurs 43-012 Angioscopie La méconnaissance par l’angiographie de certaines lésions rend compte de certains échecs précoces « inexpliqués », occlusions ou embolies, dont le point de départ est manifestement le site traité. L’angioscopie est le meilleur examen pour visualiser avec précision les anomalies endoluminales, mais ses indications se sont raréfiées, car nombre des anomalies magnifiées par l’optique méritent d’être respectées : elles « cicatrisent » le plus souvent, et leur correction peut être dangereuse. C’est le cas des thrombi marginés, adhérents à la paroi, des flaps qui disparaissent en quelques semaines, et de la plupart des fractures de plaque, si la sténose n’est pas significative. Cet examen, s’il a eu le mérite de permettre une meilleure corrélation avec les images radiologiques, est actuellement d’indication rare si on sait interpréter les anomalies rencontrées dans le contexte de la procédure (meilleure connaissance des caractéristiques de la lésion par l’analyse de l’échographie doppler). Échographie endovasculaire C’est l’examen peropératoire le plus précis [3] pour quantifier le degré de sténose résiduelle. En pathologie occlusive, on utilise des sondes de 20 ou 30 MHz, passées sur guide. Si cet examen identifie plus difficilement que l’angioscopie les anomalies endoluminales comme thrombi ou flaps, il est plus facilement réalisable à l’étage iliaque et, surtout, permet d’analyser de façon fine les anomalies pariétales induites par l’angioplastie : fracture de plaque et dissection. Sa limite principale est le coût de l’examen. Complications de l’angioplastie COMPLICATIONS IMMÉDIATES ¶ Au point de ponction – La survenue d’un hématome au point de ponction percutanée est considérée dans la littérature radiologique comme une complication bénigne. Ne sont considérés comme graves que les hématomes nécessitant une transfusion ou un geste chirurgical d’hémostase. La fréquence des hématomes au point de ponction est corrélée à la durée de la procédure, à la taille de l’introducteur utilisé et aux médicaments antithrombotiques administrés. Dans notre expérience de chirurgie d’hémostase après ponction percutanée, l’état de l’artère ponctionnée intervient également, ce qui nous incite à recommander la pratique d’une échographie-doppler avant de décider du site de ponction : la constatation d’une ectasie, d’une plaque calcifiée ou d’une endartérite irrégulière au niveau du trépied fémoral représente pour nous une indication à chercher un point de ponction plus sain, ou à réaliser un abord chirurgical du site de ponction. Les ponctions percutanées de pontages peuvent également être sources de complications : si on a parfois la chance d’obtenir après retrait du cathéter une hémostase rapide, il existe un risque de saignement prolongé (et la compression prolongée du trajet d’un pontage peut entraîner la thrombose de celui-ci) et un risque de faux anévrisme, parfois septique. – La thrombose au point de ponction est rare, liée à la formation de thrombus le long du cathéter ou de l’introducteur, le thrombus devenant occlusif lors du retrait du cathéter. ¶ Au niveau du site traité Nous avons vu, dans le paragraphe consacré à l’analyse des résultats, le détail des lésions pariétales et endoluminales induites par l’angioplastie. Si certaines, comme les flaps, les irrégularités pariétales, ou les thrombi marginés, cicatrisent en règle sans complication, d’autres méritent une prévention ou un traitement adaptés : – la thrombose du site dilaté justifie une prévention par un traitement antithrombotique, dont les modalités varient selon les 14 Techniques chirurgicales auteurs. La plupart des équipes s’accordent sur la nécessité d’un traitement antiagrégant débuté le plus souvent 24 à 48 heures avant la procédure, et une héparinothérapie pendant la procédure. Certains administrent l’héparine par voie intra-artérielle, en bolus, alors que d’autres préfèrent une héparinisation systémique ; – la persistance d’une sténose significative, par resténose élastique, par fracture de plaque ou par création d’un chenal de dissection thrombosé ou circulant, justifie une angioplastie itérative. En cas d’échec, la mise en place d’une endoprothèse, au moins à l’étage iliaque, n’est plus discutée. Le problème est plus difficile sur les vaisseaux de petit calibre, et surtout au niveau des plis de flexion, où les résultats des endoprothèses sont moins bons. Enfin, devant une lésion réclamant un traitement complémentaire risqué ou aléatoire, il est souvent plus prudent de suspendre la procédure ou de se tourner vers une revascularisation chirurgicale « classique », plutôt que de risquer une aggravation ou une extension des lésions ; – la survenue d’une rupture artérielle, heureusement rare, revêt une gravité certaine à l’étage aorto-iliaque. Elle survient plus volontiers sur les artères calcifiées, a fortiori si l’on utilise des pressions d’inflation fortes sur des artères de gros calibre, et en cas de surdilatation. Après contrôle de l’hémorragie par inflation itérative du ballon (ce qui souligne l’importance de laisser un guide à travers la lésion jusqu’à la fin de la procédure), elle peut être traitée par endoprothèse ou par chirurgie. ¶ À distance du site traité – Des lésions pariétales (lacérations, décollement de plaque) ou des thromboses peuvent être induites par l’introducteur ou par les guides et cathéters utilisés à distance du site traité. Il importe donc de les prévenir en suivant en scopie la progression de la procédure, et en contrôlant au moindre doute (sensation de ressaut, difficulté de progression), par une injection de produit de contraste, la perméabilité artérielle et la position du guide ou du cathéter par rapport à la lumière artérielle. Une fois dépistées, la correction de ces complications se fait selon les mêmes critères que les complications au niveau du site traité. – Un spasme survient d’autant plus volontiers que l’on utilise des instruments rigides ou de gros calibre par rapport à l’artère traitée. Il n’est pas toujours facile de différencier un spasme d’une lésion pariétale iatrogène, mais à l’inverse, ce diagnostic doit être évoqué avant d’entreprendre des manœuvres endoluminales supplémentaires qui risquent de l’aggraver. Il peut être prévenu par l’injection de drogues comme la papavérine, ou traité par dérivés nitrés. Compte tenu des effets secondaires possibles de ces derniers, il faut attendre un certain temps (la levée du spasme n’est pas immédiate) avant de renouveler l’injection. – Les embolies distales peuvent compromettre le résultat immédiat et entraîner une thrombose extensive. Elles peuvent être traitées par thromboaspiration ou par administration in situ de thrombolytiques (en respectant leurs contre-indications), dont le succès dépend de la nature de l’embole (la thrombolyse est inefficace en cas d’athéroembolisme). COMPLICATIONS PRÉCOCES ¶ Faux anévrisme L’apparition secondaire d’un hématome au point de ponction justifie la recherche par échographie-doppler couleur d’un faux anévrisme circulant alimenté par le point de ponction. La constatation d’un faux anévrisme circulant amène à discuter trois options thérapeutiques : chirurgie d’hémostase (avec parfois des retards de cicatrisation liés à la diffusion de l’hématome), compression prolongée [47] sous contrôle échodoppler (procédure parfois longue et inconfortable pour le patient), ou embolisation par ponction directe et injection de colle [36] ou de coils [25] (avec un risque septique théorique). ¶ Sténose au point de ponction Le passage de l’introducteur, surtout s’il est de calibre important, dans une artère pathologique peut se compliquer d’une dissection Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs localisée, qui peut se réaccoler en quelques jours ou évoluer pour son propre compte. La suture artérielle en cas d’abord chirurgical expose également à ce type de complication, surtout en cas de bourse dont les points sont passés trop en profondeur dans la paroi artérielle. ¶ Thrombose et embolie Le processus de « cicatrisation » du site traité n’étant pas immédiat, il n’est pas rare qu’une thrombose au site traité ou des embolies distales surviennent de façon retardée. Même s’il est difficile de définir de façon formelle un profil lésionnel « à risque » sur des critères purement angiographiques (l’angiographie peut méconnaître dissections et anomalies pariétales), il semble préférable de poursuivre une anticoagulation de quelques jours et de contrôler par échographie-doppler toutes les lésions traitées, en particulier les occlusions recanalisées, les lésions diffuses et les angioplasties sur un mauvais lit d’aval. COMPLICATIONS TARDIVES ¶ Resténose C’est la complication qui a fait couler le plus d’encre [20, 52, 67]. En effet, quelles que soient les améliorations apportées à l’angioplastie transluminale, les traitements adjuvants étudiés, il semble qu’on ne peut descendre à moins de 20 à 45 % de resténoses à distance en fonction de la nature de la lésion, du site traité, et de l’état du lit d’aval. Un mécanisme d’hyperplasie myo-intimale, réaction de la paroi artérielle à l’agression, a été mis en évidence par les études histologiques. Il était néanmoins curieux que le taux de resténose après angioplastie soit très supérieur à celui que l’on observe après thromboendartériectomie chirurgicale. L’amélioration des techniques d’imagerie, en particulier l’échographie endovasculaire, a permis d’analyser la part réelle de l’hyperplasie myo-intimale, qui survient en règle dans un délai de 3 à 6 mois après le geste initial, par rapport à trois autres mécanismes : – le remodelage artériel correspond à une rétraction en fibrose de l’artère traitée. Malgré des études en échographie endovasculaire, on n’a pas identifié de critères prédictifs de survenue de ce phénomène, qui a cependant justifié l’utilisation plus « libérale » des endoprothèses, à l’exemple des coronaires ; – la resténose précoce est certainement liée à des lésions pariétales significatives laissées en place et évoluant pour leur propre compte, que l’angiographie de contrôle ou les mesures d’index de pression ont initialement méconnues. Il peut s’agir d’une dissection circulante, parfois secondairement thrombosée, d’un flap occasionnant un ralentissement circulatoire intermittent, de fracture de plaque responsable de turbulences, d’irrégularités pariétales constituant le point d’appel à l’accrétion secondaire de thrombus ; – la resténose tardive est liée à la récidive in situ de lésions d’athérome floride, à laquelle s’ajoutent parfois des lésions de remodelage (diminution du calibre externe de l’artère) et d’hyperplasie myo-intimale. ¶ Réocclusion La littérature confond souvent resténose et réocclusion. La resténose par hyperplasie myo-intimale est d’autant plus significative qu’elle survient sur des artères de petit calibre, mais des facteurs thrombotiques interviennent probablement souvent : ils peuvent être secondaires aux anomalies pariétales, mais également à des variations de débit circulatoire (cardiopathie ischémique), ou à une pathologie surajoutée (cardiopathie emboligène, syndrome inflammatoire, troubles de l’hémostase). La réocclusion du site traité peut s’accompagner d’embolies distales ou d’une thrombose extensive : cette dernière éventualité paraît rare du fait de l’existence de collatérales en amont et en aval de la lésion, susceptibles de maintenir un flux circulant. ¶ Progression de l’athérome Le développement de lésions à distance du site traité peut être parfois rapporté à des complications de la procédure (traumatisme 43-012 pariétal par le guide, embolies), mais il est le plus souvent lié à l’évolutivité de la maladie athéromateuse. Celle-ci peut être favorisée par la persistance des facteurs de risque, en particulier le tabac. On peut reprocher à l’angioplastie transluminale que l’amélioration clinique rapide qu’elle entraîne, au prix d’un geste peu invasif, encourage l’insouciance du patient. Athérectomie Malgré le développement et l’efficacité maintenant reconnue de l’angioplastie transluminale par ballonnets dans le traitement des lésions athéroscléreuses, un certain nombre de limitations à ses applications ont suscité, au début des années 1990, le développement de technologies visant à l’ablation de tout ou partie de la plaque d’athérome [68] : l’athérectomie. Les principes de fonctionnement des différents athérotomes découlent de l’analyse des facteurs limitant l’efficacité de l’angioplastie transluminale [20]. Resténose Ce phénomène survient évolutivement dans 20 à 45 % des cas d’angioplasties. L’ablation de la plaque, plutôt que son remodelage, pourrait diminuer le taux de resténose. Occlusions Par rapport à l’angioplastie des sténoses artérielles, le traitement des occlusions connaît encore un taux d’échecs techniques immédiats important (impossibilité de franchir la lésion en totalité à l’aide d’un guide). L’athérectomie pourrait faciliter le franchissement des occlusions et représenter le traitement des lésions occlusives, seule ou associée à une angioplastie par ballonnet complémentaire. Facteurs anatomiques Certaines situations sont difficiles à traiter par angioplastie (lésions diffuses, sténoses ostiales, etc), et pourraient être accessibles à des technologies spécifiques. Depuis l’agrément par la Food and Drug Administration (FDA) en 1987 aux États-Unis du cathéter de Simpson, d’autres systèmes ont été développés, puis commercialisés. L’agrément par la FDA ne représente qu’un gage que ces technologies répondent à des normes de sécurité. À l’heure actuelle, aucun système n’a fait preuve d’une efficacité suffisante pour pouvoir prétendre remplacer l’angioplastie [65]. Même si certains athérotomes restent utilisés par certaines équipes en pathologie coronaire, l’athérectomie n’est plus utilisée qu’exceptionnellement en pathologie périphérique. L’exemple de l’athérectomie par laser est particulièrement frappant : après une diffusion très médiatisée [53], de nombreuses publications ont fait état de taux de perméabilité médiocres qui ont stoppé les développements de cette technologie [ 3 1 , 4 5 ] . Les différents athérotomes n’ont pas fait preuve de leur supériorité par rapport à l’angioplastie, et leur déclin a coïncidé avec le développement des indications des endoprothèses. Nous ne ferons donc que mentionner l’athérectomie rotative (fig 13) par Rotablatort [70], encore pratiquée par certaines équipes qui ont une activité mixte coronaire et périphérique, mais dont les applications restent exceptionnelles, limitées en outre par le coût de la procédure. Le Rotablatort est un athérotome rotationnel constitué d’une olive métallique dont la partie antérieure, qui fait face à la lésion à traiter, est couverte d’une poussière de particules de diamant. La rotation de l’olive, entre 120 000 et 180 000 t/min, est assurée par un câble, relié à un moteur à air comprimé, à l’intérieur d’un cathéter qui permet en outre une irrigation de sérum physiologique pour refroidir le câble et l’olive. Olive et câble passent sur un guide métallique de 0,009 in à extrémité distale en platine : ce guide est bloqué automatiquement pendant l’activation du système, mais peut sinon être avancé dans l’artère à traiter. Différentes tailles d’olive sont disponibles, de 1,5 à 3 mm. 15 43-012 Techniques endovasculaires appliquées aux artères des membres inférieurs Techniques chirurgicales * B * A 13 Athérectomie sur guide par Rotablatort. A. Architecture de l’athérotome : 1. raccord de la turbine avec l’air comprimé ; 2. poussoir ; 3. irrigation ; 4. rétrocontrôle. B. Recanalisation du tronc tibiopéronier par Rotablatort, sans angioplastie complémentaire. Après franchissement de la lésion par le guide, on active le moteur et on avance progressivement l’olive au sein de la lésion, sans forcer, au moyen de la mollette du système d’avancée : l’olive progresse ainsi de plusieurs centimètres dans la lésion. L’avancée de l’olive doit être très lente : le temps de franchissement d’une lésion segmentaire est de 3 à 5 minutes (la console est pourvue d’un tableau lumineux qui compte le temps d’activation du moteur). Une fois la lésion franchie, on retire le cathéter en activant le moteur à une vitesse de 60 000 à 90 000 t/min en laissant le guide en place, de façon à contrôler le résultat. Une sténose résiduelle impose l’utilisation d’une fraise de plus gros calibre ou une angioplastie complémentaire. L’efficacité du Rotablatort est tributaire du passage préalable de la lésion par un guide : il est illusoire et dangereux de tenter de recanaliser une occlusion par Rotablatort seul. Les complications [2] sont la rupture artérielle (surtout quand on utilise d’emblée une fraise de calibre trop proche de celui de l’artère, le flux ralenti (slow flot : l’angiographie de contrôle après passage de la fraise retrouve parfois une lenteur de progression du produit de contraste qui pourrait être liée à des phénomènes de cavitation), le spasme (que certains préviennent par administration systématique d’inhibiteurs calciques). On a également rapporté la survenue d’une hémoglobinurie, et surtout d’athéroembolisme. Endoprothèses Principes des endoprothèses En France, il a été pratiqué près de 50 000 angioplasties périphériques en l’an 2000, avec un taux de stenting de 20 %. En effet, les techniques et les matériaux utilisés ont repoussé les limites de l’angioplastie, alors que les échecs de pose sont devenus plus rares (biocompatibilité des matériaux utilisés, réduction de l’épaisseur des endoprothèses, diminution du profil distal des ballons, sertissage par machine des endoprothèses, traitement adjuvant médicamenteux adapté). Bizarrement, le terme « stent » est né en 1854, quand Charles Thomas Stent, dentiste anglais, a inventé un système de tuteur destiné à soutenir les dents (couronne). Mais c’est encore à Dotter [14] que revient le mérite d’avoir imaginé la possibilité de prothèses par voie endoartérielle. La première implantation sur l’homme d’une endoprothèse coronaire en platine fut réalisée en France à Toulouse par Jacques Puel [56] en 1986. Cet événement est important, car l’essor historique des endoprothèses, et les progrès dans leur conception, proviennent essentiellement de l’expérience des coronaires. La resténose élastique (elastic recoil) et la dissection sous-intimale ou médiale (cette distinction au sein d’une paroi très remaniée par l’athérome est souvent très théorique) sont des facteurs limitants du succès de l’angioplastie transluminale, en laissant une sténose résiduelle après déflation du ballon, et en laissant à la surface de la zone traitée des irrégularités, facteurs de turbulences et de thrombose. La surdilatation par un ballon de dimension supérieure au calibre de l’artère comporte le risque de majorer ou d’étendre les lésions, de provoquer une rupture artérielle et d’induire, en étirant 16 les fibres musculoélastiques de la média, une hyperplasie myointimale. La mise en place d’une prothèse endoluminale (stent) permet de maintenir, après angioplastie, le calibre artériel à une valeur prédéterminée, d’impacter les fragments de paroi en laissant une lumière circulante cylindrique sans turbulences [5] . Les endoprothèses couramment utilisées sont des treillis métalliques, suffisamment radio-opaques pour permettre leur pose sous contrôle scopique, qui exercent sur la paroi un certain degré de force radiaire pour maintenir la lumière vasculaire ouverte. Leur expansion peut être assurée par l’intermédiaire d’un ballon, ou en leur laissant reprendre leur diamètre nominal en les larguant à l’aide d’un cathéter dans lequel elles sont repliées : on parle dans ce dernier cas d’endoprothèses autoexpansibles. Il existe actuellement plus de 40 sociétés commercialisant des endoprothèses, et il nous a paru important de synthétiser les principes de choix d’une bonne endoprothèse, plutôt que de dresser un inventaire exhaustif (et éphémère) des produits disponibles sur le marché. Les tableaux II et III résument les caractéristiques des endoprothèses les plus couramment employées. Architecture des endoprothèses Il existe plusieurs familles d’endoprothèses (fig 14) : tubulaires, filamentaires, autoexpansives. De ces trois grandes familles est née une sous-famille : les endoprothèses multicellulaires ou tubuloflexibles. Techniques endovasculaires appliquées aux artères des membres inférieurs Techniques chirurgicales 43-012 Tableau II. – Caractéristiques des endoprothèses expandues sur ballon. Stent Société Matériaux Radio-opacité Force radiaire Flexibilité Particularité Taille desilet Herculinkt Guidant 316 L Bonne Bonne Moyenne Ballon monorail guide 0,014 in 6 et 7 F Megalinkt Guidant 316 L Bonne Bonne Moyenne Ballon coaxial guide 0,018 in 6 et 7 F Bridge Stentt Medtronic AVE 316 L Bonne Bonne Moyenne Ballon coaxial guide 0,035 in 7F Corinthient Cordis 316 LVM Bonne Bonne Moyenne Ballon coaxial 0,035 in 6 et 7 F M3t Cordis 316 L Bonne Bonne Moyenne Ballon monorail guide 0,014 in 6 et 7 F Helistentt Hexacath 316 L Bonne Bonne Moyenne Ballon coaxial guide 0,035 in 6 et 7 F Wave Maxt Jostent 316 L Bonne Bonne Moyenne Ballon coaxial guide 0,035 in 6 et 7 F Pericot Braun 316 L Bonne Bonne Moyenne Ballon coaxial guide 0,035 in 6 et 7 F Intervascular 316 L Bonne Bonne Moyenne Ballon coaxial guide 0,035 in 6 et 7 F Tableau III. – Caractéristiques des endoprothèses autoexpansives. Stent Société Matériaux Radio-opacité Force radiaire Flexibilité Particularité Taille desilet Easy Wallstent Boston Scientific Platinium/Cobalt Bonne Moyenne Bonne Cathéter coaxial guide 0,035 in 6 et 7 F Easy Wallstent RP Boston Scientific Platinium/Cobalt Bonne Moyenne Bonne Cathéter coaxial guide 0,035 in 6F Dynalink Guidant Nitinol Bonne Moyenne Bonne Cathéter coaxial guide 0,035 in 7F Symphony Boston Scientific Nitinol Bonne Moyenne Bonne Cathéter coaxial guide 0,035 in 7F Smart Cordis Nitinol Bonne Moyenne Bonne Cathéter coaxial guide 0,035 in 7F Memotherm Bard Nitinol Bonne Moyenne Bonne Catheter coaxial guide 0,035 in 7F Sinus Stent Optimed Nitinol Bonne Moyenne Bonne Catheter coaxial guide 0,035 in 7F Expander Bolton Medical Nitinol Bonne Moyenne Bonne Cathéter coaxial guide 0,035 in 7F Self X Jostent Nitinol Bonne Moyenne Bonne Cathéter coaxial guide 0,035 in 7F In Stent Vasculoil Nitinol Bonne Moyenne Bonne Cathéter coaxial guide 0,035 in 7F Z Stent Cook Nitinol Bonne Moyenne Bonne Cathéter coaxial guide 0,035 in 7F Différentes dans leur conception et leur fabrication, elles répondent à plusieurs types d’artères ou lésions. Leur développement a été initié dans les coronaires, et nous avons maintenant à notre disposition leurs applications périphériques. une grande flexibilité mais retire une grande partie de leur force radiaire. Les indications des endoprothèses filamentaires sont des zones très angulées, des zones de bifurcation. Mais elles sont moins efficaces dans les lésions calcifiées. ENDOPROTHÈSES TUBULAIRES Ce sont des stents créés à partir d’un tube en acier 316 L découpé au laser, ou à partir de plaques d’acier 316 L également découpées au laser, puis soudées entre elles pour former un tube. La particularité de ces endoprothèses est leur grande force radiaire. Mais en contrepartie, leur flexibilité est limitée. Leurs indications sont les plaques calcifiées, ou des segments d’artère droits sans angulation ni courbure. ENDOPROTHÈSES FILAMENTAIRES Leur conception est totalement différente : elles sont créées à partir d’un fil en acier 316 L ou en tantale. Elles sont conformées en « vague » et enfin enroulées sur elles-mêmes, ce qui leur procure ENDOPROTHÈSES AUTOEXPANSIVES Elles sont créées à partir d’un acier à mémoire de forme, comme le nitinol ou le cobalt/platinium. Il s’agit d’un treillis de fils tressés entre eux qui est ensuite compacté dans une gaine, ou d’un tube de nitinol prédécoupé et conditionné à froid dans une gaine. Lors du largage, ces endoprothèses se déploient à leur diamètre préétabli. De conception très flexible, elles sont utilisées dans plusieurs indications, angulation très prononcée d’artères, rupture d’artères, image de caillots résiduels accrochés à la paroi. Leurs points faibles sont un ratio métal/artère très important, un taux de resténose plus élevé, la réticence à les appliquer à des lésions touchant les bifurcations, un système de mise en place moins pratique que les 17 Techniques endovasculaires appliquées aux artères des membres inférieurs 43-012 Techniques chirurgicales * A * B 14 Différents types d’endoprothèses. A. Endoprothèses sur ballon. B. Endoprothèse autoexpansive : largage par retrait de la gaine, en faisant point fixe sur le poussoir. endoprothèses expandues par ballonnet et par conséquent un positionnement plus difficile, en partie lié à leur degré de raccourcissement plus important. – Cobalt/platinium. La plupart des endoprothèses ne sont pas ferromagnétiques afin ne pas contre-indiquer un éventuel examen d’imagerie par résonance magnétique (IRM). L’IRM n’est d’ailleurs pas un bon examen pour contrôler les stents [41]. ENDOPROTHÈSES MULTICELLULAIRES OU TUBULOFLEXIBLES Ratio métal/artère (surface de couverture) Il est variable en fonction des types d’endoprothèses (9 à 35 %). Un trop faible ratio diminue la force radiale du stent, à l’inverse, un trop fort ratio métal/artère augmente les risques de resténose ou d’occlusion thrombotique. De conception initiale tubulaire, ces endoprothèses sont appelées multicellulaires en raison de leurs cellules reliées entre elles par des ponts métalliques qui leur confèrent une flexibilité plus importante. C’est la nouvelle génération des stents tubulaires. Selon les caractéristiques du métal, ils peuvent être largués sur ballon ou autoexpansibles. Propriétés des endoprothèses CRITÈRES DE CHOIX Un certain nombre de facteurs ont été pris en compte [16, développement des endoprothèses. 17] lors du Structure métallique – La plupart des stents sont fabriqués en acier 316 L : c’est un alliage bien connu dans le milieu des endoprothèses, puisqu’il représente plus de 90 % du choix des matériaux utilisés dans ce secteur. Il est ensuite découpé au laser puis sa surface est polie. Sa découpe est faite selon un dessin travaillé sur informatique. – Elgiloy. – Nitinol. Cet alliage de nickel et de titanium est utilisé pour ses propriétés d’élasticité et de mémoire de forme. Cette dernière propriété permet au stent de retrouver son calibre nominal à température normale [49]. 18 Radio-opacité La radio-opacité d’une endoprothèse est importante pour son positionnement précis au niveau de la zone à stenter. Les stents en acier 316 L ont une bonne radio-opacité lorsqu’ils sont sertis sur le ballon (maille fermée) mais permettent néanmoins, une fois déployés, une bonne visualisation de l’artère, car leur radio-opacité est alors devenue plus faible. Force radiaire Nous avons vu qu’elle dépend de l’architecture et du ratio métal/artère. Les études réalisées ont démontré que les stents devaient résister à une pression de 0,6 à 0,7 bars. Raccourcissement Le raccourcissement est le résultat mécanique de l’expansion d’un tube métallique ou d’une endoprothèse autoexpansible. Ce raccourcissement est beaucoup plus limité dans les autres endoprothèses, en particulier multicellulaires. Flexibilité Elle était l’apanage des endoprothèses autoexpansibles, au détriment de leur force radiaire, mais la position des segments de ponts sur les différentes sinusoïdes des stents multicellulaires leur donne Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs également une flexibilité, et permet ainsi d’accéder aux vaisseaux tortueux, et d’éviter de modifier la géométrie de l’artère après l’implantation du stent. Profil Le sertissage manuel sur ballon, outre le risque de migration de l’endoprothèse (qui est surtout important quand on utilise un ballonnet qui n’a pas encore été déployé), rend aléatoire le profil du couple stent-ballon, même entre des mains expertes. Le très bas profil du stent obtenu lorsqu’il est serti en machine sur le ballon (présertissage) permet de franchir des lésions très serrées sans friction sur les éventuelles plaques d’athéromes. Expansion L’expansion du stent d’une façon uniforme est très importante. Le but est que celui-ci s’applique à la même pression sur la toute la surface du ballon. La pression d’ouverture des endoprothèses est souvent de l’ordre de 4 atmosphères, le diamètre nominal est atteint à 6 atmosphères, mais l’on conseille l’implantation des stents à des pressions de 8 à 10 atmosphères. Il ne faut pas se fier à l’aspect du ballon, rempli de sérum mélangé à du produit de contraste, ou à l’angiographie de contrôle (encore moins aux gradients de pression), pour juger du caractère complet de l’expansion de l’endoprothèse. Les contrôles en angioscopie et en échographie endovasculaire montrent souvent des irrégularités de calibre de l’endoprothèse, soit au niveau d’une plaque un peu plus épaisse ou plus dure à impacter, soit aux extrémités de l’endoprothèse : il ne faut pas hésiter à réaliser une angioplastie complémentaire (même en cas de prothèse autoexpansible) pour obtenir un calibre homogène sur toute la longueur de l’endoprothèse. Les irrégularités de calibre sont d’ailleurs souvent visibles sur les clichés sans préparation, à condition de grossir l’image et de rendre l’endoprothèse la plus opaque possible en faisant varier la pénétration des rayons. Rigidité Les partisans des stents les plus rigides arguent du fait que moins un vaisseau est rendu compliant, moins importante sera l’hyperplasie intimale. En outre, une endoprothèse rigide maintient avec plus de force le calibre que l’on veut imposer à l’artère. Cependant, la rigidité d’une endoprothèse gêne sa pose au niveau des vaisseaux sinueux : les endoprothèses rigides sont en règle plus courtes que les endoprothèses flexibles, ce qui oblige dans les lésions longues à mettre en place plusieurs endoprothèses courtes, plutôt qu’une seule endoprothèse de longueur suffisante. Quelle que soit l’endoprothèse, la flexibilité est insuffisante pour supporter les mouvements de flexion, ce qui contre-indique la mise en place d’une endoprothèse au niveau d’une articulation, en particulier en regard de l’interligne du genou. Recoïl (retour élastique) Le retour élastique est la conséquence logique de la résistance de la plaque d’athérome à l’endoprothèse. Cette résistance entraîne la diminution de diamètre du stent après la déflation du ballon. Ce phénomène est très important, car le facteur prédictif majeur de resténose est lié au diamètre final après angioplastie. Les données techniques fournies par les industriels font état d’un recoïl de 0 à 7 %. INCONVÉNIENTS DES ENDOPROTHÈSES Thrombogénicité Bien qu’une endothélialisation se produise à travers les mailles du stent qui sont recouvertes en quelques semaines, la thrombose précoce était une complication non négligeable de cette technique. Sa fréquence est limitée par l’emploi d’un métal peu thrombogène, par une architecture laissant aussi peu de métal que possible en contact avec le sang circulant, et par un traitement anticoagulant 43-012 dont les modalités (antiagrégants, héparine ou antivitamine K) et la durée restent débattues [10] , mais dont la standardisation en pathologie coronaire [29] a permis la large diffusion de la technique : elle repose sur un traitement antiagrégant plaquettaire associant l’aspirine et une thiénopyridine (ticlopidine ou clopidogrel), encadrant la procédure, et prolongé pendant au moins plusieurs semaines. La quasi-totalité de ces endoprothèses sont électropolies à la phase terminale de leur fabrication pour diminuer le risque d’agrégation plaquettaire sur leur surface. Le coating des endoprothèses par des antithrombotiques comme l’héparine [61] est actuellement à l’étude. Resténose Outre la récidive de l’athérome in situ, qui est possible avec toute technique endoluminale, un mécanisme d’hyperplasie intimale est possible, la paroi réagissant aux forces radiaires exercées contre elle lors de l’angioplastie, mais également par l’endoprothèse qui reste en place. Cette réaction pariétale entraîne une resténose d’autant plus significative que l’endoprothèse a été placée dans un vaisseau de petit calibre. Un certain nombre de resténoses aux extrémités de l’endoprothèse ont été notées, dans les semaines ou les mois qui suivaient la mise en place : bien que l’on puisse évoquer une hyperplasie myo-intimale favorisée par le changement de compliance de la paroi artérielle [31], il est probable qu’un certain nombre de ces sténoses sont dues à une couverture incomplète de la lésion à traiter : les dissections induites par l’angioplastie transluminale sont souvent plus longues que la lésion initiale, et l’angiographie est un moyen insuffisant d’appréciation, comme l’ont montré des corrélations avec l’angioscopie et, plus récemment, avec l’échographie endovasculaire. Lors du traitement de lésions ostiales, comme les sténoses de l’origine de l’iliaque primitive qui sont en règle liées à une plaque débutant sur le carrefour aortique, il faut laisser dépasser de quelques millimètres l’extrémité du stent en amont de la sténose, pour éviter la persistance d’une sténose résiduelle qui serait difficilement accessible à une angioplastie itérative. Le coating des endoprothèses par des agents susceptibles de prévenir la resténose [4] est actuellement à l’étude. Perméabilité des collatérales La faible proportion de paroi artérielle couverte est un gage théorique de maintien de la perméabilité des collatérales. Il faut néanmoins éviter de couvrir les bifurcations artérielles comme la bifurcation iliaque, en raison du risque de turbulences et de thrombose. Sepsis Il ne faut pas oublier que la mise en place d’endoprothèse est la seule technique endoluminale où on laisse un corps étranger à l’intérieur de l’artère. Même si les cas rapportés sont rares [34, 69], les précautions d’asepsie lors de l’implantation doivent être rigoureuses, et une antibioprophylaxie est recommandée [44]. Mise en place des endoprothèses MISE EN PLACE D’UNE ENDOPROTHÈSE SUR BALLON L’endoprothèse est montée repliée sur un ballon d’angioplastie. On doit choisir la taille du ballon correspondant au calibre que l’on veut donner à l’artère traitée, afin d’éviter toute sténose résiduelle. La taille du ballon doit donc correspondre au calibre souhaité en cas d’endoprothèse rigide, ou être surdimensionnée de 1 mm en cas d’endoprothèse plus flexible qui a tendance à se resserrer un peu après déflation du ballon. Même s’il existe une forte probabilité d’avoir recours à une endoprothèse dès le début de la procédure (par exemple recanalisation d’occlusion), il vaut mieux commencer par une angioplastie transluminale simple : la mise en place de l’endoprothèse sans angioplastie préalable nécessiterait de la part 19 43-012 Techniques endovasculaires appliquées aux artères des membres inférieurs du ballon une force suffisante pour à la fois dilater la lésion et assurer l’expansion de l’endoprothèse, ce qui est très aléatoire. De plus, le passage de l’endoprothèse à frottement dur contre la paroi artérielle exposerait à sa migration le long du ballon. Dans certains cas, en particulier les occlusions, mais aussi les sténoses très calcifiées, cette angioplastie première peut être réalisée à l’aide d’un ballonnet sous-dimensionné de 1 à 2 mm. Le largage d’une endoprothèse ressemble beaucoup à une angioplastie transluminale simple. Il suppose un certain nombre de précautions : – l’extrémité distale du cathéter d’angioplastie muni de l’endoprothèse est beaucoup moins flexible : lorsqu’on doit franchir des sinuosités artérielles, il est préférable de passer le cathéter sur un guide plus rigide (stiff) pour assurer une progression facile du cathéter jusqu’à la lésion. En cas de procédure par voie controlatérale (crossover), il peut même être prudent d’avoir recours à un introducteur long et courbe ; – la valve de l’introducteur risque de désolidariser l’endoprothèse du ballon lors de son passage : on protégeait les premières endoprothèses en interposant une gaine métallique, que l’on retirait une fois la valve franchie par l’endoprothèse. L’amélioration des matériaux et le sertissage préalable par les industriels, mais aussi l’amélioration des valves d’introducteurs, rendent ce problème beaucoup moins fréquent. Lorsqu’on doit franchir des artères sinueuses, ce qui est souvent le cas à l’étage iliaque, le cathéter risque de frotter contre la paroi, en provoquant une migration de l’endoprothèse par rapport au ballon ou en provoquant des embolies distales : il vaut mieux dans ce cas utiliser un introducteur long qui franchit la lésion à traiter, et qui protège l’endoprothèse lors de son positionnement au niveau de la lésion. L’introducteur est ensuite retiré en faisant point fixe sur le cathéter ; encore faut-il s’assurer avant inflation que le ballon sort de plusieurs centimètres de l’introducteur pour éviter le largage de l’extrémité proximale de l’endoprothèse dans l’introducteur ; – l’endoprothèse est assez radio-opaque pour que son positionnement en scopie soit aisé. Si on doit couvrir une lésion longue par plusieurs endoprothèses, il faut toujours commencer par couvrir la lésion la plus distale, pour éviter le passage répété du cathéter d’angioplastie qui risquerait de déloger l’endoprothèse ; – le largage de l’endoprothèse doit se faire par une inflation progressive à faible pression, pour éviter une rupture du ballon : le plus souvent 6 bars pour les endoprothèses de moins de 8 mm, moins pour les endoprothèses de calibre supérieur. En cas de rupture du ballon alors que l’endoprothèse est incomplètement déployée, on peut essayer de sauver la situation en gonflant à forte pression le ballon pour obtenir la meilleure expansion possible, puis en dégonflant le ballon le mieux possible. On retire prudemment le ballon en laissant le guide en place sous contrôle scopique : si l’endoprothèse, radio-opaque, a tendance à migrer lors du retrait du cathéter, on peut tenter une nouvelle inflation, mais il faut surtout dégonfler patiemment le ballon, et essayer de le « décrocher » de Techniques chirurgicales l’endoprothèse par de petits mouvements de va et vient ou de torsion. Une fois le cathéter retiré, il faut repasser un cathéter neuf à travers l’endoprothèse pour obtenir son expansion complète, en raison du risque de migration ultérieure ; – une fois l’endoprothèse déployée, on réalise un contrôle angiographique guide en place et un contrôle sans injection pour dépister des irrégularités de calibre. MISE EN PLACE D’UNE ENDOPROTHÈSE AUTOEXPANSIBLE On avance le cathéter jusqu’à la lésion sur un guide préalablement mis en place. Le cathéter est en règle muni d’anneaux radioopaques, qui indiquent l’endroit où l’extrémité proximale de l’endoprothèse sera positionnée après largage complet, et souvent l’endroit où l’extrémité distale de l’endoprothèse sera positionnée, ce qui est important du fait du raccourcissement lors de l’expansion. La surveillance de ces repères en cours de largage est fondamentale car, une fois l’expansion de l’endoprothèse débutée, on peut la retirer, mais on ne peut pas l’avancer vers le versant distal de la lésion, puisqu’elle est déjà en partie appliquée à la paroi. Les systèmes de largage se sont considérablement simplifiés depuis les premiers Wallstent, et le largage s’apparente le plus souvent à la technique de pose des filtres caves, l’essentiel étant d’assurer le point fixe de l’endoprothèse lors du retrait de sa gaine de protection. La surveillance du largage en scopie, en utilisant au besoin une magnification pour des endoprothèses peu radio-opaques, est fondamentale. Lorsqu’on a vérifié en scopie l’expansion complète de l’endoprothèse, on retire le cathéter en laissant le guide en place pour vérifier l’absence de sténose résiduelle en angiographie. Très souvent, une expansion complémentaire par un cathéter à ballonnet est indiquée, pour assurer une impaction complète de l’endoprothèse dans la paroi artérielle. Quand plusieurs endoprothèses sont nécessaires pour couvrir la totalité d’une lésion, on peut les faire se chevaucher de plusieurs millimètres sans qu’il y ait de ressaut. Endoprothèses couvertes L’association d’endoprothèses classiques et de matériau prothétique utilisé pour les pontages (polytétrafluoroéthylène [PTFE] ou polyester) a permis de réaliser des endoprothèses couvertes : Passagert à partir du stent de Cragg [46], Jo-stent JPSGt [18], Wallgraftt à partir du wallstent [32]. Leur bénéfice n’a pas été démontré de façon formelle en iliaque, et ils présentent un taux de thrombose non négligeable en sous-inguinal, qui pourrait être amélioré par un traitement antithrombotique adapté. Des endoprothèses couvertes de conception originale comme l’Hémobahnt ont donné des résultats cliniques prometteurs [50], à condition d’un résultat suffisant de la recanalisation première et de l’angioplastie de la lésion occlusive à traiter. Traitement des thromboses artérielles Thrombolyse médicamenteuse Depuis le premier cas de thrombolyse locorégionale rapporté en 1971 [12], la streptokinase (SK), l’urokinase (UK) et de nouvelles molécules comme l’activateur tissulaire du plasminogène (tPA) ont été administrées par l’intermédiaire d’un cathéter positionné au voisinage de la lésion dans le traitement des occlusions thrombotiques et emboliques, primitives, et secondaires à un pontage ou à un traitement endoluminal. Notre propos n’est pas de 20 discuter les indications de la thrombolyse locorégionale, mais d’exposer les différents schémas thérapeutiques. Il est important de garder à l’esprit qu’aucune technique n’assure d’administration vraiment sélective du thrombolytique [37] : ni les complications hémorragiques générales, parfois mortelles, ni les complications locales (hématomes au point de ponction nécessitant parfois une hémostase chirurgicale) ne sont directement liées à la dose horaire, à la dose totale, ou aux paramètres biologiques de surveillance. Un strict respect des contre-indications des thrombolytiques est donc de mise [51]. Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs * A 43-012 * B * C 15 Thrombolyse locorégionale : modalités d’administration. A. Infusion en amont du thrombus par guide à âme amovible ou cathéter. B. Cathéter multifenêtré assurant la perfusion au sein du thrombus. C. Cathéter à double ballonnet de Tonnesen. AGENTS THROMBOLYTIQUES ¶ Streptokinase (SK) C’est une protéine d’origine bactérienne dont la demi-vie est de 30 minutes. Son administration suscite une réponse antigénique en 5 jours pour une durée de 4 à 6 mois. Les protocoles varient suivant les auteurs : certains débutent par un bolus, puis la dose horaire varie entre 2 000 et 30 000 U/h, la dose totale entre 25 000 et 1 700 000 U. La dose horaire la plus couramment utilisée est 5 000 U/h. ¶ Urokinase (UK) C’est une protéine extraite de l’urine humaine dont la demi-vie biologique est de 10 minutes, et qui ne suscite pas de réaction antigénique. Alors qu’elle est administrée à forte dose par voie systémique dans l’infarctus du myocarde (2 à 3 MU en 60 à 90 minutes), les doses d’administration par voie locorégionale sont en règle dix fois moindres. Il existe de nombreux protocoles, certains auteurs recommandant l’association avec le lysyl-plasminogène [63] : le protocole le plus souvent appliqué est celui de McNamara [40] qui injecte une dose de 4 000 U/min tant que l’occlusion artérielle est totale, puis 1 000 à 2 000 U/min dès la levée partielle de l’occlusion. ¶ Activateur tissulaire du plasminogène (tPA) C’est une protéine sérique normalement présente à faible concentration chez l’homme, qui est maintenant synthétisée par génie génétique. Sa demi-vie biologique est de 3 à 5 minutes. Alors qu’elle est administrée à forte dose par voie systémique dans l’infarctus du myocarde (1 mg/kg en 90 à 180 minutes), la dose horaire étudiée en thrombolyse artérielle [62] varie entre 3 et 10 mg/h, éventuellement précédée d’un bolus de 5 à 10 mg. Bien que ce thrombolytique soit censé être plus spécifique que SK et UK, des accidents hémorragiques ont été rapportés avec une fréquence sensiblement identique avec ces trois agents. La corrélation de ces accidents avec une baisse du taux de fibrinogène est beaucoup moins fréquente en cas d’utilisation du tPA. ¶ Surveillance biologique Il n’y a pas de corrélation formelle entre le risque hémorragique local ou à distance, et les paramètres biologiques. Le temps de procédure, l’utilisation d’héparine, et la taille des introducteurs utilisés ont également une influence. Le bilan d’hémostase initial doit comprendre un taux de prothrombine (TP), un temps de céphaline activé (TCA), un temps de thrombine (TT), un dosage de fibrinogène (Fg), une numération globulaire et plaquettaire, en évitant de faire un temps de saignement, en raison du risque important de reprise du saignement si le traitement thrombolytique est actif. La prudence est de répéter un dosage de fibrinogène et un temps de céphaline + activateur toutes les 4 heures pendant le traitement, puis 1 heure et 4 heures après la fin de celui-ci, pour évaluer l’efficacité et le risque hémorragique. Un taux de fibrinogène inférieur à 1g/L ou chutant de plus de 50 % de sa valeur initiale, un allongement du TCA supérieur à 2,5 fois le temps du témoin (interprétable si Fg > 1g/L) indiquent l’arrêt ou la modification de posologie du traitement. MODALITÉS D’ADMINISTRATION (fig 15) L’agent thrombolytique peut être administré en amont du thrombus ou au sein de celui-ci à l’aide d’un guide ou d’un cathéter fin. Nous avons vu que des guides 0,035 inches à âme amovible permettent l’infusion d’une solution thrombolytique par leur extrémité distale ou par des orifices latéraux après retrait de l’âme. Des cathéters fins d’angiographie, 4 ou 5 F, perforés sur une plus ou moins grande hauteur [24] avec une extrémité distale éventuellement borgne, permettent l’infusion de thrombolytique sur toute la hauteur de l’occlusion, ou en amont de celle-ci selon leur position. L’injection d’une certaine quantité de thrombolytiques en amont éviterait les thromboses sur cathéter, qui se voient surtout en cas de thrombolyse prolongée. Hess [23] a montré que si on suit en scopie la progression de la thrombolyse en avançant régulièrement le cathéter dans l’occlusion, on réduit le temps de procédure. Deux éventualités sont possibles : – si le guide ou le cathéter butent au niveau de l’occlusion, on peut choisir d’administrer le thrombolytique juste en amont de l’occlusion, pour éviter de s’engager dans un faux chenal. On avance le cathéter en fonction des progrès de la thrombolyse, jusqu’à passer l’occlusion. Une fois l’occlusion franchie, on peut, selon l’estimation que l’on fait de la quantité de thrombus résiduel : – poursuivre l’infusion de thrombolytique au niveau de la zone recanalisée, l’arrêt de la thrombolyse étant alors décidé en cas d’absence d’amélioration du calibre artériel ; – compléter la thrombolyse par une thrombectomie, une thrombolyse mécanique ou une angioplastie transluminale, qui impacte le thrombus résiduel en même temps que la lésion athéromateuse sous-jacente ; – si l’occlusion est franchie en totalité, on peut procéder de plusieurs façons : – infiltrer le thrombus sur toute sa hauteur par un bolus de thrombolytique avant de commencer l’infusion ; – positionner un cathéter fenêtré sur toute la hauteur du thrombus et procéder à une infusion continue ; – réaliser une thrombolyse « pulsée » pharmacomécanique [60] en répétant des micro-injections sous pression, faisant pénétrer le thrombolytique dans le thrombus, toutes les minutes ; – Tonnesen [28] a proposé un cathéter à deux ballonnets que l’on positionne de part et d’autre de la lésion pour limiter le plus possible la diffusion systémique de l’agent thrombolytique, qui est administré entre les deux ballons. Thrombectomie mécanique Des procédés d’extraction, d’aspiration, de fragmentation du thrombus ont été développés comme alternative ou comme 21 43-012 Techniques endovasculaires appliquées aux artères des membres inférieurs * A * B * C Techniques chirurgicales une résistance au retrait du cathéter. Cette inflation suffit en règle pour permettre une thrombectomie dans de bonnes conditions. Lorsqu’on perçoit une résistance plus importante au cours du retrait du cathéter, il convient de relâcher légèrement la pression de façon à éviter de créer une lésion pariétale, en particulier lors des thrombectomies sur artères athéromateuses. Sur les cathéters de petit calibre, certains recommandent le gonflage du ballonnet à l’air plutôt qu’au sérum physiologique, de façon à avoir une sensation plus fine du gonflage ; – il est souvent inutile de multiplier les passages pour que la thrombectomie soit complète. Si le cathéter ne ramène pas de thrombus ou si le reflux n’est pas satisfaisant, il est recommandé de réaliser une artériographie ou une angioscopie pour localiser un thrombus résiduel ou une lésion sous-jacente qui peut justifier un geste complémentaire, thrombectomie à l’aide d’un autre cathéter ou geste chirurgical associé. ¶ Autres cathéters de thrombectomie Cathéter double-lumière (thru-lumen) * D 16 Cathéters de thromboembolectomie de Fogarty. A. Cathéter à ballonnet. B. Cathéter à double lumière. C. Cathéter ACCt. D. Cathéter pour thrombectomie de pontage. complément de la thrombolyse médicamenteuse. À côté de l’angioplastie transluminale ou de certains athérotomes, différents procédés ont été développés, depuis la sonde à ballonnet de Fogarty, utilisée depuis 1963 [21], que l’on pourrait considérer comme le précurseur des techniques endoluminales, jusqu’à des procédés de fragmentation du thrombus encore en voie d’évaluation. Ces différentes techniques peuvent être utilisées à travers une artériotomie, mais également dans certains cas par voie percutanée, à condition que l’on soit sûr d’éviter toute embolie distale (en particulier lorsqu’on réalise la thrombectomie sans interrompre totalement le flux sanguin), et à condition de pouvoir retirer le matériel thrombotique à travers un cathéter ou un introducteur de taille suffisante. CATHÉTERS DE FOGARTY (fig 16) Lors des thrombectomies sur artères athéromateuses, il existe un risque de dissection lors de l’introduction du cathéter. L’extrémité du cathéter est courte et effilée, mais elle n’est pas toujours centrée par rapport à l’artère : on doit donc se méfier quand on rencontre une résistance, alors que la traversée d’un thrombus est souvent facile. Des cathéters coaxiaux d’embolectomie existent dans les mêmes tailles que les cathéters d’embolectomie simples, pourvus d’une lumière centrale autorisant le passage d’un guide de 0,013 à 0,035 inches. Devant une occlusion sur artère pathologique, il est plus prudent de passer d’abord un guide, puis le cathéter, et de vérifier, après retrait du guide, que l’on est bien dans la vraie lumière artérielle par une angiographie à travers le cathéter. Cathéter pour thrombus adhérent (Adherent Clot Cathetert) Sur ce cathéter, le ballon est remplacé par une double spirale métallique gainée de latex, dont on peut régler le calibre grâce à une manette à l’extrémité proximale du cathéter. La spirale se moule sur la paroi artérielle, et les forces de friction se répartissent sur toute la hauteur de la spirale. Ce cathéter existe en trois tailles (7 à 9 F) permettant des thrombectomies dans des artères de 6 à 10 mm. Cathéter pour thrombectomie de pontage Il est constitué comme le précédent d’une double spirale, qui peut être expandue à 14 ou à 16 mm. Il permet une thrombectomie de pontage à frottement dur, la spirale n’étant pas gainée de latex. ¶ Cathéter pour embolectomie artérielle Il s’agit d’un cathéter pourvu à son extrémité d’un ballon en latex, qui peut être gonflé par injection de sérum physiologique à son extrémité proximale. Il en existe plusieurs tailles, de 2 F à 7 F, chaque taille correspondant à un ballon de calibre allant de 4 mm à 14 mm, pour une contenance de 0,2 à 5 mL. Il est important de bien connaître la contenance de chaque ballon de façon à éviter tout surgonflage, qui entraînerait une hyperpression sur la paroi artérielle et risquerait de faire éclater le ballon. Après introduction du cathéter dans l’artère jusqu’en aval de l’occlusion, on gonfle le ballonnet et l’on retire le cathéter en maintenant le ballonnet gonflé. Afin d’éviter les complications pariétales liées au retrait du cathéter (fracture de plaque, voire rupture artérielle ; hyperplasie intimale secondaire), il convient de prendre plusieurs précautions : – dans le traitement d’occlusions longues, il est prudent de réaliser la thrombectomie en plusieurs fois, de façon à éviter des forces de friction trop importantes sur la paroi ; – il n’est pas toujours nécessaire de gonfler le ballon au maximum. On teste le ballon avant introduction du cathéter, pour se rendre compte de la quantité de liquide nécessaire à provoquer un début d’inflation du ballon. Une fois le cathéter en place, le ballon étant en aval de l’occlusion, on gonfle très progressivement, jusqu’à sentir 22 INSTRUMENTATION ENDOLUMINALE Le développement de l’angioscopie a permis d’améliorer certaines procédures de thrombectomie [71] , en évitant le recours à des angiographies répétées en cours de procédure. L’enthousiasme initial pouvait faire espérer l’avènement d’une instrumentation endoluminale spécifique qui aurait permis de développer de nouvelles techniques sous contrôle de la vue. Les résultats ont été décevants, même si certains instruments comme des pinces à préhension ou des sondes de Dormia peuvent être utilisés dans des cas particuliers. L’utilisation des anneaux de Vollmar sous contrôle angioscopique permet l’ablation des dépôts de fibrine et des thrombi adhérents, qui résistent souvent au passage de la sonde de Fogarty dans les thrombectomies de prothèse [33]. THROMBOLYSE MÉCANIQUE Un certain nombre de systèmes de fragmentation du caillot [43] par hydrodissection, rotation, vibration ou ultrasons ont été développés. S’ils ont prouvé une certaine efficacité dans les thromboses d’accès d’hémodialyse, leur efficacité et leur innocuité en raison du risque de traumatisme pariétal et d’embolies distales qu’ils comportent restent à démontrer au niveau des membres inférieurs. Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs 43-012 * A * B 17 Thromboaspiration. A. De gauche à droite : emboles récents multiples du trépied jambier ; résultat après thromboaspiration des différents emboles. B. Embolie poplitée sur artère athéromateuse : récupération d’un trépied jambier perméable après thromboaspiration sur guide hydrophile. THROMBOASPIRATION La thrombectomie par aspiration (fig 17) a été développée initialement pour compléter les thrombolyses incomplètes, ou pour traiter les complications emboliques des angioplasties transluminales [66]. Elle peut être employée comme alternative à la sonde de Fogarty ou à la thrombolyse dans les embolies d’origine cardiaque, voire dans les thromboses sur artères athéromateuses. Le thrombus peut être aspiré à l’intérieur du cathéter ou « ventousé » à l’extrémité distale de celui-ci, quand le thrombus est trop dur ou trop volumineux pour être remodelé par l’aspiration. C’est dans ce dernier cas que l’extraction du thrombus de l’artère peut être difficile. Deux solutions existent : – on peut réaliser un court abord chirurgical et réaliser la procédure par une artériotomie transversale que l’on referme à points séparés de Prolènet ; – l’utilisation d’introducteurs de 8 à 10 F à valve amovible permet de réaliser la thromboaspiration en percutané. Les cathéters utilisés doivent avoir un calibre suffisant pour assurer une aspiration efficace. On peut utiliser un cathéter droit ou un cathéter légèrement angulé. Certains cathéters, utilisés en coronarographie, ont une paroi très fine et sont munis d’une extrémité plus souple (soft tip), moins traumatisante lors de la progression dans l’artère : un exemple est le cathéter « Judkins droit », qui pour un calibre externe de 8 F (2,6 mm) a une lumière interne de 0,078 inches (2 mm) et permet la plupart des thrombectomies fémoropoplitées. Pour descendre dans les artères de jambe, des cathéters de 5 ou 6 F sont préférables. Il vaut mieux débuter la procédure sous scopie : après avoir repéré le niveau du thrombus par une injection de produit de contraste, on commence par passer un guide hydrophile en aval, et on descend le cathéter de thromboaspiration sur le guide, pour minimiser le risque de traumatisme pariétal. On retire alors le guide et on assure l’aspiration en connectant une seringue de 20 mL à l’embout Luer à l’extrémité proximale du cathéter. Un cathéter légèrement angulé est utile en cas d’artères sinueuses ou de thrombus marginé. La thromboaspiration n’est pas toujours aisée. En cas de thrombus ancien partiellement adhérent, on peut commencer par injecter quelques millilitres de sérum hépariné sous pression pour détacher le thrombus : le risque embolique est minime tant que le thrombus n’est pas fragmenté. Certains utilisent la thromboaspiration couplée à la thrombolyse. D’autres préconisent une angioplastie transluminale préalable pour fractionner ou ramollir le thrombus, ou une angioplastie complémentaire si persiste un thrombus marginé partiellement sténosant. 23 Techniques endovasculaires appliquées aux artères des membres inférieurs 43-012 Techniques chirurgicales Indication des différentes techniques Angioplastie transluminale L’angioplastie transluminale par ballonnet reste la technique endoluminale de référence pour le traitement des sténoses et occlusions athéromateuses dans les cas simples, où elle a fait preuve de son efficacité et de son innocuité. Ses résultats sont actuellement bien établis, et ont été étudiés dans le Transatlantic Intersociety Consensus (TASC) [59] entre les différentes sociétés de radiologie et de chirurgie vasculaire à l’échelon international. ÉTAGE ILIAQUE À l’étage iliaque, Johnston [26] avait depuis longtemps souligné l’influence du caractère (occlusion ou sténose), de la localisation (iliaque primitive ou externe), de la longueur de la lésion, du stade clinique et du lit d’aval sur les résultats à long terme. Le taux de complications est de 3 à 6 %, et le taux de succès technique est de 95 % à 83 % selon que l’on traite une sténose ou une occlusion [59]. Les taux de perméabilité [59] (échecs techniques inclus), sont le plus souvent basés sur la mesure des index de pression systolique au cours de l’évolution : 78 % et 68 % à 1 an, 66 % et 60 % à 3 ans, selon que l’on a traité une sténose ou une occlusion. Dans une méta-analyse récente, Bosch [8] a montré une réduction par les endoprothèses du risque relatif d’échec à long terme de 39 %. Le recours de principe aux endoprothèses ne semble pas justifié, mais on leur reconnaît les indications suivantes : – résultat hémodynamique insuffisant par resténose élastique immédiate évaluée par mesure du gradient de pression ; – dissection sténosante à l’artériographie de contrôle ; – traitement des occlusions chroniques ; – ulcérations artérielles symptomatiques (athéroembolisme) ; – resténoses après angioplastie ; – lésions complexes. Les indications lésionnelles à l’échelon aorto-iliaque ont été définies en quatre groupes par le consensus TASC [59] (tableau IV) (fig 18). Le groupe A correspond aux indications préférentielles de l’angioplastie transluminale, alors que le groupe D correspond aux indications de la chirurgie conventionnelle. Il n’y a pas de consensus concernant les lésions des groupes B et C, même si les sociétés de radiologie Tableau IV. – Classification lésionnelle à l’étage iliaque en quatre types, de moins en moins favorables au traitement endoluminal du type A au type D, d’après le Transatlantic Intersociety Consensus [59] (cf fig 18). • Type A • Type B • Type C • Type D 24 1. sténose unique < 3 cm de l’iliaque primitive (IP) ou de l’iliaque externe (IE) (unilatérale/bilatérale) 2. sténose unique de 3 à 10 cm ne s’étendant pas à la fémorale commune (FC) 3. deux sténoses < 5 cm de l’IP et/ou de l’IE ne s’étendant pas à la FC 4. occlusion IP unilatérale 5. sténoses bilatérales < 5 cm de l’IP et/ou de l’IE ne s’étendant pas à la FC 6. occlusion IE unilatérale ne s’étendant pas à la FC 7. sténose IE unilatérale s’étendant à la FC 8. occlusion IP bilatérale 9. sténoses diffuses multiples unilatérales étendues à l’IP, l’IE et la FC (habituellement > 10 cm) 10. occlusion unilatérale de l’IP et de l’IE 11. occlusions IE bilatérales 12. lésions diffuses de l’aorte et des deux artères iliaques 13. sténoses iliaques chez un patient ayant un anévrisme aortique, ou une autre indication à une chirurgie aorto-iliaque 18 Classification lésionnelle à l’étage iliaque en quatre types, de moins en moins favorables au traitement endoluminal du type A au type D, d’après le Transatlantic Intersociety Consensus [59]. Noter que toutes les lésions ne sont pas représentées. Type A : traitement électif endovasculaire ; type B : traitement endovasculaire le plus souvent employé, mais preuves insuffisantes pour une recommandation ; type C : traitement chirurgical le plus souvent employé, mais preuves insuffisantes pour une recommandation ; type D : traitement électif chirurgical. insistent sur le fait que le traitement endovasculaire est celui qui est le plus souvent réalisé. Il est probable que c’est dans ces lésions que le recours aux endoprothèses permet d’améliorer les résultats du traitement endovasculaire. ÉTAGE FÉMOROPOPLITÉ À l’étage fémoropoplité, les résultats du traitement des lésions étendues sont plus décevants [11, 27]. Les résultats sont moins bons en cas d’occlusion qu’en cas de sténose, mais cette différence a tendance à s’atténuer dans les séries récentes. C’est surtout l’état du lit d’aval qui conditionne la pérennité des résultats. Le problème essentiel reste de définir, sur l’artériographie préopératoire [48], l’étendue des lésions au-delà desquelles une recanalisation endoluminale est déraisonnable. Le consensus TASC [59] définit quatre groupes de A à D (tableau V) (fig 19), comme à l’étage iliaque, en indiquant que la chirurgie est le traitement de choix pour les occlusions de plus de 5 cm (groupe D). Dans la littérature, la longueur des occlusions est fixée à 5,8 cm voire 10 cm selon les auteurs, mais il est rare qu’ils Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs 43-012 Tableau V. – Classification lésionnelle à l’étage fémoropoplité en quatre types, de moins en moins favorables au traitement endoluminal du type Aau type D, d’après le Transatlantic Intersociety Consensus [59] (cf fig 19). • Type A • Type B • Type C • Type D 1. sténose fémoropoplitée unique < 3 cm (unilatérale/bilatérale) 2. sténose unique de 3 à 5 cm sauf sur la poplitée distale (les sociétés de radiologie, soulignant que les résultats notés dans la littérature ancienne sont plus liés à des échecs techniques qu’à des différences de perméabilité à long terme, proposent, en raison de l’amélioration des techniques de cathétérisme : sténose unique de 3 à 10 cm y compris la poplitée distale) 3. sténoses très calcifiées < 3 cm 4. lésions multiples, chacune de moins de 3 cm 5. lésions uniques ou multiples sans lit d’aval tibial, afin d’améliorer l’axe donneur d’un pontage distal éventuel 6. sténose ou occlusion unique > 5 cm (les sociétés de radiologie, soulignant que les résultats notés dans la littérature ancienne sont plus liés à des échecs techniques qu’à des différences de perméabilité à long terme, proposent, en raison de l’amélioration des techniques de cathétérisme : sténose ou occlusion unique < 10 cm) 7. sténoses ou occlusions multiples, chacune de 3 à 5 cm, avec ou sans calcifications sévères 8. occlusion complète de la fémorale commune, ou occlusions fémorales superficielles, ou occlusion complète de la poplitée et du trépied jambier 20 Angioplastie en « kissing balloon » de deux sténoses ostiales d’artères de jambe (cathéters Monoraily). l’échelon fémoropoplité, mais le consensus TASC [59] leur reconnaît un rôle limité dans le traitement des échecs ou complications de l’angioplastie. – Au stade de claudication : le principal argument pour traiter des lésions segmentaires est la possibilité de les voir se transformer en occlusion fémoropoplitée. Cette éventualité semble rare, mais peut justifier l’angioplastie de telles lésions chez les sujets jeunes, à condition d’obtenir de leur part une suppression des facteurs de risque. L’angioplastie est également défendable chez les patients chez qui la réentrée poplitée est médiocre, soit parce que la lésion touche la poplitée au voisinage de l’interligne articulaire, soit parce que la fémorale profonde est très pathologique. – Au stade d’ischémie critique, les patients présentent souvent des lésions à plusieurs étages : le traitement d’une atteinte fémoropoplitée peut permettre de passer un cap, seul ou associé à un geste de revascularisation chirurgicale ou endoluminale à l’étage aorto-iliaque. En fonction du profil lésionnel, il faut considérer le bénéfice respectif de chaque traitement : l’angioplastie d’une lésion segmentaire peut être préférable à un pontage long sur un lit d’aval aléatoire ; à l’inverse, un pontage présentant de bonnes chances de succès à moyen terme est préférable à l’angioplastie de lésions étendues. 19 Classification lésionnelle à l’étage fémoropoplité en quatre types, de moins en moins favorables au traitement endoluminal du type A au type D, d’après le Transatlantic Intersociety Consensus [59]. Noter que toutes les lésions ne sont pas représentées. Type A : traitement électif endovasculaire ; type B : traitement endovasculaire le plus souvent employé, mais preuves insuffisantes pour une recommandation ; type C : traitement chirurgical le plus souvent employé, mais preuves insuffisantes pour une recommandation ; type D : traitement électif chirurgical. distinguent les occlusions thrombotiques en amont d’une lésion segmentaire des occlusions athéromateuses étendues. Par ailleurs, le terme de lésions « diffuses » est rarement précisé : il est certain que l’évolutivité d’une fémorale superficielle de petit calibre, siège de sténoses étagées, à la limite de la significativité quand on les examine séparément, laisse peu d’espoir. Quant aux lésions segmentaires, on peut se poser la question du bien-fondé de leur traitement, car la plupart des patients présentant ce type de lésions sont ou deviendront rapidement asymptomatiques. Des critères de prédictibilité hémodynamiques (pressions distales, réentrée poplitée), anatomiques (état du lit d’aval, de la fémorale profonde), et le contexte clinique du patient, sont autant d’aides à la décision thérapeutique. Il n’existe aucun argument dans la littérature pour défendre le recours de première intention aux endoprothèses à ARTÈRES DE JAMBE (fig 20) Les risques à court terme et les résultats à moyen terme de l’angioplastie sur des artères de petit calibre ne justifient pas le traitement des lésions des artères de jambe chez des patients au stade de claudication [55], d’autant que ce sont rarement ces lésions qui sont responsables de claudication : soit il existe une lésion proximale qu’il convient de traiter, soit il existe une artériopathie plus distale avec des résistances périphériques élevées, que ne modifiera pas le traitement. En revanche, au stade d’ischémie critique [9], l’angioplastie peut être discutée comme alternative ou comme complément des revascularisations fémoropoplitées ou fémorojambières. Enfin, dans le suivi évolutif des pontages, l’angioplastie d’une sténose anastomotique ou d’une lésion segmentaire sous-jacente peut être mise en balance avec une « retouche » chirurgicale parfois aléatoire. Le consensus TASC [59] propose une stratification des lésions comme aux autres étages de A àD: – type A : sténose unique de moins de 1 cm ; – type B : sténoses focales multiples de moins de 1 cm ; une ou deux sténoses de moins de 1 cm du trépied jambier ; sténose courte associée à une angioplastie fémoropoplitée ; 25 43-012 Techniques endovasculaires appliquées aux artères des membres inférieurs Techniques chirurgicales * A 21 Traitement endoluminal des occlusions artérielles : bons résultats. A. Occlusion poplitée : recanalisation au guide hydrophile et angioplastie transluminale. B. cclusion iliaque primitive : résultat après angioplastie et mise en place d’une endoprothèse Wallstent. * B – type C : sténoses de 1 à 4 cm de longueur ; occlusions de 1 à 2 cm ; sténose étendue du trépied jambier ; – type D : occlusions de plus de 2 cm ; atteinte diffuse. Alternatives à l’angioplastie Certains profils lésionnels sont responsables d’échecs techniques initiaux de l’angioplastie ou de détérioration du résultat à court ou moyen terme. C’est dans ces indications que le recours à des techniques complémentaires doit être mis en balance avec l’indication d’une chirurgie vasculaire plus traditionnelle. Chacune des technologies nouvelles développées n’ayant trouvé d’indication que dans un profil lésionnel particulier, l’angiographie seule ne représente pas un facteur décisionnel suffisant. Le recours à des examens préopératoires, comme l’échographie couplée au doppler couleur (même si ses résultats dépendent de la qualité de l’opérateur), ou peropératoires, comme l’étude des gradients de pression ou l’échographie endovasculaire, semble licite dans bien des cas (même si ces examens entraînent un surcoût et un allongement du temps de procédure). 26 OCCLUSIONS Le traitement d’occlusions segmentaires peut être simple et obtenir un résultat durable (fig 21), mais on ne doit pas perdre de vue qu’il peut exposer à des complications et à des échecs (fig 22). La recanalisation d’une occlusion impose donc l’analyse rigoureuse de ses caractéristiques en fonction du contexte clinique (durée de la symptomatologie, état prothrombotique), de l’artériographie (lésions controlatérales symétriques à un stade plus précoce, aspect des artères à distance du site lésionnel plus que les caractères de la lésion elle-même) et des données de l’échographie doppler (qui permet une analyse plus fine de la structure pariétale, de la répartition des calcifications éventuelles, et de l’existence de matériel endoluminal). On peut ainsi distinguer plusieurs situations. Occlusions thrombotiques Le traitement du thrombus permet souvent de simplifier le profil lésionnel, la lésion causale étant bien souvent une lésion segmentaire. Une thrombolyse, médicamenteuse ou mécanique, ou une thromboaspiration, peuvent être complétées par une angioplastie transluminale simple, voire par la mise en place d’une endoprothèse pour limiter le risque embolique devant un thrombus marginé résiduel irrégulier. Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs 43-012 * B * A 22 Traitement endoluminal des occlusions artérielles : complications. A. Recanalisation d’occlusion iliaque primitive gauche : embolie iliaque externe droite (côté asymptomatique). B. Recanalisation dans un plan de dissection d’une occlusion iliaque : la mise en place d’endoprothèse aboutit au maintien à distance de la perméabilité du faux chenal, avec évolution sur un mode ectasique (dont témoigne l’éloignement entre « vraie » et « fausse » iliaques primitives droites). Occlusions calcifiées Le seul athérotome efficace sur les lésions calcifiées est le Rotablatort, qui peut permettre de se passer d’angioplastie sur les artères de petit calibre, mais son usage a été limité par son coût et par l’absence de résultats cliniques probants. On peut néanmoins tenter une angioplastie, en sachant que le risque de fracture de plaque oblige souvent à la mise en place d’une endoprothèse. C’est sur les artères calcifiées que le risque de rupture est le plus important : il justifie des précautions lors de l’inflation du ballonnet, certains auteurs prônant une prédilatation à l’aide d’un ballon de petit calibre, et le stenting de principe. Les résultats préliminaires des endoprothèses couvertes demandent toujours à être confirmés. l’inverse, une greffe veineuse occluse est peut-être traitée avec moins de dégâts pariétaux par thrombolyse que par thrombectomie mécanique ou chirurgicale, d’autant qu’une anomalie segmentaire responsable de l’occlusion, identifiée par l’artériographie de contrôle, peut être traitée dans le même temps par angioplastie. LÉSIONS DIFFUSES Quelle que soit la technique utilisée, les résultats sont décevants à court (risque de thrombose extensive) ou moyen terme (resténose). L’utilisation de stents longs ou étagés ne se justifie que dans un contexte de sauvetage de membre, dans les cas peu favorables à la chirurgie conventionnelle. Occlusions fibreuses-plaques complexes Le recours aux endoprothèses est licite en cas d’artères de gros calibre (aorte, iliaques). Leur résultat est plus décevant au niveau des artères fémorale et poplitée (en particulier au pli de flexion), et mal évalué au niveau des artères de jambe (un parallèle avec les coronaires serait tentant, en raison d’un calibre identique, mais les différences de structure pariétale, de régime hémodynamique, et surtout le caractère diffus des lésions incitent à la prudence). Occlusions longues Le recours aux endoprothèses multiples donne des résultats qui se détériorent rapidement, et pose des problèmes de coût par rapport à la chirurgie traditionnelle. Certains auteurs [7, 35] sont partisans de l’angioplastie sous-intimale, en particulier dans les situations d’ischémie critique : ce mode de recanalisation n’est pas couplé à la mise en place d’endoprothèses, mais le résultat hémodynamique, jugé sur la rapidité de progression du produit de contraste à l’artériographie de contrôle, doit être bon. Au moindre doute, une angioplastie itérative est indiquée. Occlusions de pontages Les bons résultats cliniques de la thrombolyse par rapport à la chirurgie, en cas d’occlusion vue tôt (moins de 14 jours) sont tempérés par la possibilité d’incidents hémorragiques, et surtout par des résultats sensiblement équivalents à moyen terme. Les deux options thérapeutiques ne dispensent pas du traitement de l’étiologie de l’occlusion. La thrombectomie mécanique d’un pontage dans le même temps qu’un prolongement de celui-ci ou que la correction d’une anomalie anastomotique est parfaitement licite. À ATHÉROEMBOLISME Des publications, généralement sans suivi clinique à long terme, ont fait état du traitement par athérectomie des artériopathies emboligènes [13]. Même si la mise en place d’une endoprothèse peut se compliquer d’embolies distales, ce traitement est à mettre en balance avec les solutions beaucoup plus « lourdes » de la chirurgie classique (endartériectomie ou pontage-exclusion). COMPLICATIONS DE L’ANGIOPLASTIE TRANSLUMINALE La survenue d’une complication limitée au cours d’une angioplastie doit faire mettre en balance le bénéfice éventuel, le coût et le risque propres à la procédure complémentaire qu’on envisage. Il est parfois plus sage de se contenter d’un échec technique qui n’aggrave pas le patient, ou de se tourner vers une intervention chirurgicale de réalisation simple, que de se laisser guider par un « vertige technique » qui peut conduire à une situation irréparable. Complications thromboemboliques Selon la localisation et l’étendue des lésions, on discute une thrombectomie, une thromboaspiration ou une thrombolyse, en gardant présent à l’esprit le risque hémorragique de celle-ci. Complications pariétales Certaines fractures de plaque sont accessibles à une endoprothèse, dont la mise en place doit être discutée également si des lésions 27 43-012 Techniques endovasculaires appliquées aux artères des membres inférieurs plus diffuses résistent à une angioplastie itérative. En cas de rupture artérielle évoquée devant une douleur à l’inflation, une chute de tension, et visualisée par une fuite de produit de contraste, le premier geste est d’assurer l’hémostase en regonflant le ballon d’angioplastie. On a alors le choix entre une chirurgie d’hémostase, ou la mise en place d’une endoprothèse, couverte ou non [30]. Resténoses Elles peuvent être accessibles à une angioplastie itérative ou à une athérectomie [64], mais surtout à la mise en place d’une endoprothèse. Les traitements médicamenteux, surtout étudiés en coronaire, n’ont pas encore fait preuve d’une efficacité miraculeuse. La radiothérapie endocavitaire est en voie d’évaluation. La survenue d’une resténose Techniques chirurgicales sur une artère de petit calibre laisse néanmoins mal augurer du maintien de la perméabilité à long terme du site traité. Conclusion L’essor du traitement des anévrismes artériels par des endoprothèses couvertes, la discussion de nouvelles applications comme les troncs supra-aortiques, les progrès réalisés en pathologie coronaire, ont bénéficié aux techniques endoluminales appliquées aux membres inférieurs. Dans l’arsenal thérapeutique du chirurgien vasculaire, l’angioplastie transluminale a maintenant une place bien établie : ses indications cliniques et lésionnelles sont maintenant bien codifiées, bien distinctes du mauvais réflexe « oculosténotique ». L’essor de la chirurgie endoluminale continuera probablement à susciter recherches et polémiques dans les années à venir. Références [1] Abele JE. Basic technology of balloon catheters. In : Dotter CT, Schoop W, Zeitler E eds. Percutaneous transluminal angioplasty. Berlin : Springer-Verlag, 1983 : 31-36 [2] Ahn SS, Concepcion B. Current status of atherectomy for peripheral arterial occlusive disease. World J Surg 1996 ; 20 : 635-643 [3] Arko F, McCollough R, Manning L, Buckley C. Use of intravascular ultrasound in the endovascular management of atherosclerotic aortoiliac occlusive disease. Am J Surg 1996 ; 172 : 546-549 [4] Atalar E, Haznedaroglu I, Aytemir K, Aksoyek S, Ovunc K, Oto A et al. Effects of stent coating on platelets and endothelial cells after intracoronary stent implantation. Clin Cardiol 2001 ; 24 : 159-164 [5] Becker GJ. Intravascular stents: general principles and status of lower-extremity arterial applications. Circulation 1991 ; 83 (suppl I) : I122-I136 [6] Bolia A, Miles KA, Brennan J, Bell PR. Percutaneous transluminal angioplasty of occlusions of the femoral and popliteal arteries by subintimal dissection. Cardiovasc Intervent Radiol 1990 ; 13 : 357-363 [7] Bolia A, Sayers RD, Thompson MM, Bell PR. Subintimal and intraluminal recanalisation of occluded crural arteries by percutaneous balloon angioplasty. Eur J Vasc Surg 1994 ; 8 : 214-219 [8] Bosch JL, Huninck MG. Meta-analysis of the results of percutaneous transluminal angioplasty and stent placement for aortoiliac occlusive disease. Radiology 1997 ; 204 : 87-96 [9] Buckenham TM, Loh A, Dormandy JA, Taylor RS. Infrapopliteal angioplasty for limb salvage. Eur J Vasc Surg 1993 ; 7 : 21-25 [10] Bucx JJ, De Scheerder I, Beatt K, Vanden Brand M, Suryapranata H, De, Feyter PJ et al. The importance of adequate anticoagulation to prevent early rethrombosis after stenting of stenosed venous bypass grafts. Am Heart J 1991 ; 121 : 1389-1396 [11] Capek P, McLean GK, Berkowitz HD. Femoropopliteal angioplasty: factors influencing long-term success. Circulation 1991 ; 83 (suppl I) : I70-I80 [12] Chesterman CN, Nash T, Biggs JC. Small-vessel thrombosis following vascular injury: successful treatment with a lowdose intra-arterial infusion of streptokinase. BrJ Surg 1971 ; 58 : 582-585 [13] Dolmatch BL, Rholl KS, Moskowitz LB, Dake MD, Van Breda A, Kaplan JO et al. Blue toe syndrome: treatment with percutaneous atherectomy. Radiology 1989 ; 172 : 799-804 [14] Dotter CT. Transluminally-placed coilspring endarterial tube grafts: long-term patency in a canine popliteal artery. Invest Radiol 1969 ; 4 : 329-332 [15] Dotter CT, Judkins MP. Transluminal treatment of atherosclerotic obstruction: description of a new technique and a preliminary report of its application. Circulation 1964 ; 30 : 654-670 [16] Duda SH, Wiskirchen J, Tepe G, Bitzer M, Kaulich TW, Stoeckel D et al. Physical properties of endovascular stents: an experimental comparison. J Vasc Interv Radiol 2000 ; 11 : 645-654 [17] Dyet JF, Watts WG, Ettles DF, Nicholson AA. Mechanical properties of metallic stents: how do these properties influence the choice of stent for specific lesions. Cardiovasc Intervent Radiol 2000 ; 23 : 47-54 [18] Eggebrecht H, Bruch C, Haude M, Oldenburg O, Herrmann J, VonBirgelen C et al. Transluminal exclusion of a subclavian artery aneurysm with stent-graft implantation. Z Kardiol 2000 ; 89 : 761-765 [19] Ergene O, Seyithanoglu BY, Tastan A, Ergene U, Kozan O, Belgi A et al. Comparison of angiographic and clinical outcome after cutting balloon and conventional balloon angioplasty in vessels smaller than 3 mm in diameter: a randomized trial. J Invasive Cardiol 1998 ; 10 : 70-75 28 [20] Fischell TA, Stadius ML. New technologies for the treatment of obstructive arterial disease. Cathet Cardiovasc Diagn 1991 ; 22 : 205-233 [21] Fogarty TJ, Cranley JJ, Krause RJ, Strasser ES, Hafner CD. A method for extraction of emboli and thrombi. Surg Gynecol Obst 1963 ; 116 : 241 [22] Grüntzig A, Hopff H. Perkutane Rekanalisation chronischer arterieller Verschlüsse mit einem neuen Dilatationskatheter: modifikation der Dotter-Technik. Dtsch Med Wochenschr 1974 ; 99 : 2502-2505 [23] Hess H, Mietaschk A, Brückl R. Peripheral arterial occlusions: a 6-year experience with local low-dose thrombolytic therapy. Radiology 1987 ; 163 : 753-758 [24] Hicks ME, Picus D, Darcy MD, Kleinhoffer MA. Multilevel infusion catheter for use with thrombolytic agents. J Vasc Interv Radiol 1991 ; 2 : 73-75 [25] Jain SP, Roubin GS, Iyer SS, Saddekni S, Yadav JS. Closure of an iatrogenic femoral artery pseudoaneurysm by transcutaneous coil embolization. Cathet Cardiovasc Diagn 1996 ; 39 : 317-319 [26] Johnston KW. Aortoiliac disease treatment: a surgical comment. Circulation 1991 ; 83 (suppl I) : I61-I62 [27] Johnston KW. Femoral and popliteal arteries: reanalysis of results of balloon angioplasty. Radiology 1992 ; 183 : 767-771 [28] Jorgensen B, Tonnesen KH, Bülow J, Nielsen JD, Jorgensen M, Holstein P et al. Femoral artery recanalisation with percutaneous angioplasty and segmentally enclosed plasminogen activator. Lancet 1989 ; 1 : 1106-1108 [29] Karrillon GJ, Morice MC, Benveniste E, Bunouf P, Aubry P, Cattan S et al. Intracoronary stent implantation without ultrasound guidance and with replacement of conventional anticoagulation by antiplatelet therapy. 30-day clinical outcome of the french multicenter registry. Circulation 1996 ; 94 : 1519-1527 [30] Kelly AJ. Case report: iliac artery rupture--percutaneous treatment by stent insertion. Clin Radiol 1995 ; 50 : 876-877 [31] King SB. Vascular stents and atherosclerosis. Circulation 1989 ; 79 : 460-462 [32] Krajcer Z, Sioco G, Reynolds T. Comparison of wallgraft and wallstent for treatment of complex iliac artery stenosis and occlusion. Preliminary results of a prospective randomized study. Texas Heart Inst J 1997 ; 24 : 193-199 [33] Lamuraglia GM, Brewster DC, Moncure AC, Cambria RP, Gertler JP, Abbott WM. Angioscopic evaluation of unilateral aortic graft limb thrombectomy: is it helpful? J Vasc Surg 1993 ; 17 : 1069-1076 [34] Liu P, Dravid V, Freiman D, Zegel H, Weinberg D. Persistent iliac endarteritis with pseudoaneurysm formation following balloon-expandable stent placement. Cardiovasc Intervent Radiol 1995 ; 18 : 39-42 [35] London NJ, Srinivasan R, Naylor AR, Hartshorne T, Ratliff DA, Bell PR et al. Subintimal angioplasty of femoropopliteal artery occlusions: the long-term results. Eur J Vasc Surg 1994 ; 8 : 148-155 [36] Loose HW, Haslam PJ. The management of peripheral arterial aneurysms using percutaneous injection of fibrin adhesive. Br J Radiol 1998 ; 71 : 1255-1259 [37] Marzelle J, Combe S, Gigou F, Samama M. Thrombolyse artérielle : bilan et perspectives d’avenir. J Mal Vasc 1988 ; 13 : 307-316 [38] Marzelle J, Gloviczki P, Franco G, Luizy F, Cormier F, Fichelle JM et al. Explorations peropératoires en chirurgie vasculaire. Encycl Méd Chir (Éditions Scientifiques et Médicales Elsevier SAS, Paris), Techniques chirurgicales- Chirurgie vasculaire 1993 : 43-020, 1-30 [39] Matsumoto AH, Barth KH. Peripheral angioplasty balloon technology. In : Maynar-Moliner M, Castaneda-Zuniga WR, Joffre F, Zollikofer CL eds. Percutaneous revascularisation techniques. New York : Thieme Medical Publishers, 1993 : 36-40 [40] McNamara TO. Technique and results of ″higher-dose″ infusion. Cardiovasc Intervent Radiol 1988 ; 11 (suppl) : S48-S57 [41] Meyer JM, Buecker A, Schuermann K, Ruebben A, Guenther RW. MR evaluation of stent patency: in vitro test of 22 metallic stents and the possibility of determining their patency by MR angiography. Invest Radiol 2000 ; 35 : 739-746 [42] Minar E, Pokrajac B, Maca T, Ahmadi R, Fellner C, Mittlbock M et al. Endovascular brachytherapy for prophylaxis of restenosis after femoropopliteal angioplasty: results of a prospective randomized study. Circulation 2000 ; 102 : 2694-2699 [43] Moses JW. Mechanical thrombectomy in acute ischemic syndromes: cutters, suckers and busters. J Invasive Cardiol 1998 ; 10 (suppl A) : 36A-40A [44] Paget DS, Bukhari RH, Zayyat EJ, Lohr JM, Roberts WH, Welling RE. Infectibility of endovascular stents following antibiotic prophylaxis or after arterial wall incorporation. Am J Surg 1999 ; 178 : 219-224 [45] Perler BA, Osterman FA, White RI, Williams GM. Percutaneous laser probe femoropopliteal angioplasty: a preliminary experience. J Vasc Surg 1989 ; 10 : 351-357 [46] Pernes JM, Auguste MC, Hovasse D, Gignier P, Lasry B, Lasry JL. Long iliac stenosis: initial clinical experience with the Cragg endoluminal graft. Radiology 1995 ; 196 : 67-71 [47] Pinto F, Lencioni R, Stringari R, Armillotta N, Sbrana R, Russo R et al. [Doppler color US in the diagnosis and treatment of iatrogenic pseudoaneurysms]. Radiol Med 1997 ; 94 : 198-201 [48] Probst P, Cerny P, Owens A, Mahler F. Patency after femoral angioplasty: correlation of angiographic appearance with clinical findings. AJR Am J Roentgenol 1983 ; 140 : 1227-1232 [49] Rabkin DJ, Lang EV, Brophy DP. Nitinol properties affecting uses in interventional radiology. J Vasc Interv Radiol 2000 ; 11 : 343-350 [50] Rubin BG, Sicard GA. The Hemobahn endoprosthesis: a self-expanding polytetrafluoroethylene-covered endoprosthesis for the treatment of peripheral arterial occlusive disease after balloon angioplasty. J Vasc Surg 2001 ; 33 (suppl 2) : S124-S128 [51] Samama M, Michel PL, Horellou MH, Nataf J, Marzelle J, Vahanian A. Traitements thrombolytiques. Encycl Méd Chir (Éditions Scientifiques et Médicales Elsevier SAS, Paris), 1990 : Hématologie, 13-022-E-10, 1-20 [52] Sanborn TA. Recanalization of arterial occlusions: pathologic basis and contributing factors. J Am Coll Cardiol 1989 ; 13 : 1558-1560 [53] Sanborn TA, Cumberland DC, Greenfield AJ, Welsh CL, Guben JK. Percutaneous laser thermal angioplasty: initial results and 1-year follow-up in 129 femoropopliteal lesions. Radiology 1988 ; 168 : 121-125 [54] Sapirstein W, Zuckerman B, Dillard J. FDA approval of coronary-artery brachytherapy. N Engl J Med 2001 ; 344 : 297-299 [55] Schwarten DE. Clinical and anatomical considerations for nonoperative therapy in tibial disease and the results of angioplasty. Circulation 1991 ; 83 (suppl I) : I86-I90 [56] Sigwart U, Puel J, Mirkovitch V, Joffre F, Kappenberger L. Intravascular stents to prevent occlusion and restenosis after transluminal angioplasty. N Engl J Med 1987 ; 316 : 701-706 Techniques chirurgicales Techniques endovasculaires appliquées aux artères des membres inférieurs [57] Teitlebaum GP. Guide wire technology. In : MaynarMoliner M, Castaneda-Zuniga WR, Joffre F, Zollikofer CL eds. Percutaneous revascularisation techniques. New York : Thieme Medical Publishers, 1993 : 29-35 [58] Tetteroo E, Van Engelen AD, Spithoven JH, Tielbeek AV, Van der Graaf Y, Mali WP. Stent placement after iliac angioplasty: comparison of hemodynamic and angiographic criteria. Dutch Iliac stent Trial Study Group [see comments]. Radiology 1996 ; 201 : 155-159 [59] Transatlantic intersociety consensus. Management of peripheral arterial disease (PAD). J Vasc Surg 2000 ; 31 (1 part2) [60] Valji K, Bookstein JJ. Pulsed-spray pharmacomechanical thrombolysis. In : Maynar-Moliner M, Castaneda-Zuniga WR, Joffre F, Zollikofer CL eds. Percutaneous revascularisation techniques. New York : Thieme Medical Publishers, 1993 : 83-87 [61] Vander Giessen WJ, Van, Beusekom HM, Larsson R, Serruys P. Heparin-coated coronary stents. Curr Interv Cardiol Rep 1999 ; 1 : 234-240 [62] Verstraete M, Hess H, Mahler F, Mietaschk A, Roth FJ, Schneider E et al. Femoro-popliteal artery thrombolysis with intra-arterial infusion of recombinant tissue-plasminogen activator. Report of a pilot trial. Eur J Vasc Surg 1988 ; 2 : 155-159 [63] Vitoux JF, Roncato M, Pernes JM, Fiessinger JN, Aiach M, Gaux JC. Traitement par l’association urokinase-lysyl- plasminogène des poussées évolutives des artériopathies. Ann Méd Interne 1986 ; 137 : 105-107 [64] Vorwerk D, Guenther RW. Removal of intimal hyperplasia in vascular endoprostheses by atherectomy and balloon dilatation. AJR Am J Roentgenol 1990 ; 154 : 617-619 [65] Vroegindeweij D, Kemper FJM, Tielbeek AV, Buth J, Landman G. Recurrence of stenoses following balloon angioplasty and Simpson atherectomy of the femoropopliteal segment. A randomised comparative 1-year follow-up study using colour-flow duplex. Eur J Vasc Surg 1992 ; 6 : 164-171 43-012 [66] Wagner HJ, Starck EE. Acute embolic occlusions of the infrainguinal arteries: percutaneous aspiration embolectomy in 102 patients. Radiology 1992 ; 182 : 403-407 [67] Waller BF, Orr CM, Pinkerton CA, Vantassel JW, Pinto RP. Morphologic observations late after coronary balloon angioplasty: mechanisms of acute injury and relationship to restenosis. Radiology 1990 ; 174 : 961-967 [68] Waller BF, Pinkerton CA. ″Cutters, scoopers, shavers and scrapers″: the importance of atherectomy devices and clinical relevance of tissue removed. J Am Coll Cardiol 1990 ; 15 : 426-428 [69] Weinberg DJ, Cronin DW, Baker AG Jr. Infected iliac pseudoaneurysm after uncomplicated percutaneous balloon angioplasty and (Palmaz) stent insertion: a case report and literature review. J Vasc Surg 1996 ; 23 : 162-166 [70] White CJ, Ramee SR, Escobar A, Jain S, Collins TJ. Highspeed rotational ablation (Rotablator) for unfavorable lesions in peripheral arteries. Cathet Cardiovasc Diagn 1993 ; 30 : 115-119 [71] White GH, White RA, Kopchok GE, Colman PD, Wilson SE. Endoscopic intravascular surgery removes intraluminal flaps, dissections, and thrombus. J Vasc Surg 1990 ; 11 : 280-288 29 Encyclopédie Médico-Chirurgicale 43-022 43-022 Médicaments antithrombotiques en chirurgie vasculaire SX Racine CM Samama Résumé. – La thrombose artérielle représente la première complication de la chirurgie vasculaire. Aux lésions préexistantes des vaisseaux sanguins pathologiques s’ajoutent celles liées à la chirurgie (mise à nu du sousendothélium, stase sanguine au clampage, ischémie locale) qui induisent les mécanismes d’activation plaquettaire et la thrombinoformation. Les antithrombotiques et notamment les antiagrégeants ont longtemps été associés à l’augmentation du risque hémorragique. Actuellement, les études montrent qu’ils n’augmentent pas les complications hémorragiques mais diminuent la mortalité périopératoire tout en augmentant la durée de vie de certains types de pontages (notamment prothétiques). © 2001 Editions Scientifiques et Médicales Elsevier SAS. Tous droits réservés. Mots-clés : chirurgie vasculaire, chirurgie prothétique, endartérectomie carotidienne, chirurgie aortique, pontage, antiagrégeants, héparine. Introduction La thrombose artérielle en chirurgie vasculaire conduit à l’échec du pontage. Elle est due à la fois à des mécanismes d’ischémie locale activant l’agrégation plaquettaire et de perturbations de flux sanguin par baisse de débit sanguin ou de turbulences intrinsèques au pontage. La thrombose artérielle nécessite une prise en charge thérapeutique spécifique en fonction du geste chirurgical et du site anatomique de l’intervention. De nombreuses études contradictoires ont longtemps entretenu le doute sur le rapport bénéfice/risque des traitements antithrombotiques, l’hémorragie iatrogène incontrôlable représentant la crainte principale. Néanmoins, depuis quelques années, les études cliniques présentent une prise en charge consensuelle en fonction du site vasculaire, de la période d’administration et du type d’antithrombotique utilisé que sont les héparines, les antivitamines K (AVK) et les différentes classes d’antiagrégeants plaquettaires. Nous ne présentons pas la pathologie vasculaire occlusive chronique conduisant systématiquement à l’utilisation d’antithrombotiques, d’autant que d’autres pathologies y sont souvent associées. Nous détaillons les différents antithrombotiques utilisés en fonction de leur mode d’action pharmacologique et leur utilisation pour chaque type de chirurgie vasculaire. Antithrombotiques MODE D’ACTION DES ANTITHROMBOTIQUES ET RÈGLE DE PRESCRIPTION EN CHIRURGIE VASCULAIRE Les antithrombotiques ont principalement deux sites d’action correspondant à deux classes de produits. Les antiagrégeants qui Stéphane-Xavier Racine : Chef de clinique-assistant. Charles-Marc Samama : Praticien hospitalier. Département d’anesthésie-réanimation, centre hospitalier universitaire Avicenne, 125, route de Stalingrad, 93009 Bobigny cedex, France. agissent principalement sur les plaquettes et les interactions plaquette-paroi vasculaire. Les anticoagulants qui agissent sur les différentes étapes de la coagulation (fig 1). Les mécanismes d’action pharmacologiques sont donc fonction des classes d’antithrombotiques. ¶ Aspirine L’aspirine inhibe de manière irréversible la cyclo-oxygénase (COX) alors que les anti-inflammatoires non stéroïdiens (AINS) ne font que bloquer celle-ci de manière réversible. Cette enzyme catalyse l’acide arachidonique en prostanoïdes comme les prostaglandines G2 (PGG2) et H2 (PGH2). Cette PGH2 qui est habituellement labile entraîne, lorsqu’elle est activée par des médiateurs de l’inflammation, une production de thromboxane A2 (TXA2) par les plaquettes et de prostacycline (PGI2) par l’endothélium [46]. Le TXA2 est inducteur de l’agrégation plaquettaire et de la vasoconstriction dans les situations d’agression tissulaire. L’aspirine diminue la synthèse de TXA2. ¶ Flurbiprofène Le flurbiprofène est un AINS qui inhibe de manière réversible (24 heures) la COX plaquettaire, entraînant un défaut de synthèse de TXA2. C’est le seul AINS en France ayant une autorisation de mise sur le marché (AMM) pour la prévention des thromboses artérielles coronariennes. Dans le cadre d’une chirurgie programmée chez un patient sous aspirine (mais aussi sous thiénopyridine), le flurbiprofène est une alternative à un relais entre l’aspirine qui doit être arrêtée au minimum 10 jours et l’intervention chirurgicale. Le flurbiprofène ne sera arrêté que 24 heures avant l’intervention. ¶ Dipyridamole Le dipyridamole est un dérivé de la pyrimidopyrimidine possédant des propriétés vasodilatatrices et antiplaquettaires. Le mécanisme d’action est encore soumis à controverse mais il semblerait que le dipyridamole bloque le récepteur à l’adénosine qui stimule la dégradation de l’acide adénosine monophosphorique (AMP) en 5’AMP cyclique plaquettaire et réduit l’activation plaquettaire [23]. Toute référence à cet article doit porter la mention : Racine SX et Samama CM. Médicaments antithrombotiques en chirurgie vasculaire. Encycl Méd Chir (Editions Scientifiques et Médicales Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales – Chirurgie vasculaire, 43-022, 2001, 9 p. Médicaments antithrombotiques en chirurgie vasculaire 43-022 1 Site d’action des thérapeutiques antithrombotiques. vWf : facteur von Willebrand ; Gp : glycoprotéine de surface ; ADP : adénosine diphosphate. Abciximab SANG Plaquette activée Ticlopidine Clopidogrel Récepteur ADP Récepteur TXA2 PLASMA Facteurs contact : XII, prékallicréine, etc Récepteurs GPIIb/IIIa RGD-like ADP vWf fibrinogène TXA2 Gp Ib IIa V IX Facteur tissulaire VII Phospholipides plaquettaires THROMBINE Récepteurs GPIIb/IIIa Granules d'ADP Techniques chirurgicales Cyclo-oxygénase Plaquette activée Aspirine Activation plaquettaire vWf Héparines et AVK Endothéline, lipoxygénase, etc Lésion vasculaire Endothélium vasculaire ¶ Thiénopyridines (ticlopidine et clopidogrel) Les thiénopyridines (ticlopidine [Ticlidt] et clopidogrel [Plavixt]) inhibent l’agrégation plaquettaire induite par l’adénosine diphosphate (ADP) mais aussi celle induite par le collagène et la thrombine [28]. Chez les patients porteurs d’une artériopathie des membres inférieurs, le clopidogrel développe une activité antithrombotique supérieure à celle de l’aspirine [9]. Le clopidogrel tend à présent à remplacer la ticlopidine dans la prévention de la thrombose des endoprothèses coronaires, en association avec l’aspirine. ¶ Inhibiteurs des récepteurs glycoprotéiques IIb/IIIa (GP IIb/IIIa) L’abciximab (Réoprot), le tirofiban (Agrastatt) et l’eptifibatide (Integrilint) et ses dérivés, en se fixant aux récepteurs glycoprotéiques Gp IIb/IIIa des plaquettes, entrent en compétition avec le fibrinogène et accessoirement le facteur von Willebrand [24]. Le blocage de ces sites empêche les plaquettes d’agréger. Ils n’ont pas d’indication pour l’instant en chirurgie vasculaire, mais sont utilisés dans l’angor instable réfractaire et dans le cadre d’une angioplastie coronaire en association avec l’aspirine et l’héparine [10]. ¶ Héparines Les héparines sont classées en deux groupes : l’héparine non fractionnée (HNF) et les héparines de bas poids moléculaire (HBPM). L’HNF agit par l’intermédiaire de l’antithrombine (AT). Elle inhibe la thrombine (IIa) et dans la même proportion le facteur Xa (rapport Xa/IIa égal à 1). Dans une moindre mesure, elle interagit également avec les facteurs IXa, XIa et XIIa [44]. Les héparines de bas poids moléculaire (HBPM) inhibent de manière prépondérante le facteur Xa (rapport anti-Xa/anti-IIa entre 2 et 5 selon les molécules). Leur meilleure biodisponibilité par voie sous-cutanée rend compte d’une efficacité et d’une tolérance supérieures à celles de l’HNF. L’HNF est administrable par voie intraveineuse à la dose de 300 à 500 UI/kg/j, après une dose de charge de 300 UI/kg afin d’obtenir une anticoagulation efficace. L’administration en continu doit faire l’objet d’une surveillance par le temps de céphaline activée (TCA) qui doit être supérieur ou égal au double du témoin. L’HNF calcique est injectable par voie sous-cutanée. De même efficacité que l’HNF sodique, seule sa pharmacocinétique change. En effet, son pic d’efficacité est obtenu 40 minutes après l’injection sous-cutanée pour une durée moyenne de 6 heures. L’HNF sodique a son pic plasmatique dans les minutes qui suivent l’injection du bolus, mais sa demi-vie étant de 90 minutes, il est nécessaire de recourir à l’injection intraveineuse continue si l’anticoagulation doit être maintenue. 2 Les HBPM sont administrables en une ou deux injections journalières. Outre les contre-indications liées au risque hémorragique de tout antithrombotique, l’insuffisance rénale contreindique les HBPM pour une clairance de la créatinine inférieure à 30 mL/min. Elles peuvent être utilisées en mode préventif ou curatif dans le cadre de la maladie thromboembolique veineuse et l’angor instable. Leur utilisation est mal définie dans le cadre de la chirurgie vasculaire. Une seule injection par jour est nécessaire en mode préventif sans contrôle de l’activité anti-Xa. En revanche, en mode curatif, le dosage de l’activité anti-Xa au pic de l’activité (4 heures) est recommandé. Elle doit être comprise entre 0,5 et 1 UI-anti-Xa/mL pour obtenir une anticoagulation efficace pour la majorité des molécules. ¶ Antivitamines K Les AVK diminuent la synthèse des facteurs II, VII, IX, X et deux inhibiteurs physiologiques que sont les protéines C et S, en interférant avec l’activité du cofacteur de la vitamine K vis-à-vis de la gammacarboxylase hépatique. Les AVK nécessitent un délai d’action de quelques jours avant de développer une efficacité. Pour cela, il ne sont jamais prescrits seuls en première intention mais toujours en relais d’une anticoagulation par héparine. La surveillance du traitement repose sur la mesure de l’international normalized ratio (INR) qui doit être compris le plus souvent entre 2 et 3. ¶ Thrombolytiques Les thrombolytiques ont pour fonction de lyser le caillot sanguin récemment formé (moins de 2 semaines). Leur mode d’action commun est d’activer le système fibrinolytique physiologique en transformant le plasminogène inactif en plasmine active, ceci entraînant une dégradation de la fibrine, aboutissant à une lyse du thrombus. Les trois principales molécules utilisées en chirurgie vasculaire sont la streptokinase (SK) d’origine streptococcique et immunogène pour l’homme, l’urokinase (UK) isolée à partir de l’urine humaine et l’altéplase (recombinant-tissue-type plasminogen activator [rt-PA]) obtenue par génie génétique. Les doses administrées sont plus faibles que celles utilisées dans l’infarctus du myocarde pour la thrombolyse locorégionale artérielle. Pour la SK, il faut débuter par 250 000 UI en bolus puis 100 000 UI/h pendant 24 heures. Pour l’UK, il faut débuter par 4 400 UI/kg en 10 minutes, puis relayer par une perfusion intraveineuse pendant 12 à 24 heures par 2 000 UI/kg/h. Dans le cas d’une impossibilité à poursuivre le bolus local par une perfusion intraveineuse, il faut poursuivre par HNF à la dose de 500 UI/h, Médicaments antithrombotiques en chirurgie vasculaire Techniques chirurgicales 43-022 Tableau I. – Contre-indications et précautions d’emploi des antithrombotiques. Médicaments Principales contre-indications Recommandations d’emploi Aspirine Absolue : allergie aux salicylés et dérivés, ulcère gastrique en évolution, coagulopathie constitutionnelle ou acquise, risque hémorragique majeur, grossesse, association au méthotrexate à haute dose, maladies hémorragiques. En cas d’insuffisance rénale dont la clair créat < 30 mL/min, contre-indiquer l’association avec les HBPM. Dipyridamole Identiques à celles de l’aspirine en ce qui concerne le risque hémorragique. Pour les fortes doses, fractionner les prises car vasodilatation brutale possible. Clopidogrel Allergie, insuffisance hépatocellulaire sévère, lésion hémorragique évolutive, allaitement. Ne pas utiliser dans les premiers jours d’un infarctus du myocarde, d’un angor instable, de la pose de stent, d’un pontage aortocoronarien et d’un AVC ischémique de moins de 7 jours. Association à des médicaments antithrombotiques et insuffisance rénale : prudence. Ticlopidine Idem que pour l’aspirine. Arrêt 10 jours avant intervention chirurgicale, association antithrombotiques, théophylline (surdose), pentoxifylline (hémorragie), phénitoïne (surdose). Surveillance NFS (leucothrombopénie et PTT). Anti-GP IIb/IIIa Allergie à la molécule ou à ses composés (exemple : la papaïne pour le Réoprot), lésion hémorragique, ATCD d’AVC hémorragique de moins de 2 ans, TC ou intrarachidien de moins de 2 mois, lésion cérébrale tumorale, malformative ou anévrismale, HTA incontrôlée. Coagulopathie, thrombopénie, vascularite, rétinopathie vasculaire, insuffisance hépatique ou rénale. Évaluation bénéfice-risque, administration simultanée d’aspirine et héparine, surveillance en milieu de surveillance intensive. HNF/HBPM Absolue : allergie, thrombopénie, lésions tissulaires hémorragiques, coagulopathie sauf CIVD non liée à l’héparine, endocardite infectieuse aiguë (sauf si prothèse mécanique), postopératoire de neurochirurgie, AVC hémorragique. Relative : association à d’autres antithrombotiques. HBPM : insuffisance rénale avec clair créat < 30 mL/min. Risque hémorragique si association à d’autres antithrombotiques, corticothérapie à forte dose ou supérieure à 10 jours (interaction médicamenteuse). AVK Absolue : allergie à la molécule ou à ses dérivés, lésion hémorragique, neurochirurgie, chirurgie ophtalmologique, insuffisance hépatocellulaire ou rénale (clair créat < 20 mL/min), ulcère gastroduodénal récent ou évolutif, varices œsophagiennes, HTA maligne (diastolique > 12 mmHg), AVC (sauf embolie systémique). Association miconazole, phénylbutazone et AINS pyrazolés, salicylés à forte dose Si risque thrombotique, utiliser les AVK en relais avec une anticoagulation efficace (héparine) du fait du temps de latence de l’efficacité des AVK. ATCD : antécédent ; AVC : accident vasculaire cérébral ; TC : traumatisme crânien ; clair créat : clairance de la créatininémie ; IHC : insuffisance hépatocellulaire ; NFS : numération-formule sanguine ; PTT : purpura thrombotique thrombopénique ; AVK : antivitamine K ; HBPM : héparine de bas poids moléculaire ; HNF : héparine non fractionnée ; AINS : anti-inflammatoire non stéroïdien ; CIVD : coagulation intravasculaire disséminée ; HTA : hypertension artérielle. Tableau II. – Modalités de surveillance des antithrombotiques et lieu de réalisation technique : au laboratoire ou au chevet du malade. Antithrombotiques Aspirine Modalités de surveillance Temps de saignement par méthode d’Ivy PFAt épinéphrine Valeur sous traitement > 10 minutes > 160 secondes Laboratoire Malade (+) (+) Dipyridamole Pas de dosage spécifique Clopidogrel (Plavixt) Pas de dosage spécifique NFS car risque de thrombopénie Ticlopidine (Ticlidt) Pas de dosage spécifique NFS car risque de neutropénie Anti-GP IIb/IIIa (Réoprot) Pas de dosage spécifique NFS car risque de thrombopénie HNF (à dose curative) Temps de céphaline activée ACT : Hemochront, Actalyket, ACTIIt Thrombo-élastogramme NFS car risque de thrombopénie > 1,5 fois le témoin > 400 et < 600 secondes (r+k) élevé, Am normale (+) HBPM Activité anti-Xa NFS car risque de thrombopénie > 0,5 et < 1 UI (+) AVK INR INR > 2 risque hémorragique majeur si > 4 (+) (+) (+) AVK : antivitamine K ; HBPM : héparine de bas poids moléculaire ; HNF : héparine non fractionnée ; NFS : numération-formule sanguine ; ACT : activated clotting time ; INR : international normalized ratio ; Am : amplitude maximale ; (r + k) : temps de réaction + temps de coagulation. 4 heures après la thrombolyse, à condition que le fibrinogène soit supérieur à 1 g/L et le TCA inférieur à deux fois le témoin. Pour le rt-PA, il faut débuter par un bolus locorégional de 10 mg en 1 minute puis de 45 mg/h pendant 2 heures. Contrairement aux précédentes molécules, l’HNF est démarrée à l’arrêt de l’altéplase à la dose de 1 000 UI/h et adaptée en fonction du TCA. La fibrinolyse n’est arrêtée qu’après l’assurance de l’absence totale de thrombus, l’héparine en relais n’ayant pour but que d’empêcher la formation de nouveaux thrombi. La surveillance est réalisée par la clinique (chaleur et coloration cutanée, perception du pouls, point de ponction, signes hémorragiques), la biologie (temps de prothrombine [TP], TCA, numération-formule sanguine [NFS], plaquettes, fibrinogène par 6 heures pendant 24 heures) et éventuellement le doppler. La survenue d’un syndrome hémorragique, d’un hématome au point de ponction ou un taux de fibrinogène inférieur à 1 g/L doivent faire arrêter la thrombolyse. Les principales indications, contre-indications et modes de surveillance sont précisés dans les tableaux I et II. 3 Médicaments antithrombotiques en chirurgie vasculaire 43-022 Utilisation des antithrombotiques en fonction du type de chirurgie Dans ce chapitre sont présentées les principales études sur l’utilisation des antithrombotiques en fonction du type d’intervention chirurgicale (tableau III). Pour chaque site opératoire sont détaillées les pratiques thérapeutiques en fonction de la classification de la conférence de consensus nord-américaine sur l’utilisation des antithrombotiques en chirurgie vasculaire. Celle-ci a classé, après une revue de la littérature, les recommandations thérapeutiques en trois catégories (tableau III) [26] suivant le niveau avantage/inconvénient des agents antithrombotiques [29]. CHIRURGIE DE L’AORTE Le risque de thrombose après chirurgie de l’aorte est faible car le débit aortique très élevé rend difficile la fixation des composés plaquettaires. Ceci n’est plus vrai pendant le clampage aortique, du fait de la stagnation du sang dans un cul-de-sac vasculaire, des lésions traumatiques de l’endothélium vasculaire dues au clampage et de l’ischémie locale. Toutes ces conditions favorisent la formation locale d’un thrombus. La solution qu’apporte l’héparine au phénomène de thrombose au moment du clampage de l’aorte n’est peut-être que théorique. Thompson et al [50] , dans une étude multicentrique randomisée sur 284 patients, ne retrouvent pas de différences significatives entre le groupe recevant 5 000 UI d’HNF avant le clampage et le groupe non anticoagulé en termes de complications thrombotiques et hémorragiques périopératoires. En revanche, le bénéfice de l’héparine apparaît vis-à-vis de l’infarctus du myocarde avec une réduction de la morbidité (1,4 % versus 5,7 %) et de la mortalité (2 % versus 8,5 %). Dans la chirurgie de l’aorte, l’anticoagulant de référence est l’HNF. Habituellement, l’administration par voie intraveineuse est basée sur un bolus avant le clampage, suivie d’un entretien en continu ou faite de bolus répétitifs, le but étant d’obtenir une anticoagulation efficace avec un TCA double de celui du témoin. L’obtention de ce niveau d’anticoagulation nécessite un bolus initial de 100 à 150 UI/kg d’HNF et de répéter théoriquement la dose de 50 UI/kg toutes les 45 minutes pendant toute la durée du clampage. D’après Qhigley et al [ 4 3 ] , le monitorage de la coagulation peropératoire tel qu’il est pratiqué habituellement par une prise de sang périphérique est inadapté. Dans une étude observant le temps de coagulation activée (activated clotting time [ACT]) après injection d’héparine dans une chirurgie de l’aorte, les auteurs montrent que le prélèvement sanguin réalisé en amont du clampage a un ACT plus long que celui prélevé en aval du clampage. Mais l’efficacité de l’anticoagulation dépend du type de molécule utilisé et aussi du site d’injection. Kroneman et al [33], dans une étude comparative étudiant les HBPM et les HNF au cours de pontages aortobifémoraux, ne retrouvent pas de différences entre les deux groupes concernant la perte sanguine ou le risque thrombotique. Cependant, l’avantage revient aux HBPM (daltéparine) en ce qui concerne la reproductibilité de la cinétique plasmatique. En effet, la pharmacocinétique des HBPM dans le temps est beaucoup plus stable que celle de l’HNF. Ainsi, il semble que l’anticoagulation par HNF dans la chirurgie de l’aorte est aléatoire en comparaison de l’utilisation des HBPM. Ceci est confirmé par l’étude de Melissari et al [38], dans laquelle le taux et la durée de l’activité anti-Xa sont plus Techniques chirurgicales élevés avec les HBPM qu’avec l’HNF. Enfin Wilson et al [54], utilisant les HBPM, ont comparé l’influence de l’anticoagulation en fonction des sites d’injection, périphérique ou intra-aortique, et des moments d’administration, avant ou après le clampage. Bien qu’aucun patient n’ait développé de thrombose distale, les prélèvements sanguins ont montré une activité anti-Xa basse en aval du clampage aortique si l’administration est réalisée après le clampage. En revanche, l’activité anti-Xa est plus élevée dans le groupe recevant l’héparine en intra-aortique avant le clampage par rapport au groupe recevant l’héparine en périphérie, aussi bien sur des prélèvements systémiques qu’en aval du clampage. En postopératoire, l’aspirine est la molécule antiagrégeante la plus couramment utilisée. En effet, de nombreux facteurs facilitent la formation du thrombus [8] : zone de turbulence du flux sanguin, absence d’endothélium d’où mise en contact du sous-endothélium avec le sang entraînant une activation de l’hémostase. Les taux de cisaillement élevés de la circulation artérielle donnent aux plaquettes un rôle prépondérant par rapport aux facteurs de la coagulation. Dans ce contexte, les antiagrégeants sont les molécules de choix. Recommandations de la conférence de consensus nord-américaine de chirurgie aortique : – l’aspirine administrée à la dose de 81 à 325 mg/j réduit l’incidence de l’infarctus du myocarde (A1) ; – les AVK (associés ou non à l’aspirine) ne sont pas à utiliser au long cours (A1) ; – l’aspirine à la dose de 81 à 325 mg/j (associés ou non au dipyridamole à la dose de 75 mg, trois fois par jour) est recommandée dans les pontages artériels prothétiques ou pour tous les types de pontages fémoropoplités (B1) ; – l’héparinisation doit être efficace pendant le clampage artériel (B1) ; – un pontage sur une artère d’un diamètre supérieur à 6 mm ne nécessite pas l’utilisation d’antithrombotiques en postopératoire (C1). (L’association avec l’aspirine réduit la morbidité et mortalité cardiovasculaires, cf première recommandation classée A1.) CHIRURGIE VASCULAIRE ARTÉRIELLE PÉRIPHÉRIQUE ¶ Ischémie aiguë des membres inférieurs La pathologie artérielle chronique représente certes la première cause d’ischémie artérielle aiguë, mais le traumatisme et l’occlusion aiguë vasculaire occupent également une place importante dans ce domaine, avec une thérapeutique associée lourde car dépendante des autres lésions liées au traumatisme ou aux tares viscérales (cardiaque, neurologique, thoracique...). En cas de traumatisme sévère, l’anticoagulation est contre-indiquée car s’associent souvent une hémorragie, une coagulation intravasculaire disséminée et/ou une fibrinolyse massive, avec un déficit qualitatif et quantitatif majeur en facteurs de la coagulation et de l’hémostase primaire. Le traitement est orienté vers une chirurgie réparatrice en cas de section, lacération ou compression artérielle externe. Dans le cas d’occlusion artérielle aiguë de type thromboembolique, le traitement consiste à réaliser une désobstruction vasculaire par sonde de Fogarty, ou mieux par thromboaspiration (moins traumatisante pour l’endothélium vasculaire). Dans la situation d’un échec de la désobstruction artérielle par sonde endovasculaire, l’utilisation de Tableau III. – Niveaux de recommandations des études par la Société américaine de chirurgie vasculaire. Études de niveau A Méthodologie forte, résultats sûrs, étude randomisée avec échantillon ou groupe contrôlé et homogène Études de niveau B Méthodologie forte, résultats individuels par patient disparates, étude randomisée avec échantillon ou groupe contrôlé et hétérogène 1 Effets clairs, apportant un bénéfice 2 Effets équivoques, dont le bénéfice n’est pas démontré 4 Études de niveau C Méthodologie succincte, études d’observation Techniques chirurgicales Médicaments antithrombotiques en chirurgie vasculaire thrombolytiques in situ a démontré son efficacité sans augmentation de la morbidité. Dotter et al [19], dans une étude multicentrique, montrent que l’injection de SK in situ en amont d’une obstruction artérielle a un succès de reperfusion significativement supérieur à une injection intraveineuse systémique. L’étude multicentrique STILE comparant les bénéfices de la chirurgie vasculaire versus l’utilisation de thrombolytiques dans les ischémies aiguës de membres, d’origine non embolique, montre que la revascularisation chirurgicale est supérieure à la fibrinolyse lorsque les symptômes ischémiques durent depuis plus de 15 jours [47]. Dans la situation où ces symptômes datent de moins de 2 semaines, la fibrinolyse enregistre un taux plus faible d’amputations. La fibrinolyse devrait être utilisée avant qu’une restructuration endothéliale ne se développe. L’utilisation de l’héparine doit être associée, en même temps que le geste chirurgical, en l’absence de thrombolyse ou après l’utilisation de la thrombolyse. En postopératoire et en l’absence de contreindication aux antithrombotiques, il faut utiliser les mêmes thérapeutiques antithrombotiques et aux mêmes doses que pour la chirurgie vasculaire programmée. ¶ Chirurgie de reconstruction vasculaire périphérique Les prothèses vasculaires artérielles synthétiques présentent un plus grand risque de thrombose que les pontages veineux [52]. Veith et al [51] ont comparé, dans une étude randomisée multicentrique pendant 6 ans, les complications des pontages artériels en matériel synthétique (polytétrafluoroéthylène [PTFE]) par rapport à des greffons veineux. Il en résulte, de manière significative, moins de complications dans le groupe greffon veineux en termes de rethrombose (p < 0,001). Ce résultat est valable pour toutes les études comparatives similaires [20, 37]. L’hyperplasie intimale est une des complications principales aboutissant à l’échec des pontages artériels. Il se crée une zone thrombogène par les turbulences liées au mauvais écoulement sanguin et par la fragilité de l’endothélium pouvant laisser à nu le sous-endothélium. Ceci induit l’adhésion plaquettaire et active les facteurs de la coagulation. Bien que quelques études animales aient montré une diminution de l’hyperplasie intimale sous traitement antiagrégeant, d’autres études expérimentales chez l’animal [7, 12] et thérapeutiques chez l’homme [25] n’ont pas retrouvé de résultats semblables. La thrombogénicité de la surface du matériau employé rentre également en ligne de compte. En effet, la réendothélialisation est plus rapide, plus complète et de meilleure qualité sur les greffons veineux que sur les prothèses en Dacront ou en PTFE. Pumphrey et al [42] ont montré que des plaquettes marquées à l’indium 111 étaient moins nombreuses sur la surface de greffons veineux que sur les pontages en Dacront ou en PTFE. À l’inverse, l’association dipyridamole-aspirine diminue cette fixation des plaquettes de manière plus importante dans le groupe prothèses que pour les pontages en greffon veineux. Une troisième complication est liée au débit circulant dans le pontage. Pour des diamètres supérieurs à 6 mm, il n’y a pas d’indication pour une thérapeutique antiagrégeante. Les occlusions des pontages aorto-iliaques, fémoraux et des artères rénales sont beaucoup moins fréquentes que celles des pontages distaux. En revanche, les pontages artériels offrant un débit inférieur à 200 mL/min ou les pontages croisant une zone de plicature (exemple, le creux poplité) sont à haut risque de thrombose et doivent bénéficier d’un traitement par antiagrégeant [26]. Ce traitement doit être débuté le plus tôt possible avant l’intervention chirurgicale. Clyne et al [13] montrent, dans une étude randomisée, qu’un traitement associant dipyridamole avant et pendant l’intervention, et aspirine-dipyridamole après le pontage, diminue de manière significative le risque de thrombose à 6 semaines pour les prothèses artérielles alors que, pour les greffons veineux, la différence n’est pas significative. Kohler et al [31], dans une étude avec une méthodologie similaire, ont administré des 43-022 antiagrégeants après l’intervention. L’association aspirinedipyridamole n’apporte pas de bénéfice en termes de thrombose entre le groupe traité et celui non traité. L’aspirine et le dipyridamole augmentent-ils le risque hémorragique ? Une étude multicentrique [36] portant sur les patients ayant bénéficié d’un pontage veineux, fémoropoplité montre une augmentation du nombre d’hématomes en regard de la cicatrice opératoire. Dans cette étude, le groupe traité par antiagrégeant a reçu plus de transfusions que dans le groupe contrôle. Ce résultat s’oppose à l’étude multicentrique randomisée de Becquemin et al [5] sur le même type de pontage sous dipyridamole seul. En effet, dans cette étude, il n’y a pas de différence dans les deux groupes en ce qui concerne le risque hémorragique tout en obtenant moins de thromboses par rapport au groupe témoin. Une analyse rétrospective sur 2 000 patients à partir de 11 études randomisées montre que les traitements antiagrégeants diminuent de manière significative (p < 0,0001) le risque de thrombose avec un recul de 19 mois [1]. Les héparines préviennent la formation de la thrombose artérielle mais la dose, le site d’administration (voie systémique ou locale) et le moment de l’administration par rapport au clampage dépendent de l’habitude chirurgicale. L’agrégation plaquettaire induite par les HNF n’est pas retrouvée avec les HBPM [4]. Cette donnée plaide théoriquement en faveur des HBPM en chirurgie vasculaire. L’étude de Samama et al [45] montre, dans le groupe traité avec l’HNF, un risque de thrombose postopératoire plus élevé qu’avec les HBPM lors des pontages artériels périphériques (HNF versus enoxaparine, 22 % versus 8 %, p = 0,009) avec un risque hémorragique plus faible dans le groupe HBPM. Les AVK sont des anticoagulants puissants (fig 1). Les résultats des études sont contradictoires en termes de mortalité et morbidité, mais il semble que le risque hémorragique imputable aux AVK soit plus élevé, comparativement à celui induit par d’autres médicaments [2, 17] antithrombotiques . Néanmoins, une étude portant sur 12 ans montre que le pontage artériel a une durée de vie supérieure dans le groupe traité par rapport à celui non traité [32]. L’association de faibles doses d’antiagrégeants plaquettaires et d’AVK a pour but théorique d’augmenter l’efficacité de l’action antithrombotique tout en diminuant les risques hémorragiques. Une étude multicentrique portant sur 458 patients recevant soit 325 mg/j d’aspirine, soit l’association aspirine et AVK (pour obtenir un INR entre 1,5 et 2,8), après un pontage fémorotibial, fémoropoplité ou fémoropédieux sur un suivi de 4 ans, ne montre pas de différence en termes de complications hémorragiques entre les deux groupes. En revanche, cette étude révèle que la prise médicamenteuse au long cours des anticoagulants oraux est aléatoire car des contrôles d’INR ont montré fréquemment un sous-dosage [30]. Pour s’assurer de la viabilité d’un pontage, il faut tenir compte de la bonne compliance au traitement antithrombotique du patient. Recommandations de la conférence de consensus nord-américaine de chirurgie vasculaire périphérique : – l’aspirine administrée à la dose de 81 à 325 mg/j réduit l’incidence de l’infarctus du myocarde (A1) ; – les AVK (associés ou non à l’aspirine) ne sont pas à utiliser au long cours (A1), sauf (classé B2) en cas de pontage distal associé à un risque de thrombose ; – l’aspirine à la dose de 81 à 325 mg/j (associés ou non au dipyridamole à la dose de 75 mg, trois fois par jour) est recommandée dans les pontages artériels prothétiques ou pour tous les types de pontages fémoropoplités (B1) ; – l’héparinisation doit être efficace pendant le clampage artériel (B1) ; – en cas de thrombus ou d’embole artériel après une thromboembolectomie, il faut utiliser l’héparine à dose efficace puis faire un relais par les AVK (C1). 5 43-022 Médicaments antithrombotiques en chirurgie vasculaire CHIRURGIE CAROTIDIENNE La complication la plus redoutée per- et postopératoire de ce type de chirurgie est l’embolisation distale de débris athéromateux provenant de la carotide. En théorie, l’aspirine administrée avant l’intervention devrait prévenir la formation de ces emboles provenant de la zone opérée. En effet, des plaquettes marquées à l’indium 111 ont permis d’observer, à la scintigraphie, une adhésion endothéliale juste après l’intervention [48]. Cette adhésion décroissante dans le temps est probablement liée à la réendothélialisation vasculaire de la lumière artérielle. Findlay et al [ 2 2 ] ont montré que l’association aspirine et dipyridamole diminuait la fréquence des interactions adhésionagrégation entre l’endothélium et les plaquettes, tout en diminuant l’incidence des accidents vasculaires cérébraux périopératoires. Fields et al [21] ont évalué le bénéfice apporté par 650 mg d’aspirine biquotidien chez des patients opérés d’endartériectomie carotidienne contre un groupe traité par placebo. Après 2 ans de traitement, le bénéfice est statistiquement en faveur du traitement par l’aspirine, avec une diminution globale de la mortalité et de la morbidité liée à l’athérosclérose carotidienne (accident vasculaire ischémique, infarctus cérébral, accident ischémique transitoire, amaurose, etc). Cependant, les études ne vont pas toutes dans le même sens. Findlay et al comparant 50 à 100 mg/j d’aspirine, contre un groupe placebo, administré après une endartériectomie carotidienne, n’ont pas détecté de différence en termes de mortalité et morbidité. Dans cette étude, certains biais n’ont pas permis de conclure sur le bénéfice de l’utilisation d’une faible dose (dose variable non adaptée au poids, démarrage de la première prise postopératoire allant de 1 semaine à 3 mois). Plus récemment, Lindblad et al [35] ont confirmé, dans une étude en double aveugle avec placebo, que 75 mg/j d’aspirine en préopératoire diminuaient significativement les accidents cérébraux per- et postopératoire sans augmentation du risque de saignement. Les données de l’étude NASCET (North American symptomatic carotid endarteriectomy) ont montré que les accidents vasculaires cérébraux survenaient principalement dans le mois qui suit une endartériectomie. Cette étude suggérait que ces accidents étaient plus faibles pour les patients traités par de fortes doses d’aspirine (de 325 à 650 mg deux fois par jour) contre ceux ne recevant pas d’aspirine ou recevant moins de 325 mg/j [3]. Ce dernier résultat, par l’analyse d’un sous-groupe, s’opposait aux études comparant l’utilisation de faibles doses d’aspirine contre placebo. Les résultats de l’étude ACE (ASA and carotid endarteriectomy) contredisent ceux de l’étude NASCET. Cette étude multicentrique, randomisée en double aveugle et portant sur 2 849 patients, a observé l’effet de quatre dosages d’aspirine donnés avant une endartériectomie carotidienne jusque 3 mois après l’intervention. Les résultats montrent que le risque d’accident vasculaire cérébral, d’infarctus du myocarde et de décès à 30 jours et à 3 mois de l’opération est plus faible dans les groupes traités avec 81 et 325 mg d’aspirine (5,4 % versus 7 % à 30 jours, 6,2 % versus 8,4 % à 3 mois) que dans ceux traités avec 650 et 1 300 mg [49]. Les études confirment que l’aspirine administrée en préopératoire et en postopératoire diminue le risque d’accidents vasculaires cérébraux ischémiques pour une dose quotidienne supérieure à 75 mg. Néanmoins, les complications hémorragiques ne sont pas rares, pouvant s’élever jusqu’à 3 % des endartériectomies. L’héparinothérapie et les poussées hypertensives associées à un traitement antiagrégeant augmentent l’incidence des hémorragies périopératoires [34]. Chez des patients non opérés, asymptomatiques mais porteurs d’une sténose carotidienne, aucune étude ne montre de bénéfice apporté par l’aspirine administrée au long cours, en ce qui concerne les complications cérébrales. Seule l’étude de Coté et al [16] a observé l’absence de bénéfice du traitement sur une période de 2 à 3 ans, mais il n’existe pas d’étude randomisée sur une plus longue période concernant le bénéfice de l’aspirine en termes de mortalité, comme celles réalisées dans l’infarctus du myocarde. 6 Techniques chirurgicales Chez les patients opérés d’une endartériectomie carotidienne, il ne semble pas que l’aspirine au long cours diminue le risque de resténose, comme le montrent les études rétrospectives de Clagett et al [11] et Cossman et al [15], confirmé par Harker et al [27] qui ne retrouvent aucun bénéfice en termes de resténose carotidienne pour les patients traités par l’association aspirine et dipyridamole. L’héparine en chirurgie carotidienne est l’antithrombotique de référence. Habituellement, l’HNF est administrée à la dose de 85 UI/kg avant le clampage carotidien. Même si la durée de ce clampage est court, il est souhaitable de monitorer régulièrement au bloc opératoire l’anticoagulation. En ce qui concerne la chirurgie carotidienne, la mesure d’un ACT supérieure à 300 secondes semble diminuer les complications neuropsychiques emboliques postopératoires [41]. Il s’agit d’une anticoagulation efficace et donc potentiellement hémorragique. Ce risque hémorragique doit être néanmoins relativisé car, en chirurgie cardiaque, l’ACT souhaité est supérieur à 450 secondes. Quoi qu’il en soit, la diminution du risque hémorragique passe par une consultation clinique permettant d’éliminer toutes les contre-indications aux antithrombotiques. En postopératoire, faut-il antagoniser l’héparine par le sulfate de protamine ? Si l’antagonisation est fréquente aux États-Unis, elle l’est beaucoup moins en France. Les études montrent qu’il n’y a pas de bénéfice en termes de saignement ou de complication embolique liés à la protamine [18]. En revanche, la protamine peut être responsable d’effets secondaires de type allergique ou hémodynamique. Depuis plus d’une trentaine d’années, les anesthésistes ont mis au point des techniques d’anesthésie locorégionale (ALR) cervicale pour les endartériectomies. Celles-ci consistent à injecter, par une ou plusieurs ponctions, des anesthésiques locaux le long du bord postérieur du muscle sterno-cléido-mastoïdien, afin de bloquer la conduction nerveuse de racines C2 à C6 (voire plus en fonction du volume et de la concentration administrée). Si quelques cas d’intoxication aux anesthésiques locaux ont été décrits, aucune étude n’a pu mettre en évidence d’accidents hémorragiques pour les anesthésies locales cervicales comparativement à l’anesthésie générale. Actuellement, l’utilisation de stimulateurs nerveux et l’adoption de la technique à une seule ponction limitent le risque d’une perforation vasculaire pouvant entraîner un saignement incontrôlable. Recommandations de la conférence de consensus nord-américaine de chirurgie carotidienne : – l’aspirine à la dose de 81 à 650 mg biquotidienne doit être donnée à vie après une endartériectomie (diminue le risque de thrombose et d’accident vasculaire cérébral ischémique) (A1) ; – l’héparinisation doit être efficace pendant le clampage artériel (B1). ANGIOPLASTIE PERCUTANÉE TRANSLUMINALE L’angioplastie percutanée en cathétérisant une artère dans laquelle le ballonnet, situé sur la partie distale, dilate la sténose, restaure le chenal artériel mais peut créer des lésions thrombogènes de la paroi artérielle ou, par fracture de plaques athéromateuses, peut libérer des emboles en aval de la dilatation [6]. Des études expérimentales montrent que les plaquettes s’accumulent 30 minutes après le début de la dilatation, cette réaction est d’autant plus importante qu’il existe des lésions histologiques à type de dissection [53]. Les études concernant l’utilisation des antithrombotiques dans l’angioplastie périphérique sont peu nombreuses par rapport à l’angioplastie coronarienne. Néanmoins, il existe quelques études randomisées pouvant orienter la thérapeutique. Dans les traitements au long cours après angioplastie périphérique, une étude multicentrique [ 3 9 ] n’a pas montré de différences en termes d’inhibition de l’activité plaquettaire à 1 an entre l’association aspirine-dipyridamole contre un placebo. Par ailleurs, cette étude comparant de fortes doses d’aspirine (1 g/j) à de faibles doses d’aspirine (100 mg/j) n’a pas montré de différences en termes de bénéfice ; en revanche, les complications gastriques sont plus élevées dans le groupe à forte dose. Une autre étude randomisée étudiant l’activité plaquettaire par agrégométrie montre, sur un suivi de Techniques chirurgicales Médicaments antithrombotiques en chirurgie vasculaire 18 mois après une angioplastie, que l’utilisation de 100 mg d’aspirine ne bloque que 60 % de l’activité plaquettaire, mais qu’aucun patient n’a développé de complication thrombotique [40]. Plus récemment a été développée l’utilisation des inhibiteurs des récepteurs plaquettaires GP IIb/IIIa, comme l’abciximab, l’eptifibatide et le tirofiban, pour les interventions coronariennes percutanées. Le but de ces molécules est de prévenir les complications cardiaques ischémiques au cours des angioplasties coronariennes, des athérectomies ou lors de la pose de stent. Les anti-GP IIb/IIIa doivent être utilisés en association avec de l’aspirine et de l’HNF. Cependant, aucune étude n’a été publiée sur leur utilisation en chirurgie vasculaire non cardiaque. On peut se demander si le risque hémorragique ne peut pas l’emporter en utilisant à la fois deux antiagrégeants plaquettaires (aspirine + inhibiteur GP IIb/IIIa) et un anticoagulant (HNF) pour une intervention vasculaire sur les gros vaisseaux artériels. Le manque de résultats en recherche clinique montre bien la difficulté du choix d’une molécule et de son dosage, mais surtout de l’utilité des antithrombotiques dans l’angioplastie non coronarienne qui semble pourtant indispensable par le risque thrombotique qu’engendre le matériel vasculaire synthétique. Recommandations de la conférence de consensus nord-américaine de chirurgie de l’angioplastie percutanée transluminale : – l’héparinisation doit être efficace pendant le clampage artériel (B1) ; – l’aspirine associée à la ticlopidine sont recommandées pour les angioplasties fémorales et artérielles périphériques (B2) ; – l’aspirine doit être administrée avant et après les angioplasties aortiques et iliaques (C1). Problèmes particuliers ANTITHROMBOTIQUES ET RISQUES THROMBOEMBOLIQUES VEINEUX PÉRIOPÉRATOIRES EN CHIRURGIE VASCULAIRE La maladie thromboembolique veineuse repose sur l’atteinte d’au moins un des éléments suivants que sont une lésion de l’endothélium vasculaire (étirement ou compression veineuse), la stase veineuse (alitement, plâtre, mauvais retour veineux postchirurgie pelvienne ou des membres inférieurs, etc), et l’hypercoagulabilité (activation des médiateurs de l’inflammation post-traumatique, infection, etc). Plusieurs types de risques sont à prendre en compte de manière indépendante, l’association de ces différents facteurs augmentant le risque de maladie thromboembolique veineuse (MTEV). Le risque chirurgical ne semble pas être majeur en chirurgie vasculaire. En effet, la conférence de consensus de l’Assistance publique-hôpitaux de Paris [14] n’a pas retenu ce type de chirurgie. La chirurgie viscérale, 43-022 gynéco-obstrétricale et carcinologique abdominopelvienne, ainsi que la chirurgie orthopédique, notamment de la hanche, présentent un risque élevé de thrombose veineuse. Cependant, la chirurgie de l’aorte représente un risque thromboembolique qui doit être considéré au minimum comme modéré (chirurgie abdominale et du bassin) nécessitant une prévention de la MTEV. En revanche, le risque lié au terrain classe le plus souvent le patient de chirurgie vasculaire en risque modéré ou élevé. Le risque modéré est représenté par l’âge supérieur à 40 ans, la présence de varices, une contraception œstroprogestative, une insuffisance cardiaque, un alitement périopératoire supérieur à 4 jours, une infection, le post-partum et l’obésité. Le risque élevé lié au terrain est surtout associé à une pathologie préexistante sévère (cancer évolutif, anomalies de certains facteurs de la coagulation comme les protéines C, S, AT III, la présence d’anticoagulants circulants, hémopathie, etc), mais surtout un antécédent de MTEV. Bien qu’aucune conférence de consensus ne précise les modalités de prise en charge de la MTEV en chirurgie vasculaire, ce type de chirurgie est à risque modéré (sauf en cas de risque élevé lié au terrain). La prévention de la MTEV débute par les moyens mécaniques. La déambulation précoce, la surélévation des membres inférieurs, les bas de contention (sauf en cas de pontage artériel des membres inférieurs), voire la mise en place d’une compression intermittente plantaire ou du mollet représentent des techniques peu coûteuses et ayant une réelle efficacité. L’autre versant thérapeutique est l’utilisation de médicaments comme les HBPM, les AVK (surtout aux États-Unis), le danaparoïde sodique (Orgarant) qui n’a une AMM que pour la chirurgie orthopédique, carcinologique et les thrombopénies induites par l’héparine, les autres molécules comme l’hirudine, les pentasaccharides et le mélagatran sont en cours d’évaluation. Quoi qu’il en soit, les thérapeutiques antithrombotiques artérielles utilisées en postopératoires d’une chirurgie vasculaire sont utilisées à dose curative (aspirine, HBPM, HNF, etc) avec une hémostase plus proche du versant hémorragique que du versant thrombotique. Néanmoins, au-delà de cette période postopératoire précoce, le risque de MTEV est lié au terrain plus qu’à la chirurgie. Si à ce stade aucune thérapeutique antithrombotique artérielle au long cours n’est envisagée (AVK, antiagrégeants, etc), le risque de MTEV devient prépondérant pour la chirurgie vasculaire intéressant les membres inférieurs (tableau IV). ANESTHÉSIE LOCORÉGIONALE ET TRAITEMENTS ANTITHROMBOTIQUES Il faut distinguer deux types d’ALR. Tout d’abord, il y a les ALR médullaires (péridurales et rachianesthésies). La survenue d’un hématome liée à une anesthésie médullaire est de l’ordre de 1/150 000 en l’absence de trouble de la coagulation. Cette incidence augmente en présence d’antiagrégeant ou d’anticoagulant. Les conséquences d’un hématome dans cette région contre-indiquent Tableau IV. – Prévention des maladies thromboemboliques veineuses (MTEV) en chirurgie vasculaire, en l’absence de traitement antithrombotique artériel associé. Risque de MTEV faible (situation peu courante en chirurgie vasculaire) Déambulation précoce Risque de MTEV modéré : âge > 40 ans, varices, contraception œstroprogestative, insuffisance cardiaque décompensée, alitement périopératoire > 4 jours, infection, postpartum, obésité HBPM à dose modérée ± bas de contention (sauf pontage des membres inférieurs) + déambulation précoce Risque de MTEV élevé : cancer évolutif, anomalies de certains facteurs de la coagulation : les protéines C, S, AT III, anticoagulants circulants, hémopathie, antécédent de MTEV HBPM à dose élevée + bas de contention (sauf pontage des membres inférieurs) + déambulation précoce Problèmes particuliers Les bas de contention ne sont pas à utiliser pour les pontages artériels des membres inférieurs (surtout distaux) : risque de bas débit artériel ; idem pour la surélévation des jambes Si des thérapeutiques antithrombotiques artérielles (HNF, aspirine, etc) sont utilisées à dose curative en postopératoire d’une chirurgie vasculaire, les médicaments anti-MTEV ne doivent pas être surajoutés (risque hémorragique) HBPM : héparine de bas poids moléculaire ; HNF : héparine non fractionnée. 7 Médicaments antithrombotiques en chirurgie vasculaire 43-022 Techniques chirurgicales Tableau V. – Antithrombotiques utilisables en fonction du site opératoire ou de la technique chirurgicale utilisée. Site ou type chirurgical Phase périopératoire Thérapeutique au long cours Aorte Héparine pendant le clampage Aspirine (diminue la morbidité cardiovasculaire) Fogarty, thromboaspiration : ischémie aiguë, subaiguë Symptômes (< 2 semaines) Symptômes (> 2 semaines) Thrombolytique seul Chirurgie ± thrombolytique + héparine Identique aux pontages périphériques Identique aux pontages périphériques Pontage périphérique : - greffon veineux - prothèse synthétique Héparine pendant le clampage Héparine pendant le clampage AVK inutiles (sauf pontage fémoropoplité) AVK et/ou aspirine et/ou dipyridamole Endartériectomie carotidienne Héparine pendant le clampage + aspirine Aspirine Angioplastie Héparine Aspirine ou aspirine + ticlopidine AVK : antivitamine K. Notions essentielles en dix points. – Les antithrombotiques (sauf l’héparine) interviennent sur l’hémostase primaire en bloquant soit l’adhésion ou soit l’agrégation plaquettaire, l’héparine agit sur la coagulation. – Une altération de l’endothélium vasculaire est souvent à l’origine de la thrombose. – La chirurgie est un des mécanismes inducteurs de thrombose par traumatisme (clampage vasculaire, ischémie sur la zone opératoire et en aval du clampage) et réaction inflammatoire in situ. – En chirurgie aortique, les HBPM ont une meilleure stabilité pharmacocinétique que les HNF. – Dans l’ischémie aiguë des membres inférieurs, la technique de revascularisation est fonction du début d’apparition des symptômes. Moins de 15 jours de symptômes, les résultats à long terme sont meilleurs avec la fibrinolyse alors que pour des symptômes plus anciens, seule la revascularisation chirurgicale a une plus faible morbidité. – Les HBPM préviennent mieux la thrombose que l’HNF pour les pontages fémoraux. – L’échec de l’utilisation des AVK en postopératoire est souvent lié à la mauvaise compliance des patients au traitement. – L’aspirine administrée à faible dose avant et après une endartériectomie carotidienne diminue les complications de morbidité et de mortalité dans l’infarctus du myocarde et les accidents vasculaires cérébraux. L’aspirine au long cours n’offre pas de bénéfice en termes de resténose. – L’aspirine n’offre pas de bénéfice en cas de sténose carotidienne asymptomatique non opérée. – Actuellement, aucun bénéfice n’est lié à un traitement antithrombotique pour l’angioplastie percutanée transluminale non coronarienne. formellement l’anesthésie médullaire en cas d’anomalie de l’hémostase. L’aspirine doit être arrêtée 10 jours avant l’intervention, les AINS en moyenne 48 heures (si le patient ne doit pas arrêter son aspirine, un relais par flurbiprofène peut être envisagé que l’on arrête 24 heures avant l’intervention), pour les HBPM, maintenir un délai de 24 heures entre la dernière injection et l’anesthésie, attendre un délai de 4 heures après le retrait du cathéter de péridurale avant de reprendre l’héparine. Pas d’ALR si un INR sous AVK est supérieur à 2 ou dans les 24 heures d’une fibrinolyse, dans ces deux cas précis et en cas d’urgence chirurgicale ne permettant pas une anesthésie générale, il faut apporter des facteurs de coagulation ou du fibrinogène pour pouvoir effectuer une ALR médullaire. L’autre type d’ALR correspond aux blocs nerveux. Généralement, les blocs très superficiels ne perforant pas les vaisseaux ne présentent pas de réel danger (dans l’hypothèse d’un hématome, celui-ci est rarement compressif). En ce qui concerne les blocs plus profonds qui traversent la masse musculaire (exemple : le bloc sciatique), ceux-ci s’apparentent aux mêmes dangers que les injections intramusculaires en ce qui concerne la survenue d’un hématome. Dans ce cas, les précautions concernant les antithrombotiques doivent être identiques à celles concernant les ALR médullaires. 8 Reste le cas particulier des blocs en regard du site opératoire (exemple : le bloc cervical, cf supra), ceux-ci ne posent aucun problème en termes d’hématome compressif, et le bloc cervical en particulier n’a jamais démontré de risque hémorragique supérieur par rapport à l’anesthésie générale. Conclusion Globalement la chirurgie vasculaire peut se limiter à l’utilisation de deux ou trois antithrombotiques pour les techniques chirurgicales les plus courantes (tableau V). L’héparine reste la molécule à utiliser dans la période périopératoire avec une préférence pour les HBPM plutôt que l’HNF. Dans le cas des pontages prothétiques, l’aspirine prévient efficacement la thrombose. Ceci n’est pas formellement démontré pour les greffons veineux. Dans tous les cas, l’aspirine utilisée en chirurgie vasculaire diminue le risque d’accident vasculaire cérébral ischémique et les complications morbides et mortelles de l’infarctus du myocarde, sans que le risque hémorragique soit plus élevé. Techniques chirurgicales Médicaments antithrombotiques en chirurgie vasculaire 43-022 Références [1] Antiplatelet trialists collaboration. Collaborative overview of randomised trial of antiplatelet treatment: Part II. Maintenance of vascular graft or arterial patency by antiplatelet therapy. Br Med J 1994 ; 308 : 159-168 [2] Arfvidsson B, Lundgren F, Drott C, Schersten T, Lundholm K. Influence of coumarin treatment on patency and limb salvage after peripheral arterial reconstructive surgery. Am J Surg 1990 ; 159 : 556-560 [3] Barnett HJ, Eliasziw M, Meldrum HE. Drugs and surgery in the prevention of ischemic stroke. N Engl J Med 1995 ; 332 : 238-248 [4] Barradas MA, Mikhailidis DP, Epemolu O, Jeremy JY, Fonseca V, Dandona P. Comparison of the platelet proagregatory effects of conventional unfractionated heparins and a low molecular weight heparin fraction (CY 222) Br J Haematol 1987 ; 67 ; 451-457 [5] Becquemin JP. Effect of ticlopidine on the long-term patency of saphenous vein bypass grafts in the legs. N Engl J Med 1997 ; 337 : 1725-1731 [6] Block PC, Myler RK, Stertzer S, Fallon JT. Morphology after transluminal angioplasty in human beings. N Engl J Med 1981 ; 305 : 382-385 [7] Bomberger RA, Depalma RJ, Ambrose TA, Manado P. Aspirin and dipyridamole inhibit endothelial healing. Arch Surg 1982 ; 117 : 1459-1464 [8] Brutus. Essai clinique d’un agent anti-agrégant plaquettaire, le Cebutid 50 dans la prévention des rethromboses post-opératoires en chirurgie vasculaire. Comptes rendus Thér 1986 ; 39 : 4-9 [9] CAPRIE steering committee. A randomized, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events. Lancet 1996 ; 348 : 1329-1339 [10] CAPTURE investigators. Randomized placebo-controlled trial of abciximab before and during coronary intervention in refractory unstable angina. Lancet 1997, 349 ; 1429-1435 [11] Clagett GP, Rich NM, McDonald PT, Salander JM, Youkey JR, Olson DW. Etiologic factors for recurrent carotid artery stenosis. Surgery 1983 ; 93 : 313-318 [12] Clowes AW, Karnovsky MJ. Failure of certain antiplatelet drugs to affect myointimal thickening following arterial injury. Lab Invest 1997 ; 36 : 452-458 [13] Clyne CA, Archer TJ, Atuhaire LK, Chant AD, Webster JH. Random control trial of short course of aspirin and dipyridamole (Persantinet) for femoro-distal grafts. Br J Surg 1987 ; 74 : 245-248 [14] Comité scientifique thrombose de l’AP-HP. Prophylaxie des thromboses veineuses postopératoires : recommandations de l’Assistance Publique-Hôpitaux de Paris. Sang Thromb Vaiss 1995 ; 7 : 119-129 [15] Cossman D, Callow AD, Stein A, Matsumoto G. Early restenosis after carotid endarteriectomy. Arch Surg 1978 ; 113 : 275-278 [16] Coté R, Battista RN, Abrahamowicz M, Langlois Y, Bourque F, Mackey A. Lack of effect of aspirin in asymptomatic patients with carotid bruits and substantial carotid narrowing. Ann Inten Med 1995 ; 123 : 649-655 [17] Dawson I, Van Bockel JH, Ferrari MD, Van der Meer FJ, Brand R, Terpstr JL et al. Ischemic and hemorrhagic stroke in patients on oral anticoagulants after reconstruction for chronic lower limb ischemia. Stroke 1993 ; 24 : 1655-1663 [18] Dorman BH, Elliott BM, Spinale FG, Bailey MK, Walton JS, Robison JG et al. Protamine use during peripheral vascular surgery : a prospective randomized trial. J Vas Surg 1995 ; 22 : 248-255 [19] Dotter CT, Rosch J, Seaman AJ. Selective clot lysis with lowdose streptokinase. Radiology 1974 ; 111 : 31-37 [20] Eickhoff JH, Buchardt Hansen HJ, Bromme A, Ericsson BF, Kordt KT, Mouritzen C, et al. A randomized clinical trial of PTFE versus human umbilical vein for femoropopliteal bypass surgery: preliminary results. Br J Surg 1983 ; 70 : 85-88 [21] Fields WS, Lemak NA, Frankowski RF, Hardy RJ. Controlled trial of aspirin in cerebral ischemia: Part II. Surgical group. Stroke 1978 ; 9 : 309-319 [22] Findlay JM, Lougheed WM, Gentili F, Walker PM, Glyun MF, Honle S et al. Effect of perioperative platelet inhibition on postcarotid endarterectomy mural thrombus formation. Results of a prospective randomized controlled trial using aspirin on a dipyridamole in human. J Neurosurg 1985 ; 63 : 693-698 [23] Fitzgerald GA. Dipyridamole. N Engl J Med 1987 ; 316 : 1247-1257 [24] Fitzgerald GA, Patrono C. Antiplatelet drugs. In : Verstraete M, Fuster V, Topol E eds. Cardiovascular thrombosisthrombocardiology, thromboneurology. Philadelphia : Lippincott-Raven Press, 1998 : 121-139 [25] Fuster V, Chesebro JH. Role of platelets and platelets inhibitors in aortocoronary artery vein-graft disease. Circulation 1986 ; 73 : 227-232 [26] Guyatt GH, Cook DJ, Sackett DL, Eckman M, Pauker S. Grades of recommandation for antithrombotic agents. Chest 1998 ; 114 (suppl 5) : 441S-444S [27] Harker LA, Bernstein EF, Dilley RB, Scala TE, Sise MJ, Hye RJ. Failure of aspirin plus dipyridamole to prevent restenosis after carotid endarterectomy. Ann Intern Med 1992 ; 116 : 731-736 [28] Ito MK, Smith AR, Lee ML. Ticlopidine: a new platelet aggregation inhibitor. Clin Pharm 1992 ; 11 : 603-617 [29] Jackson MR, Clagett GP. Antithrombotic therapy in peripheral arterial occlusive disease. Chest 1998 ; 114 (suppl 5) : 666S-682S [30] Johnson WC, Blebea J, Cantelmo NL et al. Does oral anticoagulation improve patency of vein bypasses? A prospective randomized study. In : 51th annual congress of the society for vascular surgery, Boston, 1st and 2nd june 1997 [31] Kohler TR, Kaufman JL, Kacoyanis G, Clowes A, Donaldson MC, Kelly E et al. Effect of aspirin and dipyridamole on the patency of lower extremity bypass grafts. Surgery 1984 ; 96 : 462-466 [32] Kretschmer GJ, Holzenbein T. The role of anticoagulation in infrainguinal bypass surgery. In : Yao JS, Pearce WH eds. The ischemic extremity. Advance in treatment. East Norwalk : Appleton and Lange, 1995 : 447-454. [33] Kroneman H, Eikelboom BC, Knot EA, De Smit P, Groenland TH, De Maat MP et al. Pharmacokinetics of lowmoleculer-weight heparin and unfractionated heparin during elective aortobifemoral bypassgrafting. J Vasc Surg 1991 ; 14 : 208-214 [34] Kunkel JM, Gomez ER, Spebar MJ, Delgado RJ, Jarstfer BS, Collins GJ. Wound hematomas after carotid endarteriectomy. Am J Surg 1984 ; 148 : 844-847 [35] Lindblad B, Persson NH, Takolander R, Bergqvist D. Does low-dose acetylsalicylic acid prevent stroke after carotid surgery? A double-blind, placebo controlled randomized trial. Stroke 1993 ; 24 : 1125-1128 [36] McCollum C, Alexander C, Kenchington G, Franck PJ, Greenhalgh RM. Antiplatelet drugs in femoropopliteal vein bypasses: a multicenter trial. J Vasc Surg 1991 ; 13 : 150-162 [37] McCollum C, Kenchington G, Alexander C, Franks PJ, Greenhalgh RM. PTFE or HUV for femoro-popliteal bypass: a multicenter trial. Eur J Vasc Surg 1991 ; 5 : 435-443 [38] Melissari E, Stringer MD, Kakkar VV. The effect of a bolus of unfractionated or low molecular weight heparin during aortobifemoral bypass grafting. Eur J Vasc Surg 1989 ; 3 : 121-126 [39] Minar E, Ahmadi A, Koppensteiner R, Maca T, Stumpflen A, Ugurluoglu A et al. Comparison of effects of high-dose and low-dose aspirin on restenosis after femoropopliteal percutaneous transluminal angioplasty. Circulation 1995 ; 91 : 2167-2173 [40] Mueller MR, Salat A, Stangl P, Murabito M, Pulaki S, Boehm D et al. Variable platelet response to low-dose ASA and the risk of limb deterioration in patients submitted to peripheral arterial angioplasty. Thromb Haemost 1997 ; 78 : 1003-1007 [41] Poisik A, Heyer EJ, Solomon RA, Quest DO, Adams DC, Baldasserini CM et al. Safety and efficacity of fixed-dose heparin in carotid endarterectomy. Neurosurgery 1999 ; 45 : 434-441 [42] Pumphrey CW, Chesebro JH, Dewanjee MK, Wahner HW, Hollier LH, Pairolero PC. In vivo quantification of platelet deposition on human peripheral arterial bypass grafts using indium 111 labeled platelets: effect of dipyridamole and aspirine. Am J Cardiol 1983 ; 51 : 796-801 [43] Quigley FG, Jamieson GG, Lloyd JV, Faris IB. Monitoring heparin in vascular surgery. J Vasc Surg 1988 ; 8 : 125-127 [44] Rosenberg RD, Bauer KA. The heparin-antithrombin system: a natural anticoagulant mechanism. In : Colman RW, Hirsh J, Marder VJ eds. Hemostasis and thrombosis: basic principles and clinical practice. Philadelphia : JB Lippincott, 1992 : 837-860 [45] Samama CM, Gigou F, Ill P. Low molecular weight heparin vs unfractionated heparin in femorodistal reconstructive surgery: a multicenter open randomized study. Ann Vasc Surg 1995 ; 9 (suppl) : S45-S53 [46] Smith WL, Garavito RM, Dewitt DL. Prostaglandin endoperoxide H synthases (cyclooxygenase) -1 and -2. J Biol Chem 1996 ; 271 : 33157-33160 [47] STILE investigators. Results of a prospective randomized trial evaluating surgery versus thrombolysis for ischemia of the lower extremity. Ann Surg 1994 ; 220 : 251-268 [48] Stratton JR, Zierler E, Kazmers A. Platelet deposition at carotid endarteriectomy sites in humans. Stroke 1987 ; 18 : 722-727 [49] Taylor DW, Barnett HJ, Haynes RB, Ferguson GG, Sackett DL, Thorpe KE et al. Low-dose and high-dose acetylsalicylic acid for patients undergoing carotid endarterectomy: a randomized controlled trial. Lancet 1999 ; 353 : 2179-2184 [50] Thompson JF, Mullee MA, Bell PR, Campbell WB, Chant AD, Darke SG et al. Intraoperative heparinisation, blood loss and myocardial infarction during aortic aneurysm surgery: a joint vascular research group study. Eur J Vasc Endovasc Surg 1996 ; 12 : 86-90 [51] Veith FJ, Gupta SK, Ascer E, White-Flores S, Samson RH, Scher LA et al. Six years prospective multicenter randomized comparison of autologous saphenous vein and expanded polytetrafluoroethylene grafts in infrainguinal arterial reconstructions. J Vasc Surg 1986 ; 3 : 104-113 [52] Wakefield TW, Shulkin BL, Fellow EP, Petry NA, Splauding SA, Stanley JC. Platelet reactivity in human aortic grafts: a prospective, randomized midterm study of platelet adherence and release products in Dacront and polytetrafluoroethylene conduits. J Vasc Surg 1989 ; 9 : 234-243 [53] Wilentz JR, Sanborn TA, Haudenschild CC, Valeri CR, Ryan TJ, Faxon DP. Platelet accumulation in experimental angioplasty: time course and relation to vascular injury. Circulation 1987 ; 75 : 636-642 [54] Wilson NV, Melissari E, Standfield NJ, Kakkar VV. Intraoperative antithrombotique therapy with low molecular weight heparin in aortic surgery. How should heparin be administered? Eur J Vasc Surg 1991 ; 5 : 565-569 9 Encyclopédie Médico-Chirurgicale 43-028-A 43-028-A Chirurgie des anévrysmes artériels des membres (I) JB Ricco C Camiade P Patra P Plagnol Résumé. – Les anévrysmes artériels des membres sont moins fréquents que les anévrysmes aortiques, mais ils représentent quand même 18 % des anévrysmes artériels. À côté de l’étiologie dégénérative habituelle, il existe de nombreuses autres étiologies, en particulier traumatiques et iatrogènes, à l’origine de faux anévrysmes survenant après cathétérisme artériel. Les anévrysmes infectieux seront traités à part, qu’ils soient de faux ou de vrais anévrysmes infectés. Tous les anévrysmes peuvent entraîner des complications graves et en particulier la perte du membre par accident embolique. Nous avons revu dans cet article les différentes étiologies et les différentes techniques chirurgicales. Nous avons précisé les différentes indications en fonction de la localisation de l’anévrysme et de son étiologie. © 2000 Editions Scientifiques et Médicales Elsevier SAS. Tous droits réservés. Introduction Les anévrysmes artériels périphériques ont une topographie et une étiologie très variables. Un anévrysme se définit comme une perte du parallélisme des parois artérielles, localisée à un segment artériel, et correspondant à une augmentation de 50 % du diamètre artériel normal. Une artériomégalie se définit comme une dilatation artérielle diffuse, sans perte du parallélisme des parois. Ce travail a pour but de préciser les caractéristiques cliniques et les traitements appropriés pour chaque localisation et pour chaque étiologie. Les anévrysmes fémoraux et poplités sont les plus fréquents, ils sont le plus souvent dégénératifs et s’observent avant tout chez l’homme. À l’opposé, les anévrysmes des artères sousclavières sont le plus souvent dus à une compression artérielle dans le défilé costoclaviculaire. À côté de ces anévrysmes fréquents, il existe deux causes rares d’anévrysme artériel périphérique : ceux survenant sur l’artère sous-clavière droite rétro-œsophagienne et ceux survenant sur l’artère sciatique persistante. Bien que les lésions artérielles des vascularites et de la maladie de Behçet soient le plus souvent de type occlusif, les artères de ces malades peuvent aussi évoluer vers une pathologie anévrysmale ; il en va de même pour les dysplasies artérielles. À côté de ces anévrysmes vrais, il existe de faux anévrysmes sans paroi propre dont l’étiologie est variable : faux anévrysmes posttraumatiques, faux anévrysmes anastomotiques fémoraux, enfin anévrysmes infectieux, qui représentent une entité à part et dont le traitement a été modifié par l’utilisation des allogreffes artérielles cryocongelées in situ. Jean-Baptiste Ricco : Professeur des Universités, praticien hospitalier, chef de service. Christophe Camiade : Interne des Hôpitaux. Service de chirurgie vasculaire, hôpital Jean-Bernard, centre hospitalier universitaire, 86021 Poitiers cedex, France. Philippe Patra : Professeur des Universités, praticien hospitalier, chef de service, service de chirurgie vasculaire, hôpital Guillaume et René Laennec, centre hospitalier universitaire, 44035 Nantes cedex, France. Philippe Plagnol : Professeur des Universités, praticien hospitalier, chef de service, service de chirurgie vasculaire, centre hospitalier général Pasteur, rue Paul-Langevin, 33212 Langon cedex, France. Ce chapitre technique est donc très varié et ce sont tous ces aspects que nous allons décrire en choisissant, pour chacun d’entre eux, un exemple et une localisation appropriés. Étiologies Les anévrysmes artériels des membres sont essentiellement dégénératifs. ANÉVRYSMES DÉGÉNÉRATIFS Ils sont les plus fréquents, le plus souvent limités à une zone anatomique (poplitée, fémorale superficielle, sous-clavière). Ils sont quelquefois multiples et étendus à plusieurs segments anatomiques contigus des membres ou situés à distance les uns des autres. L’association à des lésions occlusives athéromateuses, notamment carotidiennes et coronariennes, est fréquente. AUTRES ÉTIOLOGIES Les anévrysmes infectieux sont en général consécutifs à une greffe bactérienne au niveau d’une lésion artérielle athéromateuse préexistante. Ils réalisent des ruptures artérielles responsables d’anévrysmes sacciformes. Les faux anévrysmes sont des entités particulières. Il s’agit d’anévrysmes sacciformes sans paroi propre dont l’étiologie est le plus souvent iatrogène. L’exemple le plus simple étant la ponction artérielle fémorale qui aboutit, par défaut d’hémostase, à la création d’un hématome périartériel qui s’organise avec une coque fibreuse, le faux anévrysme étant alimenté par l’orifice de ponction resté perméable. Ces faux anévrysmes peuvent aussi se développer au niveau des anastomoses fémorales des pontages aortiques. Leur risque de rupture est important car ils communiquent à plein canal avec la lumière artérielle. Enfin, il existe des anévrysmes plus rares dus à des traumatismes artériels répétés suite à une compression anatomique (anévrysme axillo-sous-clavier et syndrome de la Toute référence à cet article doit porter la mention : Ricco JB, Camiade C, Patra P et Plagnol P. Chirurgie des anévrysmes artériels des membres (I). Encycl Méd Chir (Editions Scientifiques et Médicales Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales - Chirurgie vasculaire, 43-028-A, 2000, 19 p. Chirurgie des anévrysmes artériels des membres (I) 43-028-A traversée thoracobrachiale, anévrysme poplité poststénotique des artères poplitées piégées) ou externe (anévrysme de l’artère cubitale au cours du syndrome du marteau hypothénar). Classification La classification des anévrysmes artériels périphériques que nous avons adoptée est anatomique. Nous allons successivement décrire : Techniques chirurgicales Tableau I. – Données concernant les anévrysmes poplités. Références Sexe (hommes-femmes) Âge moyen au moment du diagnostic Anévrysmes asymptomatiques Anévrysmes bilatéraux Association à d’autres anévrysmes Association à un AAA* 33-1 63 ans 39 % 56 % 50 % 33 % [8, 13, 99, 24] [8, 12, 14, 19, 24] [2, 14, 24] [12, 14, 24] [8, 13, 19] [2, 12, 14, 24] AAA : anévrysme de l’aorte abdominale. – les anévrysmes poplités ; – les anévrysmes fémoraux ; – les anévrysmes axillo-sous-claviers ; – les anévrysmes du membre supérieur et de la main. Pour certaines localisations, les étiologies seront décrites en raison de leur fréquence relative. Par exemple, au niveau fémoral : les faux anévrysmes et les anévrysmes infectieux. Pour chaque localisation, les modalités opératoires sont précisées en décrivant à chaque fois l’abord chirurgical et les principes du traitement. Nous préciserons aussi certaines particularités du geste technique qui peuvent varier en fonction de l’étiologie de l’anévrysme. Anévrysmes des membres inférieurs ANÉVRYSMES DÉGÉNÉRATIFS POPLITÉS Les anévrysmes poplités sont les plus fréquents des anévrysmes artériels périphériques (tableau I), 84 % d’après Dent [5] sur une série de 1 488 malades porteurs d’anévrysmes artériels périphériques. L’incidence des anévrysmes poplités bilatéraux varie entre 45 et 68 %. De plus, Vermillion [24] avait retrouvé, chez 55 % des malades ayant un anévrysme poplité, d’autres anévrysmes artériels périphériques. Les anévrysmes poplités sont souvent fusiformes et étendus de l’artère poplitée à l’artère fémorale superficielle (fig 1). Ce type d’anévrysme est souvent associé à des lésions sténosantes sus- et sous-jacentes, d’où la nécessité d’un bilan préopératoire artériographique complet (fig 2). Les anévrysmes sacculaires, plus rares, touchent préférentiellement la partie moyenne de l’artère * A 2 * B A. Dysplasie artérielle fémoropoplitée avec anévrysme fémoral superficiel. B. Pièce opératoire montrant l’anévrysme avec un thrombus mural. 1 Dysplasie artérielle fémoropoplitée avec anévrysme poplité bilatéral. 2 Techniques chirurgicales Chirurgie des anévrysmes artériels des membres (I) 3 43-028-A Anévrysme poplité sacculaire avec thrombus mural. A Échodoppler. B. Artériographie montrant l’occlusion de l’artère tibiale antérieure et de l’artère tibiale postérieure. * A * B poplitée (fig 3), leur diamètre est plus important (fig 4), mais ils sont peu étendus. ¶ Signes cliniques Quatre séries cliniques (tableau I) montrent que 39 % des patients porteurs d’un anévrysme poplité sont asymptomatiques lors du diagnostic initial. La rupture des anévrysmes poplités est rare (3 %) [24]. Le symptôme révélateur d’un anévrysme poplité pouvant être une ischémie aiguë contemporaine de l’occlusion de l’anévrysme ou de la dernière artère de jambe encore perméable, la thrombose du lit artériel jambier constitue certainement l’un des problèmes les plus difficiles à résoudre chez ces malades découverts au stade ultime d’ischémie critique ou aiguë. 4 Volumineux anévrysme poplité sacculaire comprimant les veines poplitées. Malade ayant une thrombose de la veine poplitée. ¶ Diagnostic Le diagnostic repose sur l’examen clinique qui comporte la palpation du creux poplité. L’échodoppler couleur confirme le diagnostic. Il permet de mesurer le diamètre de l’anévrysme et son extension en longueur. Il met aussi en évidence l’existence ou non d’un thrombus mural (fig 3). L’échodoppler donne aussi une idée exacte du réseau artériel d’amont et d’aval. L’artériographie est primordiale pour planifier la revascularisation et préciser l’état du lit artériel d’aval, compte tenu de la fréquence des embolies artérielles jambières. La tomodensitométrie permet de faire le diagnostic d’anévrysme poplité, mais il s’agit d’un examen peu contributif pour adapter la stratégie thérapeutique. L’imagerie par résonance magnétique peut être utile quand on suspecte un anévrysme sur une artère poplitée piégée, afin de préciser ses rapports musculoligamentaires et de localiser la compression extrinsèque. ¶ Indications chirurgicales D’après les données de la littérature [23], il semble raisonnable de recommander le traitement chirurgical pour tout anévrysme poplité symptomatique, sauf si le lit artériel jambier ne permet pas d’envisager une revascularisation. Pour les anévrysmes poplités asymptomatiques, en l’absence d’étude randomisée et épidémiologique récente, on doit décider de l’attitude à adopter en tenant compte des études cliniques chirurgicales publiées ces dernières années [1]. D’après ces données de la littérature, il semble logique de recommander le traitement chirurgical de tous les anévrysmes poplités asymptomatiques de plus de 2 cm de diamètre, surtout s’ils contiennent un thrombus et 3 Chirurgie des anévrysmes artériels des membres (I) 43-028-A 5 Exclusion-pontage. Après ligature et section des deux pôles de l’anévrysme, on restaure la continuité artérielle par un pontage saphène. Cette technique laisse l’anévrysme vascularisé par ses branches collatérales. Il est essentiel de réaliser une section complète en amont et en aval de l’anévrysme pour éviter sa recanalisation. Tableau II. – Résultats de la chirurgie des anévrysmes poplités à 5 ans. Références Occlusion des pontages en veine saphène Occlusion des pontages prothétiques Taux de sauvetage de membre chez les malades asymptomatiques Taux de sauvetage de membre chez les malades symptomatiques 20 % 55 % 98 % [19, 8, 13, 12, 24, 14, 2] 81 % [2, 8, 12, 13, 14, 19, 24] Techniques chirurgicales [2, 8, 12, 13, 14, 19, 24] [2, 8, 12, 13, 14, 19, 24] si les artères de jambe présentent des signes d’embolies périphériques. La seule condition restrictive à cette indication opératoire est de pouvoir disposer d’une veine saphène interne pour faire le pontage (tableau II). La perméabilité médiocre des pontages prothétiques sur la poplitée basse ou sur les artères de jambe ne justifie pas leur utilisation systématique pour un petit anévrysme poplité asymptomatique. ¶ Technique chirurgicale Principes généraux La technique chirurgicale doit tenir compte de l’extension de l’anévrysme, des lésions associées de l’artère fémorale superficielle et des artères de jambe. Le but de la chirurgie est d’éliminer tout risque embolique et tout risque de rupture ou de compression à partir de l’anévrysme. Les anévrysmes fusiformes, souvent étendus jusqu’au tiers inférieur de l’artère fémorale superficielle, mais de petit diamètre, ne compriment pas les structures de voisinage et peuvent être traités par simple exclusion bipolaire avec sectionsuture de chaque extrémité artérielle et pontage autogène (fig 5). À l’inverse, les anévrysmes sacculaires de gros diamètre compriment les structures de voisinage et ont un potentiel évolutif local. Ils doivent être traités par mise à plat (endoanévrismorraphie oblitérante), associée à un pontage autogène (fig 6). " A1 La résection de l’anévrysme n’est pas recommandée, sauf si l’anévrysme est de petite taille et non adhérent. Le danger de cette technique est la plaie de la veine poplitée, voire des nerfs périphériques, ces éléments étant étalés sur la poche anévrysmale (fig 7). " A2 " B1 " B2 6 4 Mise à plat-pontage de l’anévrysme poplité. A. Ouverture de l’anévrysme (A1), hémostase des collatérales par suture endoanévrysmale et revascularisation à l’aide d’une greffe veineuse inversée. B. Anévrysme poplité avec des lésions artérielles associées d’amont ou d’aval. On réalise selon la topographie des lésions une revascularisation par un pontage sa- phène inversé implanté en terminal par voie endoanévrysmale et en latéral sur l’artère jambière perméable (B1). Exclusion de l’anévrysme. Dysplasie artérielle d’amont : anastomose proximale latérale, exclusion de l’anévrysme et anastomose distale terminale endoanévrysmale (B2). Chirurgie des anévrysmes artériels des membres (I) Techniques chirurgicales 43-028-A * A * A * B 7 Résection-pontage. Le risque de cette technique est la plaie veineuse ou nerveuse de voisinage. Cette technique n’est indiquée que pour les petits anévrysmes poplités. A. La section première d’un des pôles de l’anévrysme permet de le mobiliser et facilite sa dissection. B. La restauration artérielle est effectuée dans un deuxième temps par interposition d’une courte greffe veineuse inversée. * B Le choix du greffon est simple. La veine grande saphène représente le meilleur matériel pour les pontages artériels périphériques. Deux possibilités sont offertes à l’opérateur : – soit le greffon saphène est inversé et transposé. Cette technique est bien adaptée au traitement des anévrysmes poplités ; – soit on a recours à une greffe veineuse in situ qui est plus adaptée aux longs pontages pour des lésions étendues dysplasiques ou athéromateuses associées (fig 8). En l’absence de veine grande saphène, on peut utiliser la veine petite saphène ou une veine superficielle des membres supérieurs, mais leur longueur et leur diamètre sont rarement suffisants et leur perméabilité semble être inférieure à celle observée avec les veines grandes saphènes. On peut aussi utiliser une homogreffe artérielle cryocongelée qui semble donner des résultats acceptables à moyen terme. Enfin, on peut utiliser une prothèse synthétique en polyester ou en polytétrafluoroéthylène expansé (PTFE). En l’absence de matériel autogène utilisable, il faut savoir rediscuter l’indication opératoire en fonction de la symptomatologie, du diamètre de l’anévrysme et de l’état des artères de jambe, le pronostic d’un pontage fémoropoplité bas prothétique n’étant pas obligatoirement plus favorable que celui d’un petit anévrysme poplité asymptomatique. * C Voies d’abord Deux voies d’abord sont utilisées pour le traitement des anévrysmes poplités dégénératifs. La voie interne est la plus utilisée, la voie postérieure a des indications plus limitées. • Voie interne Le patient est installé en décubitus dorsal, le membre inférieur en abduction, genou fléchi. L’opérateur est placé du côté opposé au membre opéré, l’aide est placé en face de l’opérateur. L’installation du membre dans un jersey stérile fendu et maintenu par un champ * D 8 Techniques de prélèvement de la veine saphène. A, B, C. Incisions discontinues. D. Incision continue. 5 43-028-A Chirurgie des anévrysmes artériels des membres (I) transparent collant permet d’aborder la région fémorale au triangle de Scarpa, la région fémoropoplitée et tout le trajet de la veine grande saphène qui a été repéré. Si la veine grande saphène homolatérale ne semble pas être utilisable pour le pontage, les deux membres inférieurs sont mis dans le champ opératoire pour prélever éventuellement la veine Techniques chirurgicales grande saphène La voie d’abord latérale nécessite deux incisions : une supra- et une infragéniculée. Dans certains cas, ces deux incisions peuvent être continues (fig 9). 9 6 controlatérale. " A1 " A2 " A3 " A4 " B1 " B2 " B3 " B4 Abord de l’artère poplitée. A. Incision cutanée de l’abord poplité haut (A1). Dissection sous-cutanée et isolement de la veine grande saphène (A2). Incision de la gaine du couturier (A3). Incision de l’aponévrose jambière, de la gaine du demitendineux, puis du droit interne (A4). B. Incision de découverte de l’artère poplitée haute (B1). L’aponévrose fémorale est incisée, découvrant le muscle sartorius, récliné ou arriéré par un écarteur autostatique (B2). L’artère grande anastomotique, le nerf saphène interne sont repérés au sortir de l’aponévrose de Hunter (B3). La section du tendon du troisième adducteur expose l’artère poplitée et la jonction fémoropoplitée (B4). Techniques chirurgicales Chirurgie des anévrysmes artériels des membres (I) " C1 43-028-A " C2 " C3 9 " C4 (suite) C. Artère poplitée basse. Un écarteur de Beckman prend appui sur le jumeau interne en arrière et expose l’artère poplitée basse. En cas d’anévrysme bas situé, il est nécessaire d’inciser l’arcade du soléaire pour exposer le tronc tibiopéronier. En combinant les deux voies supra- et infragéniculées, on réalise un abord complet de l’artère poplitée haute et basse. L’artère poplitée moyenne ne peut être abordée directement que si l’on sectionne l’insertion du muscle jumeau interne. D. Détail de l’abord du tronc tibiopéronier par incision de l’arcade du soléaire. " C5 * D 7 Chirurgie des anévrysmes artériels des membres (I) 43-028-A – Abord supragéniculé : l’incision cutanée débute à la jonction du tiers moyen et du tiers inférieur de la cuisse, en avant du muscle sartorius, et se termine 2 cm en arrière du condyle fémoral médial. La veine grande saphène doit être repérée et disséquée sur toute la hauteur de l’incision, puis protégée par une compresse imprégnée de sérum. La veine grande saphène ne sera prélevée qu’après avoir terminé la dissection de l’anévrysme et choisi les sites d’anastomoses du pontage. L’aponévrose fémorale est incisée, découvrant le muscle sartorius qui est récliné en arrière avec les tendons du muscle demitendineux par un écarteur autostatique de type Beckman, créant un espace limité en haut par le muscle grand adducteur (fig 9A). L’aponévrose de Hunter et l’anneau du grand adducteur sont ensuite sectionnés pour exposer la jonction fémoropoplitée (fig 9B). L’artère poplitée est entourée d’un réseau veineux très adhérent. Il faut, dans la mesure du possible, respecter à ce niveau le nerf saphène interne et l’artère descendante du genou (grande anastomotique) qui est repérée à son émergence de l’aponévrose de Hunter. – Abord infragéniculé : l’incision cutanée débute 1 cm en arrière de la saillie du condyle fémoral médial. Elle est légèrement arciforme et se poursuit 2 cm en arrière du bord postérieur du tibia (fig 9C). Elle correspond au trajet de la veine grande saphène qui est disséquée et protégée. L’incision de l’aponévrose jambière remonte au bord postérieur du sartorius. Pour voir correctement l’artère poplitée basse, il faut remonter jusqu’aux tendons des muscles demitendineux et droit interne dont les gaines aponévrotiques sont incisées. Un écarteur de Beckman, prenant appui en arrière sur le muscle jumeau interne et en avant sur le bord postérieur du tibia, * A 10 * B 8 Techniques chirurgicales met en évidence le paquet vasculonerveux. L’artère poplitée est accompagnée par deux veines poplitées, l’une antéroexterne, l’autre postéro-interne qui recouvre l’artère lors de son abord. En cas d’anévrysme bas situé, il est nécessaire de disséquer le tronc tibiopéronier, après section de l’arcade du muscle soléaire (fig 9D). Dans le cas d’anévrysmes volumineux, il peut être nécessaire de désinsérer les tendons de la patte d’oie sans section musculaire afin de contrôler l’anévrysme. Cet artifice technique permet de garder un plan périosté solidaire qui est réinséré en fin d’intervention par des agrafes fixées au tibia. Cette voie d’abord interne a des avantages, car elle permet d’aborder tout l’axe artériel du membre inférieur et de prélever sans problème la veine grande saphène. Elle a aussi des inconvénients, car il est parfois nécessaire de sectionner les tendons de la patte d’oie pour avoir un contrôle satisfaisant. En tout état de cause, l’abord de l’artère poplitée moyenne rétroarticulaire demeure difficile, à moins de sectionner l’insertion du muscle jumeau interne, au prix de séquelles fonctionnelles importantes. • Voie postérieure Le malade est installé en décubitus ventral. L’incision est faite en « baïonnette », avec un court segment horizontal au niveau du pli de flexion du genou (fig 10A). La partie supérieure, longue de 8 à 10 cm, est décalée en dedans et longe le relief externe du muscle demi-membraneux. La partie inférieure est légèrement externe et s’infléchit en dedans. Après incision de l’aponévrose superficielle, la veine petite saphène et son nerf satellite sont refoulés latéralement. * C * D Voie d’abord poplitée postérieure avec incision en « baïonnette ». A, B. Après incision de l’aponévrose superficielle, la veine saphène externe et son nerf satellite sont refoulés latéralement. C. L’anévrysme poplité est exposé en écartant latéralement les deux muscles jumeaux. D. Cette voie rend difficile l’extension vers l’artère fémorale superficielle et le prélèvement de la saphène interne. Techniques chirurgicales Chirurgie des anévrysmes artériels des membres (I) La veine petite saphène sert de repère pour gagner la veine poplitée. Elle peut servir de greffon autogène si sa longueur et son diamètre sont suffisants. L’artère poplitée moyenne est alors exposée en écartant, en dedans et de haut en bas, le muscle demi-membraneux et le muscle jumeau interne, puis, en dehors et de haut en bas, le muscle long biceps et le muscle jumeau externe (fig 10C). Les avantages de cette voie d’abord sont l’absence de section musculotendineuse et l’exploration aisée de l’artère poplitée moyenne rétroarticulaire. Les inconvénients de cette voie d’abord sont la difficulté de réaliser un prélèvement de la veine grande saphène et de poursuivre la dissection vers l’artère fémorale superficielle (fig 10D). Cette voie d’abord est indiquée dans les petits anévrysmes survenant sur des artères poplitées piégées. Traitement de l’anévrysme • Mise à plat-pontage Elle consiste à réaliser par voie endoanévrysmale l’oblitération des collatérales partant de la poche. Il s’agit d’une technique sûre car elle limite au minimum la dissection de l’anévrysme (fig 6). Elle comporte l’abord de l’artère fémorale superficielle en amont et son contrôle, puis l’abord de l’artère poplitée basse ou du trépied jambier selon l’extension de l’anévrysme. Le malade est alors hépariné (0,5 mg/kg) et l’anévrysme est clampé, puis ouvert. Le thrombus mural est enlevé et l’hémostase des collatérales est faite par des points de fil non résorbable (Prolènet). En cas de reflux important, une hémostase temporaire des collatérales peut être réalisée à l’aide de sondes à ballonnet occlusives, mais cela est rarement nécessaire au niveau poplité. Si l’anévrysme est peu étendu, on peut réaliser la totalité du geste par voie endoanévrysmale en anastomosant la veine grande saphène inversée en terminoterminal à chaque extrémité de l’anévrysme poplité. Cette anastomose endosacculaire est souvent facile à réaliser. Elle évite toute dissection inutile. Elle ne peut être réalisée que si l’axe artériel d’amont et d’aval est relativement sain. En cas de lésions artérielles d’amont ou d’aval, la mise à plat de l’anévrysme est associée à une revascularisation exosacculaire, sur une artère saine disséquée à distance de l’anévrysme (fig 6). • Exclusion-pontage Elle associe l’exclusion de l’anévrysme et la revascularisation artérielle par un pontage (fig 5). Il s’agit d’un traitement « à distance de l’anévrysme ». Cette méthode a des avantages : elle est simple, rapide ; mais elle a un inconvénient majeur : elle laisse l’anévrysme revascularisé par ses collatérales, d’où risque de croissance de l’anévrysme et de rupture. Cette méthode peut être utilisée pour les anévrysmes poplités de petit diamètre qui ont essentiellement un risque embolique. Elle n’est pas recommandée pour les anévrysmes dont le volume est important. De plus, l’anévrysme restant en place, son volume rend difficile le passage du greffon en position anatomique et conduit à réaliser un trajet sous-cutané par tunnellisation. • Résection-pontage Elle comporte l’exérèse de l’anévrysme et la restauration artérielle par un pontage autogène (fig 7). Cette technique classique est cependant dangereuse car la dissection de l’anévrysme expose à une blessure des éléments de voisinage qui sont le plus souvent comprimés et étalés sur la paroi de l’anévrysme poplité. La résection-pontage peut être réalisée pour les petits anévrysmes sacculaires et les anévrysmes infectieux. • Résultats du traitement chirurgical Les résultats du traitement chirurgical des anévrysmes poplités asymptomatiques sont excellents avec une perméabilité à 5 ans de 80 % et un taux de sauvetage de membre de 98 %. À l’opposé, les malades opérés pour un anévrysme symptomatique ont un taux 43-028-A 11 Anévrysme poplité fissuré. Traitement par stent-graft poplité. Image de fissuration anévrysmale injectée par le produit de contraste. d’amputation de 19 %, un taux de mortalité de 5 % et une perméabilité à 5 ans de 65 % [10]. • Endoprothèses couvertes Dans certains cas, chez des sujets en très mauvais état général, inopérables ou ayant une espérance de vie limitée, on peut mettre en place des endoprothèses couvertes. Celles-ci permettent de conserver, sous anesthésie locale, le membre inférieur, à condition d’avoir un lit d’aval jambier suffisant. Cette méthode de sauvetage a permis de passer un cap chez des malades inopérables qui faisaient des embolies distales récidivantes ou qui avaient une fissuration de l’anévrysme poplité (fig 11). Il faut discuter ces indications en fonction de la localisation de l’anévrysme poplité. La mise en place d’une endoprothèse sur l’artère poplitée haute sans plicature au pli de flexion est possible. Elle est discutable sur la poplitée moyenne au niveau de l’interligne articulaire. Il n’y a pas actuellement de recul suffisant pour l’appréciation de cette technique. TRAITEMENT DES ANÉVRYSMES POPLITÉS COMPLIQUÉS ¶ Rupture Le traitement des ruptures nécessite un contrôle d’amont rapide et un clampage. Ce contrôle est facile pour les anévrysmes poplités. L’hémostase d’aval peut être assurée par des ballonnets occlusifs. Le reste du traitement chirurgical est inchangé. Dans ce contexte, l’infection de l’anévrysme doit être évoquée et fait discuter comme premier choix une résection avec prélèvement bactériologique et anatomopathologique, puis une mise à plat associée à une revascularisation par une greffe veineuse autologue. À défaut, une allogreffe artérielle cryocongelée est préférable aux matériaux prothétiques. ¶ Thrombose aiguë Comme pour toute oblitération artérielle aiguë, le délai écoulé entre la survenue de l’oblitération artérielle et la restauration du flux artériel est capital. Les moyens thérapeutiques sont pharmacologiques et chirurgicaux. Dès l’évocation du diagnostic, l’héparine intraveineuse doit être débutée à doses efficaces pour éviter l’extension de la thrombose. Les fibrinolytiques peuvent être employés par voie intra-artérielle in situ à l’aide d’un cathéter multiperforé introduit par voie percutanée au niveau de l’artère fémorale, et dont l’extrémité est mise en place dans l’anévrysme. Cette fibrinolyse est contrôlée par des artériographies répétées toutes les 6 heures et par le dosage de la fibrine. Les résultats de la fibrinolyse semblent être satisfaisants pour de nombreux auteurs [10], avec une récupération partielle ou totale du lit d’aval, des séquelles moindres et une meilleure perméabilité de la revascularisation artérielle. Ces résultats favorables n’ont pas été confirmés par l’étude randomisée STILE [25]. La durée de la fibrinolyse étant en moyenne de 12 heures, cette méthode ne peut pas être réalisée pour les ischémies aiguës où l’on ne dispose que de 9 43-028-A Chirurgie des anévrysmes artériels des membres (I) * A Techniques chirurgicales * B 12 A. Anévrysme poplité thrombosé à partir du Hunter. B. Récupération progressive d’un lit d’aval après fibrinolyse locale (rt-PA [recombinant tissue plasminogen activator]). C. Revascularisation par un pontage fémoropoplité bas réalisée 90 min après le début de la fibrinolyse locale. * C quelques heures pour réussir une revascularisation distale. Pour notre part, nous préconisons chez ces malades en ischémie aiguë une attitude intermédiaire, avec un abord chirurgical premier de la poplitée basse et du trépied jambier en aval de l’anévrysme (fig 12). La réalisation d’une artériographie directe est suivie, si nécessaire, d’une thrombolyse du lit d’aval par rt-PA (recombinant tissue plasminogen activator) ou urokinase. Cette méthode a l’avantage de ne pas faire perdre de temps à réaliser une fibrinolyse de la poche anévrysmale et de l’artère fémorale superficielle dont l’intérêt est nul, pour se concentrer sur la lyse du thrombus des artères de jambe. Le reste de l’intervention (mise à plat de l’anévrysme poplité, préparation de la veine grande saphène) se déroule pendant que la fibrinolyse locale agit. La revascularisation est réalisée dès que l’artériographie montre la récupération d’une artère de jambe correcte. C’est en effet la perméabilité du lit d’aval qui conditionne le résultat de la revascularisation (fig 13). Cette technique représente un gain de temps qui permet d’espérer un meilleur résultat fonctionnel sur les structures nerveuses et musculaires (fig 14). Des aponévrotomies sont nécessaires si l’ischémie a été sévère et prolongée. En postopératoire, outre la surveillance des bilans biologiques (créatinémie et kaliémie), il faut réaliser une surveillance clinique du membre inférieur avec échographie-doppler, et éventuellement prise des pressions dans les loges musculaires. En résumé, si le lit d’aval est perméable au-dessous de l’anévrysme thrombosé, il faut réaliser un pontage d’emblée ; s’il n’y a pas de lit d’aval jambier visible et si le malade est en ischémie subaiguë, on 10 13 Anévrysme poplité thrombosé. Ischémie aiguë. Récupération après 45 min de fibrinolyse sous-poplitée faite directement dans l’artère tibiale postérieure. peut réaliser une fibrinolyse percutanée suivie par une revascularisation conventionnelle. Enfin, si le malade est en ischémie Chirurgie des anévrysmes artériels des membres (I) Techniques chirurgicales * A 14 A. Thrombose aiguë d’un anévrysme poplité gauche sur artère poplitée piégée. B. Abord des lésions par voie postérieure. aiguë, il faut réaliser un abord poplité bas et une fibrinolyse locale peropératoire pour récupérer une artère de jambe, et faire un pontage tibial. 43-028-A * B * C C. Résection de l’anévrysme et greffe veineuse poplitée terminoterminale. Tableau III. – Données concernant les anévrysmes dégénératifs de l’artère fémorale commune. Références ANÉVRYSMES FÉMORAUX ¶ Anévrysmes fémoraux dégénératifs Il s’agit, après la localisation poplitée, de la localisation la plus fréquente des anévrysmes artériels périphériques. Les anévrysmes fémoraux dégénératifs siègent habituellement au niveau de l’artère fémorale commune. Le tableau III montre leur association fréquente avec d’autres localisations de la maladie anévrysmale. Les anévrysmes fémoraux sont fréquemment bilatéraux et associés à d’autres anévrysmes artériels périphériques (fig 15). Leur localisation au niveau de l’artère fémorale profonde est plus rare (fig 16). Comme les anévrysmes poplités, les anévrysmes fémoraux peuvent entraîner une ischémie distale par embolie ou thrombose de l’anévrysme, une compression locale (nerveuse ou veineuse). Les embolies distales sont fréquentes. La rupture anévrysmale est plus rare : elle survient dans moins de 5 % des cas [16]. En raison de leur localisation, les anévrysmes fémoraux sont habituellement diagnostiqués par la palpation. L’échodoppler * A 15 Anévrysmes fémoraux dégénératifs bilatéraux. A. Aspect tomodensitométrique. Âge moyen au moment du diagnostic Sexe (hommes-femmes) Anévrysmes bilatéraux Association à un AAA Risque d’amputation en l’absence de traitement d’un petit anévrysme fémoral asymptomatique Risque relatif de rupture et de complications thromboemboliques 65 ans 28-1 54 % 75 % 5% 2/13 [3, 11, 16] [3, 11, 16] [3, 11, 16] [3, 11, 16] [11] [11] AAA : anévrysme de l’aorte abdominale. confirme aisément le diagnostic et précise la qualité du réseau artériel d’amont et d’aval, ainsi que l’existence d’autres lésions anévrysmales et de sténoses athéromateuses. Les anévrysmes fémoraux sont souvent associés à un anévrysme aortique ou poplité et sont souvent bilatéraux. Les anévrysmes fémoraux symptomatiques doivent être opérés en raison du risque d’embolie distale et de rupture. À l’opposé, l’indication opératoire est plus discutée pour les anévrysmes asymptomatiques. Graham [11] avait retrouvé, dans une * B * C B, C. Vues peropératoires. 11 Chirurgie des anévrysmes artériels des membres (I) 43-028-A 16 Anévrysme de l’artère fémorale profonde droite. Techniques chirurgicales série de 105 anévrysmes fémoraux non opérés, qu’un tiers des malades avaient des complications ischémiques après un suivi moyen de 28 mois. L’indication opératoire des anévrysmes fémoraux asymptomatiques dépend du diamètre de l’anévrysme (3-4 cm), de l’existence d’un thrombus mural à l’échodoppler et des facteurs de risque du malade. Technique opératoire des anévrysmes fémoraux dégénératifs L’atteinte fréquente de la bifurcation fémorale explique les différentes modalités techniques du traitement chirurgical des anévrysmes fémoraux. La voie d’abord est inguinale externe, arciforme, passant en dehors de la lame ganglionnaire afin de minimiser les risques de lymphocèle et de lymphorrée (fig 17). Si l’anévrysme fémoral est inflammatoire ou de volume important, il est préférable de contrôler dans un premier temps l’artère iliaque externe par une voie suscrurale rétropéritonéale. Au pôle inférieur de l’anévrysme, on contrôle facilement l’artère fémorale superficielle. Le contrôle de l’artère fémorale profonde est plus délicat si l’anévrysme s’étend " A1 " B3 " B1 " A2 " B2 17 " A3 12 A. Abord de l’artère fémorale commune : incision verticale arciforme. B. Incision passant en dehors de la lame ganglionnaire. C. Au pôle inférieur de l’anévrysme, on contrôle l’artère fémorale superficielle. Le contrôle de l’artère fémorale profonde peut nécessiter une dissection plus étendue avec section de la veine circonflexe externe et quadricipitale, ou être fait par voie endoanévrysmale par une sonde à ballonnet. * C Chirurgie des anévrysmes artériels des membres (I) Techniques chirurgicales 18 43-028-A A. Anévrysme fémoral respectant l’origine de l’artère fémorale superficielle et de l’artère fémorale profonde. B. Résection de l’anévrysme. C. Revascularisation par un pontage prothétique terminoterminal au niveau de la jonction iliofémorale et terminal sur une palette comprenant les ostiums de l’artère fémorale profonde et superficielle. D. Mise à plat de l’anévrysme fémoral et pontage avec réimplantation directe de l’artère fémorale profonde dont l’hémostase a été faite par une sonde à ballonnet. E. Même technique de revascularisation avec résection de l’anévrysme fémoral. F, G. Revascularisation limitée à l’artère fémorale profonde en cas d’occlusion de l’artère fémorale superficielle. * A * B * C * F * D * E vers l’origine de la bifurcation fémorale. Dans ce cas, il faut réaliser, après clampage, l’occlusion temporaire de l’artère fémorale profonde par voie endoanévrysmale à l’aide d’une sonde à ballonnet. Après héparinisation et clampage, l’anévrysme est mis à plat, la revascularisation artérielle est effectuée par une prothèse synthétique tubulaire ou bifurquée en polyester ou en PTFE. Dans le cas le plus simple, la prothèse est anastomosée en terminoterminal sur les derniers centimètres de l’artère iliaque externe, puis sur une palette comportant les ostiums de l’artère fémorale superficielle et de l’artère fémorale profonde (fig 18). Si l’anévrysme se continue sur les premiers centimètres de l’artère fémorale profonde et de l’artère fémorale superficielle, il faut réaliser un pontage bifurqué en commençant par le pontage fémoral profond sur lequel on branche en Y un jambage revascularisant l’artère fémorale superficielle. L’utilisation préférentielle d’un pontage veineux autogène ne se justifie pas dans cette localisation. * G ¶ Anévrysmes infectieux fémoraux L’infection des artères des membres est rare. Elle se traduit par une thrombose, une rupture, et plus rarement par un anévrysme infectieux (fig 19). Une enquête réalisée en 1997 en France [17] avait retrouvé 44 anévrysmes des artères des membres, dont 30 anévrysmes de l’artère fémorale commune et de l’artère fémorale superficielle. Ces malades avaient une symptomatologie évocatrice d’une infection locale dans 84 % des cas, une rupture ou une fissuration avait été révélatrice dans 13,7 % des cas. Parmi ces malades, 27,4 % avaient une endocardite infectieuse responsable d’anévrysmes infectieux secondaires ou « mycotiques » se développant à partir d’une greffe bactérienne sur une paroi artérielle souvent saine. Le délai d’apparition de l’anévrysme après l’endocardite infectieuse était variable, allant de 5 jours à 3 ans. Dans cette même étude, 58,8 % des malades avaient une bactériémie d’origine extracardiaque responsable d’anévrysmes infectieux 13 43-028-A Chirurgie des anévrysmes artériels des membres (I) * A 19 Techniques chirurgicales * B A. Anévrysme infectieux de l’artère fémorale profonde, maladie d’Osler. B. Anévrysme infectieux de l’artère fémorale superficielle. * C C. Anévrysme infectieux poplité. * A 20 Anévrysme infectieux poplité sur un pontage en polytétrafluoroéthylène. A. Aspect clinique. B. Artériographie montrant un faux anévrysme poplité. C. Pièce opératoire montrant l’anévrysme infectieux réséqué. * B primaires développés sur une lésion athéromateuse préexistante. Toute bactériémie peut être à l’origine d’une greffe infectieuse artérielle, particulièrement celles à point de départ digestif dues aux salmonelles. L’anévrysme infectieux primaire peut aussi compliquer une immunodéficience acquise. Chez les malades restants (13,7 %), l’anévrysme infectieux était la conséquence d’une contamination externe à partir d’un traumatisme ouvert, d’une ponction artérielle, d’un foyer infectieux de voisinage ou de l’infection d’un pontage artériel prothétique (fig 20). Tout cathétérisme artériel est susceptible d’entraîner un faux anévrysme infectieux. L’infection artérielle après injection de drogue constitue une entité particulièrement grave en raison du terrain sur lequel elle 14 * C survient. Le toxicomane ponctionne ses artères quand toutes les veines périphériques sont thrombosées en raison des phlébites infectieuses répétées. L’anévrysme infectieux se développe alors chez un malade dénutri, souvent contaminé par les virus de l’immunodéficience humaine (VIH), de l’hépatite B (VHB) ou C (VHC), ce qui aggrave le pronostic chirurgical. Dans tous les cas, l’artériographie est l’examen complémentaire essentiel. Elle peut montrer l’aspect caractéristique multilobé des anévrysmes infectieux sans calcification, associé à d’autres localisations anévrysmales ou emboliques. Les germes le plus souvent rencontrés sont le staphylocoque doré, le streptocoque et les salmonelles. Techniques chirurgicales Chirurgie des anévrysmes artériels des membres (I) 43-028-A 21 Pontage croisé par voie périnéale. A. Installation du malade, les cuisses en abduction, le scrotum est relevé et fixé à la paroi abdominale. B. Trajet du pontage croisé par voie périnéale. * B * A Traitement des anévrysmes infectieux Deux techniques sont possibles : Le traitement antibiotique des anévrysmes infectieux est toujours associé au traitement chirurgical. Dans la littérature, la durée du traitement antibiotique est variable. Une durée moyenne de 6 semaines a été proposée. – pontage croisé par voie périnéale : il n’est réalisable que si l’axe iliofémoral controlatéral est indemne de lésion sténosante ou si la sténose iliaque controlatérale est dilatable dans un premier temps. La nécessité de passer à distance de la zone infectée impose de réaliser le pontage par voie périnéale. Les deux cuisses sont maintenues en abduction et légère flexion, le scrotum est relevé et fixé à la paroi abdominale (fig 21). Le pontage peut être réalisé sur l’artère fémorale profonde ou l’artère fémorale superficielle. L’artère fémorale profonde est abordée par voie médiocrurale en passant entre les muscles sartorius et droit antérieur, puis entre le vaste interne et le moyen adducteur. L’abord fémoral controlatéral est un abord inguinal classique du trépied fémoral. La tunnellisation périnéale est réalisée en passant en avant du muscle moyen adducteur de chaque côté. Elle est réalisée au doigt, à la partie postérieure de la racine des bourses, pour effondrer la cloison médiane. La tunnellisation est poursuivie jusqu’à l’artère fémorale profonde ou superficielle ; Traitement chirurgical. Le traitement d’un anévrysme infectieux fémoral comprend outre la résection de l’anévrysme, le parage et le drainage des tissus infectés. Ce temps est essentiel, en particulier pour les anévrysmes infectés des toxicomanes. La revascularisation est le plus souvent nécessaire au niveau de l’artère fémorale commune ; , elle n’est pas toujours indispensable au niveau de l’artère fémorale superficielle. Si l’anévrysme fémoral infecté est rompu avec une cellulite diffuse de la région inguinale, le risque de rupture secondaire du pontage est important. Yeager et Porter [26] ont montré que, chez le toxicomane, l’excision-ligature entraînait 23 % d’amputations et 6 % d’hémorragies graves, alors que la revascularisation in situ autogène entraînait 6 % d’amputations et 31 % d’hémorragies graves. Ces anévrysmes infectieux sont donc difficiles à traiter et il n’existe pas de solution idéale. Il faut essayer de tenir compte des règles de la chirurgie vasculaire en milieu septique, c’est-à-dire réaliser des anastomoses sur des artères saines et tunnelliser le pontage en tissu sain avec, si nécessaire, un lambeau de couverture épiploïque. Une fois ce temps vasculaire « propre » réalisé, il faut supprimer le foyer infectieux artériel en réalisant une excision large de l’anévrysme infectieux et des tissus infectés. • Revascularisation extra-anatomique Elle consiste à effectuer dans un premier temps le pontage à distance du foyer infectieux, puis, après fermeture des incisions, à réaliser le parage des tissus infectés et la résection de l’anévrysme fémoral. C’est la technique de choix en cas de rupture infectieuse hémorragique, mais la revascularisation extra-anatomique n’est pas toujours facile à réaliser au niveau fémoral. – pontage iliofémoral par le trou obturateur : comme pour le pontage fémorofémoral croisé, l’abord de la fémorale profonde est réalisé par voie médiocrurale. L’abord de l’artère iliaque homolatérale est réalisé par voie sous-péritonéale (fig 22). L’incision iliaque est prolongée vers le pubis afin de permettre l’abord de la région obturatrice. La tunnellisation est réalisée à la partie postéroinférieure de la membrane obturatrice afin d’éviter la blessure du paquet vasculonerveux obturateur. Dans les faits, cette tunnellisation est le plus souvent aveugle. Le tunnellisateur est introduit à partir de la voie d’abord crurale, le long du muscle grand adducteur et en avant du demi-tendineux. On palpe et on guide le tunnellisateur au travers de la membrane obturatrice. Cette technique peut se compliquer lors de la tunnellisation par la rupture de volumineuses veines pelviennes de suppléance qui sont la conséquence de la thrombose veineuse iliofémorale souvent associée à l’infection artérielle fémorale. 15 43-028-A Chirurgie des anévrysmes artériels des membres (I) Techniques chirurgicales * A * B 22 Pontage iliofémoral par le trou obturateur. A. Préparation du champ opératoire permettant de tunnelliser le pontage à distance de l’anévrysme septique fémoral. B. Trajets de tunnellisation du pontage obturateur. C. Passage d’un clamp tracteur à partir de la face endopelvienne du canal sous-pubien. D. Sites possibles d’implantation proximale du pontage obturateur. 1. Sur l’artère iliaque commune homolatérale ou controlatérale ; 2. sur l’artère iliaque interne controlatérale, le pontage étant tunnellisé dans l’espace présacré pour rejoindre le trou obturateur ; 3. la revascularisation extra-anatomique est suivie de l’exclusion de l’anévrysme septique (mise à plat et drainage ou résection). * C * D 16 Techniques chirurgicales Chirurgie des anévrysmes artériels des membres (I) Tableau IV. – Données concernant les faux anévrysmes fémoraux. Références Incidence des faux anévrysmes fémoraux Incidence d’anévrysmes décelés par angiographie numérisée Sexe (hommes-femmes) Intervention initiale pour anévrysme Intervention initiale pour lésion occlusive Anévrysme après reconstruction aorto-iliaque Anévrysme après reconstruction fémoropoplitée Récidive après suture simple Récidive après interposition prothétique 4% 44 % [6, 7, 21] 8,5-1 41 % 59 % 92 % 8% 27 % 7% [4, 6, 19] [21] [6, 7, 19] [4, 6, 7, 19] [4, 6, 19] [4, 6, 19] [4, 6, 19] [4, 6, 19] • Revascularisation in situ La revascularisation in situ peut être proposée si l’infection est contrôlée. Le matériel utilisé doit être autogène : veine grande saphène, veine petite saphène ou artère fémorale superficielle prélevée sur le membre controlatéral. En l’absence de greffon autogène, les allogreffes cryocongelées peuvent être utilisées in situ. L’utilisation des prothèses polyester ou PTFE, imprégnées ou non d’antibiotiques, n’est pas recommandée en cas de revascularisation in situ. ¶ Faux anévrysmes fémoraux Les faux anévrysmes peuvent être la conséquence de plusieurs mécanismes qui ont en commun l’existence d’une rupture de la continuité artérielle avec une extravasation de sang dans les tissus périartériels. Faux anévrysmes fémoraux anastomotiques La plupart des faux anévrysmes iatrogènes surviennent après une reconstruction artérielle (tableau IV). Ils sont la conséquence d’une désunion entre la prothèse et l’artère native (fig 23). La fuite sanguine conduit à la formation d’une coque fibreuse qui limite la collection sanguine, mais se développe progressivement sous l’effet de la pression artérielle. La fréquence des faux anévrysmes est variable. Szilagyi [22] a retrouvé 1,7 % de faux anévrysmes dont les trois quarts étaient au niveau fémoral. Les conditions d’apparition des faux anévrysmes anastomotiques fémoraux sont précisées sur le 43-028-A tableau IV. L’infection joue certainement un rôle dans la survenue des faux anévrysmes anastomotiques. Seabrook [20] a retrouvé, après mise en culture dans des milieux enrichis et après sonication de la prothèse, 60 % de cultures positives. Le germe mis en évidence était le plus souvent un Staphylococcus epidermidis. En dehors des prothèses artérielles, toute ponction artérielle peut aussi engendrer la formation d’un faux anévrysme. Messina [15] a montré un taux de complication des cathétérismes fémoraux à visée thérapeutique de 3,4 %, les faux anévrysmes représentant 16 % de ces complications. Les cathétérismes diagnostiques avaient un taux de complication de 0,7 %, les faux anévrysmes représentant 32 % de ces complications. La prévention des faux anévrysmes par ponction fémorale est actuellement en évaluation. Il s’agit de systèmes de fermeture artérielle transcutanés type perclose ou angioseal. • Traitement chirurgical des faux anévrysmes anastomotiques fémoraux Le principe du traitement chirurgical consiste à reconstruire l’anastomose désunie et à la transformer en anastomose terminoterminale [18]. Il est souhaitable, dans un premier temps, de contrôler la prothèse par une courte voie d’abord sus-crurale rétropéritonéale. Dans un deuxième temps, une voie inguinale prolongée vers la cuisse doit permettre de contrôler l’artère fémorale superficielle et l’artère fémorale profonde (fig 24). Si le contrôle est difficile du fait de la sclérose périanévrysmale, il faut prévoir un contrôle endoanévrysmal d’aval par des sondes à ballonnet dès le clampage d’amont et l’ouverture du faux anévrysme. Dès l’ouverture, l’évacuation du thrombus permet de retrouver facilement la désunion de l’anastomose et de compléter éventuellement l’hémostase par la mise en place de sondes à ballonnet occlusives. Même si la désunion est partielle, il faut la traiter comme une désunion totale et réimplanter la prothèse en mettant en place une prothèse intermédiaire anastomosée en terminoterminal sur la prothèse en amont, ce qui impose de suturer la fémorale commune ou l’origine de l’iliaque externe par voie endoanévrysmale. L’anastomose distale terminoterminale est ensuite faite en suturant en « canon de fusil » le bord commun ouvert en « V » des artères fémorales profonde et superficielle. Les deux artères ainsi réunies sont réimplantées en terminoterminal dans la prothèse. Si l’ostium des deux artères est trop éloigné ou 23 Faux anévrysme anastomotique fémoral : désunion entre la prothèse et l’artère native. 17 43-028-A Chirurgie des anévrysmes artériels des membres (I) Techniques chirurgicales * A * B * C 24 * D 18 Faux anévrysme anastomotique fémoral. A. Contrôle artériel d’amont par abord fémoral ou rétropéritonéal. Ouverture du faux anévrysme et hémostase endovasculaire par sondes à ballonnet occlusives. B. Cure du faux anévrysme par interposition prothétique utilisant le même site d’anastomose distale après ablation de tout le matériel prothétique. C. Cure du faux anévrysme avec résection de l’ancienne anastomose distale, suture de l’artère fémorale commune en amont, anastomose proximale du segment prothétique interposé et anastomose distale du segment prothétique interposé sur les berges de l’ostium de l’artère fémorale profonde et superficielle. D. Interposition d’un pontage fémoral terminoterminal sur lequel est implanté le segment prothétique. Cette technique permet de conserver la vascularisation iliaque rétrograde vers l’iliaque interne. Techniques chirurgicales Chirurgie des anévrysmes artériels des membres (I) pathologique, on réimplante d’abord l’artère fémorale profonde, puis l’artère fémorale superficielle par un court pontage en Y. • Faux anévrysmes traumatiques À côté des faux anévrysmes infectés déjà vus, il faut insister sur les complications artérielles des cathétérismes à visée diagnostique et thérapeutique. Toute exploration endoartérielle entraîne une brèche artérielle. De façon immédiate ou retardée, un hématome important peut se développer. La possibilité d’extension rétropéritonéale latente cliniquement, surtout après ponction haute au-dessus de l’arcade crurale, doit être connue. Les faux anévrysmes résultent de la reperméabilisation secondaire de ces hématomes et sont constitués par une poche contenant du sang circulant, en communication avec la lumière artérielle. L’échodoppler couleur est actuellement le meilleur examen pour confirmer le diagnostic, visualiser la poche, préciser sa taille exacte et authentifier la présence d’un flux systolique, traduisant un faux anévrysme communicant, ou d’un flux continu traduisant une fistule artérioveineuse. Le traitement des faux anévrysmes dépend de leur symptomatologie, de leur diamètre et de leur évolution suivie par échodoppler couleur. On admet que les anévrysmes symptomatiques de plus de 2 cm de diamètre augmentant à deux examens doppler successifs nécessitent un traitement chirurgical. Plus récemment, des auteurs ont proposé dans un premier temps une compression manuelle guidée par le doppler. Cette technique consiste à comprimer l’anévrysme tout en maintenant un flux dans 43-028-A l’artère adjacente. Le taux de succès global de cette technique est de 56 % pour Feld [9]. Ce taux de succès varie selon que le malade reçoit ou non un traitement anticoagulant : 88 % de succès en son absence et seulement 29 % en sa présence. Il existe un taux de récidive de 10 %. On peut donc raisonnablement proposer cette technique non invasive pour les faux anévrysmes de moins de 2 cm de diamètre, asymptomatiques chez des malades qui n’ont pas besoin d’être anticoagulés. Après l’échec de deux tentatives, le malade doit être opéré. Le traitement non chirurgical s’est récemment enrichi de l’apport des techniques endovasculaires, par exemple des endoprothèses couvertes, dont l’utilisation au niveau fémoral est discutable compte tenu du risque d’occlusion de l’artère fémorale profonde et de plicature du stent. Traitement chirurgical Le traitement chirurgical des faux anévrysmes dus aux cathétérismes comporte un contrôle de l’artère fémorale commune ou de l’artère iliaque externe par une voie sus-crurale, puis l’ouverture de la poche anévrysmale et la fermeture de la brèche artérielle par des points séparés. Les faux anévrysmes fémoraux associés à une fistule artérioveineuse nécessitent une exploration artérielle guidée par l’échodoppler peropératoire jusqu’à la mise en évidence de la fistule et sa fermeture par voie endoartérielle ou endoveineuse. La disparition du thrill et du signal doppler continu permet de confirmer immédiatement l’efficacité du geste chirurgical. Références [1] Anton GE, Hertzer NR, Beven EG, O’Hara PJ, Krajewski LP. Surgical management of popliteal aneurysms: trends in presentation, treatment and results from1952-1984. J Vasc Surg 1986 ; 3 : 125-134 [2] Cole CW, Thijssen AM, Barber CG. Popliteal aneuryms: an index of generalized vascular disease. Can J Surg 1989 ; 32 : 65-68 [3] Cutler BS, Darling RC. Surgical management of arteriosclerotic femoral aneurysms. Surgery 1973 ; 74 : 764-773 [4] Dennis JW, Littooy FN, Greisler HP. Anastomotic pseudoaneurysm: a continuing late complication of vascular reconstructive procedures. Arch Surg 1986 ; 121 : 314-317 [5] Dent TL, Lindenauer SM, Ernst CB et al. Multiple arteriosclerotic arterial aneurysms. Arch Surg 1972 ; 105 : 338-344 [6] Dimarzo L, Strandness EL, Schultz RD, Feldhaus RJ. Reoperation for femoral anastomotic false aneurysm: a 15-year experience. Ann Surg 1987 ; 206 : 168-172 [7] Ernst CB, Elliott JP, Ryan CJ et al. Recurrent femoral anastomotic aneurysm: a 30 years experience. Ann Surg 1988 ; 208 : 401-409 [8] Farina C, Cavallaro A, Schultz RD. Popliteal aneurysms. Surg Gynecol Obstet 1989 ; 169 : 7-13 [9] Feld R, Patton GM, Carabasi RA, Alexander A, Merton D, Needleman L. Treatment of iatrogenic femoral artery injuries with US guided compression. J Vasc Surg 1992 ; 16 : 832-840 [10] Giddings AE. Influence of thrombolytic therapy in the management of popliteal aneurysms. In : Yao JS, Pearce WH eds. Aneurysms: new findings and treatments. Norwalk : Appleton and Lange, 1994 : 493-508 [11] Graham LM, Zelenock GB, Whitehouse WM Jr et al. Clinical significance of arteriosclerotic femoral artery aneurysms. Arch Surg 1980 ; 115 : 502-507 [12] Lilly MP, Flinn WR, McCarthy WJ et al. The effect of distal arterial anatomy on the success of popliteal aneurysm repair. J Vasc Surg 1988 ; 7 : 653-660 [13] Mangiante EC, Fabian TC, Huffstutter PJ. Popliteal aneurysms: a clinical appraisal. Am Surg 1984 ; 50 : 469-472 [14] Melliere D, Veit R, Becquemin JP, Etienne G. Should all spontaneous popliteal aneurysms be operated on? J Cardiovasc Surg 1986 ; 27 : 273-277 [15] Messina LM, Brothers TE, Wakefield TW, Zelenock GB, Lindenauer SM, Greenfield LJ et al. Clinical characteristics and surgical management of vascular complications in patients undergoing cardiac catheterization: interventional versus diagnostic procedures. J Vasc Surg 1991 ; 13 : 593-600 [16] Pappas G, Janes JM, Bernatz PE et al. Femoral aneurysms; review of surgical management. JAMA 1964 ; 190 : 489-493 [17] Patra P, Pillet JC, Chaillou P, Raffi F. Anévrysmes infectieux des artères cervicales et des membres. In : Kieffer E, GoeauBrissonnière O, Pechere JC éd. Infections artérielles. Paris : édition AERCV, 1997 : 287-306 [18] Schellack J, Salam A, Abouzeid MA, Smith RB 3rd, Stewart MT, Perude GD. Femoral anastomotic aneurysms: a continuing challenge. J Vasc Surg 1987 ; 6 : 308-317 [19] Schellack J, Smith RB 3red, , Perdue GD. Nonoperative management of selected popliteal aneurysm. Arch Surg 1987 ; 122 : 372-375 [20] Seabrook GR, Schmitt DD, Bandyk DF, Edmiston CE, Krepel CJ, Towne JB. Anastomotic femoral pseudoaneurysms: an investigation of occult infection as an etiologic factor. J Vasc Surg 1990 ; 11 : 629-634 [21] Sieswerda C, Skotnicki SH, Barentsz JO et al. Anastomotic aneurysms: an underdiagnosed complication after aortoiliac reconstruction. Eur J Vasc Surg 1989 ; 3 : 233-238 [22] Szilagyi DE, Scharwtz RL, Reddy DJ. Popliteal artery aneurysms. Arch Surg1981 ; 116 : 724-728 [23] Szilagyi DE, Smith RF, Elliott JP et al. Anastomotic aneurysms after vascular reconstruction: problem of incidence, etiology and treatment. Surgery 1975 ; 78 : 800-811 [24] Vermillion BD, Dimmins SA, Pace WG et al. A review of one hundred forty seven popliteal aneurysms with long-term follow-up. Surgery 1981 ; 90 : 1009-1014 [25] Weaver FA, and the STILE Investigators. Surgical revascularization versus thrombolysis for non embolic lower extremity native artery occlusions: results of a prospective randomized trial. J Vasc Surg 1996 ; 24 : 513-523 [26] Yeager RA, Porter JM. Infections artérielles et prothétiques. Ann Chir Vasc 1992 ; 6 : 485-491 19 Encyclopédie Médico-Chirurgicale 43-028-B 43-028-B Chirurgie des anévrysmes artériels des membres (II) JB Ricco C Camiade P Patra P Plagnol Anévrysmes des membres supérieurs ANÉVRYSMES AXILLO-SOUS-CLAVIERS DÉGÉNÉRATIFS Les anévrysmes axillo-sous-claviers sont rares, mais il est difficile d’en connaître l’incidence exacte. Les étiologies les plus fréquentes sont les traumatismes et l’athérosclérose. Les autres étiologies possibles sont les infections, les artérites inflammatoires, les dysplasies fibromusculaires et les anomalies congénitales (tableau I). Les traumatismes chroniques entraînent préférentiellement des anévrysmes de l’artère sous-clavière distale. Ils sont causés habituellement par l’existence d’une côte cervicale ou par une bande fibreuse retrouvée dans le cadre d’un syndrome du défilé thoracique. Les anévrysmes de l’artère sous-clavière proximale et moyenne sont dégénératifs. Ils sont souvent associés à des anévrysmes aortiques ou poplités et sont le plus souvent asymptomatiques. Leur expansion aiguë ou leur fissuration entraînent des douleurs cervicales ou thoraciques. Ces anévrysmes peuvent aussi entraîner une ischémie aiguë ou chronique du membre supérieur par embolie athéromateuse, des signes de compression du plexus brachial, une dysphonie par compression du nerf laryngé récurrent droit, des signes de compression trachéale, un accident vasculaire transitoire ou définitif par embolie rétrograde dans les artères à destinée Tableau I. – Données sous-clavière. concernant les anévrysmes de l’artère Références Sexe (hommes-femmes) Âge moyen au moment du diagnostic Côté (droite-gauche) Étiologie dégénérative 2-1 49 ans 2-1 46 % [3 , 8 , 14, 15] [3 , 8 , 14, 15] encéphalique. L’examen clinique peut mettre en évidence une masse sus-claviculaire battante et expansive, un souffle sus-claviculaire, des microembolies digitales, un déficit neurologique périphérique par compression du plexus brachial, un syndrome de Claude Bernard-Horner. Le diagnostic peut être suspecté sur une radiographie pulmonaire où l’on met en évidence un syndrome tumoral du médiastin supérieur. La tomodensitométrie et l’échodoppler permettent d’établir le diagnostic qui est précisé par l’artériographie. Celle-ci est indispensable pour étudier le réseau artériel d’aval et les limites de l’anévrysme par rapport à l’origine de l’artère vertébrale homolatérale. Les anévrysmes du tiers externe de l’artère sous-clavière englobent souvent la jonction axillo-sous-clavière. À la différence des anévrysmes dégénératifs situés aux tiers interne et moyen de l’artère sous-clavière, ces anévrysmes sont presque constamment associés à la présence d’une côte cervicale et plus rarement à une anomalie de la première côte. Il existe dans ces cas une compression artérielle avec une dilatation poststénotique conduisant au développement d’un anévrysme sous-clavier ou axillo-sous-clavier. Ces anévrysmes sont plus fréquents à droite, mais peuvent être bilatéraux. Ils sont aussi plus fréquents chez la femme. L’échodoppler met souvent en évidence un thrombus intra-anévrysmal, source d’embolies au niveau du membre supérieur. Des embolies rétrogrades vertébrales et carotidiennes ont aussi été décrites. Le traitement des anévrysmes sous-claviers dépend de leur localisation et de leur étiologie. Actuellement, la plupart de ces anévrysmes sous-claviers sont traités par chirurgie conventionnelle, mais la mise en place d’endoprothèses couvertes a été décrite à ce niveau et peut représenter une alternative intéressante, surtout en cas de faux anévrysme traumatique où la zone à recouvrir par l’endoprothèse est relativement courte. [3 , 8 , 14, 15] [3 , 8 , 14, 15] Jean-Baptiste Ricco : Professeur des Universités, praticien hospitalier, chef de service. Christophe Camiade : Interne des Hôpitaux. Service de chirurgie vasculaire, hôpital Jean Bernard, centre hospitalier universitaire, 86021 Poitiers cedex, France. Philippe Patra : Professeur des Universités, praticien hospitalier, chef de service, service de chirurgie vasculaire, hôpital Guillaume et René Laennec, centre hospitalier universitaire,44035 Nantes cedex, France. Philippe Plagnol : Professeur des Universités, praticien hospitalier, chef de service, service de chirurgie vasculaire, centre hospitalier général Pasteur, centre hospitalier universitaire, rue Paul-Langevin, 33212 Bordeaux cedex, France. ¶ Traitement chirurgical des anévrysmes sous-claviers Les anévrysmes sous-claviers sont abordés le plus souvent par une incision sus- et sous-claviculaire respectant la clavicule et éventuellement prolongée dans le sillon deltopectoral. Après intubation trachéale, le malade est installé en décubitus dorsal. La tête est laissée en position indifférente. L’incision est faite 2 à 3 cm au-dessus de la clavicule. Elle débute à 1 cm de la ligne médiane (fig 1). Le plan de clivage est situé à la surface du muscle sternocléido-mastoïdien (SCM). Le chef sternal du SCM n’est sectionné que si l’anévrysme a une extension nécessitant le contrôle des premiers centimètres de l’artère sous-clavière (fig 2). La graisse préscalénique Toute référence à cet article doit porter la mention : Ricco JB, Camiade C, Patra P et Plagnol P. Chirurgie des anévrysmes artériels des membres (II). Encycl Méd Chir (Editions Scientifiques et Médicales Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales – Chirurgie vasculaire, 43-028-B, 2000, 7 p. Chirurgie des anévrysmes artériels des membres (II) 43-028-B Techniques chirurgicales * A * C * B 1 B. Section du muscle omohyoïdien. Le muscle sterno-cléido-mastoïdien n’est sectionné que si un contrôle proximal est indispensable. C. Section du muscle scalène antérieur en protégeant le nerf phrénique. Anévrysme isolé de l’artère sous-clavière. A. Incision sus-claviculaire. * B * C * A 2 Anévrysme isolé de l’artère sous-clavière. A. Dissection de l’artère en amont de l’anévrysme, dissection de l’origine de l’artère vertébrale. B. Abord des premiers centimètres de l’artère sous-clavière avec section du muscle sterno-cléido-mastoïdien et des muscles sous-hyoïdiens qui permet de contrôler la terminaison du tronc artériel brachiocéphalique et l’origine de la carotide commune droite. C. Résection de l’anévrysme et pontage en veine saphène. est clivée en regard du muscle scalène antérieur. Le nerf phrénique est récliné avec précaution. Le muscle scalène antérieur est sectionné au ras de son insertion sur la première côte. Les racines C5-C6 et C7 sont libérées. Puis le muscle scalène moyen est sectionné. L’artère sous-clavière est ainsi exposée sur tout son trajet. Cet abord peut être complété par un abord axillaire dans le sillon deltopectoral (fig 3). ou rétroscalénique de l’artère sous-clavière, il est souhaitable de la réimplanter dans l’artère carotide commune. Anévrysme sous-clavier et syndrome du défilé thoracobrachial La première côte est ensuite disséquée en extrapériosté. Le col de la côte est sectionné après avoir récliné le plexus brachial (fig 4, 5). S’il existe une côte cervicale, elle est réséquée par cette voie avec le muscle scalène moyen. Une courte voie sous-claviculaire est nécessaire en fonction de l’étendue de l’anévrysme pour réséquer l’extrémité antérieure de la première côte. Cure de l’anévrysme L’anévrysme est en général réséqué (fig 6) car il est souvent de volume réduit, mais il existe toujours un risque de plaie nerveuse et veineuse. Si l’anévrysme est plus important (fig 7), avec une sclérose périanévrysmale englobant le plexus brachial et la veine sousclavière, on réalise de préférence une mise à plat de l’anévrysme. Restauration artérielle La continuité artérielle est rétablie de préférence par un pontage en veine grande saphène inversée. Si la veine grande saphène n’a pas un diamètre suffisant, un pontage prothétique peut être réalisé. Si l’artère vertébrale est intéressée par un anévrysme de la portion pré2 La réalisation d’une voie d’abord transclaviculaire partant du sillon deltopectoral avec section de la clavicule à sa partie moyenne se prolongeant en sus-claviculaire interne n’est pas indispensable (fig 8). Elle peut cependant être réalisée en urgence dans certains cas d’anévrysmes post-traumatiques ou d’anévrysmes sous-claviers fissurés. ¶ Cas particulier des anévrysmes de l’artère sousclavière droite rétro-œsophagienne de l’adulte Ils peuvent se manifester par une compression œsophagienne responsable d’une dysphagie, un anévrysme développé sur un diverticule de Kommerell pouvant comprimer l’œsophage et se rompre (tableau II). Ces anévrysmes peuvent aussi être associés à une coarctation, un anévrysme ou une dissection aortique (fig 9). Cela explique les problèmes de la voie d’abord et du rétablissement de la continuité artérielle. En cas d’anévrysme ou de volumineux diverticule de Kommerell, on peut réaliser, dans les cas les plus simples, une voie sus-claviculaire droite pour réimplanter l’artère sous-clavière dans la carotide commune droite. Puis, après avoir changé la position du malade, on fait une thoracotomie postérolatérale gauche permettant le contrôle de l’aorte thoracique, un clampage aortique latéral et une suture aortique de l’origine de l’artère sous-clavière droite appuyée sur des feutres de Téflont. Si la base d’implantation aortique est trop large, il faut réaliser un clampage aortique total. Chirurgie des anévrysmes artériels des membres (II) Techniques chirurgicales 43-028-B 3 4 A. Extension de l’incision dans le sillon deltopectoral. B. Section de l’aponévrose clavipectorale et du muscle grand pectoral, repérage de la veine céphalique. C. Section du muscle petit pectoral, abord de l’artère axillaire. D. Contrôle de l’artère axillaire après ligature et section de l’artère acromiothoracique. Anévrysme de l’artère axillaire et syndrome du défilé thoracobrachial (premier temps). A. Incision sus- et sous-claviculaire. B. Section du muscle grand pectoral au bord inférieur de la clavicule. C. Abord de l’origine de l’artère axillaire. D. Section de l’insertion du muscle scalène antérieur sur la première côte. * A * A * B * B * C * C * D * D 3 43-028-B Chirurgie des anévrysmes artériels des membres (II) * A * B Techniques chirurgicales * C 5 Anévrysme de l’artère axillaire et syndrome du défilé thoracobrachial (deuxième temps). A. Abord sus-claviculaire. B. Section du muscle sterno-cléido-mastoïdien et repérage du nerf phrénique. C. Abord sous-claviculaire complémentaire avec section du muscle sous-clavier et des muscles intercostaux, puis du scalène antérieur. D. Résection de la partie antérieure de la première côte. E. Résection par voie sus-claviculaire de l’arc postérieur de la première côte. La résection d’une côte cervicale peut être réalisée par la même voie d’abord. * D * E 6 Résection de l’anévrysme sous-clavier avec revascularisation par un pontage en veine saphène-grande saphène. ANÉVRYSMES DU MEMBRE SUPÉRIEUR ET DE LA MAIN ¶ Anévrysme post-traumatique aigu de l’artère cubitale Les anévrysmes dégénératifs de l’avant-bras et de la main sont rares. La plupart de ces anévrysmes sont en relation avec un traumatisme chronique. Nous prendrons pour exemple les anévrysmes cubitaux traumatiques qui peuvent se voir dans deux cadres différents : l’anévrysme aigu traumatique par plaie ou choc direct de l’artère cubitale et le syndrome du marteau hypothénar lié à des microtraumatismes répétés. Les circonstances de survenue sont diverses (plaie ouverte, choc, traumatisme du poignet), avec souvent un temps de latence entre le traumatisme initial et le diagnostic. Il existe une tuméfaction douloureuse de l’éminence hypothénar et le diagnostic est confirmé par l’échodoppler, puis l’artériographie. Il s’agit en fait d’un hématome dont l’organisation constitue un faux anévrysme. La gravité potentielle des complications emboliques à partir de ces anévrysmes est en faveur de leur traitement chirurgical 4 Chirurgie des anévrysmes artériels des membres (II) Techniques chirurgicales * A 7 43-028-B * B Anévrysme sous-clavier et syndrome du défilé thoracobrachial. A. Anévrysme sous-clavier associé à la présence d’une côte cervicale. B. Anévrysme réséqué avec thrombus intra-anévrysmal. 9 Artère sous-clavière droite rétro-œsophagienne avec sténose aortique susvalvulaire. ¶ Syndrome du marteau hypothénar 8 Anévrysme sous-clavier rompu. Voie d’abord transclaviculaire donnant accès à la totalité de l’artère sous-clavière. Cette voie peut être agrandie vers l’artère axillaire et vers la terminaison du tronc artériel brachiocéphalique. Tableau II. – Données concernant les anévrysmes sur artère sousclavière rétro-œsophagienne (ASCRO). Références Sexe (hommes-femmes) Incidence de l’ASCRO Dysphagie Anomalie visible sur la Rx pulmonaire Crosse aortique à gauche, artère sous-clavière droite rétro-œsophagienne Association à un AAA Rupture 2,5-1 0,5 % 39 % 94 % 97 % [1, 4, 16] 25 % 20 % [1, 4, 16] [1, 4, 16] [1, 4, 16] [1, 4, 16] [1, 4, 16] Il constitue une entité spécifique et peut entraîner des complications graves avec des nécroses digitales. Il s’agit le plus souvent d’un travailleur manuel qui utilise la paume de la main comme un outil. Ces impacts répétés entraînent des traumatismes de l’artère cubitale au niveau de l’éminence hypothénar, juste après son passage sous le crochet de l’os crochu où elle se divise pour donner l’arcade palmaire superficielle. Ces traumatismes entraînent une dysplasie fibreuse de la paroi artérielle qui va évoluer vers la constitution d’un anévrysme. Cet anévrysme a un risque de thrombose in situ ou d’embolies dans les artères digitales. Le symptôme le plus fréquent est un phénomène de Raynaud unilatéral et asymétrique prédominant aux trois derniers doigts de la main dominante. Une gangrène digitale est révélatrice dans un tiers des cas. L’échodoppler et l’artériographie sont indispensables au diagnostic. Le traitement dépend des lésions artérielles. En cas de thrombose cubitale, le traitement médical est logique car le mécanisme embolique ne peut plus se produire et par conséquent de nouvelles aggravations cliniques sont improbables. Lorsque l’anévrysme est perméable (fig 10), il faut réaliser, si le réseau artériel d’aval est satisfaisant, une résection-suture ou une revascularisation par une greffe veineuse avec les techniques habituelles de la microchirurgie. [1, 4, 16] AAA : anévrysme de l’aorte abdominale ; Rx : radiographie. systématique. Il est rarement possible de suturer directement la brèche artérielle. Il est souvent nécessaire de faire une résection de l’anévrysme suivi d’une revascularisation par une greffe veineuse ou par une autogreffe artérielle en adoptant les techniques microchirurgicales. La ligature artérielle n’est possible que si la revascularisation est trop aléatoire et s’il existe une artère radiale perméable avec une arcade palmaire complète. Étiologies plus rares ANÉVRYSMES DES VASCULARITES ET DE LA MALADIE DE BEHÇET Les vascularites constituent un groupe de maladies hétérogènes définies par l’association d’une inflammation et d’une altération structurale de la paroi vasculaire. La survenue d’anévrysmes artériels périphériques au cours des vascularites est connue (tableau III). 5 43-028-B Chirurgie des anévrysmes artériels des membres (II) Techniques chirurgicales * A * B 10 Anévrysme de l’artère cubitale, syndrome du marteau hypothénar. A. Anévrysme situé sur l’artère cubitale, au niveau de l’os crochu, juste avant la naissance de l’arcade palmaire superficielle. B. Tracé de l’incision cutanée. C. Résection de l’anévrysme et revascularisation par un pontage cubitopalmaire. * C Tableau III. – Données concernant les anévrysmes au cours de la maladie de Takayasu. des thromboses postopératoires et des faux anévrysmes anastomotiques. Références Incidence des anévrysmes au cours de la maladie de Takayasu Distribution relative des anévrysmes - Carotides - Artère sous-clavière - Aorte thoracique - Aorte abdominale 12 % [9, 17] [17] 20 % 10 % 40 % 30 % [17] [17] [17] [17] Les critères de diagnostic internationaux de la maladie de Behçet sont des ulcérations orales récurrentes plus de trois fois par an et deux des manifestations suivantes : ulcérations génitales, lésions oculaires, lésions cutanées, pathergy test positif. L’atteinte artérielle s’exprime par des thromboses ou par des anévrysmes diversement associés. Les anévrysmes sont de mauvais pronostic car ils exposent à la dissection et à la rupture. Chez ces malades, le risque iatrogène des ponctions artérielles directes est connu. Le traitement fait appel à des pontages utilisant moins souvent une greffe veineuse qu’une prothèse, du fait de l’atteinte veineuse fréquente au cours de la maladie de Behçet. Ces malades posent des problèmes complexes en raison de la fréquence 6 ANÉVRYSMES DE LA DYSPLASIE FIBROMUSCULAIRE Les localisations au niveau des artères iliaques externes et des artères des membres inférieurs sont rares et ont été rapportées chez des sujets jeunes. Il peut s’agir de dilatations interstructurales à l’origine d’embolies périphériques au niveau des orteils ou de dissections. Quelques rares cas d’anévrysmes de l’artère fémorale profonde ou de l’artère poplitée ont été décrits. Dans ces cas, il faut réaliser une résection-pontage ou une mise à plat-pontage, comme cela a été précédemment décrit. ANÉVRYSMES POST-STÉNOTIQUES DES MEMBRES Ils sont le plus souvent consécutifs à une artère piégée aboutissant à la formation d’un anévrysme post-sténotique. Les deux localisations préférentielles sont l’artère sous-clavière en cas de syndrome du défilé thoracobrachial déjà vu et l’artère poplitée piégée avec développement d’un anévrysme poplité post-sténotique ou dû à l’atteinte directe de la paroi artérielle par des microtraumatismes répétés. Ces anévrysmes s’accompagnent des complications thromboemboliques classiques avec dégradation du lit d’aval. Il faut réséquer le piège anatomique et traiter l’anévrysme comme précédemment. Chirurgie des anévrysmes artériels des membres (II) Techniques chirurgicales Tableau IV. – Données concernant l’artère sciatique persistante (ASP). Références Incidence de l’ASP Côté (gauche-droite-bilatéral) Sexe (hommes-femmes) Âge moyen au moment du diagnostic Survenue d’un anévrysme Traitement Taux d’amputation [7, 13, 18] 0,025-0,06 % 9-8-6 5-4 65 ans [2, 5, 6] [6, 7, 10, 11] [2, 6, 13, 14] En regard du grand trochanter Ligature ou embolisation + pontage fémoropoplité 28 % [13] [2, 13] [12] 43-028-B du système artériel embryonnaire avec une artère sciatique persistante complète ou incomplète associée à un système fémoral hypoplasique ou normal (tableau IV). L’anévrysme est la complication la plus fréquente des artères sciatiques persistantes. Le siège des anévrysmes de l’artère sciatique persistante est presque toujours situé entre le grand trochanter et le muscle grand fessier. Le diagnostic clinique est souvent évoqué devant une tuméfaction battante de la fesse. Le traitement isolé de l’artère sciatique persistante est souvent suffisant. Il peut être réalisé par embolisation ou par ligature en utilisant une voie postérieure transfessière afin de contrôler l’artère sciatique persistante dans le canal sous-pyramidal. Cette voie comporte un risque de blessure du nerf sciatique. On peut aussi réaliser une ligature en amont par une voie rétropéritonéale en contrôlant l’origine de l’artère iliaque interne. ANÉVRYSMES DE L’ARTÈRE SCIATIQUE PERSISTANTE Les anévrysmes de l’artère sciatique persistante sont rares. L’existence d’une artère sciatique persistante est due à la persistance La revascularisation est souvent nécessaire. Elle est le plus souvent réalisée par un pontage entre l’artère fémorale et l’artère poplitée. Références [1] Austin EH, Wolfe WG. Aneurysm of aberrant subclavian artery with a review of the literature. J Vasc Surg 1985 ; 2 : 571-577 [2] Becquemin JP, Gaston A, Coubret P, Urzan C, Melliere D. Aneurysm of persistent sciatic artery: report of a case treated by endovascular occlusion and femoropopliteal bypass. Surgery 1985 ; 98 : 605-611 [3] Coselli JS, Crawford ES. Surgical treatment of aneurysms of the intrathoracic segment of the subclavian artery. Chest 1987 ; 91 : 704-708 [4] Esposito RA, Khalil I, Spencer FC. Surgical treatment for aneurysm of aberrant subclavian artery based on a case report and a review of the literature. J Thorac Cardiovasc Surg 1988 ; 95 : 888-891 [5] Freeman MP, Tisnado J, Cho SR. Persistent sciatic artery: report of three cases and literature review. Br J Radiol 1986 ; 59 : 217-223 [6] Gerner T, Henjum A, Dedichten H. Persistent sciatic artery. Acta Chir Scand 1988 ; 154 : 667-668 [7] Greebe J. Congenital anomalies of the iliofemoral artery. J Cardiovasc Surg 1977 ; 18 : 317-323 [8] Hobson RW, Sarkaria J, O’Donnell JA et al. Atherosclerotic aneurysms of the subclavian artery. Surgery 1979 ; 85 : 368-371 [9] Lande A, La Porta A. Takayasu arteritis: an arteriographic and pathological correlation. Arch Pathol Lab Med 1976 ; 100 : 437-440 [10] Loh FK. Embolization of a sciatic artery aneurysm: an alternative to surgery. Angiology 1985 ; 7 : 472-476 [11] Mandell VS, Jaques PF, Delany DJ, Oberhen V. Persistent sciatic artery: clinical, embryologic, and angiographic features. AJR Am J Roentgenol 1985 ; 144 : 245-249 [12] Martin KW, Hyde GL, McCready RA, Hull DA. Sciatic artery aneurysms: report of three cases and review of the literature. J Vasc Surg 1986 ; 4 : 365-371 [13] Mayschak DT, Flye MW. Treatment of a persistent sciatic artery. Ann Surg 1984 ; 199 : 69-74 [14] McCollum CH, Da Gama AD, Noon GP, et al. Aneurysm of the subclavian artery. J Cardiovasc Surg 1979 ; 20 : 159-164 [15] Pairolero PC, Walls JT, Payne WS et al. Subclavian-axillary artery aneurysms. Surgery 1981 ; 90 : 757-763 [16] Rodger B, Talber J, Hollenbeck J. Aneurysm of anomalous subclavian artery: an unusual cause of dysphagia lusoria in childhood. Ann Surg 1978 ; 187 : 158-161 [17] Seko Y, Yazaki Y, Uchimura H, Isobe M, Tsuchimochi H, Kurabayashi M et al. A case of Takayasu’s disease with ruptured carotid aneurysm. Jpn HeartJ 1986 ; 27 : 523-531 [18] Williams LR, Flanigan DP, O’Connor RJ, Schuler JJ. Persistent sciatic artery: clinical aspects and operative management. Am J Surg 1983 ; 145 : 687-693 7 ENCYCLOPÉDIE MÉDICO-CHIRURGICALE 43-029-G2 43-029-G2 Pontages veineux sur les artères de jambe et du pied J Watelet R é s u m é. – La réussite d’un pontage infrapoplité tient à la réunion de plusieurs conditions : un patient susceptible d’être réadapté fonctionnellement, des lésions ischémiques distales réversibles, un réseau artériel d’aval correct et du matériel veineux autologue disponible. La présence d’une veine grande saphène utilisable joue un rôle décisif dans la réussite du pontage ; en son absence il est souvent possible d’utiliser d’autres matériels veineux autologues avec des résultats acceptables. La technique d’utilisation de la veine, in situ ou inversée, a peu d’influence sur les résultats hormis pour les veines de diamètre inférieur ou égal à 3 mm qui semblent tirer un bénéfice de l’utilisation in situ. L’état du réseau artériel d’aval est également déterminant pour la perméabilité du pontage : la présence d’une artère de jambe en continuité directe ou indirecte avec une arche plantaire étant le meilleur garant d’une perméabilité durable sous couvert d’une surveillance attentive par échodoppler. © 1999, Elsevier, Paris. Introduction Voies d’abord Avec la vulgarisation de la technique in situ, les indications des pontages sur les artères de jambe se sont multipliées ; les indications habituelles sont les ischémies sévères résistant au traitement médical et menaçant la vitalité du membre. Quelques auteurs considèrent que l’indication d’un pontage sur artère de jambe peut être portée pour une claudication intermittente incapacitante après l’échec d’un traitement médical bien conduit, lorsque existent un bon réseau artériel jambier et une veine grande saphène (VGS) utilisable. Cette indication reste toutefois exceptionnelle et il faut garder à l’esprit que, dans ces conditions, l’échec précoce du pontage engendre habituellement une aggravation de la symptomatologie et peut même faire courir un risque d’amputation. Tronc tibiofibulaire Le succès des pontages sur artère de jambe tient avant tout à la possibilité d’utiliser la VGS. Les résultats décevants des pontages prothétiques réalisés à ce niveau, quel que soit le matériel utilisé, en limitent les indications à l’absence de matériel veineux. © Elsevier, Paris La technique in situ prend au niveau jambier tout son intérêt, offrant une meilleure adéquation du calibre des vaisseaux à anastomoser et la possibilité d’utiliser avec succès des veines dont le diamètre au niveau jambier n’excède pas 2,5 à 3 mm. En contrepartie, la destruction valvulaire pose d’autant plus de problèmes que le pontage est long et que la veine est de petit calibre. Le pontage inversé garde toutefois des partisans [19] qui invoquent une plus grande faisabilité et des résultats à peu près superposables. Jacques Watelet : Professeur des Universités, praticien hospitalier, Service de chirurgie vasculaire, centre hospitalier universitaire Charles-Nicolle, 1, rue de Germont, 76031 Rouen cedex, France. Toute référence à cet article doit porter la mention : Watelet J. Pontages veineux sur les artères de jambe et du pied. Encycl Méd Chir (Elsevier, Paris), Techniques chirurgicales – Chirurgie vasculaire, 43-029-G2, 1999, 13 p. L’abord du tronc tibiofibulaire (TTF) par voie rétrotibiale interne n’est qu’une extension de l’abord poplité bas (fig 1). L’incision cutanée est prolongée vers le bas de plusieurs centimètres en restant 1 cm en arrière du bord postérieur du tibia ou mieux encore en regard de la VGS préalablement repérée. L’aponévrose est incisée à proximité de son insertion tibiale ; après section de l’arcade du soléaire facilitée par la dissection de l’artère et de la veine tibiale antérieure, l’incision du soléaire est effectuée parallèlement au bord interne du tibia jusqu’à mettre en évidence le paquet vasculaire. La gaine vasculaire incisée laisse apparaître le TTF en rapport étroit avec une volumineuse veine satellite souvent dédoublée et la bifurcation artérielle en artère tibiale postérieure et fibulaire. Artère tibiale postérieure et branches de division Tiers supérieur-tiers moyen (fig 2A, B, C, D1, D2) L’incision cutanée est faite en regard de la VGS habituellement située 1 à 2 cm en arrière du bord postéro-interne du tibia. L’aponévrose incisée laisse apparaître le bord interne du muscle gastrocnémien médial qui est libéré et récliné en arrière. Le muscle soléaire peut être désinséré du tibia ou incisé perpendiculairement à ses fibres à un travers de doigt de son bord interne. Le plan aponévrotique épais recouvre un espace celluleux et l’aponévrose profonde qui, une fois effondrée donne accès au paquet vasculonerveux avec le nerf tibial et, en dedans et en avant de lui, l’artère avec ses deux veines satellites. Tiers inférieur (fig 2D3, E) Le soléaire fusionné au muscle gastrocnémien n’a plus d’insertion osseuse et l’incision de l’aponévrose jambière mène dans un plan celluleux situé entre le triceps sural en arrière et le plan profond en avant constitué par les muscles long fléchisseur des orteils et tibial postérieur. Au sein de cet espace siège le paquet vasculonerveux recouvert par le feuillet profond de l’aponévrose jambière. 43-029-G2 PONTAGES VEINEUX SUR LES ARTÈRES DE JAMBE ET DU PIED Techniques chirurgicales A 1 A. Voie d’abord du tronc tibiofibulaire (TTF), tracé de l’incision de l’arcade du soléaire. B. La section de l’arcade découvre le TTF, sa veine satellite et la bifurcation en artères tibiale postérieure et fibulaire. B A 2 A. Abord de la tibiale postérieure (TP) aux tiers supérieur, tiers moyen et tiers inférieur de la jambe. Régions rétro- et sous-malléolaire Abord rétromalléolaire (fig 2F, G, H) Le genou fléchi à 60°, le membre inférieur en rotation externe, le pied est posé sur un billot pour ouvrir l’espace rétro- et sous-malléolaire. L’incision cutanée de 6 à 8 cm verticale puis légèrement incurvée en avant à sa partie inférieure (à l’aplomb de la pointe de la malléole) est faite à égale distance du tendon calcanéen et du bord postérieur de la malléole interne. Le pied étant en flexion forcée, l’aponévrose superficielle est incisée devant le tendon calcanéen puis, le pied étant mis en équin et le tendon calcanéen récliné par un écarteur, l’aponévrose profonde nacrée et épaisse est incisée au ras de son bord interne. La gaine vasculaire ouverte, l’artère apparaît flanquée d’une ou deux veines satellites. Abord sous-malléolaire (voie calcanéenne interne) (fig 2F, I) L’incision curviligne à concavité supérieure est faite à égale distance du bord interne du pied et de la malléole interne remontant, à la demande, en rétromalléolaire. L’incision longe le bord supéro-interne du muscle abducteur de l’hallux ; le rétinaculum des fléchisseurs est incisé au ras du muscle qui est relâché par une adduction du pied et récliné vers le bas. La section de l’expansion du muscle abducteur de l’hallux au page 2 B B. Abord de la TP au tiers supérieur de jambe. L’incision de l’aponévrose découvre le bord interne du gastrocnémien médial qui est récliné en arrière ; incision du soléaire. sustentaculum tali facilite cette manœuvre ; la dissection de la bifurcation de l’artère tibiale postérieure et des premiers centimètres des artères plantaires est facilitée par la section du muscle abducteur de l’hallux. L’artère plantaire latérale, plus volumineuse que la branche médiale, apparaît habituellement inférieure dans la position opératoire ; un abord plus étendu de cette artère peut être obtenu en sectionnant le bord interne de l’aponévrose plantaire et le muscle court fléchisseur des orteils. Lors de cette dissection, il faut s’attacher à préserver l’artère calcanéenne interne, branche collatérale naissant en amont de la bifurcation plantaire et d’une particulière importance chez les patients présentant une ischémie du talon. Trajet des pontages vers l’artère tibiale postérieure En cas de pontage effectué in situ, la VGS est mobilisée sur une dizaine de centimètres ; la destruction valvulaire obéit aux principes décrits (cf supra). Le site de l’anastomose inférieure est repéré et marqué sur l’artère, puis sur la veine mise sous tension et disposée harmonieusement, genou en extension. Les aponévroses jambières, superficielle et profonde, doivent être incisées suffisamment haut pour éviter une angulation de la veine. Pour les pontages inversés, le trajet peut être sous-cutané ou anatomique. Le trajet sous-cutané réalisé entre les deux sites anastomotiques au prix Techniques chirurgicales 43-029-G2 PONTAGES VEINEUX SUR LES ARTÈRES DE JAMBE ET DU PIED D1 D2 C 2 (suite) C. L’incision du soléaire récliné en arrière donne accès au paquet vasculonerveux tibial postérieur. D. Coupes de l’abord de la tibiale postérieure. Au tiers supérieur de la jambe (D1), au tiers moyen (D2), au tiers inférieur (D3) ; LFH : long fléchisseur de l’hallux. D3 F E G d’une ou deux contre-incisions, chemine à la face antéro-interne de la cuisse en regard de la ligne de ligature de l’artère fémorale superficielle puis à la face interne du genou et de la jambe. Le tunnelliseur utilisé doit avoir un diamètre suffisant pour ménager un tunnel où le pontage sera à l’abri de toute compression. E. Abord de la TP au tiers inférieur de jambe. Après incision de l’aponévrose jambière, le paquet vasculonerveux recouvert par le feuillet profond de l’aponévrose jambière apparaît entre le triceps sural récliné en arrière et le plan musculaire profond en avant. F. Abord de la tibiale postérieure rétro- et sous-malléolaire (incision cutanée). G. Abord rétromalléolaire, incision de l’aponévrose profonde. H. Découverte du paquet vasculonerveux. I.Abord sous-malléolaire. La section de l’abducteur du gros orteil facilite la dissection de l’origine des artères plantaires H I Le trajet anatomique emprunte la face postérieure du muscle sartorius, traverse le creux poplité entre les muscles gastrocnémiens et rejoint l’abord de la tibiale postérieure. Ce trajet nécessite un abord de la partie basse du creux poplité qui permet de guider le tunnelliseur le long de l’axe vasculaire entre les chefs gastrocnémiens. Il est habituellement page 3 43-029-G2 PONTAGES VEINEUX SUR LES ARTÈRES DE JAMBE ET DU PIED A B 3 C1 Techniques chirurgicales C2 A. Abord de l’artère fibulaire par voie rétrotibiale interne. Les temps initiaux sont ceux de l’abord de la tibiale postérieure. L’aponévrose profonde est incisée entre les muscles long fléchisseur de l’hallux (LFH) et tibial postérieur (TP). B. Le fléchisseur propre récliné vers l’arrière laisse apparaïtre le paquet vasculonerveux fibulaire, qui repose sur le muscle TP. C. Coupes de l’abord de l’artère fibulaire au tiers supérieur de jambe (1), et au tiers moyen (2). possible de faire progresser le tunnelliseur de la partie basse du creux poplité à la face postérieure du muscle sartorius, sans aborder le creux poplité au-dessus de l’interligne. Le trajet sous-cutané a l’avantage de la simplicité et d’une surveillance plus aisée mais expose au risque de compression posturale. Le trajet anatomique est plus harmonieux. De plus, il n’est pas exposé au risque de plicature lors des mouvements de flexion du genou et protège mieux le pontage des risques d’une infection superficielle des voies d’abord. Ce trajet est ainsi utilisé de préférence au trajet sous-cutané pour les pontages veineux inversés et a fortiori si un matériel prothétique est utilisé. Artère fibulaire (fig 3A, B) Voie rétrotibiale interne Elle permet d’aborder ses deux tiers supérieurs mais la situation assez profonde de l’artère peut rendre l’anastomose délicate. Les temps initiaux de l’abord sont analogues à ceux de l’artère tibiale postérieure. Le paquet tibial postérieur repéré est récliné vers l’avant et l’on recherche l’interstice entre les muscles tibial postérieur et long fléchisseur de l’hallux. L’aponévrose profonde est incisée à ce niveau et le bord interne du muscle long fléchisseur de l’hallux est libéré et récliné en arrière, laissant apparaître le paquet vasculonerveux fibulaire reposant sur le muscle tibial postérieur. L’artère est entourée de ses grosses veines satellites qui rendent sa dissection difficile ; l’utilisation de la bande d’Esmarch prend dans ce cas tout son intérêt permettant de limiter au minimum la dissection de l’artère. Les rapports de l’artère fibulaire et du muscle long fléchisseur de l’hallux varient en fonction du niveau considéré (fig 3C) : – au tiers supérieur de jambe, l’artère reposant sur le muscle tibial postérieur est retrouvée au bord interne du muscle long fléchisseur de l’hallux ; – au tiers moyen de jambe, l’artère est fréquemment entourée par les fibres musculaires du long fléchisseur de l’hallux pouvant réaliser un véritable canal musculaire ; la découverte de l’artère est facilitée en amorçant sa dissection plus en amont et en dissociant à partir de là, vers le bas, les fibres musculaires ; – au tiers inférieur de jambe, l’artère est approchée au mieux par voie externe avec résection de la fibula. page 4 4 Abord de l’artère fibulaire par voie externe. La résection de la fibula découvre le paquet vasculonerveux fibulaire reposant sur le long fléchisseur commun des orteils. Voie externe avec résection de la fibula (fig 4) L’incision cutanée de 10 à 12 cm est centrée sur la fibula en fonction du site anastomotique choisi. Le muscle long fibulaire est libéré du bord externe de l’os et récliné en arrière avec le muscle long fléchisseur de l’hallux. Les faces externe et postérieure de l’os sont ensuite libérées à la rugine sur 7 à 8 cm, d’autant plus facilement vers la partie basse de la jambe que la fibula se dégage des muscles qui l’entouraient plus haut : les tendons des muscles fibulaires restent sur son bord postérieur et le muscle troisième fibulaire, faisceau ultime du muscle long extenseur des orteils ne s’insère que sur le bord antérieur de l’os. Il est aisé ensuite de Techniques chirurgicales PONTAGES VEINEUX SUR LES ARTÈRES DE JAMBE ET DU PIED 43-029-G2 A C E B 5 D A. Abord de la tibiale antérieure au tiers supérieur et au tiers moyen de jambe (incision cutanée). B. L’écartement des muscles tibial antérieur et long extenseur des orteils découvre le paquet vasculonerveux tibial antérieur. C. Coupes de l’abord de la tibiale antérieure. D, F. Abord de la tibiale antérieure au tiers intérieur de jambe, incision cutanée et coupe. E. Le paquet vasculonerveux tibial antérieur apparaît entre les muscles tibial antérieur et long extenseur de l’hallux. F réséquer à la scie de Gigli un segment osseux de 6 à 8 cm en prenant soin de disséquer la membrane interosseuse adhérente au bord interne de l’os ; cette résection ne compromet pas la stabilité de l’articulation tibiotarsienne dont la malléole externe reste intacte. Le paquet vasculaire est aisément retrouvé reposant directement sur le corps du muscle long fléchisseur des orteils. Artère tibiale antérieure et artère dorsale du pied Voie postéroexterne ou rétrofibulaire Au tiers supérieur-tiers moyen de jambe (fig 5A, B, C) La voie jambière postéroexterne ou rétrofibulaire donne un accès limité et malaisé à l’artère dans sa partie moyenne. La jambe est maintenue en flexion à 30-40°, par un billot placé sous le genou. L’opérateur est en dehors, une incision de 8 cm est située sur une ligne joignant la dépression préfibulaire et le milieu du cou de pied ; l’aponévrose est incisée en regard de l’interstice qui sépare les muscles tibial antérieur et long extenseur des orteils. Cet interstice est retrouvé plus facilement dans la partie inférieure de l’incision en maintenant le pied en extension. L’interstice est marqué par ailleurs par l’émergence de petits vaisseaux. Les muscles étant relâchés par la mise en flexion du pied, on récline aisément en dedans le muscle tibial antérieur qui recouvre le muscle long extenseur des orteils et le clivage est poursuivi vers le haut sur toute la hauteur de l’incision. Le pédicule vasculonerveux est profond ; le nerf surcroise l’artère fréquemment masquée par des fibres aponévrotiques dépendant de l’aponévrose interosseuse ou par ses veines satellites dilatées. Trajet des pontages vers l’artère fibulaire Le trajet est analogue à celui des pontages destinés à l’artère tibiale postérieure lorsque l’artère est abordée par voie rétrotibiale interne. Si l’artère a été abordée par voie externe, le trajet le plus logique est externe (cf fig 6A) : le pontage emprunte un trajet extra-anatomique qui croise obliquement en « écharpe » en bas et en dehors les faces antérieure puis externe de la cuisse, longe la face externe du genou entre le tubercule de Gerdy et la tête de la fibula et de là rejoint la voie jambière externe. La VGS peut être utilisée soit inversée soit non inversée, ex situ après destruction valvulaire. Deux contre-incisions courtes permettent d’effectuer la tunnellisation sous-cutanée de l’artère fémorale à l’artère fibulaire. Le trajet externe a l’avantage d’une surveillance aisée et d’éviter tout risque d’angulation du pontage notamment en flexion aiguë du genou. En cas d’abord externe et de pontage in situ, la résection de la fibula peut permettre également de tunnelliser le pontage à partir du site de prélèvement interne vers la loge externe en passant en arrière du paquet vasculonerveux tibial postérieur. L’artère tibiale antérieure est abordée communément par voie antérieure, plus rarement par voie postéro-interne. Abord par voie antérieure Au tiers inférieur de jambe (fig 5D, E, F) L’abord de l’artère est aisé car elle est moins profonde et les corps musculaires font place à de volumineux tendons ; l’écartement des deux tendons des muscles tibial antérieur et extenseur de l’hallux laisse apparaître le paquet vasculonerveux appliqué contre l’os. À la partie basse de l’incision, l’artère s’engage en arrière du tendon de l’extenseur propre qu’il faut récliner en dehors avec le tendon du long extenseur des page 5 43-029-G2 PONTAGES VEINEUX SUR LES ARTÈRES DE JAMBE ET DU PIED Techniques chirurgicales I G K 5 H orteils pour trouver le paquet vasculaire au contact du bord externe du muscle tibial antérieur. L’extension de l’abord vers l’aval nécessite la section du rétinaculum des extenseurs. Au quart supérieur de jambe (fig 5G) La voie d’abord peut être étendue jusqu’à la tête de la fibula ; le clivage des muscles tibial antérieur et long extenseur des orteils permet de suivre l’artère tibiale antérieure qui devient de plus en plus profonde jusqu’au point où elle pénètre dans la loge antérieure. La dissection complète de l’artère peut être aidée le cas échéant par la section de rameaux nerveux que les nerfs fibulaire commun et tibial antérieur envoient au muscle tibial antérieur ; leur section n’entraîne qu’une paralysie incomplète car le muscle reçoit beaucoup plus bas un autre rameau moteur. Il peut être possible, par cette voie, de disséquer la bifurcation poplitée et le TTF mais il est vrai que cette dissection est grandement facilitée par la résection temporaire (ou définitive) de l’extrémité supérieure de la fibula. Abord par voie postéro-interne (fig 5H) Cet abord est rarement utilisé car l’accès obtenu sur l’artère tibiale antérieure est profond et ne facilite pas la réalisation de l’anastomose. Les premiers temps sont identiques à ceux décrits pour l’abord tibial postérieur ; le cheminement se fait en avant du pédicule tibial postérieur et des muscles profonds jusqu’à la membrane interosseuse qu’il faut page 6 (suite) G. Abord de la tibiale antérieure au quart supérieur de jambe. Le clivage de l’extrémité supérieure des muscles tibial antérieur et long extenseur des orteils permet d’aborder l’origine de la tibiale antérieure et la poplitée adjacente. H. Abord de la tibiale antérieure par voie postérieure (coupe). I. Abord de la dorsale du pied (incision cutanée). J. La dorsale du pied et sa première branche externe, l’artère tarsienne latérale apparaissent entre le long extenseur de l’hallux et le chef interne du court extenseur. La dissection plus poussée de l’artère tarsienne latérale impose de sectionner partiellement le court extenseur de l’hallux. K. L’abord de l’artère dorsale du pied distale dans le premier espace métatarsien permet d’effectuer une anastomose à ce niveau. J inciser largement pour découvrir le pédicule tibial antérieur par sa face profonde. L’artère doit être mobilisée aussi largement que possible pour rendre la confection d’une anastomose réalisable sans trop de difficultés. Cette voie n’est indiquée que lorsque des lésions cutanées interdisent l’abord par voie antérieure. Abord de l’artère dorsale du pied (fig 5I, J) Le pied étant en extension et le genou fléchi, l’incision cutanée va du milieu du cou de pied à l’extrémité postérieure du premier espace interosseux sur 4 à 5 cm ; elle longe ainsi le bord externe du tendon du long extenseur de l’hallux ; la branche interne du nerf musculocutané est laissée en dehors ; l’incision de l’aponévrose superficielle au bord externe du tendon du long extenseur de l’hallux laisse apparaître, en dehors, le chef interne musculaire du court extenseur de l’hallux. L’extenseur propre de l’hallux est récliné en dedans et le chef musculaire du court extenseur en dehors, donnant accès en profondeur au paquet vasculaire appliqué sur l’os ; l’artère et la veine dorsales du pied sont longées en dedans par le nerf tibial antérieur qu’il faut ménager. L’abord de l’artère dorsale du pied peut être étendu vers le haut en échancrant à la demande le rétinaculum inférieur des extenseurs ; en aval, l’artère dorsale du pied devient l’artère plantaire profonde en traversant le premier espace métatarsien pour s’anastomoser avec l’artère plantaire latérale. Cette traversée détermine un orifice limité (fig 5K) : – en arrière par le ligament métatarsien dorsal ; Techniques chirurgicales PONTAGES VEINEUX SUR LES ARTÈRES DE JAMBE ET DU PIED 43-029-G2 – en avant par le muscle premier interosseux dorsal dont les deux faisceaux d’insertion sur les premier et deuxième métatarsiens circonscrivent, à l’extrémité postérieure du muscle, une boucle dans laquelle descend l’artère plantaire profonde ; – en dedans et en dehors par la base des premiers métatarsiens. À la sortie de ce tunnel, l’artère plantaire profonde s’anastomose avec l’artère plantaire latérale pour former l’arcade plantaire profonde. L’incision longitudinale, de 3 à 4 cm de longueur sur la face dorsale de la portion moyenne et antérieure du pied, permet de disséquer l’artère dorsale du pied en aval de sa bifurcation en artère plantaire profonde et première artère métatarsienne dorsale. Le muscle court extenseur de l’hallux est écarté en dehors ou sectionné ; le muscle premier interosseux dorsal est échancré pour donner un meilleur accès à la partie proximale de l’artère plantaire profonde. Le périoste de la partie adjacente du deuxième métatarsien est ruginé et écarté afin d’exciser suffisamment de fût métatarsien pour obtenir une bonne exposition de l’artère plantaire profonde et permettre d’effectuer une anastomose à ce niveau [2]. B Artère tarsienne latérale C’est une source non négligeable de vascularisation pour le dos du pied grâce à ses anastomoses avec la branche terminale antéroexterne de l’artère fibulaire et avec l’artère plantaire latérale. L’artère tarsienne latérale naît de la partie proximale de l’artère dorsale du pied près du bord inférieur du rétinaculum des extenseurs. De là, elle se dirige en avant et en dehors, en arrière du muscle extenseur des orteils. Après section du rétinaculum inférieur des extenseurs et dissection de la partie proximale de l’artère dorsale du pied, l’origine de l’artère tarsienne latérale est repérée ; une dissection plus poussée de son trajet impose de récliner en dehors le tendon du muscle long extenseur des orteils et d’inciser partiellement le muscle court extenseur. Trajet des pontages vers l’artère tibiale antérieure Pour les pontages in situ, la veine doit être mobilisée sur tout son segment jambier à partir de l’interligne du genou. La partie basse du creux poplité est abordée avec une dissection a minima de la bifurcation poplitée. La membrane interosseuse est dégagée puis incisée longitudinalement sur 2 à 3 cm à la partie supérieure de l’abord antérieur ; un instrument mousse est passé de la loge antérieure vers le creux poplité guidé par un doigt interne. La veine est disposée dans son trajet sous tension physiologique, genou en extension afin d’éviter une brièveté du pontage. L’anastomose distale doit être réalisée à une distance suffisante de l’endroit où la veine franchit la membrane interosseuse ; la veine doit en effet être parallèle à l’artère pour réaliser de façon optimale l’anastomose à la face antéroexterne de celle-ci. Réalisée trop près de la traversée de la membrane interosseuse, l’anastomose est menacée d’une plicature au niveau de son talon (fig 6B). Le pontage inversé emprunte le trajet anatomique, à la face postérieure du sartorius puis entre les chefs gastrocnémiens, avant de rejoindre la loge antérieure selon les modalités qui viennent d’être décrites. Le trajet sous-cutané externe est employé préférentiellement lorsque l’abord du creux poplité est interdit du fait d’un sepsis ou non souhaitable du fait du risque de sclérose engendré par des abords itératifs. Trajet transosseux Il constitue une alternative intéressante au trajet à travers la membrane interosseuse. Il consiste à effectuer un tunnel osseux transtibial oblique en bas et en dehors permettant au pontage de rejoindre selon un trajet harmonieux la loge antérieure (fig 6A, C, D). Le tunnel doit préserver l’intégrité des crêtes tibiales pour ne pas altérer la solidité de l’os. L’orifice d’entrée est réalisé au niveau de la face postérieure ou au niveau de la face interne du tibia ; à partir de là le tunnel rejoint la face externe de l’os selon un angle dont l’obliquité ne doit pas excéder 60° pour éviter de fragiliser la diaphyse. Le siège de l’orifice de sortie du tunnel sur la face externe de l’os est choisi en fonction du niveau de l’anastomose sur l’artère tibiale antérieure : une distance de 2 à 3 cm entre les deux est nécessaire pour pouvoir réaliser l’anastomose sans risque de plicature. La face externe de l’os est dégagée du périoste sur 1 cm2 ; après avoir entamé la corticale à la pointe carrée, le trajet peut être fait avec celle-ci, mais l’utilisation A D C 6 A. Trajets des pontages vers la tibiale antérieure. a. anatomique ; b. sous-cutané externe commun à la tibiale antérieure et à l’artère fibulaire abordée par voie externe ; c. trajet transosseux ; c’. trajet à travers la membrane interosseuse. B. Le pontage franchit la membrane interosseuse à distance de l’anastomose pour éviter le risque de plicature. C. Trajet transosseux : trajet du tunnel. D. Trajet transosseux : passage du pontage. d’une broche introduite au moteur pneumatique est préférable, permettant de guider au mieux la mèche au moment du forage. En fonction de la face choisie, l’orifice d’entrée doit être postérieur sur la face interne, proche du bord interne ou postéro-interne sur la face postérieure. Une mèche de 7 donne un diamètre suffisant au tunnel dont les orifices d’entrée et de sortie sont émoussés à la fraise pour n’être pas vulnérants. Le tunnel transosseux est particulièrement intéressant pour les pontages in situ anastomosés sur la partie basse de l’artère tibiale antérieure ; en l’absence de tunnel, la veine doit en effet emprunter un trajet souscutané qui croise le bord antérieur saillant de l’os pour rejoindre l’artère tibiale antérieure. Le trajet transosseux, de réalisation technique aisée, page 7 43-029-G2 PONTAGES VEINEUX SUR LES ARTÈRES DE JAMBE ET DU PIED Techniques chirurgicales supprime tout risque de compression extrinsèque. Le risque théorique d’affaiblir la trame osseuse incite à ne pas utiliser cette technique dans les ostéoporoses avérées. Une variante de cette technique a été décrite [21] consistant à réaliser non pas un tunnel mais une simple gouttière creusée dans la corticale du bord antérieur de l’os. Les incisions du prélèvement de la veine et de l’abord antérieur de l’artère tibiale antérieure sont utilisées pour exposer les faces interne et externe et le bord antérieur de l’os ; une mèche permet de forer la crête tibiale de façon superficielle et la gouttière ainsi réalisée est émoussée et régularisée. Cette technique n’offre pas d’avantage évident par rapport à la précédente et est de réalisation plus délicate du fait de la difficulté du forage de la crête tibiale. En outre, le risque est réel d’affaiblir l’architecture osseuse comme le démontre le risque de survenue de fracture « pathologique» en regard de la gouttière [21]. Abord des artères de jambe par voie postérieure Les voies d’abord postérieures des artères de jambe sont très rarement utilisées, car elles supposent que les lésions artérielles aient une topographie sous-poplitée permettant la réalisation d’un pontage poplité-jambier. Cette topographie lésionnelle est surtout l’apanage du patient diabétique et a la particularité de ménager dans un bon nombre de cas la partie distale des artères de jambe ou du pied offrant la possibilité d’une revascularisation courte. La voie postérieure peut certes permettre le prélèvement de la VGS jambière et gonale, mais elle tire réellement son intérêt de pouvoir utiliser la veine petite saphène (VPS). L’examen du patient en orthostatisme peut parfois permettre d’apprécier l’état de la VPS mais l’échodoppler veineux nous semble toujours nécessaire, permettant d’apprécier l’anatomie de la veine, de repérer et de marquer son trajet et la naissance des principales collatérales ; il précise en outre les éventuelles altérations pariétales et le diamètre proximal et distal mesuré au mieux sous garrot et jambe pendante. La veine est considérée comme utilisable si le diamètre externe mesuré dans ces conditions est supérieur ou égal à 3 mm et si elle est indemne d’altération pariétale. Dans l’expérience d’Ouriel, la VPS était utilisable chez 72 % des patients relevant d’une revascularisation souspoplitée [13]. L’échodoppler a enfin l’avantage de situer le niveau de l’abouchement de la VPS dans la veine poplitée et par là même de prévoir la longueur de veine disponible pour le pontage. Installation du patient Le patient est confortablement installé en décubitus ventral avec un coussin placé sous les crêtes iliaques, le membre inférieur enrobé jusqu’au tiers supérieur de cuisse dans un jersey collé. Des champs placés sous le genou maintiennent l’articulation en extension et facilitent l’abord de l’artère poplitée. Compte tenu de la position du patient et de la durée opératoire prévisible, l’anesthésie générale est préférable à l’anesthésie péridurale. Incision cutanée Si la VPS est utilisable, l’incision centrée sur la veine débute au pli du genou et s’étend vers le bas en fonction du site de l’anastomose inférieure et de la longueur de veine nécessaire. En cas d’anastomose sur l’artère tibiale postérieure distale, une courte voie d’abord complémentaire parallèle au bord interne du tendon calcanéen est souhaitable, afin d’éviter un décollement sous-cutané trop important, source de troubles de cicatrisation. La longueur de l’incision dépend du mode d’utilisation de la veine pour le pontage : – en cas de pontage inversé, l’incision peut être continue ou discontinue ménageant de courts intervalles de peau saine, permettant la dissection de la veine et son prélèvement ; – en cas de pontage in situ, seules les parties proximales et distales de la veine sont abordées et disséquées en regard des futures zones anastomotiques. Dans sa moitié inférieure, la VPS est sus-aponévrotique longée par le nerf saphène externe ; au tiers moyen de jambe, elle s’enfonce dans un dédoublement de l’aponévrose superficielle qui engaine séparément le nerf situé en avant d’elle. Au niveau du creux poplité, elle est située entre les aponévroses superficielle et profonde, perforant celle-ci en regard de page 8 7 Abord postérieur des artères de jambe : tracé des incisions. a. Extension poplitée haute ; b + c. incision sur le trajet de la veine petite saphène ; c. abord distal de l’artère fibulaire ; d. abord distal de l’artère tibiale postérieure. l’interligne articulaire pour s’aboucher à la face postérieure de la veine poplitée. La crosse peut être haut située par rapport à l’interligne articulaire, offrant 5 à 6 cm supplémentaires utilisables pour le pontage. L’artère poplitée sous articulaire est aisément abordée après avoir récliné en dehors successivement le nerf tibial puis la veine poplitée. L’abord de l’artère poplitée sus-articulaire nécessite une extension de la voie d’abord vers le haut selon un trajet en « baïonnette » interne (fig 7). Abord proximal des artères de jambe L’abord du TTF et de l’origine des artères de jambe nécessite le clivage de la fusion médiane des muscles gastrocnémiens qui sont écartés avec leur pédicule. Le muscle soléaire forme une nappe épaisse et large, du moins dans la partie supérieure de la jambe. À la partie basse de la jambe, il devient plus étroit et peut être contourné latéralement. Le muscle soléaire peut être désinséré de son attache tibiale sur toute sa longueur ou sectionné à proximité de celle-ci ; il peut être également incisé sur la ligne médiane selon la voie classique de ligature de l’artère tibiale postérieure, l’incision pouvant se prolonger jusqu’au niveau calcanéen (fig 8). On découvre ainsi très largement le TTF, les artères tibiale postérieure en dedans et fibulaire en dehors croisée près de son origine par le nerf tibial. Le TTF et l’origine des artères de jambe sont masqués par un réseau de veines plexiformes et de branches nerveuses dont le respect est souhaitable pour éviter des parésies musculaires, source de gêne fonctionnelle ultérieure. La partie proximale des artères tibiale postérieure et fibulaire est exposée de façon satisfaisante par cet abord. En revanche, l’artère tibiale antérieure n’est accessible que dans ses 15 premiers millimètres avant le franchissement du bord supérieur de la membrane interosseuse dont la section permet l’exposition de 1 à 2 cm complémentaires. Abord distal des artères de jambe Le tiers moyen et le tiers inférieur des artères tibiale postérieure et fibulaire sont abordés au mieux par de courtes voies d’abord parallèles aux bords du tendon calcanéen. Artère tibiale postérieure (fig 9) Un abord longitudinal de 8 à 10 cm est réalisé au bord interne du tendon calcanéen. L’incision de l’aponévrose jambière superficielle donne accès à un espace celluleux situé entre le muscle triceps sural et le plan musculaire profond sur lequel repose l’artère recouverte par l’aponévrose jambière profonde. À proximité de la malléole, l’artère tibiale postérieure chemine en arrière du muscle long fléchisseur des orteils qu’il faut écarter en dedans pour aborder la partie distale de l’artère. PONTAGES VEINEUX SUR LES ARTÈRES DE JAMBE ET DU PIED Techniques chirurgicales 43-029-G2 A 10 Abord de l’artère fibulaire distale par voie postérieure. 1. Aponévrose superficielle ; 2. triceps sural ; 3. muscle long fléchisseur de l’hallux ; 4. artère fibulaire. 8 Abord postérieur des artères de jambe par voie médiane transsoléaire. 1. Artère poplitée ; 2. tronc tibiofibulaire ; 3. muscle soléaire ; 4. artère tibiale antérieure ; 5. artère fibulaire ; 6. artère tibiale postérieure. B dehors en sectionnant si besoin quelques fibres musculaires qui s’insèrent sur une cloison tendineuse commune avec des faisceaux du muscle tibial postérieur. À sa partie basse, l’artère s’applique sur la membrane interosseuse et se divise en deux branches terminales antéroexterne et postéro-interne. Le repérage de l’artère peut être facilité par la palpation de la fibula située immédiatement en dehors de l’artère. Anastomose proximale Elle est faite selon les données angiographiques sur l’artère poplitée haute ou basse, voire exceptionnellement sur le TTF ou une artère de jambe proximale. En cas de technique in situ, la destruction valvulaire est réalisée au mieux sous contrôle angioscopique : – soit avant la réalisation de l’anastomose proximale, l’angioscope introduit par la partie haute de la veine contrôlant l’action du valvulotome introduit par le bas ; – soit après la réalisation de l’anastomose proximale, l’angioscope pouvant être solidarisé à la tige du valvulotome, l’optique étant située un peu en retrait de l’olive. En cas de technique inversée, la tunnellisation du pontage peut être faite en sous-aponévrotique, ou mieux encore en avant du muscle soléaire, selon un trajet anatomique qui met le pontage à l’abri d’une éventuelle infection des voies d’abord. Anastomose distale Artère tibiale postérieure A L’anastomose peut être faite à un niveau quelconque du trajet de l’artère jusqu’à la bifurcation plantaire qui est aisément abordée dans cette position, la cheville et le dos du pied étant appuyés sur un billot et le pied maintenu en valgus. 9 Abord de l’artère tibiale postérieure distale par voie postérieure. 1. Muscle long fléchisseur des orteils ; 2. triceps sural ; 3. artère tibiale postérieure. Artère fibulaire B Artère fibulaire (fig 10) Les aponévroses superficielle et profonde de jambe sont incisées longitudinalement en dehors du tendon calcanéen au niveau de la partie basse de l’incision de prélèvement de la VPS ; l’artère est recouverte en arrière par le muscle long fléchisseur de l’hallux qu’il faut écarter en Elle peut être revascularisée jusqu’à sa bifurcation, l’anastomose pouvant même être faite distalement sur la branche de division postérointerne lorsque celle-ci est hypertrophiée et reprend en charge l’arche malléolaire. Artère tibiale antérieure L’accès de ses premiers centimètres est possible après section du bord supérieur de la membrane interosseuse ; au-delà, elle est d’un accès difficile mais néanmoins parfois réalisable par voie antérieure après mise page 9 43-029-G2 PONTAGES VEINEUX SUR LES ARTÈRES DE JAMBE ET DU PIED en rotation externe du membre. Si la revascularisation doit porter sur l’artère dorsale du pied, le pontage peut être tunnellisé en sous-cutané en avant de la malléole interne et l’anastomose distale faite après fermeture des voies d’abord postérieures et réinstallation du patient en décubitus dorsal. Discussion Les conditions du succès d’un pontage distal sont multifactorielles. La présence de matériel veineux et d’un réseau d’aval correct est le meilleur garant d’une perméabilité durable ; la qualité des suites opératoires et notamment l’absence de morbidité reposent en grande partie sur le choix pertinent de la voie d’abord et la qualité de sa réalisation. Une cicatrisation per primam autorise une reprise rapide de la marche et abrège la durée d’hospitalisation. À l’inverse, les troubles de cicatrisation retardent la réadaptation fonctionnelle, génèrent des douleurs et prolongent l’hospitalisation, quand ils ne sont pas responsables directement ou indirectement de complications septiques. La fréquence des complications cutanées varie de 7 à 30 % selon les séries qui se sont intéressées à ce problème. Leur survenue est favorisée par les conditions locales et générales parmi lesquelles l’état de dénutrition, le degré d’ischémie, la présence d’une infection ou la proximité de troubles trophiques. Leur prévention repose avant tout sur la qualité de la réalisation de la voie d’abord et de sa fermeture, fruit de l’expérience chirurgicale et de l’engagement de l’opérateur. Le tracé des incisions est essentiel et doit être réalisé par l’opérateur lui-même ; il doit permettre l’abord de la veine, l’exposition de l’artère et la tunnellisation. Dans les pontages à haut risque de thrombose, le choix des voies d’abord et le tracé des incisions doivent tenir compte d’un échec potentiel et contrarier le moins possible la réalisation d’une éventuelle amputation. La réalisation de la voie d’abord doit respecter les structures anatomiques de voisinage. La peau et le tissu cellulaire sous-cutané sont particulièrement vulnérables dans cet environnement ischémique. Les décollements intempestifs, les coagulations trop proches de la peau, les écartements agressifs inutilement prolongés doivent être prohibés. La dissection doit être atraumatique. Les délabrements musculaires résultant souvent d’une connaissance insuffisante de l’anatomie doivent être évités. Les nerfs sont souvent maltraités et leur contusion peut être responsable de névralgies gênantes. Les collatérales musculaires des nerfs profonds doivent être autant que possible préservées car la section de certaines d’entre elles peut entraîner des faiblesses musculaires fâcheuses. Les veines jambières sont intimement adhérentes à l’artère adjacente, souvent dédoublées, parfois plexiformes ; leur blessure impose souvent leur ligature source de phlébite postopératoire. L’utilisation de la bande d’Esmarch pour réaliser l’anatomose distale constitue dans cette optique un réel progrès et doit être largement utilisée. Elle permet de réduire la zone de dissection de l’artère à revasculariser, limitant par là les risques de traumatismes nerveux, veineux et artériels. L’artère est seulement exposée et non plus disséquée, encore moins circonscrite ; la palpation localise un segment artériel adéquat de 15 à 20 mm ou doit porter l’anastomose. Choix du site de l’anastomose distale et de la voie d’abord Choix de la voie d’abord Il repose sur l’analyse de plusieurs paramètres : la présence de lésions cutanées, le matériel veineux disponible, les éventuels abords préalables, le morphotype du patient. La voie rétrotibiale interne permet d’aborder simultanément la VGS, l’artère tibiale postérieure et la moitié supérieure de l’artère fibulaire. La partie distale de l’artère fibulaire est abordée au mieux par voie externe ; cette voie peut être choisie électivement lorsque l’abord de la partie supérieure de l’artère s’annonce difficile par voie interne en raison d’abords antérieurs ou du fait du morphotype du patient. Dans la majorité des cas, l’artère tibiale antérieure est abordée par voie antérieure ; l’abord postéro-interne n’est indiqué que pour améliorer l’accès par voie rétrotibiale interne des premiers centimètres de l’artère au niveau et en aval de sa crosse ou lorsque des lésions cutanées interdisent l’abord antérieur. La voie postérieure des artères tibiale postérieure et fibulaire, très rarement utilisée, est réservée aux lésions artérielles sous-poplitées et page 10 Techniques chirurgicales suppose que la VPS soit utilisable. Les avantages de cette voie d’abord sont nombreux ; elle préserve la VGS et facilite l’abord artériel en cas de repontage. Les complications cutanées seraient rares et l’œdème exceptionnel. L’abord distal de l’artère fibulaire est plus aisé et moins délabrant que par voie externe. A contrario, cette voie offre une accessibilité limitée au tiers supérieur et moyen des artères de jambe imposant un clivage des muscles gastrocnémiens et une section étendue du muscle soléaire. Les nerfs des muscles de la loge postérieure superficielle sont relativement vulnérables dans cet abord et leur traumatisme peut entraîner des parésies musculaires gênantes. Site de l’anastomose distale Dans les ischémies sévères, rares sont les cas où plusieurs artères de jambe sont perméables et de qualité suffisante pour permettre une revascularisation séquentielle. Dans la majorité des cas une seule artère de jambe offre les conditions requises pour une revascularisation élective : absence d’altération diffuse, continuité directe avec le réseau artériel du pied ou continuité indirecte (artère fibulaire) par l’intermédiaire d’anastomoses suffisantes. L’artère tibiale postérieure offre rarement ces conditions et la revascularisation intéresse le plus souvent l’artère tibiale antérieure et surtout l’artère fibulaire assez fréquemment épargnée par l’athérome, mais dont le pronostic de la revascularisation tient à la qualité des anastomoses qu’elle contracte avec les arches plantaires. En présence de lésions sténosantes du TTF ou de l’origine des artères de jambe, les indications respectives d’une revascularisation poplitée en amont des lésions sténosantes ou d’une revascularisation jambière sur une artère présumée saine dépendent avant tout du matériel veineux disponible. Une veine saphène perméable et de calibre adéquat incite à utiliser le meilleur site anastomotique possible en aval des lésions sténosantes. Pontage sur l’artère fibulaire ou au pied ? En cas d’athérosclérose évoluée, l’artère fibulaire reste souvent la dernière artère perméable et l’on peut avoir le choix entre la revascularisation de celle-ci ou d’une artère du pied revascularisée indirectement par l’artère fibulaire. La revascularisation de l’artère fibulaire a l’avantage potentiel de permettre un pontage plus court et donc de nécessiter moins de matériel veineux ; cet avantage devant être pondéré si une voie d’abord et un trajet externe sont choisis. La revascularisation d’une artère de la cheville ou du pied a l’avantage d’un abord aisé et d’une revascularisation plus efficace des zones ischémiques distales. L’étude de la littérature ne permet pas de trancher en faveur de l’une ou l’autre option ; les taux de perméabilité des pontages sur l’artère fibulaire et des pontages plus distaux étaient comparables dans l’expérience de Shah et al [18] adeptes de la technique in situ et d’Elliott [7] , Schneider [17] ou Bergamini [3] . Les taux de sauvetage de membre étaient également comparables à l’exception de la série d’Elliott où le taux de sauvetage de membre obtenu après pontage sur l’artère fibulaire (55 % à 2 ans) était significativement inférieur à celui obtenu après pontage sur les artères tibiales ou les artères du pied (67 %) [7]. Le choix entre artère fibulaire et artère du pied est ainsi influencé par la longueur de matériel veineux disponible, la qualité des anastomoses entre l’artère fibulaire et le réseau du pied, l’existence ou non de lésions nécrotiques distales et enfin par les préférences de l’opérateur. Technique in situ ou inversée ? Le choix de la technique d’utilisation de la VGS reste un sujet de controverse. Pour les pontages destinés au quart inférieur de jambe ou à la cheville, la destruction valvulaire selon la technique rétrograde impose pratiquement un relais dans la région périgonale ou crurale basse du fait des différences importantes entre les calibres proximal et distal du pontage ; il est en effet rarement possible d’utiliser des valvulotomes de plus de 2,5 mm au niveau jambier, valvulotomes qui s’avéreront souvent insuffisants pour assurer une destruction valvulaire adéquate au niveau crural. La destruction valvulaire à l’aide du valvulotome de Mills effectuée sous contrôle angioscopique prend dans cette indication tout son intérêt. PONTAGES VEINEUX SUR LES ARTÈRES DE JAMBE ET DU PIED Techniques chirurgicales 43-029-G2 Tableau I. – Perméabilité des pontages veineux fémorojambiers [4, 5, 6, 8, 11, 20, 24]. Perméabilité primaire (ou primaire assistée) Auteurs Années Nombre de cas Type de pontage Feinberg [8] 1990 57 In situ Bergamini [4] 1991 246 In situ Donaldson [6] 1991 100 In situ 63 % (primaire assistée 71 %) Londrey [11] 1991 93 61 Inversé In situ 59 % NS 72 % Taylor [20] 1991 203 Inversé Dalman [5]* 1990 Wengerter [24]** 1991 2 ans 3 ans Inversé In situ 5 ans 63 % 70 % Inversé In situ 63 62 4 ans 64 % 67 % 62 % 68 % 61 % NS 58 % * Méta-analyse ; ** étude prospective randomisée ; NS : différence non significative. Résultats Les taux de perméabilité actuarielle des pontages fémorojambiers sont peu différents, que la technique utilisée soit in situ ou inversée (tableau I). Dans une étude rétrospective appréciant l’influence du diamètre de la veine sur la perméabilité, Wengerter et al [23] ont montré que les taux de perméabilité des pontages fémorojambiers en veine inversée d’un diamètre externe de 3,5 mm étaient à peu près équivalents à ceux des pontages réalisés avec des veines de diamètre supérieur ou égal à 4 mm. Dans cette étude, le diamètre critique au-dessous duquel la perméabilité des pontages veineux inversés diminuait de façon nette était de 3 mm. Dans les études rétrospectives (tableau I) les taux de perméabilité primaire exprimés à 5 ans varient de 59 à 67 % pour la technique inversée et de 63 à 72 % pour la technique in situ. Dans la méta-analyse réalisée par Dalman [5], les taux moyens de perméabilité primaire à 4 ans étaient respectivement de 62 et 68 % pour les pontages inversés et in situ, la perméabilité secondaire étant de 76 et 81 %. Dans l’étude prospective randomisée multicentrique de Wengerter et al [24] comparant les pontages in situ et inversés au niveau infrapoplité, les perméabilités actuarielles primaire et secondaire des deux types de pontage étaient équivalentes (perméabilité primaire et secondaire à 2 ans : inversés = 61 et 67 % ; in situ = 58 et 69 %). Toutefois, la perméabilité des pontages in situ effectués avec des veines de diamètre inférieur ou égal à 3 mm était supérieure à celle des pontages inversés de même diamètre (in situ : 75 % ; inversés : 37 % à 1 an) ; la différence n’étant toutefois pas statistiquement significative du fait des faibles populations en présence. Outre la technique d’utilisation de la VGS, les perméabilités seraient également influencées par le réseau artériel d’aval et notamment l’état des artères du pied, une réintervention, une insuffisance rénale terminale, la poursuite du tabagisme, la qualité de la surveillance. L’influence d’autres facteurs tels que le diabète, le stade initial de l’ischémie, le sexe, les traitements adjuvants est plus controversée. Pontages distaux paramalléolaires et inframalléolaires Indications Avec l’amélioration des techniques, les indications des pontages se sont étendues progressivement vers la distalité du membre avec la revascularisation des artères jambières à la cheville, voire au pied. La revascularisation peut en effet intéresser les branches de division de l’artère tibiale postérieure, la partie distale de l’artère dorsale du pied ou une de ses branches hypertrophiées. Les artériopathies distales, apanage de l’artérite diabétique, fournissent l’essentiel des indications ; deux tableaux cliniques peuvent être distingués : – le plus fréquent concerne les patients dont le pouls poplité est perçu et les pouls distaux abolis ; l’artériographie révèle une oblitération proximale ou distale des artères de jambe avec un réseau artériel du pied pouvant être partiellement respecté par l’athérome ; – le deuxième tableau, plus rare, est constitué de patients dont les pouls sont perçus dans la région malléolaire mais qui présentent néanmoins une ischémie distale sévère ; l’artériographie peut parfois objectiver en aval d’une oblitération paramalléolaire, une branche de division de l’artère tibiale postérieure ou une artère dorsale du pied distale susceptibles d’être revascularisée. Compte tenu du pronostic des revascularisations distales et de leur relative difficulté technique, les indications doivent être réservées aux gangrènes ischémiques ne cicatrisant pas en dépit d’un traitement médical agressif et de débridements chirurgicaux effectués à la demande. L’artériographie doit étudier particulièrement les artères jambières et le réseau artériel du pied. L’opacification du réseau du pied a bénéficié grandement de l’apport de l’angiographie digitalisée ; rares sont les cas où une artère distale perméable n’est pas visualisée par cette technique ; à défaut, la présence d’un signal doppler audible sur le trajet d’une artère doit inciter à l’explorer chirurgicalement. Après héparinisation générale, l’artère exposée peut être cathétérisée avec un Cathlon 22 G, mais le risque de dissection pariétale sur une artère de petit calibre doit plutôt inciter à effectuer sur la zone la plus favorable, une courte artériotomie longitudinale qui permet de cathétériser à vue la lumière distale. Du sérum hépariné est poussé à la seringue dans le cathéter : une résistance élevée à l’injection contre-indique la réalisation du pontage ; la mesure de la résistance, lorsqu’elle est techniquement réalisable, revêt dans ce cas un intérêt particulier. Un cliché artériographique pratiqué par le cathéter permet d’apprécier précisément l’état de l’artère et sa collatéralité avant la réalisation du pontage. Pontages longs ou courts ? En fonction de l’état du réseau artériel fémoropoplité, le pontage peut être soit long, anastomosé sur l’artère fémorale commune, soit court, anastomosé sur l’artère fémorale superficielle basse voire sur l’artère poplitée en dessous de l’interligne ; plus rarement, l’anastomose proximale peut être faite sur une artère de jambe. Dans tous ces cas, la réalisation d’une anastomose basse est subordonnée à l’absence de sténose d’amont supérieure ou égale à 30 %. Plusieurs séries de la littérature non prospectives ont montré que la longévité des pontages courts était au moins égale sinon supérieure à celle des pontages longs [12, 15, 16, 22]. La supériorité des pontages courts serait encore plus nette quand l’anastomose distale porte sur une artère du pied et/ou quand le réseau d’aval est médiocre. Matériel utilisé En l’absence de matériel veineux, les chances de perméabilité des pontages très distaux réalisés avec du matériel prothétique sont très faibles, même en utilisant les artifices destinés à augmenter leur perméabilité : – le pontage long bénéficie au mieux de l’utilisation in situ de la VGS [18] ; page 11 43-029-G2 PONTAGES VEINEUX SUR LES ARTÈRES DE JAMBE ET DU PIED Techniques chirurgicales – pour les pontages courts et en particulier pour les pontages naissant sous l’interligne du genou, la technique inversée présente de nombreux avantages permettant notamment d’utiliser la portion la plus adéquate de la veine et d’éviter les problèmes de déroutage de celle-ci ; en contrepartie, elle fait perdre le bénéfice d’une meilleure congruence anastomotique ; pour cette raison, certains auteurs préconisent d’utiliser la VGS non inversée après destruction valvulaire. Site anastomotique distal Dans ces indications de pontage très distaux, l’artère réceptrice est rarement préservée par l’athérome ; les calcifications sont fréquentes et parfois circonférentielles ; la dissection doit s’attacher à retrouver la zone la moins pathologique possible pour réaliser l’anastomose. L’exploration doit ainsi parfois être poussée : – au-delà de la bifurcation plantaire, lorsque l’artère tibiale postérieure rétro- et sous-malléolaire est trop pathologique et en particulier vers l’artère plantaire latérale, de calibre habituellement plus important que l’artère plantaire médiale et qui donne l’arcade plantaire profonde ; – vers la partie distale de l’artère dorsale du pied dans sa plongée vers la région plantaire. En cas d’oblitération des troncs principaux, certaines branches ou collatérales telles que l’artère tarsienne latérale, l’artère arquée ou l’artère plantaire médiale peuvent s’hypertrophier et bénéficier le cas échéant d’une revascularisation ; ces revascularisations ne sont toutefois concevables qu’effectuées avec du matériel veineux et en l’absence de nécrose tissulaire évoluée. L’expérience d’Ascer dans ce domaine fixe les limites des revascularisations distales comme une solution alternative à une amputation de jambe [2]. 11 Trajet du pontage in situ vers l’artère dorsale du pied. 1. trajet idéal ; 2. à éviter. Résultats Incisions distales et trajet du pontage La technique in situ impose de réaliser distalement deux incisions cutanées pour prélever la VGS et aborder l’artère à revasculariser. Ces deux incisions sont d’autant plus proches que l’on descend plus distalement sur le pied, en particulier sur l’artère dorsale du pied (fig 11). Le pont cutané déterminé par les deux incisions est d’autant plus exposé à l’ischémie que les incisions sont proches, que l’ischémie du pied est sévère et qu’un décollement est fait sous ce lambeau pour dérouter et tunnelliser la veine. Le risque d’ischémie du lambeau cutané peut être réduit en écartant autant que possible les deux incisions et en évitant de tunnelliser la veine sous le pont cutané, le décollement étant un facteur d’ischémie supplémentaire. La mobilisation de la veine doit être amorcée plus haut et la veine est tunnellisée en amont du pont cutané. Anastomose distale La réalisation de l’anastomose distale doit bénéficier d’une technique rigoureuse : utilisation de grossissement optique (loupes 2,5 à 4,5, voire microscope lorsque le diamètre de la lumière avoisine le millimètre), fil monobrin fin 6 ou 7/0 serti d’aiguilles très fines, surjet suspendu et anastomose réalisée sous bande d’Esmarch pour éviter le traumatisme du clampage des parois de l’artère. page 12 Les résultats des pontages effectués sur l’artère dorsale du pied [14] ou sur l’artère tibiale postérieure rétro- et sous-malléolaire, voire sur l’artère plantaire latérale [1], sont bien meilleurs que ne le laisserait espérer a priori le réseau artériel d’aval très réduit dans lequel elles débouchent. Contrairement à ce qui est habituellement démontré à l’étage poplité ou jambier, il ne semble pas exister de corrélation aussi fidèle entre la perméabilité des pontages inframalléolaires et le réseau artériel récepteur du pied. En particulier, l’état de l’arche malléolaire, longtemps invoqué comme une condition indispensable de succès, n’influerait pas sur la perméabilité des pontages distaux [10, 14]. Le haut degré de collatéralité du réseau du pied et la richesse des anastomoses entre les artères dorsale du pied et plantaires pourraient expliquer cette apparente discordance. Les perméabilités actuarielles primaires des pontages para- et inframalléolaires varient de 58 % à 3 ans [17] à 68 % à 5 ans [14] (perméabilités secondaires dans les deux séries : 82 %). Les séries les plus importantes concernent les revascularisations de l’artère dorsale du pied plus volontiers épargnée par les calcifications, notamment chez le diabétique et d’un abord chirurgical aisé. À propos de 384 pontages effectués sur l’artère dorsale du pied, Pomposelli et al font état de perméabilité primaire et secondaire de 68 % et 82 % à 5 ans [14]. L’expérience de Harrington [9] est plus nuancée : à propos de 73 pontages la perméabilité primaire à 2 ans était de 59 % ; les facteurs d’échec identifiés dans cette série étaient la qualité médiocre de la veine, une arche antérieure déficiente et une infection extensive du pied. Techniques chirurgicales PONTAGES VEINEUX SUR LES ARTÈRES DE JAMBE ET DU PIED 43-029-G2 Références [1] Andros G, Harris RW, Salles-Cunha SX, Dulawa LB, Oblath RW. Lateral plantar artery bypass grafting: defining the limits of foot revascularization. J Vasc Surg 1989 ; 10 : 511-521 [2] Ascer E, Veith FJ, Gupta SK. Bypasses to plantar arteries and other tibial branches : An extended approach to limb salvage. J Vasc Surg 1988 ; 8 : 434-441 [3] Bergamini TM, George SM, Massey HT, Henke PK, Klamer TW, Lambert GE et al. Pedal or peroneal bypass: which is better when both are patent? J Vasc Surg 1994 ; 20 : 347-356 [4] Bergamini TM, Towne JB, Bandyk DF, Seabrook GR, Schmitt DD. Experience with in situ saphenous vein bypasses during 1981 to 1989: Determinant factors of long-term patency. J Vasc Surg 1991 ; 13 : 137-149 [9] [10] [11] [12] [13] [14] [5] Dalman RL, Taylor LM. Basic data related to infrainguinal revascularization procedures. Ann Vasc Surg 1990 ; 4 : 309-312 [6] Donaldson MC, Mannick JA, Whittemore JA. Femorodistal bypass with in-situ greater saphenous vein. Long-term results using the Mills valvulotome. Ann Surg 1991 ; 213 : 457-465 [15] [7] Elliott BM, Robison JG, Brothers TE, Cross MA. Limitations of peroneal artery grafting for limb salvage. J Vasc Surg 1993 ; 18 : 881-888 [16] [8] Feinberg RL, Winter RP, Wheeler JR, Gregory RT, Snyder SO, Gayle RG et al. The use of composite grafts in femorocrural bypasses performed for limb salvage : a review of 108 consecutive cases and comparison with 57 in situ saphenous vein bypasses. J Vasc Surg 1990 ; 12 : 257-263 [17] Harrington EB, Harrington ME, Schanzer H, Jacobson JH, Haimov M. The dorsalis pedis bypass - moderate success in difficult situations. J Vasc Surg 1992 ; 15 : 406-416 Klamer TW, Lambert GE, Richardson JD, Banis JC, Garrison RN. Utility of inframalleolar arterial bypass grafting. J Vasc Surg 1990 ; 11 : 164-170 Londrey GL, Ramsey DE, Hodgson KJ, Barkmeier LD, Sumner DS. Infrapopliteal bypass for severe ischemia: comparison of autogenous vein, composite, and prosthetic grafts. J Vasc Surg 1991 ; 13 : 631-636 Marks J, King TA, Baele H, Rubin J, Marmen C. Popliteal –to-distal bypass for limb-threatening ischemia. J Vasc Surg 1992 ; 15 : 755-760 Ouriel K. The posterior approach to popliteal-crural bypass. J Vasc Surg 1994 ; 19 : 74-80 Pomposelli FB, Marcaccio EJ, Gibbons GW, Campbell DR, Freeman DV, Burgess AM et al. Dorsalis pedis arterial bypass: durable limb salvage for foot ischemia in patients with diabetes mellitus. J Vasc Surg 1995 ; 21 : 375-384 Rhodes GR, Rollins D, Sidawy AN, Skudder P, Buchbinder D. Popliteal-to-tibial in situ saphenous vein bypass for limb salvage in diabetic patients. Am J Surg 1987 ; 154 : 245-247 Rosenbloom MS, Walsh JJ, Schuler JJ, Meyer JP, Schwarcz TH, Eldrup-Jorgensen J et al. Long-term results of infragenicular bypasses with autogenous vein originating from the distal superficial femoral and popliteal arteries. J Vasc Surg 1988 ; 7 : 691-696 Schneider JR, Walsh DB, McDaniel MD, Zwolak RM, Besso SR, Cronenwett JL. Pedal bypass versus tibial bypass with autogenous vein: a comparison of outcome and hemodynamic results. J Vasc Surg 1993 ; 17 : 1029-1040 [18] Shah DM, Darling RC, Chang BB, Kaufman JL, Fitzgerald KM, Leather RP. Is long vein bypass from groin to ankle a durable procedure? An analysis of a ten-year experience. J Vasc Surg 1992 ; 15 : 402-408 [19] Taylor LM, Edwards JM, Phinney ES, Porter JM. Reversed vein bypass to infrapopliteal arteries; modern results are superior to or equivalent to in situ bypass for patency and for vein utilization. Ann Surg 1987 ; 205 : 90-97 [20] Taylor LM, Hamre D, Dalman RL, Porter JM. Limb salvage vs amputation for critical ischemia. The role of vascular surgery. Arch Surg 1991 ; 126 : 1251-1258 [21] Valentine RJ, Blankenship CL, Wind GG. The tibial gutter: a protected route for bypass grafts to the distal anterior tibial artery. J Vasc Surg 1989 ; 10 : 465-467 [22] Veith FJ, Gupta SK, Samson RH, Flores RW, Janko G, Scher LA. Superficial femoral and popliteal arteries as inflow sites for distal bypasses. Surgery 1981 ; 90 : 980-990 [23] Wengerter KR, Veith FJ, Gupta SK, Ascer E, Rivers SP. Influence of vein size (diameter) on infrapopliteal reversed vein graft patency. J Vasc Surg 1990 ; 11 : 525-531 [24] Wengerter KR, Veith FJ, Gupta SK, Goldsmith J, Farrell E, Harris PL et al. Prospective randomized multicenter comparison of in situ and reversed vein infrapopliteal bypasses. J Vasc Surg 1991 ; 13 : 189-199 page 13 ENCYCLOPÉDIE MÉDICO-CHIRURGICALE 43-029-I 43-029-I Pontages séquentiels, mixtes et prothétiques. Pontages avec matériel veineux autologue autre que la veine grande saphène. Pontages avec allogreffes vasculaires J Watelet R é s u m é. – Quand la veine saphène est absente ou de longueur insuffisante, le choix de la technique et du matériel de pontage dépend du niveau de la revascularisation, de la présence ou non d’autre matériel veineux autologue et des habitudes de l’opérateur. Au niveau sus-articulaire, le matériel prothétique peut être utilisé avec des résultats satisfaisants. Au niveau infragéniculé, la supériorité du matériel veineux sur les divers substituts artériels est telle que son utilisation doit être privilégiée ; une exploration complète du capital veineux doit être ainsi réalisée avant de recourir au matériel prothétique. Les veines des membres supérieurs sont fréquemment utilisables avec des résultats proches de ceux obtenus avec les veines grandes saphènes (VGS) ; les veines petites saphènes (VPS) sont particulièrement adaptées aux revascularisations infragéniculées poplitées-distales. Enfin, des segments veineux d’origine diverse peuvent être compilés avec des résultats acceptables. L’insuffisance de veine peut être résolue par divers procédés : l’abaissement de l’anastomose supérieure souvent possible, au prix parfois d’une thromboendartériectomie de l’artère fémorale superficielle ; le pontage séquentiel dont la réalisation est facilitée par la présence d’une artère poplitée suspendue ; le pontage mixte dont les performances nettement inférieures aux deux procédés précédents peuvent néanmoins être comparées favorablement à celles des pontages prothétiques. En l’absence de matériel veineux, le choix se circonscrit entre : le matériel prothétique dont les résultats semblent tirer un bénéfice de l’utilisation d’artifices au niveau de l’anastomose distale et les allogreffes artérielles dont les perspectives séduisantes doivent être encore confirmées. © 1999, Elsevier, Paris. Pontages séquentiels En 1971, De Laurentis et Friedman ont décrit une technique de restauration artérielle sous-inguinale utilisant de façon séquentielle un © Elsevier, Paris Jacques Watelet : Professeur des Universités, praticien hospitalier, service de chirurgie vasculaire, centre hospitalier universitaire Charles-Nicolle, 1, rue de Germont, 76031 Rouen cedex, France. Toute référence à cet article doit porter la mention : Watelet J. Pontages séquentiels, mixtes et prothétiques. Pontages avec matériel veineux autologue autre que la veine grande saphène. Pontages avec allogreffes vasculaires. Encycl Méd Chir (Elsevier, Paris), Techniques chirurgicales - Chirurgie vasculaire, 43-029-I, 1999, 12 p. pontage prothétique et une veine saphène inversée [12]. Ce type de pontage était destiné à des patients nécessitant une revascularisation de l’artère poplitée sous-articulaire ou d’une artère de jambe, et dont le capital veineux était insuffisant pour effectuer tout le pontage. Le pontage proximal prothétique était anastomosé sur une artère poplitée haute, perméable ou endartériectomisée, et le pontage distal franchissant l’interligne du genou revascularisait une artère de jambe. Utilisée par ces auteurs en présence de veines saphènes inadéquates, cette technique avait pour objectif d’éviter la traversée du pli du genou par du matériel prothétique. Cette technique de revascularisation peut être proposée dans diverses configurations anatomiques ; le tableau habituel associe une oblitération de l’artère fémorale superficielle (AFS) avec reperméation d’une artère poplitée suspendue ; de ce segment d’artère poplitée, naissent des artères jumelles et articulaires qui revascularisent distalement une ou plusieurs artères de jambe. 43-029-I PONTAGES SÉQUENTIELS, MIXTES ET PROTHÉTIQUES. PONTAGES AVEC MATÉRIEL VEINEUX Techniques chirurgicales AUTOLOGUE AUTRE QUE LA VEINE GRANDE SAPHÈNE. PONTAGES AVEC ALLOGREFFES VASCULAIRES 1 Pontage séquentiel prothétique et veineux fémoropoplité et poplitétibial antérieur. A B C 2 Plus rarement, l’artère poplitée alimente une artère de jambe pathologique, oblitérée à un niveau variable, avec reperméation en aval d’une artère pédieuse ou tibiale postérieure paramalléolaire, susceptible d’être revascularisée. Dans les deux cas de figure, l’artère poplitée peut servir de relais pour le pontage proximal. L’intervention consiste typiquement à effectuer un pontage prothétique de l’artère fémorale commune (AFC) à l’artère poplitée haute ; un second pontage est branché latéralement sur la prothèse en amont de l’anastomose distale, franchit l’interligne du genou et revascularise distalement l’artère de jambe la plus adéquate (fig 1). En revascularisant deux territoires distincts, cette technique augmente le réseau artériel récepteur, abaisse le niveau des résistances et augmente de ce fait le débit dans le pontage proximal. Avec la pratique d’anastomoses séquentielles, des augmentations de débit de plus de 50 % dans le pontage proximal ont été démontrées aussi bien expérimentalement qu’en pratique clinique. Cette technique est particulièrement justifiée lorsque l’état de la VGS (longueur disponible insuffisante, taille réduite...) n’autorise pas la réalisation d’un pontage conventionnel, in situ ou inversé, sur une artère de jambe ; dans ce cas, le pontage prothétique proximal fémoropoplité permet d’économiser 20 à 30 cm de veine, et la portion crurale de la veine suffit habituellement pour effectuer le pontage distal. De plus, le pontage prothétique limité à la région susarticulaire a une longévité acceptable. Par rapport au pontage mixte, cette technique évite l’écueil de l’anastomose intermédiaire et, en particulier, son risque de plicature. page 2 Pontage « continu » fémoro-tibio-péronier avec relais poplité selon trois modalités. A. Par une anastomose latérolatérale. B. Par court pontage veineux ou prothétique interposé. C. Par l’intermédiaire d’une saphène dédoublée. Technique Pontage continu Le pontage veineux ou prothétique peut être continu de l’AFC à l’artère jambière. Le relais sur l’artère poplitée peut revêtir trois modalités. – Par une anastomose latérolatérale (fig 2A). Le pontage emprunte un trajet anatomique passant entre les jumeaux. Après confection de l’anastomose proximale sur l’artère fémorale commune, le pontage est tunnellisé en arrière du couturier, puis entre les jumeaux. Le site anastomotique sur l’artère poplitée est choisi en fonction des données confrontées de l’artériographie et de la palpation de l’artère. Le membre inférieur étant en extension et le pontage sous tension, le site correspondant sur la prothèse est repéré. Après flexion du genou et clampage de l’artère poplitée et du pontage, l’artériotomie est faite sur 20 à 25 mm, à moins que la présence de plaques d’athérome adjacentes n’oblige à en réduire la longueur. Une ouverture de longueur équivalente est faite en regard sur le pontage, en excisant une pastille ovalaire de 2 ou 3 mm de large pour ouvrir l’anastomose. Le surjet est débuté au milieu de la berge postérieure en nouant d’emblée le premier point, et poursuivi de part et d’autre vers Techniques chirurgicales PONTAGES SÉQUENTIELS, MIXTES ET PROTHÉTIQUES. PONTAGES AVEC MATÉRIEL VEINEUX AUTOLOGUE AUTRE QUE LA VEINE GRANDE SAPHÈNE. PONTAGES AVEC ALLOGREFFES VASCULAIRES 43-029-I 3 Technique de l’anastomose latérolatérale : le surjet débuté au milieu de la berge postérieure est poursuivi de part et d’autre vers l’angle correspondant. A 5 B C Variétés de relais des pontages séquentiels prothétiques et veineux. A. Anastomose latéroterminale entre le pontage prothétique et le pontage veineux. B. Anastomoses « indépendantes ». C. Zone anastomotique commune. – Par un court pontage veineux ou prothétique interposé entre le pontage fémorojambier et l’artère poplitée ; les anastomoses étant réalisées latéralement (fig 2B). – Par l’intermédiaire d’une saphène dédoublée (fig 2C). Pontages successifs A 4 B Dangers de l’anastomose latérolatérale. A. Artériotomie trop haute par rapport au pontage : plicature du pontage. B. Artériotomie trop basse : traction sur l’artère pouvant couder l’origine du pontage sous-jacent. l’angle correspondant (fig 3). On peut ainsi, à la demande, agrandir l’une des deux ouvertures sur l’artère ou la prothèse. L’anastomose se termine par la suture de la berge antérieure. Après les manœuvres de purge habituelles, l’artère poplitée est mise en charge et la prothèse clampée au ras de l’anastomose ; l’anastomose distale peut être ensuite réalisée. En cas de pontage veineux, la veine est utilisée de façon optimale en position inversée ; si l’anastomose inférieure doit être faite très distalement, il peut être souhaitable d’utiliser la veine de façon non inversée, après destruction valvulaire, pour avoir une meilleure congruence anastomotique. Danger : les sites anastomotiques doivent être rigoureusement concordants sur l’artère et le pontage ; si l’artériotomie est effectuée trop haut par rapport au pontage, l’anastomose entraîne une plicature sur le pontage (fig 4A), qui peut être corrigée par une meilleure répartition de l’excès de longueur en amont et par une éventuelle fixation du pontage à l’artère adjacente. Si l’artériotomie est effectuée trop bas, le pontage exerce une traction sur l’anastomose pouvant couder l’artère et l’origine du pontage sous-jacent (fig 4B). La technique usuelle fait appel à deux pontages successifs, proximal prothétique et distal veineux. L’artère poplitée haute (ou l’AFS basse) constitue le relais idéal fournissant un réseau artériel récepteur (artères articulaires et jumelles) non négligeable et évitant la traversée du genou par la prothèse. À défaut, l’artère poplitée basse peut être utilisée, voire le tronc tibiopéronier. Plusieurs modalités de relais entre les deux pontages sont possibles (fig 5) : – le pontage proximal est anastomosé sur l’artère poplitée haute ou basse et le pontage distal est anastomosé latéralement quelques centimètres en amont de l’anastomose inférieure (fig 5A) ; – les deux pontages sont indépendants et l’anastomose distale du pontage d’amont reste à distance de l’anastomose proximale du pontage sous-jacent (fig 5B) ; cette technique nécessite un segment suffisamment long d’artère perméable (par exemple, artère poplitée haute et basse) ou endartériectomisé. La zone endartériectomisée doit être assez longue pour permettre la réalisation de deux anastomoses successives et doit être faite, si possible, en regard de collatérales (grande anastomotique...) dont la revascularisation assurera la longévité de la zone endartériectomisée ; – la zone anastomotique est commune aux deux pontages dont les extrémités sont adossées l’une à l’autre (fig 5C). L’artériographie de contrôle doit s’attacher à vérifier les deux anastomoses dont l’opacification optimale est obtenue en clampant alternativement l’origine du pontage distal et l’anastomose poplitée. La mesure du débit et des résistances revêt, dans ce type de pontage, un intérêt particulier objectivant et quantifiant l’abaissement des résistances et l’augmentation du débit avec l’adjonction du pontage distal. À distance, la thrombose est la principale complication ; elle peut intéresser l’ensemble du pontage mais, assez fréquemment, elle épargne le pontage proximal qui continue d’alimenter le territoire poplité ; la thrombose du pontage distal est marquée par une chute des pressions distales, alors que le pouls poplité reste perçu avec des pressions inchangées à la partie basse de la cuisse. La perméabilité du pontage proximal réduit l’importance de la récidive ischémique et permet page 3 43-029-I PONTAGES SÉQUENTIELS, MIXTES ET PROTHÉTIQUES. PONTAGES AVEC MATÉRIEL VEINEUX Techniques chirurgicales AUTOLOGUE AUTRE QUE LA VEINE GRANDE SAPHÈNE. PONTAGES AVEC ALLOGREFFES VASCULAIRES A a b B C 6 Anastomose intermédiaire d’un pontage mixte prothétique et veineux. A. Extrémités congruentes : anastomose terminoterminale par triangulation. B. Extrémités non congruentes : élargissement de la veine, a : par une angioplastie triangulaire ; b : en utilisant l’origine d’une collatérale. C. Anastomose spatulée. Une collatérale permet d’élargir le talon de la veine. 7 Plicature sténosante de la veine compliquant une anastomose avec une veine de petit calibre. habituellement d’éviter l’amputation. Dans quelques rares cas, la thrombose du pontage distal peut être attribuée à un phénomène de flux compétitifs engendré par une collatéralité insuffisamment déconnectée entre les différents territoires intéressés par la revascularisation séquentielle. De façon occasionnelle, le pontage distal peut rester perméable en dépit de la thrombose du pontage proximal [51] grâce à la remarquable aptitude des pontages veineux à rester perméables en dépit d’un débit effondré. Dans cette situation, un nouveau pontage proximal permet de remettre en charge le pontage distal et d’en pérenniser la perméabilité. Résultats Les perméabilités varient selon les séries de 74 à 86 %, à 1 an et de 62 à 72 % à 4 ans [36]. Pontages mixtes prothétiques et veineux La réalisation d’un pontage distal est confrontée, dans 20 à 40 % des cas, à une insuffisance (ou une absence) de matériel veineux. Le pontage mixte associant matériels veineux et prothétique constitue l’une des solutions techniques à ce problème. La prothèse en polytétrafluoroéthylène (PTFE) de 6 mm est implantée proximalement sur l’AFC ou l’AFS et anastomosée au segment veineux utilisable. Le niveau de l’anastomose intermédiaire, dicté par la longueur de veine disponible, doit être situé, de préférence, en amont de l’interligne articulaire du genou. La tunnellisation est faite entre les jumeaux après vérification de l’absence de fuite au niveau de l’anastomose intermédiaire. Après rinçage au sérum hépariné et ligature de l’extrémité distale de la veine, le pontage est mis sous tension, genou étendu ; on peut ainsi apprécier, au mieux, le siège de la section veineuse en regard du site artériel choisi pour l’anastomose, en évitant tout risque de torsion. L’anastomose distale est ensuite réalisée selon la technique coutumière. Le matériel veineux autologue peut provenir de la VGS homo- ou controlatérale, mais aussi de la VPS ou des veines du membre supérieur. La veine peut être utilisée inversée s’il n’y a pas de disparité de calibre notable entre les extrémités proximale et distale ; dans les autres cas, l’utilisation non inversée est souhaitable, permettant de limiter la disparité de calibre entre la veine et la prothèse, et de faciliter d’autant la réalisation de l’anastomose intermédiaire. La destruction valvulaire est faite, pontage en charge, de façon habituelle à l’aide d’un valvulotome conventionnel ou du valvulotome de Mills. page 4 L’anastomose intermédiaire est faite habituellement de façon terminoterminale (fig 6) : – les extrémités peuvent être spontanément congruentes : l’anastomose est faite en terminoterminale au fil 5 ou 6/0, par triangulation en évitant un surjet sténosant par tension excessive de la suture (fig 6A) ; – l’anastomose peut être rendue congruente en élargissant le calibre de la veine par une angioplastie veineuse triangulaire (fig 6Ba)ou en utilisant une bifurcation veineuse (fig 6Bb); – l’anastomose peut être spatulée : l’obliquité respective des plans de coupe étant fonction du calibre des extrémités à anastomoser (fig 6C) ; l’utilisation du talon d’une collatérale veineuse permet d’élargir la tranche de section veineuse. Le risque commun de ces anastomoses est la plicature sténosante de la veine qui survient plus volontiers si la veine est de petit calibre (fig 7). Une disparité de calibre importante entre la prothèse et la veine peut inciter : – soit à réaliser une anastomose terminolatérale de la saphène sur la prothèse (fig 8, 9) élargie le cas échéant par le talon d’une collatérale ou une angioplastie veineuse ; l’anastomose peut utiliser l’artifice de Linton, surtout si la veine est de petit calibre ; la prothèse est ensuite sectionnée obliquement au ras de l’anastomose et refermée en surjet ; la terminalisation de l’anastomose ainsi réalisée réduirait les conséquences hémodynamiques délétères de l’anastomose latérale ; – soit mieux encore : à choisir la solution du pontage séquentiel si les conditions anatomiques le permettent. Outre les complications analogues à celles des pontages veineux et prothétiques, les pontages mixtes sont exposés au risque particulier de faux anévrysme et surtout de sténose de l’anastomose intermédiaire. Le faux anévrysme peut être dépisté par la surveillance clinique et surtout échographique et traité simplement par résection-greffe. La sténose procède habituellement d’une hyperplasie myo-intimale (HMI) analogue à celle qui se développe au niveau des anastomoses prothétoartérielles distales. De survenue précoce, la sténose est diagnostiquée au mieux par échodoppler. L’angioplastie transluminale est souvent décevante dans le traitement de ces sténoses qui relèvent d’angioplasties d’élargissement ou d’une résection greffe. Le pontage mixte doit être préféré au pontage prothétique fémorojambier même si la brièveté du segment veineux disponible ne permet pas de reporter l’anastomose intermédiaire en amont de l’interligne articulaire. L’association du PTFE au matériel veineux donnait les meilleurs résultats dans l’étude de Feinberg [14]. Techniques chirurgicales PONTAGES SÉQUENTIELS, MIXTES ET PROTHÉTIQUES. PONTAGES AVEC MATÉRIEL VEINEUX AUTOLOGUE AUTRE QUE LA VEINE GRANDE SAPHÈNE. PONTAGES AVEC ALLOGREFFES VASCULAIRES 8 Anastomose intermédiaire latéroterminale. La veine est implantée dans la prothèse : la section suture de la prothèse au ras de l’anastomose permet de terminaliser celle-ci. 43-029-I niveau fémoropoplité les pontages en PTFE avec ou sans renforcement externe n’a pas démontré d’avantage significatif en faveur des prothèses renforcées, notamment au niveau sous-articulaire [19]. L’addition d’une interface en carbone dans la lumière prothétique a fait l’objet d’une étude prospective dont les résultats préliminaires ne démontraient pas d’avantage significatif par rapport aux prothèses en PTFE conventionnelles [3] ; à plus long terme, les résultats étaient plus favorables aux prothèses revêtues de carbone, mais la différence observée n’était pas statistiquement significative (perméabilité secondaire à 2 ans : 54 % versus 38 %). L’adjonction d’un traitement à l’antivitamine K au long cours améliorerait selon Kreschtmer [26] et Flinn [15] la perméabilité à long terme des pontages prothétiques infrapoplités (37 % à 4 ans pour Flinn versus 12 % dans l’étude prospective de Veith [47]). Dacront 9 Une veine de petit calibre peut être anastomosée sur un patch veineux (technique de Linton). Les taux actuariels de perméabilité au niveau fémorojambier varient de 30 % à 2 ans [14] à 28 % à 5 ans [15] et sont nettement supérieurs à ceux obtenus par Londrey [29] avec le seul matériel prothétique sans artifice au niveau de l’anastomose distale (7 % à 5 ans). Au niveau fémoropoplité sous-articulaire, l’étude de Hall [20] suggère que le pontage mixte serait supérieur au pontage en PTFE lorsque le réseau artériel d’aval est de mauvaise qualité. Pontages prothétiques Matériaux En dépit d’une recherche exhaustive du capital veineux par l’examen clinique et surtout par échodoppler, il est fréquemment nécessaire de recourir à des matériels prothétiques dont le plus couramment utilisé est le PTFE. La veine ombilicale semble fournir les meilleurs taux de perméabilité mais, à long terme, ce type de matériel expose au risque de dégradation anévrysmale avec une fréquence inquiétante [25, 42] et son utilisation est interdite en France, depuis 1995, pour des raisons de nonconformité aux normes sécuritaires en vigueur depuis le décret de loi du 24 mars 1994. Polytétrafluoroéthylène Le problème majeur de ce matériau est la forte incidence de thromboses précoces le plus souvent inexpliquées ; en l’absence de problème technique, la perméabilité est habituellement restaurée par une simple thrombectomie qui est plus facile et plus complète que pour un Dacront, ou une veine. Les thromboses tardives ont comme cause principale la progression des lésions artérielles distales (40 % dans l’expérience de Quinonesbaldrich [37]) associées une fois sur deux à une sténose de l’anastomose distale par HMI [18] ; les prothèses en PTFE semblent en effet stimuler une réaction d’HMI anastomotique avec une fréquence plus élevée que les autres matériels prothétiques. La thrombectomie associée à une angioplastie chirurgicale ou endoluminale de la sténose anastomotique donne des résultats décevants au niveau infrapoplité, et certains auteurs jugent préférable de réaliser d’emblée un nouveau pontage, de préférence veineux [37]. Parmi les améliorations apportées aux prothèses en PTFE, le calibre progressivement décroissant n’a pas fait jusqu’à présent la preuve de son efficacité. La paroi mince permet de réaliser l’anastomose sur les artères de petit calibre dans de meilleures conditions techniques. Le support externe par addition d’anneaux, destiné à prévenir le risque de plicature et d’écrasement aux plis de flexion, pourrait altérer la biostabilité de la prothèse [18] ; en outre, une étude prospective randomisée comparant au Il n’est plus utilisé que par de rares équipes au niveau sous-inguinal ; pourtant, rien ne permet de penser que les résultats obtenus avec ce type de matériel seraient inférieurs à ceux du PTFE, en tout cas au niveau fémoropoplité. Une étude prospective randomisée comparant PTFE et Dacront (polyester tricoté imprégné de collagène) au niveau poplité sus-articulaire a fait état de résultats comparables en termes de morbimortalité et de perméabilité (perméabilité primaire à 5 ans de 67 % pour le Dacront versus 57 % pour le PTFE [1]. En dehors de leurs inconvénients spécifiques, les substituts artériels biologiques ou synthétiques ont en commun un risque infectieux plus élevé que celui du matériel veineux et dont les conséquences sont souvent dramatiques. En dehors de rares exceptions, l’infection d’une prothèse impose habituellement son exérèse et se complique souvent d’une amputation haute. La préparation du patient et notamment de la région inguinale revêt, de ce fait, une importance particulière ; la préparation cutanée doit être débutée plusieurs jours avant l’opération avec des solutions antiseptiques (Bétadinet), et les éventuels foyers infectieux distaux soigneusement détergés. Technique Un diamètre prothétique de 7 ou 8 mm est adapté à la région fémoropoplitée, le diamètre de 6 mm voire 5 mm à la région fémorojambière. La technique d’implantation diffère peu de celle d’une greffe veineuse : la taille de la prothèse est faite en « palette », en arrondissant le sommet et le talon pour éviter le risque de sténose au niveau des angles de l’artériotomie. La tendance anévrysmale de l’anastomose est prévenue par une taille évitant l’excès de largeur de la palette. La longueur de la palette doit être égale à environ deux fois le diamètre de la prothèse, soit un angle de coupe proche de 60°. L’anastomose proximale est faite en premier ; la suture entre le matériel rigide et l’artère est facilitée par la technique du surjet suspendu. La technique d’anastomose doit être rigoureuse, car la rigidité de la prothèse ne tolère pas les imperfections de la suture, notamment au niveau des angles ; ainsi, une insuffisance de longueur de la palette par rapport à l’artériotomie se complique d’une sténose au niveau de l’angle distal par tension excessive de la suture sur l’artère ; ce problème peut être prévenu par une section adéquate de la palette et le passage d’un point provisoire à l’angle distal qui bâtit l’anastomose. En cas d’emploi du PTFE, l’utilisation d’un fil du même matériau limite le saignement au niveau des trous d’aiguille et facilite le serrage du surjet suspendu, du fait des propriétés de glissement de ce fil. La tunnellisation peut adopter un trajet sous-cutané ou anatomique ; le trajet sous-cutané externe semble réduire le risque de plicature en flexion avec ses conséquences délétères sur la perméabilité. La réalisation de l’anastomose inférieure est analogue à celle d’un pontage veineux. Le clampage de la prothèse au ras de l’anastomose proximale, pendant la confection de l’anastomose distale, doit être le plus atraumatique possible ; les clamps de Fogarty habillés de gaines souples remplissent cette condition. Le contrôle artériographique est réalisé selon les modalités habituelles avec mise en place d’un Cathlon 19 G à la partie supérieure du pontage (ou mieux encore dans l’artère d’amont) et réalisation de clichés en circulation libre sous amplificateur de brillance numérisé. page 5 43-029-I PONTAGES SÉQUENTIELS, MIXTES ET PROTHÉTIQUES. PONTAGES AVEC MATÉRIEL VEINEUX Techniques chirurgicales AUTOLOGUE AUTRE QUE LA VEINE GRANDE SAPHÈNE. PONTAGES AVEC ALLOGREFFES VASCULAIRES Moyens d’améliorer les résultats des pontages sous-poplités prothétiques L’échec des pontages prothétiques anastomosés sur des artères de petit calibre dépend de plusieurs facteurs dont les plus fortement invoqués sont la forte thrombogénicité de la paroi prothétique, la progression de l’atteinte artérielle d’aval et surtout le développement d’une sténose par HMI au niveau de l’anastomose distale. La thrombogénicité de la paroi prothétique pourrait, au moins en théorie, bénéficier d’un ensemencement cellulaire. Le recouvrement de la surface thrombogène du matériel prothétique par une couche de cellules endothéliales douées de propriétés antithrombotiques est intellectuellement séduisant, mais peu d’évaluations cliniques des techniques d’ensemencement cellulaire ont été réalisées à ce jour. La vulgarisation de ce procédé pose de plus des problèmes techniques actuellement non résolus. Les moyens pharmacologiques de prévention de l’HMI se sont avérés jusqu’à présent de peu d’effet. Parmi les procédés imaginés pour améliorer la perméabilité des pontages prothétiques distaux, les plus intéressants sont l’addition d’une fistule artérioveineuse (FAV) distale et l’interposition de matériel veineux au niveau de l’anastomose distale. Interposition de matériel veineux au niveau de l’anastomose distale L’interposition d’un patch veineux au niveau de l’anastomose distale a été proposée par Linton en 1973 [27]. Elle consiste à réaliser un patch veineux au niveau de l’artériotomie et à anastomoser ensuite le tube prothétique au milieu de ce patch. Ce procédé facilite la réalisation de l’anastomose, mais il n’a jamais fait la preuve de son efficacité ; les meilleurs résultats obtenus avec cette technique sont à l’actif de Batson [5] avec 65 % de perméabilité à 3 ans pour 68 pontages prothétiques effectués pour sauvetage de membre. En 1986, Buth [7] proposait un autre type d’interposition veineuse entre veine ombilicale et artère de jambe pour éviter la protrusion des berges suturées de la veine ombilicale dans la lumière artérielle. À l’aide d’un court segment veineux de 2 ou 3 cm, l’auteur réalisait l’équivalent d’une anastomose conventionnelle puis refendait longitudinalement le tube veineux à sa face antérieure et anastomosait la veine ombilicale sur la palette veineuse ainsi obtenue. Patch de Taylor (fig 10) [45] : la technique décrite par Taylor consiste à insérer un large patch veineux à cheval sur l’artériotomie et la prothèse ; l’artériotomie distale est faite sur 2,5 à 3 cm et le greffon prothétique est anastomosé sur le premier centimètre ; la face supérieure du greffon est ensuite incisée sur 2 cm dans l’axe de l’artériotomie et un large patch veineux est inséré à cheval sur l’artériotomie et la prothèse. La longueur du patch ainsi réalisé est d’environ 5 cm. L’auteur propose d’effectuer également un patch de 3 cm sur l’anastomose proximale. À propos d’une série rétrospective de 83 pontages fémorotibiaux prothétiques (PTFE), dont l’anastomose distale était réalisée selon sa technique originale, Taylor [45] fait état d’une perméabilité actuarielle de 54 % à 5 ans, très nettement supérieure aux chiffres publiés dans la littérature avec ce type de matériel. Cette technique est en cours d’évaluation dans une étude prospective randomisée aux États-Unis, comparant les pontages prothétiques sous-inguinaux avec et sans patch de Taylor. En 1979, Siegman [41] préconisait l’emploi d’une collerette veineuse en tout point similaire à la description qu’en fit Miller en 1984 pour les anastomoses entre artère et matériel prothétique [31]. Ce procédé (fig 11) consiste à interposer entre la prothèse et l’artère une collerette veineuse (ou cuff) suturée aux berges de l’artériotomie. Un court segment veineux de trois ou quatre fois la longueur de l’artériotomie est incisé longitudinalement, puis suturé à l’artériotomie distale par un surjet de fil Monobrin 7/0. Les extrémités de la collerette ainsi réalisée sont suturées l’une à l’autre. Après recoupe oblique, la prothèse est ensuite anastomosée sur la collerette par un surjet de fil Monobrin 6/0. Au plan technique, ce procédé facilite la réalisation de l’anastomose, permettant notamment un placement précis des points au niveau des extrémités de l’artériotomie. Selon Miller, cette technique aurait également l’intérêt de réaliser une chambre de compliance intermédiaire entre prothèse et artère, susceptible de réduire l’HMI. L’expérience clinique initiale de l’auteur portait sur 29 pontages fémorojambiers dont 21 étaient perméables avec un suivi moyen de page 6 10 Patch de Taylor. Le patch veineux est inséré à cheval sur la prothèse et l’artériotomie. A B 11 Procédé de Miller. A. La veine incisée longitudinalement est anastomosée aux berges de l’artériotomie et ses deux extrémités suturées l’une à l’autre. B. La prothèse recoupée en « palette » est anastomosée sur l’anneau veineux. 8 mois [31]. Avec cette technique, Wolfe et Tyrrel [50] ont rapporté une série de 55 pontages prothétiques longs (> à 70 cm) en PTFE sur les artères de jambe avec une perméabilité actuarielle de 52 % à 3 ans. Sous le nom de Saint-Mary’s-Boot, Tyrrel et Wolfe [46] ont proposé en 1991 une modification de la cuff de Miller où l’extrémité de la collerette est suturée à la partie distale de l’artériotomie (fig 12) ; le reste de la suture est réalisé selon la technique originale ; la partie redondante de la collerette est partiellement réséquée. Les auteurs espèrent que Techniques chirurgicales PONTAGES SÉQUENTIELS, MIXTES ET PROTHÉTIQUES. PONTAGES AVEC MATÉRIEL VEINEUX AUTOLOGUE AUTRE QUE LA VEINE GRANDE SAPHÈNE. PONTAGES AVEC ALLOGREFFES VASCULAIRES 43-029-I 13 Fistule artérioveineuse au niveau de l’anastomose distale. Un surjet d’adossement est fait entre l’artère et la phlébotomie et la prothèse anastomosée sur l’ostium commun ainsi créé. 2 ans) ; ce résultat n’a toutefois pas été confirmé par une étude prospective randomisée belge ou les perméabilités des pontages avec et sans cuff étaient à peu près comparables [33]. Au niveau infrapoplité, le taux de perméabilité à 4 ans des pontages sans cuff est de 21 % dans la méta-analyse de Dalman [10] et de 12 % dans l’étude prospective de Veith [47]. Si la plupart des études rétrospectives concluent à une supériorité des pontages avec cuff, il faut noter toutefois que la seule étude comparative randomisée réalisée à ce niveau n’a pas objectivé de différence statistiquement significative entre les deux types de pontage (37 % versus 53 % à 2 ans pour les pontages avec et sans cuff) [33]. 12 Augmentation du débit par adjonction d’une fistule artérioveineuse distale Saint-Mary’s-boot : collerette de Miller modifiée par Tyrrel et Wolfe. l’amélioration du profil de la cuff se traduise par un gain hémodynamique avec une réduction des turbulences. Une nouvelle modification a été proposée en 1995 par Karacagil [24] où la collerette veineuse fait l’objet d’une coupe en forme de V, dont la pointe est suturée au talon de la prothèse ; cette technique améliorerait encore, selon l’auteur, le profil hémodynamique de la cuff ; 21 pontages sous-inguinaux ont été réalisés avec cette technique (dont 10 sur artères de jambe) avaient une perméabilité actuarielle de 69 % à 1 an. L’adjonction d’une FAV au niveau de l’anastomose distale a pour effet d’abaisser les résistances périphériques et, par voie de conséquence, d’augmenter le débit et la vitesse du flux sanguin dans le pontage. La vitesse circulatoire est ainsi augmentée bien au-delà du seuil critique de vélocité au-dessous duquel un pontage prothétique a toute chance de se thromboser [35] ; l’augmentation du débit réduirait l’incidence de l’HMI au niveau de l’anastomose distale. La fistule est réalisée entre l’artère revascularisée et une veine adjacente, soit au niveau de l’anastomose distale selon la technique décrite par Dardik [11], soit en amont ou en aval de celle-ci. Résultats Au niveau de l’anastomose distale Au niveau poplité sus-articulaire, les taux de perméabilité primaire des pontages prothétiques sont respectivement de 67 % à 5 ans pour le Dacront et de 57 % pour le PTFE dans l’étude prospective randomisée d’Abbott et al [1]. Dans la méta-analyse de Michaels [30], les perméabilités secondaires des pontages en PTFE sont proches de 45 % à 5 ans. Au niveau poplité sous-articulaire, les taux de perméabilité des pontages prothétiques (PTFE) réalisés sans artifice au niveau de l’anastomose distale varient de 22 % [13] à 54 % à 4 ans [47]. Dans l’étude prospective randomisée réalisée au Royaume-Uni [44] comparant les pontages prothétiques avec et sans cuff, il existait une différence statistiquement significative en faveur des pontages avec cuff (52 % versus 29 % à C’est la technique la plus utilisée ; l’usage de la bande d’Esmarch permet de limiter au minimum la dissection de l’artère et de la veine adjacente. La longueur de la phlébotomie faite en regard de l’artériotomie est controversée : la plupart des auteurs lui donnent la même longueur que l’artériotomie, d’autres préconisent de réduire sa longueur au tiers de celle de l’artériotomie (fig 13) pour éviter un hyperdébit générateur de vol vasculaire. Sous agrandissement optique, un surjet d’adossement entre la phlébotomie et la partie adjacente de l’artériotomie est réalisé au fil 7/0. Le pontage est ensuite anastomosé sur l’ostium commun créé par l’adossement de la veine et de l’artère page 7 43-029-I PONTAGES SÉQUENTIELS, MIXTES ET PROTHÉTIQUES. PONTAGES AVEC MATÉRIEL VEINEUX Techniques chirurgicales AUTOLOGUE AUTRE QUE LA VEINE GRANDE SAPHÈNE. PONTAGES AVEC ALLOGREFFES VASCULAIRES En amont La fistule est faite 2 ou 3 cm en amont du site de l’anastomose distale au niveau d’une zone artérielle souple préalablement repérée [32]. Pour éviter d’être gêné par le pontage, il vaut mieux réaliser la fistule d’emblée, avant l’anastomose distale. Sous bande d’Esmarch, l’artère et la veine sont incisées en regard sur une longueur équivalente. La longueur idéale à donner à la fistule selon les études expérimentales est de 5 mm [35] ; une fistule de ce calibre, non seulement augmente le débit dans le pontage et l’artère réceptrice, mais préserve également la perfusion distale. Une fistule de calibre supérieur expose au risque d’hémodétournement. L’anastomose latérolatérale est faite au fil Monobrin 6 ou 7/0 sous agrandissement optique en démarrant le surjet au niveau d’un angle ou au milieu des berges postérieures ; la réalisation de l’anastomose peut être facilitée par l’introduction d’une sonde tutrice dans l’artère à partir de l’artériotomie sous-jacente, destinée à recevoir le pontage. En aval Après réalisation de l’anastomose distale, la FAV est faite sur l’artère réceptrice, selon la technique décrite (cf supra), à une distance qui peut varier de 5 à 15 cm ; certains auteurs proposent même de reporter la FAV au niveau de la cheville par une voie d’abord séparée [35]. Chaque site a ses avantages et ses inconvénients propres : la technique la plus répandue consiste à effectuer la fistule au niveau de l’anastomose distale ; cette solution a l’avantage d’une relative simplicité et préserve l’intégrité de l’artère réceptrice en amont et en aval ; cependant, la présence de la fistule au niveau de l’anastomose est un facteur de turbulences et donc potentiellement d’HMI [32, 33, 34, 35] ; en outre, le risque d’hémodétournement par la fistule aux dépens du réseau artériel distal semble plus important que lorsque la fistule est située à distance de l’anastomose. La situation de la fistule en amont et surtout en aval de l’anastomose aurait plusieurs avantages : – elle évite les flux turbulents au niveau de l’anastomose distale [35] ; – elle augmente le flux dans l’artère réceptrice ; – le segment artériel compris entre l’anastomose et la fistule constituerait un frein susceptible de réduire le débit dans la fistule et donc le risque d’hémodétournement [32] ; Association d’une « cuff » et d’une FAV Elle a été proposée par Harris [21] ; les flux turbulents engendrés par la fistule au niveau de l’anastomose distale stimuleraient, à moyen terme, l’apparition d’une HMI que l’adjonction d’une collerette veineuse pourrait prévenir. Dans une étude personnelle, l’auteur a comparé des pontages prothétiques infrapoplités réalisés selon cette technique à des pontages avec FAV isolée et à une série contemporaine de pontages veineux infrapoplités ; les taux de perméabilité à 2 ans étaient respectivement de 62 %, 28 % et 68 % (différence statistiquement significative entre groupes I et II : p < 0,01) [21]. La technique proposée par Ascer [2] s’inspire du même principe ; l’auteur interpose entre la prothèse et l’artère réceptrice une veine profonde jouant le rôle de la cuff. Une veine satellite de l’artère est sectionnée après ligature d’amont et anastomosée sur l’artériotomie (fig 14) ; la prothèse est ensuite anastomosée sur cette veine. À propos de 68 pontages prothétiques infrapoplités réalisés avec cette technique, Ascer fait état d’un taux de perméabilité primaire assistée de 62 % à 3 ans. Pontages avec matériel veineux autologue autre que la veine grande saphène Les résultats médiocres des pontages prothétiques infragéniculés justifient d’effectuer une exploration préalable complète du capital veineux autologue disponible en l’absence de VGS homolatérale. Dans cette circonstance, la VGS controlatérale reste pour la plupart des équipes le matériel de pontage utilisé de première intention sauf en cas d’ischémie critique pouvant faire l’objet d’une revascularisation à plus ou moins brève échéance. Les veines des membres supérieurs et les VPS constituent une réserve de matériel veineux autologue peu utilisée et souvent disponible. Le page 8 14 Procédé d’Ascer. capital veineux comprend également les veines profondes fémorales superficielles et poplitées dont l’utilisation reste à ce jour anecdotique. Veines du membre supérieur Elles offrent un capital veineux souvent utilisable. En 1969, Kakkar montrait que la veine céphalique était de longueur suffisante pour aller de l’artère fémorale commune à l’artère poplitée basse et pouvait résister à des pressions de 400 mmHg. D’excellents résultats ont été obtenus avec ce matériel [4]. La veine céphalique peut être prélevée en continuité, du sillon deltopectoral à la tabatière anatomique par une incision continue ; la longueur de veine ainsi obtenue permet de réaliser un pontage fémorojambier. Le diamètre du conduit après implantation est d’environ 5 à 7 mm, de 1 à 2 mm supérieur à celui de la VGS ; le calibre presque uniforme d’une extrémité à l’autre justifie l’utilisation en position inversée. On peut également utiliser la veine basilique ou encore son segment brachial en continuité avec la veine céphalique antibrachiale (fig 15) ; ces deux combinaisons fournissent une longueur suffisante pour réaliser un pontage fémoropoplité. Lorsque les veines de l’avant-bras sont inutilisables, on peut prélever d’un seul tenant, comme l’a montré Logerfo [28], la veine basilique, la veine intermédiaire du coude et la veine céphalique (fig 16) ; ces deux veines sont plus larges que les veines de l’avant-bras et offrent, bout à bout, une longueur suffisante pour effectuer un pontage infragéniculé. Le prélèvement d’un seul tenant n’est possible que si la veine intermédiaire du coude est perméable : cela peut être habituellement déterminé par l’examen clinique aidé d’un garrot. Cependant, l’échodoppler est le plus souvent nécessaire pour compléter les données de l’examen clinique ; il précise le siège des collatérales et d’éventuelles lésions pariétales engendrées par des ponctions antérieures ; le diamètre proximal et distal de la veine est déterminé au mieux sous garrot, et l’examen est terminé par un marquage de la veine et de ses collatérales qui facilite le temps de prélèvement. Dès que l’utilisation des veines d’un membre supérieur est envisagée, il faut interdire toute perfusion ou ponction veineuse. Lorsque le calibre du réseau veineux de l’avant-bras déterminé au mieux par échodoppler et sous garrot apparaît « limite » pour le pontage (proche de 2,5 mm), certains ont proposé d’effectuer une artérialisation temporaire du réseau de l’avant-bras afin d’en augmenter le calibre [6, 39] ; une FAV peut être ainsi réalisée au poignet entre la veine céphalique et l’artère radiale par une anastomose latérale. D’autres sites anastomotiques sont possibles en fonction de l’anatomie du réseau veineux (anastomose entre la veine basilique au poignet et l’artère cubitale, anastomose latérale au pli du coude entre veine intermédiaire PONTAGES SÉQUENTIELS, MIXTES ET PROTHÉTIQUES. PONTAGES AVEC MATÉRIEL VEINEUX AUTOLOGUE AUTRE QUE LA VEINE GRANDE SAPHÈNE. PONTAGES AVEC ALLOGREFFES VASCULAIRES Techniques chirurgicales 43-029-I du membre supérieur effectué par des incisions continues doit être très minutieux ; les collatérales doivent être squelettisées avant ligature pour éviter des brides rétractiles. Une fois la veine exposée, une infiltration périveineuse est faite avec du sérum hépariné additionné de papavérine pour prévenir le spasme. En dépit de ces précautions, le spasme complique habituellement le prélèvement ; il peut être levé en injectant par le bout périphérique de la veine du sérum ou du sang hépariné ; le risque d’hyperpression est évité si l’on prend soin, lors de l’injection, de ne pas clamper l’extrémité distale de la veine. Si les veines basilique et céphalique ont été prélevées en continuité, la veine basilique, du fait de son calibre plus important, est utilisée non inversée et la veine céphalique inversée ; les congruences anastomotiques sont ainsi plus favorables, notamment entre la partie distale de la céphalique et une artère poplitée basse ou jambière. Après réalisation de l’anastomose supérieure, la destruction des jeux valvulaires de la veine basilique utilisée non inversée est faite à l’aide d’un valvulotome conventionnel ou d’un valvulotome de Mills introduit par le moignon de veine céphalique antibrachiale gardé dans ce but. Après vérification du flux obtenu, le moignon de veine céphalique est refermé et l’anastomose distale peut être réalisée. 15 Diverses possibilités d’utilisation des veines du membre supérieur. AEB : veine céphalique ; CD : veine basilique ; AEC : veine céphalique, veine intermédiaire du coude, veine basilique. et artère humérale...). Un délai de 10 à 15 jours et quelques séances de garrottage seraient suffisants pour obtenir une dilatation significative du réseau veineux. Technique L’anesthésie générale est impérative ; la réalisation simultanée du temps de prélèvement et des voies d’abord par deux équipes permet de réduire la durée opératoire. En raison de leur finesse, le prélèvement des veines L’implantation doit être faite de préférence en sous-cutané pour faciliter la surveillance ultérieure, car les veines du membre supérieur présentent, à distance, une certaine tendance à la dilatation, justifiant une surveillance clinique et échographique suivie. Le trajet sous-cutané permet en outre une autosurveillance par le patient et une plus grande accessibilité pour le traitement endoluminal ou chirurgical des complications. Résultats Les taux de perméabilité actuarielle des revascularisations sousinguinales effectuées avec les veines des membres supérieurs sont très discordants, variant de 43 à 85 % à 1 an en fonction des séries [43]. Les taux très différents de malades diabétiques d’une série à l’autre (27 à 80 %) expliqueraient selon Stonebridge la dispersion des résultats [43]. À propos de 102 pontages sous-inguinaux (dont 52 % étaient 1 3 2 2 3 3 2 4 16 Utilisation des veines basilique et céphalique en continuité pour réaliser un pontage infrapoplité (Logerfo avec autorisation de l’auteur). 1. Veine axillaire ; 2. veine céphalique ; 3. veine basilique ; 4. artère tibiale postérieure ; 5. artère fémorale. 5 page 9 43-029-I PONTAGES SÉQUENTIELS, MIXTES ET PROTHÉTIQUES. PONTAGES AVEC MATÉRIEL VEINEUX Techniques chirurgicales AUTOLOGUE AUTRE QUE LA VEINE GRANDE SAPHÈNE. PONTAGES AVEC ALLOGREFFES VASCULAIRES infrapoplités) réalisés avec des veines des membres supérieurs non compilées, Harris [22] obtenait 82 % de perméabilité à 1 an et 60 % à 5 ans. La série de Balshi [4] portait sur 36 pontages dont 58 % étaient infrapoplités ; les pontages réalisés avec des veines du membre supérieur d’un seul tenant avaient des perméabilités primaire et secondaire de 73 et 82 % à 1 an. Les pontages compilés résultant de segments anastomosés de veines des membres supérieurs avaient des perméabilités primaire et secondaire de 53 et 66 % à 1 an. Dans la même série, les pontages infrapoplités avaient une perméabilité secondaire à 1 an de 79 %. Une réduction statistiquement significative des thromboses postopératoires était obtenue grâce au contrôle angioscopique peropératoire dans la série de Stonebridge [43]. L’expérience de Gentile et al [16] portait sur 187 pontages réalisés au niveau fémoropoplité (54 cas) et jambier (133 cas) avec du matériel veineux autre que la VGS. Les veines des membres supérieurs étaient utilisées dans 144 pontages (77 %) de façon exclusive dans 97 cas ou partielle dans 47 cas ; la VPS était utilisée dans 11 cas et la veine fémorale superficielle dans cinq cas. Sur 114 pontages qui résultaient de la compilation de plusieurs segments veineux d’origines diverses, il y avait une anastomose intermédiaire dans 87 cas (76 %) et deux anastomoses ou plus dans 27 cas. Les taux de perméabilité primaire assistée étaient de 63 % à 5 ans pour les pontages fémoropoplités et de 72 % pour les pontages fémorojambiers. Ces résultats étaient comparables à ceux obtenus par l’auteur avec la VGS comme matériel de pontage. L’expérience la plus importante en matière d’utilisation des veines des membres supérieurs est celle d’Hölzenbein [23] ; en l’absence de VGS homolatérale, l’auteur choisit de première intention les veines des membres supérieurs comme matériel de pontage. La sélection des veines était aidée par l’utilisation routinière de l’angioscopie qui a permis de guider des gestes de correction dans 52 % des cas pour améliorer la qualité du conduit. Sur 199 pontages réalisés d’un seul tenant et 51 avec des veines compilées, il y avait 114 pontages fémorotibiaux, 41 fémoropoplités et 33 poplitédistaux. La veine céphalique était utilisée dans 86 % des pontages et constituait l’unique matériel de pontage dans 50 % des cas. Les veines basilique et céphalique utilisées en continuité selon la technique de Logerfo représentaient 35,6 % des pontages. La perméabilité primaire assistée à 1 an de l’ensemble des pontages était de 70,6 %, et la perméabilité secondaire de 77 %. À 3 ans, le taux de perméabilité primaire était de 52 % pour les pontages effectués de première intention, de 42 % pour les pontages itératifs et de 57 % pour les pontages ayant fait l’objet d’une réparation avec les veines des membres supérieurs. D’autres auteurs ont fait état de résultats plus modestes ; pour Calligaro et al [8], les taux de perméabilité primaire assistée et secondaire étaient respectivement de 46 et 55 % à 2 ans. Dans cette série, les meilleurs résultats étaient à l’actif des pontages effectués avec un matériel veineux d’un seul tenant (perméabilité primaire assistée à 2 ans de 55 % et secondaire de 64 %). Dans l’expérience de Sesto et al [39], 34 pontages dont 25 infragéniculés, les taux de perméabilités primaire et secondaire étaient respectivement de 40 et 46 % à 3 ans. Veine petite saphène Longtemps ignorée en raison des problèmes posés par son prélèvement, la VPS représente une autre alternative intéressante en l’absence de VGS. D’après Weaver [49], les VPS seraient utilisables dans 85 %, des cas pour un pontage. Dans l’expérience d’Ouriel [34], la VPS était utilisable chez 72 % des patients relevant d’une revascularisation souspoplitée. L’appréciation clinique de la VPS étant souvent difficile, il peut être nécessaire de demander un échodoppler pour connaître l’anatomie de la veine, ses tailles proximale et distale, le siège de ses principales collatérales et son mode de terminaison dans la veine poplitée. Technique Le prélèvement est réalisé, malade en décubitus ventral, par une incision continue centrée par le repérage échographique. Les deux VPS compilées permettent d’effectuer un pontage fémorojambier. Dans les indications de pontage entre l’artère poplitée basse et une artère à la cheville, la VPS peut être utilisée in situ selon la technique décrite page 10 par Shandall [40]. Le malade étant en décubitus dorsal, l’artère poplitée est abordée par une incision rétrotibiale conventionnelle agrandie largement vers le bas pour permettre d’aborder par un décollement sousaponévrotique la partie terminale de la VPS ; après section de sa partie distale, la veine est mobilisée suffisamment pour l’amener au contact de l’artère poplitée. Les collatérales repérées lors de la dissection sont liées. La partie basse de la veine est abordée séparément et peut être anastomosée, soit à l’artère tibiale postérieure au prix d’un court tunnel sous-cutané, soit à l’artère tibiale antérieure après création d’un tunnel à travers le muscle et la membrane interosseuse. Après réalisation de l’anastomose proximale, la destruction valvulaire peut être faite sous contrôle angioscopique avec le valvulotome de Mills, ou de façon habituelle à l’aide d’un valvulotome conventionnel. Une variante de cette technique d’utilisation in situ de la VPS consiste à effectuer tout ou partie du pontage en décubitus ventral. La crosse de la saphène est disséquée par une incision en « baïonnette » dans le creux poplité ou par une incision transversale large, en regard ou un peu audessus du pli du genou, en fonction des données du repérage échographique préopératoire. La saphène sectionnée au ras de la veine poplitée peut être aisément anastomosée sur l’artère poplitée adjacente. La destruction valvulaire est effectuée après section de la saphène à la cheville. Le pontage peut être ensuite anastomosé : – sur l’artère tibiale postérieure, soit dans sa partie supérieure par une incision para-achilléenne interne, soit plus distalement dans sa partie rétro- et même sous-malléolaire jusqu’à sa bifurcation, la cheville et le dos du pied étant appuyés sur un billot et le pied maintenu en valgus ; – sur l’artère fibulaire dont l’abord de la partie distale est aisé par voie postérieure [48] jusqu’à sa bifurcation, l’anastomose pouvant même être faite distalement sur la branche de division postéro-interne lorsque celle-çi est hypertrophiée et reprend en charge l’arche malléolaire ; – soit enfin sur l’artère tibiale antérieure basse ou l’artère pédieuse, après fermeture des voies d’abord et réinstallation du malade en décubitus dorsal, le pontage étant tunnellisé soit en sous-cutané en avant de la malléole interne, soit à travers la membrane interosseuse. Résultats Dans l’expérience de Weaver [49], la VPS a été utilisée dans 29 cas isolément pour réaliser une revascularisation de la poplitée sousarticulaire dans quatre cas et des artères de jambe dans 25 cas avec un taux actuariel de perméabilité de 60 %, à 3 ans. Dans 14 cas, la VPS a été utilisée en association avec du matériel autologue avec un taux de perméabilité de 47 % à 1 an et 38 % à 18 mois. Ouriel [34] a effectué une revascularisation poplitée jambière par voie postérieure à l’aide de la VPS chez 21 patients ; 81 % des patients étaient diabétiques ; l’anastomose supérieure du pontage était située sur l’artère poplitée sus-articulaire dans quatre cas et sous-articulaire dans 17 cas ; l’anastomose distale était faite sur le tronc tibiofibulaire dans six cas, l’artère fibulaire dans neuf cas, l’artère tibiale postérieure dans quatre cas et l’artère tibiale antérieure dans deux cas. Le taux de perméabilité primaire était de 83 % à 18 mois. Pour Calligaro [8], les résultats des pontages infrapoplités réalisés avec des VPS étaient décevants avec des taux de perméabilité primaire assistée de 23,5 % à 2 ans, comparables aux résultats des pontages infrapoplités en PTFE (26 %). Les résultats obtenus par les revascularisations utilisant les VPS compilées ou non sont donc discordants. Ce matériel semble particulièrement adapté aux revascularisations poplitées distales effectuées par voie postérieure avec la VPS utilisée in situ ou inversée. Veines fémorales superficielles et poplitées L’utilisation de la veine fémorale superficielle pour les pontages sousinguinaux a été proposée par Schulman [38] ; les veines fémorales superficielles et poplitées sont prélevées par une incision unique ou deux incisions ménageant un pont cutané. L’hémostase des collatérales est assurée par des clips. Les veines fémorales, commune et profonde, sont préservées pour assurer le drainage veineux du membre inférieur. Le prélèvement nécessite la section de l’anneau du troisième adducteur et, le cas échéant, celle des muscles et tendons internes du genou. Étant donné que la confluence des veines fémorales superficielle et commune est située 8 cm plus bas que la bifurcation artérielle, la perte de longueur impose souvent de réaliser des pontages courts, naissant de l’artère Techniques chirurgicales PONTAGES SÉQUENTIELS, MIXTES ET PROTHÉTIQUES. PONTAGES AVEC MATÉRIEL VEINEUX AUTOLOGUE AUTRE QUE LA VEINE GRANDE SAPHÈNE. PONTAGES AVEC ALLOGREFFES VASCULAIRES fémorale superficielle ou de l’artère fémorale profonde. La destruction valvulaire est faite selon la technique coutumière. La greffe est utilisée non inversée et tunnellisée en position profonde. Les anastomoses sont faites sur une longueur d’au moins 3 cm, assurant une réduction progressive du calibre de la greffe, dans le but d’améliorer les conditions hémodynamiques et, par là même, de diminuer l’incidence de l’HMI. Les veines d’un calibre supérieur à 12 mm, responsables dans l’expérience de Schulman d’un taux d’échec important, doivent être écartées ; aucun trouble trophique de type postphlébitique n’a été observé par l’auteur et l’œdème postopératoire se résorbe progressivement en quelques mois. Les résultats obtenus par Schulman au niveau fémoropoplité égalent ceux d’une série comparative de pontages effectués avec la veine saphène inversée et sont équivalents à ceux des meilleures séries de pontages veineux saphéniens (perméabilités primaire et secondaire à 3 ans de 82 et 89 %) [38] . Toutefois, aucune série n’a, jusqu’à présent, confirmé dans la littérature ces résultats. Veines compilées En cas d’insuffisance de longueur du segment veineux principal, ces divers matériels veineux peuvent être suturés entre eux, selon de multiples combinaisons, pour réaliser un pontage sous-poplité. Un soin particulier doit être apporté à la réalisation des anastomoses veinoveineuses, dont certains auteurs soulignent l’effet délétère sur la perméabilité tardive imposant une surveillance renforcée par échodoppler. Les anastomoses sont réalisées en terminoterminal, en s’aidant le cas échéant d’un tuteur ; sur les veines de petit calibre, des refends opposés permettent d’avoir une anastomose oblique longue. Une trop grande disparité de calibre peut inciter à réaliser une anastomose latérale. L’anastomose est faite sous magnification optique au fil fin (6 ou 7/0) par deux hémisurjets. En cas d’anastomose sur des veines de petit calibre (inférieur ou égal à 4 mm) des points séparés peuvent être faits sur une hémicirconférence. Dans l’étude de Harris [22], 41 pontages compilés veineux réalisés avec du matériel veineux autologue provenant des membres supérieurs et inférieurs ont été anastomosés dans 80 % des cas en infrapoplité avec un taux de perméabilité actuarielle de 73 % à 1 an. L’expérience de Chang [9] portait sur 184 pontages réalisés avec des veines compilées d’origine diverse (membre supérieur : 11 %, VPS : 28 %, VGS homo- ou controlatérale : 61 %) ; 84 % des pontages étaient infrapoplités ; les perméabilités primaires et secondaires de l’ensemble des pontages étaient de 45 % et 61 % à 4 ans. Ces taux de perméabilité étaient nettement inférieurs à ceux obtenus par l’auteur avec les 43-029-I pontages in situ d’un seul tenant. Belkin a souligné l’importance de la surveillance par échodoppler, 29 % des pontages de ce type faisant l’objet dans son expérience de révisions (chirurgicales ou endoluminales) pour des sténoses sur les sites d’anastomoses veinoveineuses. Pontages avec allogreffes vasculaires Les résultats médiocres des matériaux prothétiques de petit calibre ont relancé l’intérêt des allogreffes vasculaires. Plusieurs travaux ont souligné de plus l’excellent comportement des allogreffes artérielles en milieu infecté. La conservation en milieu nutritif à 4 °C et la cryoconservation sont les méthodes de conservation les plus employées. La conservation en milieu nutritif à 4 °C fournit des greffons riches en cellules et vivants, donc doués d’une faible thrombogénicité et résistants à l’infection, mais dont le délai d’utilisation est limité à 45 jours. La cryoconservation bénéficie actuellement de l’utilisation d’un cryoprotecteur, le diméthylsulfoxyde (DMSO) et d’une congélation par descente progressive en température. La cryoconservation diminuerait l’antigénicité du greffon et conserverait un endothélium fonctionnel. Les dégradations pariétales des allogreffes procèdent en grande partie de l’agression immunologique de la paroi artérielle. La recherche d’une identité ABO, voire d’un cross-match négatif semble de peu d’effet. La décellularisation du greffon avant son implantation, en éliminant les massifs protéiques antigéniques, supprimerait l’immunogénicité du greffon mais sensibiliserait ce dernier à l’infection. En pratique, la conservation en milieu nutritif préservant la richesse cellulaire de l’allogreffe est particulièrement adaptée au traitement des sepsis de prothèse. La décellularisation respectant la matrice extracellulaire non thrombogène et supprimant l’antigénicité créerait les conditions favorables à une perméabilité durable. À de rares exceptions près, les résultats des revascularisations infragéniculées réalisées avec des allogreffes veineuses sont décevants. À l’inverse, les allogreffes artérielles laissent entrevoir des perpectives prometteuses. En 1993, à propos de 94 allogreffes artérielles infragéniculées réalisées par trois équipes françaises pour sauvetage de membre (dont 64 pontages sur artères de jambe), les taux de perméabilité actuarielles secondaires étaient de 65 % à 18 mois (résultats non publiés). En 1995, Gournier [ 1 7 ] rapportait une série de 52 pontages infragéniculés ; il s’agissait d’une troisième revascularisation dans 77 % des cas : 30 pontages sur 52 étaient infrapoplités ; les perméabilités primaires et secondaires étaient respectivement de 43 et 65 % à 2 ans. Références [1] [2] [3] [4] Abbott WM, Green RM, Matsumoto T, and the aboveknee femoropopliteal study group. Prosthetic aboveknee femoropliteal bypass grafting: results of a multicenter randomized trial. J Vasc Surg 1997 ; 25 : 19-28 Ascer E, Gennaro M, Pollina RM, Ivanov M, Yorkovich WR, Ivanov M et al. Complementary distal arteriovenous fistula and deep vein interposition: a five-year experience with a new technique to improve infrapopliteal prosthetic bypass patency. J Vasc Surg 1996 ; 24 : 134-143 Bacourt F, et l’association universitaire de recherche en chirurgie. Prospective randomized study of carbonimpregnated polytetrafluoroethylene grafts for belowknee popliteal and distal bypass : results at 2 years. Ann Vasc Surg 1997 ; 11 : 596-603 Balshi JD, Cantelmo NL, Menzoian JO, Logerfo FW. The use of arm veins for infrainguinal bypass in endstage peripheral vascular disease. Arch Surg 1989 ; 124 : 1078-1081 [5] Batson RC, Sottiurai VS, Craighead CC. Linton patch angioplasty. An adjunct to distal bypass with polytetrafluoroethylene grafts. Ann Surg 1984 ; 199 : 684-693 [6] Beals RL. Surgically created arteriovenous fistula to augment the cephalic vein used as an arterial graft. N Engl J Med 1971 ; 285 : 29-30 [7] Buth J, Cohen RF, Lawson J. Composite femorocrural bypass using a small caliber autogenous vein cuff and an umbilical vein graft. Surg Gynecol Obstet 1986 ; 163 : 179-180 Calligaro KD, Syrek JR, Dougherty MJ, Rua I, Raviola CA, De Laurentis DA. Use of arm and lesser saphenous vein with prosthetic grafts for infrapopliteal arterial bypass: are they worth the effort ? J Vasc Surg 1997 ; 26 : 919-927 Chang BB, Darling RC, Bock DE, Shah DJ, Leather RP. The use of spliced vein bypasses for infrainguinal arterial reconstruction. J Vasc Surg 1995 ; 21 : 403-412 [8] [9] [10] Dalman RL, Taylor LM. Basic data related to infrainguinal revascularization procedures. Ann Vasc Surg 1990 ; 4 : 309-312 [11] Dardik H, Sussman B, Ibrahim IM, Kahn M, Svoboda JJ, Mendes D et al. Distal arteriovenous fistula as an adjunct to maintaining arterial and graft patency for limb salvage. Surgery 1983 ; 94 : 478-486 [12] De Laurentis DA, Friedman P. Arterial reconstruction about and below the knee. Another look.Am J Surg 1971 ; 121 : 392-397 [13] Eickhoff JH, Broome A, Ericsson BF, Buchardt Hansen HJ, Kordt KF, Mouritzen C et al. Four years’results of a prospective randomized clinical trial comparing polytetrafluoroethylene and modified human umbilical vein for belowknee femoropopliteal bypass. J Vasc Surg 1987 ; 6 : 506-511 page 11 43-029-I [14] [15] [16] [17] [18] [19] [20] [21] [22] [23] [24] [25] PONTAGES SÉQUENTIELS, MIXTES ET PROTHÉTIQUES. PONTAGES AVEC MATÉRIEL VEINEUX Techniques chirurgicales AUTOLOGUE AUTRE QUE LA VEINE GRANDE SAPHÈNE. PONTAGES AVEC ALLOGREFFES VASCULAIRES Feinberg RL, Winter RP, Wheeler JR, Gregory RT, Snyder SO, Gayle RG et al. The use of composite grafts in femorocrural bypasses performed for limb salvage: a review of 108 consecutive cases and comparison with 57 in situ saphenous vein bypasses. J Vasc Surg 1990 ; 12 : 257-263 Flinn WR, Rohrer MJ, Yao JS, McCarthy WJ, Fahey VA, Bergan JJ. Improved longterm patency of infragenicular polytetrafluoroethylene grafts. J Vasc Surg 1988 ; 7 : 685-690 Gentile AT, Lee RW, Moneta GL, Taylor LM, Edwards JM, Porter JM. Results of bypass to the popliteal and tibial arteries with alternative source of autogenous vein. J Vasc Surg 1996 ; 23 : 272-280 Gournier JP, Favre JP, Gay JL, Barral X. Cryopreserved arterial allografts for limb salvage in the absence of suitable saphenous vein: two-year results in 20 cases. Ann Vasc Surg 1995 ; 9 (suppl) : S7-S14 Guidoin R, Awad J. Les greffes artérielles. Encycl Méd Chir (Elsevier, Paris), Techniques chirurgicalesChirurgie vasculaire, 43-022-A-6,1989 : 1-12 Gupta SK, Veith FJ, Kram HB, Wengerter KR. Prospective randomized comparison of ringed and nonringed polytetrafluoroethylene femoropopliteal bypass grafts: a preliminary report. J Vasc Surg 1991 ; 13 : 162-172 Hall RG, Coupland GA, Lane R, Delbridge L, Appleberg M. Vein, GoretexT or a composite graft for femoropopliteal bypass. Surg Gynecol Obstet 1985 ; 161 : 308-312 Harris PL, Bakran A, Enabi L, Nott DM. ePTFE grafts for femorocrural bypass. Improved results with combined adjuvant venous cuff and arteriovenous fistula ? Eur J Vasc Surg 1993 ; 7 : 528-533 Harris RW, Andros G, Sallescunha SX, Dulawa LB, Oblath RW, Apyan R. Alternative autogenous vein grafts to the inadequate saphenous vein. Surgery 1986 ; 100 : 822-827 Holzenbein TJ, Pomposelli FB, Miller A, Contreras MA, Gibbons GW, Campbell DR et al. Results of a policy with arm veins used as the first alternative to an unavailable ipsilateral greater saphenous vein for infrainguinal bypass. J Vasc Surg 1996 ; 23 : 130-140 Karacagil S, Narbani A, Almgren B, Bowald S, Bergqvist D. Modified vein cuff technique for distal polytetrafluoroethylene graft anastomoses: how we do it, surgical technique. Eur J Surg 1995 ; 161 : 47-48 Karkow WS, Cranley JJ, Cranley RD, Hafner CD, Ruoff BA. Extended study of aneurysm formation in umbilical vein grafts. J Vasc Surg 1986 ; 4 : 486-492 page 12 [26] Kretschmer G, Herbst F, Prager M, Sautner T, Wenzl E, Berlakovich GA et al. A decade of oral anti coagulant treatment to maintain autologous vein grafts for femoropopliteal atherosclerosis. Arch Surg 1992 ; 127 : 1112-1115 [27] Linton RR, Wide WL. Modifications in the technique for femoropopliteal saphenous vein bypass autografts. Surgery 1970 ; 67 : 234-248 [28] Logerfo FW, Paniszyn CW, Menzoian J. A new arm vein graft for distal bypass. J Vasc Surg 1987 ; 5 : 889-891 [29] Londrey GL, Ramsey DE, Hodgson KJ, Barkmeier LD, Sumner DS. Infrapopliteal bypass for severe ischemia : comparison of autogenous vein, composite, and prosthetic grafts. J Vasc Surg 1991 ; 13 : 631-636 [30] Michaels A. Choice of material for aboveknee femoropopliteal bypass graft. Br J Surg 1989 ; 76 : 7-14 [31] Miller JH, Foreman RK, Ferguson L, Faris L. Interposition vein cuff for anastomosis of prosthesis to small artery. Aust NZ J Surg 1984 ; 54 : 283-285 [32] Moody AP, Al Fagih S, Edwards PR, Campbell H, Harris PL. The use of an adjuvant arteriovenous shunt in prosthetic femorocrural bypass. Eur J Vasc Surg 1991 ; 5 : 327-332 [33] Nevelsteen A. Vein interposition cuff at the distal anastomosis: valuable adjunctive procedure in infrainguinal synthetic arterial reconstruction ? Résumé présenté au XIIIe congrès annuel de la SCV, Paris, 29 septembre1er octobre 1998 [34] Ouriel K. The posterior approach to popliteal-crural bypass. J Vasc Surg 1994 ; 19 : 74-80 [35] Paty PS, Shah DM, Saifi J, Chang BB, Feustel PJ, Kaufman JL et al. Remote distal arteriovenous fistula to improve infrapopliteal bypass patency. J Vasc Surg 1990 ; 11 : 171-178 [36] Perler BA, Burdick JF, Melville Williams G. The multiple sequential distal bypass graft: sevenyear followup. J Vasc Surg 1987 ; 6 : 296-300 [37] Quinonesbaldrich WJ, Prego A, Ucelaygomez R, Vescera CL, Moore WS. Échecs des revascularisations sous-inguinales en PTFE, aspects cliniques, options thérapeutiques et pronostic. Ann Chir Vasc 1991 ; 5 : 163-169 [38] Schulman ML, Badhey MR, Yatco R. Superficial femoralpopliteal veins and reversed saphenous veins as primary femoropopliteal bypass grafts: a randomized comparative study. J Vasc Surg 1987 ; 6 : 1-10 [39] [40] [41] [42] [43] [44] [45] [46] [47] [48] [49] [50] [51] Sesto ME, Sullivan TM, Hertzer NR, Krajewski LP, O’Hara PJ, Beven EG. Cephalic vein grafts for lower extremity revascularization. J Vasc Surg 1992 ; 15 : 543-549 Shandall AA, Leather RP, Corson JD, Kupinski AM, Shah DM. Use of the short saphenous vein in situ for poplitealtodistal artery bypass. Am J Surg 1987 ; 154 : 240-244 Siegman FA. Use of the venous cuff for graft anastomosis. Surg Gynecol Obstet 1979 ; 148 : 930 Sommeling SA, Buth J, Jakimowicz JJ. Long-term behaviour of modified human umbilical vein grafts; late aneurysmal degeneration established by colourduplex scanning. Eur J Vasc Surg 1990 ; 4 : 89-94 Stonebridge PA, Miller A, Tsoukas A, Brophy CM, Gibbons GW, Freeman DV et al. Angioscopy of arm vein infrainguinal bypass grafts. Ann Vasc Surg 1991 ; 5 : 170-175 Stonebridge PA, Prescott RJ, Ruckley CV, for the joint vascular research group. Randomized trial comparing infrainguinal polytetrafluoroethylene bypass grafting with and without vein interposition cuff at the distal anastomosis. J Vasc Surg 1997 ; 26 : 543-550 Taylor RS, McFarland RJ, Cox ML. An investigation into the causes of failure of PTFE grafts. Eur J Vasc Surg 1987 ; 1 : 335-343 Tyrrell MR, Chester JF, Vipond MN, Clarke GH, Taylor RS, Wolfe JH. Experimental evidence to support the use of interposition vein collars/ patches in distal PTFE anastomoses. Eur J Vasc Surg 1990 ; 4 : 95-101 Veith FJ, Gupta SK, Ascer E, White-Flores S, Samson RH, Scher LA et al. Six-year prospective multicenter randomized comparison of autologous saphenous vein and expanded polytetrefluoroethylene grafts in infra inguinal arterial reconstructions. J Vasc Surg 1986 ; 3 : 104-114 Watelet J. Revascularisation des artères de jambe par voie postérieure. Encycl Méd Chir (Elsevier, Paris), Techniques chirurgicales-Chirurgie vasculaire, 43-029-H, 1995 : 1-3 Weaver FA, Barlow CR, Edwards WH, Mulherin JL, Jenkins JM. The lesser saphenous vein : autogenous tissue for lower extremity revascularization. J Vasc Surg 1987 ; 5 : 687-692 Wolfe JH, Tyrrel MR. Justifying arterial reconstruction to crural vessels even with a prosthetic graft. Br J Surg 1991 ; 78 : 897-899 Yao JS, Flinn WR. Sequential bypass grafting. In : Rutherford RB ed. Vascular surgery. Philadelphia : WB Saunders, 1989 : 597-606 Encyclopédie Médico-Chirurgicale 43-029-N 43-029-N Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) J Cron JP Becquemin Résumé. – La chirurgie des artères du membre supérieur représente moins de 3 % de l’ensemble des restaurations artérielles périphériques. Les procédés de revascularisation varient selon la localisation et l’extension des lésions. À l’étage axillaire, les pontages carotido- et sous-clavier-huméraux, utilisant une veine saphène ou un greffon prothétique, peuvent suivre un trajet anatomique ou extra-anatomique. Au niveau du bras et de l’avant-bras, les veines in situ peuvent être utilisées avec de bons résultats. Les revascularisations distales bénéficient des techniques dérivées de la microchirurgie. En l’absence de possibilité de revascularisation, la sympathectomie thoracoscopique peut améliorer les symptômes au prix d’une morbidité opératoire faible. Les techniques endovasculaires ont peu de place au membre supérieur ; elles concernent surtout les lésions axillaires. © 2000 Editions Scientifiques et Médicales Elsevier SAS. Tous droits réservés. Mots-clés : ischémie chronique, membre supérieur, artère axillaire, artère humérale, artère radiale, artère cubitale, pontage in situ, veine céphalique, veine basilique. Introduction La chirurgie des artères du membre supérieur représente moins de 3 % de l’ensemble des restaurations artérielles périphériques. Elle intéresse les artères axillaire, humérale, les artères de l’avant-bras, du poignet et de la main. Le chirurgien est rarement confronté aux lésions concernant ces artères, mais une bonne connaissance de l’anatomie et des différentes possibilités chirurgicales peut lui permettre d’éviter les erreurs techniques et les échecs. Les procédés de revascularisation varient selon la localisation et l’extension des lésions. Nous ne détaillons pas dans ce travail les revascularisations pour ischémie aiguë et traumatisme décrites ailleurs. À l’étage axillaire, les pontages carotido- et sous-clavier-huméraux, utilisant une veine saphène ou un greffon prothétique, peuvent suivre un trajet anatomique ou extra-anatomique. Au niveau du bras et de l’avant-bras les veines in situ peuvent être utilisées avec de bons résultats. Les revascularisations distales bénéficient des techniques dérivées de la microchirurgie. En l’absence de possibilité de revascularisation, la sympathectomie thoracoscopique peut améliorer les symptômes au prix d’une morbidité opératoire faible. L’efficacité des fistules artérioveineuses au membre supérieur dans le cadre d’un sauvetage de membre reste à déterminer. Les techniques endovasculaires ont peu de place au membre supérieur ; elles concernent surtout les lésions axillaires. Nous exposons dans ce travail, pour chaque localisation, les voies d’abord, les pathologies le plus fréquemment rencontrées et les différentes techniques utilisables. Chirurgie de l’artère axillaire VOIE D’ABORD L’artère axillaire est abordée le plus facilement dans le sillon deltopectoral (fig 1A). L’incision débute à la pointe de l’apophyse coracoïde aisément palpable sous la peau et s’achève 1 ou 2 cm audessus du bord libre du grand pectoral. Après avoir récliné la veine céphalique en dehors, la dissection est effectuée dans l’interstice avasculaire séparant les fibres musculaires verticales du deltoïde et horizontales du grand pectoral. Le petit pectoral est sectionné au bistouri électrique dans la portion musculotendineuse voisine de l’insertion coracoïdienne. Le plan vasculonerveux apparaît alors au sein d’un tissu adipeux dense (fig 1B). L’artère axillaire est masquée par le tronc antéroexterne et les racines du médian. Elle est passée sur un lac dont la traction douce facilite la dissection. Vers le haut, on rencontre rapidement l’artère thoracique sous-croisée par l’anse des pectoraux et la mammaire externe qui peuvent être conservées ou liées selon la longueur d’artère nécessaire à l’artériotomie. L’abord peut être étendu en haut avec une incision sus- ou sousclaviculaire. L’incision sous-claviculaire permet d’aborder l’artère sous-clavière distale. L’incision sus-claviculaire permet l’exposition de l’artère sous-clavière (fig 2, 3). L’artère carotide primitive est exposée après section du sterno-cléido-mastoïdien. L’abord peut être étendu en bas par une incision séparée brachiale interne pour l’exposition de l’artère humérale. PATHOLOGIE Jérôme Cron : Chef de clinique, assistant des hôpitaux de Paris. Jean-Pierre Becquemin : Professeur des Universitées, praticien hospitalier. Service de chirurgie vasculaire, hôpital Henri Mondor, 51, avenue du Maréchal-de-Lattre-de-Tassigny, 94010 Créteil cedex, France. ¶ Lésions De nombreuses étiologies peuvent intervenir dans la pathologie de l’artère axillaire [6, 9, 13, 19, 21, 34, 38, 42]. Citons les plus fréquentes. Toute référence à cet article doit porter la mention : Cron J et Becquemin JP. Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus). Encycl Méd Chir (Editions Scientifiques et Médicales Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales - Chirurgie vasculaire, 43-029-N, 2000, 15 p. 43-029-N Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) 1 Techniques chirurgicales 3 Abord de l’artère axillaire dans le sillon deltopectoral. A. Schéma de l’incision cutanée. B. Exposition du plan vasculonerveux après section du petit pectoral. Abord de l’artère axillaire avec extension sousclaviculaire. * A * B 2 Abord de l’artère axillaire avec extension sus- ou sous-claviculaire et humérale : schéma des incisions cutanées. 4 Artériographie axillohumérale pour ischémie chronique du membre supérieur droit : sténose athéromateuse de la terminaison de l’artère axillaire (flèche). – L’athérosclérose (fig 4) reste la cause la plus fréquente chez les sujets ayant les facteurs de risque habituels. – La maladie de Takayasu, plus rare, doit être évoquée chez la femme jeune qui présente une altération de l’état général avec syndrome inflammatoire et hypertension artérielle. Les lésions sont segmentaires et comportent des sténoses ou des occlusions, voire des dilatations anévrismales. L’atteinte sous-clavière postvertébrale est fréquente. – La maladie de Horton atteint la femme âgée dans un contexte de syndrome inflammatoire et réalise des sténoses lisses et longues ou des occlusions en « bec de flûte ». – Les lésions artérielles après irradiation axillaire et sus-claviculaire pour tumeur du sein ou hémopathie se produisent en moyenne entre 5 ans et 10 ans après l’irradiation. L’atteinte artérielle est associée en règle à une radiodermite se traduisant par une sclérose cutanée et tissulaire dense, parfois à une plexite radique responsable de douleurs intenses, voire à une fibrose ou une thrombose veineuse, éléments qui viennent compliquer la restauration artérielle (fig 5). 2 5 Artériographie axillohumérale pour nécrose de l’avant-bras, 20 ans après une irradiation de l’épaule pour tumeur de la clavicule : aspect de sténose radique (flèche). – Les syndromes du défilé thoracobrachial peuvent se compliquer de lésions de l’artère axillaire par extension vers l’aval d’un Techniques chirurgicales Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) 43-029-N 8 Mécanisme des embolies distales à partir d’un anévrisme de l’artère circonflexe postérieure [6]. 1. Anévrisme de l’artère circonflexe postérieure ; 2. microembolie ; 3. thrombus. 1 2 3 6 Artériographie axillaire pour ischémie subaiguë du membre supérieur gauche après traumatisme par étirement : aspect de sténose avec dissection intimale. 7 Aspect opératoire des lésions intimales après traumatisme fermé de l’artère axillaire. – Chez le sportif, des embolies distales peuvent provenir des altérations des branches de l’artère axillaire et notamment des artères circonflexes antérieures et postérieures. Ce syndrome a été décrit chez les joueurs de base-ball. Les mouvements importants exercés au cours du lancer de balle soumettent l’artère à un étirement puis à une dégénérescence anévrismale. Un thrombus dans la poche anévrismale peut alors emboliser dans les artères digitales (fig 8). – La ponction de l’artère axillaire lors des interventions endovasculaires à visée diagnostique ou thérapeutique est source de complications. Il peut s’agir d’hématome au point de ponction, de thrombose par décollement de plaques ou de dissection, d’embolie distale, de sténose secondaire, de faux anévrisme et de fistule artérioveineuse. Une atteinte du plexus brachial peut être à l’origine de séquelles neurologiques graves réalisant le syndrome du compartiment brachial interne. – Lors d’actes de chirurgie orthopédique, l’artère axillaire peut être lésée notamment lors des interventions pour luxation récidivante de l’épaule, pseudarthrose de la clavicule, ostéosynthèse des fractures du col huméral et résection de la première côte par voie axillaire. ¶ Physiopathologie La richesse du réseau collatéral et la faible masse musculaire du membre supérieur expliquent le faible retentissement habituel des occlusions de l’artère axillaire. Le réseau anastomotique le plus important provient des artères scapulaires inférieure et postérieure et de l’artère acromiothoracique. La réentrée se fait par les artères circonflexes ou les branches de l’humérale profonde. anévrisme sous-clavier poststénotique ou par occlusion axillo-sous-clavière. – Les plaies pénétrantes (balle, chevrotine, arme blanche, complications des drainages thoraciques ou des ponctions susclaviculaires) et les traumatismes fermés après choc sur la ceinture scapulaire (avec fracture de la première côte ou de la clavicule, luxation ou fracture de la tête de l’humérus, impaction du moignon de l’épaule) entraînent des lésions artérielles variables : rupture complète avec ou sans dilacération de la paroi entraînant hémorragie ou thrombose, rupture partielle sans rétraction des extrémités artérielles conduisant à un faux anévrisme, rupture n’intéressant que la média et/ou l’intima (fig 6, 7) et source d’occlusion secondaire, voire rupture dans la veine axillaire entraînant une fistule artérioveineuse. EXPLORATIONS ¶ Examen clinique En cas d’occlusion chronique, le degré d’ischémie est apprécié cliniquement. Il peut s’agir de troubles trophiques telle une gangrène pulpaire, ou de plusieurs phalanges, de nécrose cutanée et musculaire du bras et de l’avant-bras, de douleurs continues de la main qui est froide, œdématiée, blanche ou cyanique. Dans les formes les mieux tolérées, les symptômes surviennent uniquement au froid ou à l’effort. Un syndrome de Raynaud est fréquent, caractérisé par des épisodes de vasospasme artériel digital majoré par le froid et les stimuli émotionnels. Souvent, l’occlusion est asymptomatique et la découverte d’une anisotension peut être révélatrice. 3 43-029-N Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) Techniques chirurgicales 9 Pontage veineux carotidohuméral : confection de l’anastomose carotidienne. A. Utilisation d’une collatérale pour élargir la veine. B. Suture de la berge postérieure par surjet. C. Suture de la berge antérieure. * A * B En cas de traumatisme, la plaie vasculaire est évoquée s’il existe une hémorragie extériorisée ou un hématome pulsatile. Sinon, le diagnostic est difficile, en particulier lorsqu’il existe des lésions orthopédiques. L’absence de pouls et la pauvreté du remplissage veineux sont des signes qui doivent attirer l’attention. ¶ Examen doppler En cas de doute, il précise l’absence de flux artériel dans l’artère humérale situant ainsi le niveau axillaire de l’obstacle. ¶ Échographie endovasculaire Son utilisation au niveau des artères du membre supérieur reste exceptionnelle. Dans le cadre de certaines lésions traumatiques, elle peut permettre de préciser l’existence d’éventuelles lésions intimales [6]. ¶ Artériographie En dehors des cas d’hémorragie externe incontrôlable, nécessitant un geste d’hémostase immédiat, l’artériographie est l’examen de base pour définir la stratégie thérapeutique. Conventionnelle ou digitalisée, elle ne doit pas se limiter aux troncs supra-aortiques et à l’artère axillaire, mais elle doit permettre l’analyse de l’ensemble du membre supérieur [7, 29]. Pour cela, des clichés de la crosse de l’aorte et des segments proximaux de l’artère sous-clavière sont effectués par Seldinger fémoral. Une injection sélective permet ensuite d’analyser les artères axillaire, humérale, radiale et cubitale et même les artères de la main après, au besoin, l’administration de vasodilatateurs pour lever le spasme distal qui gêne la bonne interprétation des radiographies. PROCÉDÉS ¶ Installation L’opéré est placé en décubitus dorsal, les anesthésistes à la tête ou du côté opposé au membre opéré. Le bras est placé en abduction et repose sur une table à bras. Le champ opératoire ménage un accès à la région cervicale, la tête de l’opéré est tournée du côté opposé au membre et placée en légère hyperextension. Il est préférable d’installer l’ensemble du membre supérieur dans le champ opératoire pour ménager un éventuel abord distal. L’opérateur se place en dedans et l’aide lui fait face. Il est également prudent de prévoir un accès à l’un des membres inférieurs, pour prélever si besoin un segment veineux. ¶ Anesthésie Il s’agit habituellement d’une anesthésie générale bien qu’un bloc plexique soit également réalisable. 4 * C ¶ Greffon La veine saphène interne ou à défaut un greffon prothétique, notamment en polytétrafluoroéthylène (PTFE) [12, 15], peuvent être utilisés. Pour certains auteurs l’utilisation de la veine saphène interne doit être systématique afin de limiter le risque de plicature [25]. Pour d’autres, la perméabilité des pontages étant excellente avec les deux matériaux, il faut privilégier l’utilisation des prothèses afin de préserver le capital veineux et éviter les dégénérescences anévrismales des pontages saphéniens [ 1 5 ] . L’utilisation in situ de la veine céphalique en cas d’occlusion axillaire a également été rapportée avec de bons résultats [4, 25, 30]. ¶ Procédés Pontages Ce sont les restaurations les plus utilisées [9, 12, 15, 25, 31, 41, 43]. Les revascularisations par pontage aortoaxillaire, carotidoaxillaire, axilloaxillaire et fémoroaxillaire ayant été décrites avec la chirurgie des troncs supra-aortiques, nous ne traitons que les revascularisations aboutissant à l’artère humérale. • Pontage carotidohuméral L’artère humérale est exposée par une incision brachiale interne puis l’artère carotide primitive est abordée par une incision susclaviculaire et mobilisée sur quelques centimètres. La tunnellisation est ensuite préparée entre la clavicule et la première côte en prenant garde de ne pas blesser les éléments veineux et nerveux. L’emploi d’une pince longuette munie d’une « noisette » facilite la tunnellisation. Lorsque l’espace créé apparaît trop étroit, certains ont proposé de réséquer l’arc moyen de la première côte. L’extrémité proximale du greffon est préparée en utilisant, si c’est une veine, une collatérale pour élargir l’implantation (fig 9). Une dose de 0,5 mg/kg d’héparine est administrée par voie intraveineuse, puis la carotide est clampée en plaçant les deux clamps sur la berge externe. Une rotation des clamps de 90 à 110° vers l’avant expose correctement le bord externe sur lequel l’artériotomie carotidienne est effectuée. Le talon de l’anastomose est placé en haut, ce qui offre un trajet plus harmonieux au greffon. Nous réalisons généralement un surjet coulissant pour le talon, puis la pointe est fixée et deux hémisurjets latéraux sont effectués. Après les manœuvres de purge, la carotide est déclampée. Un clamp est placé à l’extrémité distale du greffon ce qui permet de contrôler la morphologie du greffon et de le marquer par du bleu de méthylène pour contrôler l’absence de torsion pendant le passage rétrojugulaire et surtout rétroclaviculaire. L’artère humérale est ensuite clampée et ouverte longitudinalement. La longueur du greffon est calculée, greffon en charge puis coupé en biseau. L’anastomose est effectuée selon la même technique que précédemment. Après les contrôles de perméabilité, les incisions sont refermées sur deux drains de Redon (fig 10). Techniques chirurgicales Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) 10 43-029-N 11 Pontage carotidohuméral. A. Vue d’ensemble. B. Détail de l’anastomose carotidienne. C. Détail de l’anastomose humérale. Pontage carotidohuméral extra-anatomique : le greffon a un trajet souscutané au bord externe du moignon de l’épaule. * A deltoïde. Le greffon rejoint l’artère humérale par un trajet souscutané plutôt que transbicipital (fig 11). Cette variation est utilisée en cas de sclérose importante du creux axillaire, pour laquelle le trajet classique comporte le risque de blessure des éléments veineux et nerveux et celui d’une compression du pontage. L’indication principale est représentée par les artérites radiques (fig 12) [3]. • Pontage carotidohuméral profond * B En cas d’obstruction axillohumérale, l’artère humérale profonde peut être le seul axe perméable au bras. Plutôt que d’effectuer un long pontage carotidoradial ou cubital qui franchit deux plis de flexion, il est intéressant d’utiliser l’artère humérale profonde comme artère réceptrice. Celle-ci est abordée par une incision brachiale interne en suivant l’artère humérale commune. Elle plonge en regard du bord libre du grand pectoral dans la gouttière radiale à la face postérieure de l’humérus, accompagnée par le nerf radial. Le talon de l’anastomose peut être appliqué sur l’artère humérale commune endartériectomisée, et la pointe du greffon est suturée sur la profonde comme pour une angioplastie fémorale communefémorale profonde. Ce pontage permet de réinjecter les rameaux tricipitaux de l’humérale profonde et la branche anastomotique radiale (fig 13). Lorsque ces collatérales sont insuffisantes, le pontage est prolongé sur les artères de l’avant-bras assurant une revascularisation séquentielle. • Pontage sous-clavier-huméral * C C’est une variante des pontages précédents, l’artère donneuse étant l’artère sous-clavière. Celle-ci est abordée par une incision sousclaviculaire ou par une incision sus-claviculaire. Dans ce dernier cas, la sous-clavière rétroscalénique est libérée, après section du scalène antérieur, en respectant le nerf phrénique. L’anastomose est effectuée en zone saine en terminoterminal ou mieux en latéroterminal. La tunnellisation du greffon et l’anastomose inférieure sont effectuées selon les principes décrits (cf supra). Ce pontage est indiqué dans les lésions traumatiques de l’artère axillaire. Les lésions athéroscléreuses se prêtent moins bien à ce procédé, car la sousclavière est fréquemment pathologique. • Pontage carotidohuméral extra-anatomique Angioplastie d’élargissement Il diffère du pontage carotidohuméral par le trajet donné au greffon. La tunnellisation est effectuée en sous-cutané au-dessus de l’articulation acromioclaviculaire puis sur le relief externe du Sa principale indication vient des complications des pontages axillofémoraux (faux anévrisme ou thrombose) lorsque la prothèse doit être explantée et plus rarement des ruptures artérielles 5 Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) 43-029-N Techniques chirurgicales 14 Résection d’un anévrisme de l’artère circonflexe postérieure sans geste au niveau du tronc de l’artère axillaire. Résections-sutures, sutures simples, greffes veineuses ou prothétiques Elles sont pratiquées essentiellement pour les lésions traumatiques limitées, iatrogènes ou non, de l’artère axillaire. * A En cas d’anévrisme des branches de l’artère axillaire, une résection limitée de l’anévrisme doit être effectuée (fig 14). Elle est associée à une courte greffe veineuse ou prothétique de l’artère axillaire quand celle-ci est sténosée. En cas de microemboles dans les artères digitales, une thrombolyse in situ peropératoire peut améliorer la perfusion distale [6]. Dans le cadre des syndromes du défilé thoracobrachial compliqués d’anévrisme s’étendant à l’artère axillaire ou d’occlusion sousclavioaxillaire, la réparation artérielle est effectuée par une greffe veineuse, artérielle ou prothétique. Le geste de résection des éléments osseux compressifs est réalisé dans le même temps opératoire. Ligature * B 12 Pontage veineux carotidohuméral extra-anatomique pour artérite radique. A. Contrôle artériographique du pontage (les flèches indiquent les anastomoses). B. Aspect des incisions. 13 Pontage aboutissant à l’artère humérale profonde. Elle est indiquée dans les lésions septiques ou en cas d’hémorragie sévère chez un polytraumatisé pour lequel d’autres lésions vitales font l’objet d’un geste prioritaire. La surveillance postopératoire doit alors être particulièrement vigilante pour poser l’indication d’une revascularisation secondaire pour les cas où une ischémie sévère se développerait, mais celle-ci n’est pas obligatoire. ¶ Soins postopératoires L’héparine est utilisée en postopératoire immédiat. Les anticoagulants n’ont pas d’indication au long cours et on leur préfère les antiagrégants plaquettaires. La main doit être légèrement surélevée et une kinésithérapie est très rapidement instituée, mais les mouvements larges des articulations doivent rester prudents jusqu’à la cicatrisation des sutures vasculaires, ce qui demande 2 à 3 semaines. Les antibiotiques sont prescrits à titre prophylactique pendant 48 heures ou institués pour traiter une complication infectieuse patente et authentifiée par les prélèvements bactériologiques. ¶ Contrôle de la revascularisation La perméabilité est attestée cliniquement par la présence d’un pouls radial et par un flux pulsé au doppler. Un contrôle angiographique est cependant souvent préférable pour détecter une anomalie potentiellement évolutive. partielles. L’artère axillaire est abordée dans le sillon deltopectoral. Dans certains cas, en particulier pour les ruptures avec hématome important ou en cas de sclérose liée à un abord antérieur, il est préférable de contrôler, en préalable, l’axe artériel à distance par deux abords (sous-clavier et huméral). Cette stratégie limite les risques de blessure du plexus brachial. Après contrôle, l’artère est refermée à l’aide d’un patch prothétique (Dacront ou PTFE). 6 ¶ Résultats des pontages carotidoou sous-clavier-huméraux Les amputations restent exceptionnelles et la perméabilité des pontages est bonne, entre 70 [19] et 92 % [12] à 5 ans. Les échecs sont plus fréquents lorsque les artères de l’avant-bras sont obstruées [11, 39]. Techniques chirurgicales Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) 15 * A 43-029-N Artériographie A. Sténose de l’artère axillaire (flèche). B. Résultat après angioplastie par voie humérale (flèche). * B ¶ Techniques endovasculaires Technique La dilatation peut être menée par voie fémorale, par voie humérale homolatérale ou par ces deux abords simultanément (fig 15). Certains auteurs recommandent un abord chirurgical de l’artère humérale afin de limiter les embolies distales surtout après recanalisation d’occlusions longues [42]. Les sténoses peuvent être franchies avec des guides « téflonnés » 0,035 (type Bentson) qu’il faut préférer en début d’expérience aux guides hydrophiles de même taille (type Térumo) dont l’utilisation est source de dissections. Ces derniers, droits ou angulés, sont en revanche nécessaires en cas de recanalisation d’occlusion. Le diamètre du ballonnet doit être adapté au diamètre de l’artère à dilater et varie de 6 à 8 mm. En cas de lésions serrées, très calcifiées ou radiques, une prédilatation avec un ballonnet de diamètre inférieur diminue le risque de dissection. Des pressions d’insufflation élevées sont parfois nécessaires. La pose d’endoprothèse n’est pas systématique : elle peut être indiquée en cas de recanalisation d’occlusion, de lésions potentiellement emboligènes, de recoil ou de sténose résiduelle, de dissection postangioplastie, et en cas de resténose. Il est préférable d’utiliser des stents flexibles (tels que les endoprothèses autoexpansibles Wallstent [Schneidert] ou les stents en Nitinolt) ou des stents très courts en raison des risques de compression ou de fracture lors des mouvements de l’épaule. Le traitement antithrombotique périopératoire est inspiré des protocoles d’angioplastie coronaire : le patient est mis sous Aspirinet la veille de l’intervention et reçoit durant la procédure 0,5 mg/kg d’héparine. L’héparinothérapie est poursuivie pendant 24 à 48 heures (le temps de l’hospitalisation en général). Le patient garde ensuite un antiagrégant plaquettaire au long court, pouvant être associé à un deuxième antiagrégant durant le premier mois en cas de pose d’une endoprothèse afin de limiter les rethromboses précoces. Résultats Les lésions de l’artère axillaire étant rares, peu de grandes séries sont disponibles [10]. Avec une perméabilité de 65 % à 26 mois, les résultats de l’angioplastie axillaire sont décevants, surtout quand les lésions traitées sont longues et diffuses [16]. Néanmoins, en cas d’artérite radique, cette option thérapeutique est séduisante car elle peut éviter une chirurgie artérielle difficile et extensive du fait de la sclérose tissulaire [37]. Chirurgie des artères du bras et de l’avant-bras ABORDS ¶ Abord de l’artère humérale L’incision cutanée est effectuée entre les reliefs des muscles biceps et vaste interne du triceps, en arrière de la veine basilique (fig 16A). * A * B 16 Abord de l’artère humérale. A. Schéma de l’incision cutanée. B. Exposition de l’artère, le nerf médian est récliné en haut. L’aponévrose brachiale est incisée et maintenue refoulée par un petit écarteur de Beckman. Le nerf médian apparaît, il est écarté avec précaution et l’axe artériel est dégagé (fig 16B). En cas d’oblitération chronique ou de traumatisme, l’artère humérale est très grêle et peut être difficile à identifier. L’abord peut être étendu en haut vers le creux axillaire, et en bas vers le coude et si besoin l’avant-bras. Pour le passage du pli du coude, l’incision est inclinée en dehors puis à nouveau en dedans, réalisant un S allongé (fig 17). La bifurcation de l’artère humérale est abordée en sectionnant l’expansion aponévrotique du biceps (fig 18). L’artère part en dedans et s’engage sous le rond pronateur cubital et les muscles épitrochléens, l’artère radiale prolonge la direction de l’artère humérale et donne l’artère récurrente radiale qui s’anastomose avec la branche terminale de l’humérale profonde. Le tronc des interosseuses et l’interosseuse antérieure sont abordés depuis la terminaison de l’artère humérale au pli du coude, en sectionnant le rond pronateur et au besoin l’arcade du fléchisseur commun superficiel, voire son corps musculaire. Le nerf médian qui est en avant de l’interosseuse doit être ménagé. 7 43-029-N Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) 17 Abord de l’artère humérale et de ses branches de division : schéma de l’incision cutanée. Techniques chirurgicales 19 Abord des artères radiales (R) et cubitale (C) : schéma des incisions cutanées. ¶ Abord des artères de l’avant-bras L’artère radiale est abordée à la partie moyenne de l’avant-bras en incisant l’aponévrose en dedans de la veine radiale. Le long supinateur est récliné en dehors par un écarteur de Beckman et l’artère est disséquée entre ses deux veines satellites. La cubitale est abordée par une incision antibrachiale interne selon une ligne s’étendant de l’épitrochlée au relief du pisiforme (fig 19). L’artère est profonde. Après avoir incisé l’aponévrose, les muscles cubital antérieur et fléchisseur commun superficiel sont écartés. Le nerf cubital apparaît et l’artère est recherchée en dehors sur le fléchisseur profond. PATHOLOGIE ¶ Lésions Elles ont plusieurs étiologies. – L’athérosclérose est assez rare. – Les embolies anciennes sont plus fréquentes : l’embole peut être méconnu dans la phase initiale lorsqu’il n’entraîne pas d’ischémie aiguë. L’obstruction artérielle est découverte secondairement, en raison du développement d’une ischémie permanente ou d’effort. Les emboles sont d’origine cardiaque dans plus de 90 % des cas. Ils peuvent également provenir de plaques athéroscléreuses ulcérées ou d’anévrismes de la sous-clavière dont la cause la plus fréquente, chez le sujet jeune, est le défilé thoracobrachial. Ces lésions doivent être traitées simultanément ou en préalable à une revascularisation plus distale du membre. L’obstruction progressive des petites artères puis des axes principaux pose des problèmes chirurgicaux parfois difficiles en raison de la rareté d’axe revascularisable [11, 23]. – Les complications artérielles après ponction humérale sont les mêmes qu’au niveau axillaire [20, 24]. Une atteinte du nerf médian peut être associée. – Les traumatismes ouverts du bras après plaie (arme à feu, arme blanche ou agent tranchant) ou les traumatismes fermés avec fracture du tiers moyen de l’humérus ou fracture supracondylienne 18 Abord des branches de division de l’artère humérale au coude. A. Section de l’expansion aponévrotique du biceps. B. Découverte de l’artère radiale et de l’artère cubitale. * A 8 * B Techniques chirurgicales Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) 43-029-N * * A B Schéma d’utilisation des veines in situ pour revascularisations distales du membre supérieur. A. Utilisation de la veine céphalique et de la veine radiale superficielle in situ. B. Utilisation de la veine basilique et de la veine cubitale superficielle in situ. * * C D C. Utilisation de la veine céphalique in situ et de la veine basilique inversée. D. Utilisation de la veine basilique in situ et de la veine céphalique inversée. s’accompagnent très fréquemment de lésions du nerf médian qui vont dominer le pronostic fonctionnel en dépit d’une revascularisation correcte. L’essentiel de la pathologie chirurgicale des artères de l’avant-bras est représenté par les traumatismes et surtout par les traumatismes ouverts. En France, il s’agit avant tout d’accidents du travail avec des agents tranchants, ou parfois d’accidents de la voie publique avec des dégâts ostéotendineux importants. ¶ Anesthésie 20 ¶ Physiopathologie En cas d’obstruction du segment brachial de l’artère humérale, les suppléances sont assurées par l’artère humérale profonde et l’artère collatérale interne qui servent de relais, la réentrée se faisant dans l’artère récurrente radiale ou les rameaux musculaires du biceps. En cas d’obstruction du segment distal de l’artère humérale, les suppléances au coude s’établissent par l’intermédiaire des artères récurrentes radiale et cubitale anastomotiques avec les branches postérieures de l’humérale et avec l’humérale profonde. EXPLORATIONS Outre les explorations employées pour l’artère axillaire, il peut être utile de préciser artériographiquement l’état de l’artère interosseuse et de ses deux branches terminales par des clichés de profil du coude. On évite ainsi les erreurs d’interprétation lorsque l’une des deux artères est thrombosée. PROCÉDÉS La chirurgie des artères du bras et de l’avant-bras se prête assez bien à l’anesthésie locorégionale par bloc plexique. ¶ Greffon Les bons résultats obtenus avec les veines du membre supérieur pour les revascularisations des membres inférieurs rendent leur utilisation logique au niveau du bras et de l’avant-bras. Ce choix permet l’économie d’une veine saphène. Les veines du bras peuvent être utilisées inversées ou in situ [30]. Cette dernière technique offre une meilleure congruence entre les segments artériels et veineux, et limite les voies d’abords. Quand on utilise les veines du membre supérieur, de multiples adaptations dans le montage sont possibles en fonction de la longueur de pontage nécessaire. Ainsi, la partie proximale du pontage peut être constituée par la veine céphalique in situ et la partie distale par la veine basilique basculée et utilisée inversée quand les veines de l’avant-bras ne sont pas utilisables. De la même façon, la veine basilique peut être utilisée in situ et la veine céphalique basculée et inversée (fig 20). Quelle que soit la veine utilisée, celle-ci doit être prélevée de façon atraumatique et gonflée à des pressions physiologiques avec du sang hépariné et de la papavérine, afin de limiter les fibroses ultérieures par hyperplasie intimale. Les veines du membre sont généralement fragiles et se spasment facilement ; une grande attention est de mise lors de leur préparation. ¶ Installation ¶ Procédés Elle est identique à celle de l’artère axillaire, un abord cervical étant parfois nécessaire. Quel que soit le procédé employé, l’artère humérale diffère des artères de jambe par sa texture, la rareté des lésions d’athérosclérose 9 43-029-N Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) Techniques chirurgicales 21 Angioplastie veineuse pour traumatisme iatrogène de l’artère humérale. * A et, en conséquence, les possibilités de spasme qui peuvent compromettre une revascularisation a priori correcte. Pour limiter ce phénomène, le plus simple est de dilater modérément l’artère, soit mécaniquement par les obturateurs de Garrett, soit pharmacologiquement par l’injection de papavérine et de sérum hépariné. Au niveau de l’avant-bras l’application des techniques dérivées de la microchirurgie contribue beaucoup à la qualité des résultats. Dans tous les cas, il est préférable de contrôler sur table d’opération la revascularisation, par la palpation des pouls au poignet, la prise d’un doppler et surtout d’une artériographie qui peut détecter les éventuels défauts techniques ou les obstructions résiduelles d’aval. Suture simple Elle est possible en cas de traumatisme punctiforme que l’on observe après les cathétérismes vasculaires. * B 22 Pontage veineux humérohuméral. A. Terminoterminal. B. Latéral avec exclusion de l’artère pathologique. Pontages Résection-suture de l’artère humérale Elle comporte, dans un. premier temps, la résection complète des segments d’artère contuse, y compris les dommages de la couche endothéliale. Lorsque les zones sont saines, on vérifie que les deux extrémités viennent au contact l’une de l’autre sans traction excessive. La suture est ensuite effectuée à points séparés pour éviter une sténose due à un surjet trop serré. Cette technique est employée pour les plaies franches, les contusions limitées et dans certains traumatismes iatrogènes après ponction artérielle. Angioplastie d’élargissement de l’artère humérale Elle comporte l’excision de la portion de paroi artérielle pathologique et la fermeture de l’artère par un patch veineux ou plus rarement prothétique. Le patch est suffisamment long pour éviter les sténoses aux extrémités et pas trop large pour éviter une évolution anévrismale (fig 21). Ce procédé est applicable dans les traumatismes avec rupture incomplète et dans les complications des ponctions artérielles. En cas d’artère pathologique, la fixation d’une plaque d’athérome ou d’un ressaut intimal par quelques points peut s’avérer nécessaire. Endartériectomie de l’artère humérale Elle n’est que très rarement effectuée. Il s’agit en fait plus d’intimectomie que d’endartériectomie. Elle peut être réalisée en complément d’autres procédés, en particulier des pontages, pour récupérer des collatérales importantes. 10 • Pontages axillohuméral et humérohuméral Ils sont effectués à l’aide d’une veine. Ils comportent, après abord de l’artère axillaire ou de l’artère humérale haute puis de l’humérale basse, une anastomose proximale latéroterminale et une anastomose distale latérale ou terminale (fig 22A). Ce pontage, plus ou moins long selon l’étendue des lésions, est placé parallèlement à l’axe huméral. Lorsque l’on craint une infection de la zone opératoire, il convient de placer les sutures en zones saines et de dérouter le pontage, éventuellement en avant ou en dehors du biceps (fig 22B). En cas d’hématome infiltrant, l’incision cutanée peut être difficile à fermer et, plutôt que de prendre le risque d’une nécrose cutanée avec exposition du pontage, ou celui d’une compression du greffon, il est préférable de réaliser une incision cutanée et aponévrotique de décharge sur le bord externe du bras. • Pontage huméroradial Les axes artériels sont libérés selon le siège lésionnel, et le pontage est effectué avec un segment de saphène pris à la jambe ou une veine céphalique ou basilique. Le pontage est placé anatomiquement en lui donnant une courbure arciforme externe et en vérifiant l’absence de plicature lorsque le coude est fléchi (fig 23, 24) [14, 39]. • Pontage humérocubital Il répond aux mêmes principes que le pontage huméroradial. La plicature du greffon peut être évitée par un trajet interne ou un long trajet en « S » (fig 25, 26). Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) Techniques chirurgicales 23 25 Pontage huméroradial. 43-029-N Pontage humérocubital. 26 Contrôle artériographique de l’anastomose distale d’un pontage humérocubital. 24 Contrôle artériographique d’un pontage huméroradial en veine saphène interne inversée. • Pontage huméroséquentiel En cas de doubles lésions proximales, il est intéressant de revasculariser les deux artères de l’avant-bras. Pour cela, on utilise un greffon veineux bifurqué ou on réimplante la cubitale dans le greffon huméroradial (fig 27). • Pontage huméro-interosseux En l’absence d’artères radiale et cubitale à la partie proximale ou moyenne de l’avant-bras, l’artère interosseuse peut être utilisée comme artère réceptrice (fig 28) [19]. • Pontages radioradial et cubitocubital Les anastomoses sont terminoterminales aux deux extrémités. Ces revascularisations sont indispensables en cas d’atteinte des deux axes artériels. Les pontages sont également utiles en cas de lésions d’un seul axe, bien que plus discutables, le but étant alors de 27 Pontage veineux bifurqué dévalvulé huméroradial et cubital. prévenir les ischémies par suppléances insuffisantes ou de préserver l’avenir (plaies itératives) [18]. Lorsqu’une seule artère est lésée et que la réparation est effectuée tardivement (au-delà de quelques heures), il est important d’assurer un débit maximal dans l’axe restauré pour éviter la thrombose par compétition de flux. Pour cela, on comprime 11 Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) 43-029-N Techniques chirurgicales 29 Abord de l’artère radiale dans la tabatière anatomique. 28 Pontage huméro-interosseux antérieur. digitalement l’artère saine pendant une quinzaine de minutes avant de refermer les plaies [40]. Ligature Elle est indiquée dans les lésions hautement septiques lorsqu’un pontage à distance n’est pas faisable. 30 Abord de l’artère cubitale : schéma de l’incision cutanée. ¶ Soins postopératoires Ils sont similaires à ceux des revascularisations axillaires. En cas de pontage franchissant le pli du coude, le bras est maintenu en légère flexion pour ne pas exercer de traction sur les sutures. En cas d’œdème important ou d’hématome infiltrant, la couverture des abords vasculaires peut être obtenue par des incisions cutanées et aponévrotiques de décharge des bords, interne ou externe, de l’avant-bras. Dans certains cas, il faut avoir recours à des plasties de recouvrement par lambeau de peau ou par interposition musculaire. ¶ Résultats La perméabilité des pontages est supérieure quand l’anastomose distale est effectuée en amont de la bifurcation humérale : 83 % versus 53 % à 2 ans pour McCarty [19], 94 % versus 84 % à 2 ans pour Harris [13]. Chirurgie des artères du poignet et de la main 31 Artériographie d’un anévrisme post-traumatique du poignet développé au niveau de l’artère cubitale. ABORDS L’artère radiale est abordée dans la gouttière du pouls. Elle est sousaponévrotique et accompagnée par deux veines satellites. Elle peut également être abordée dans la tabatière anatomique par une incision dorsale dans l’axe de la première commissure (fig 29). Les fibres sensitives du nerf radial sont ménagées et les tendons du long et du court extenseur puis du court abducteur du pouce sont réclinés. L’artère cubitale et l’arcade palmaire superficielle sont abordées par une incision cutanée en « S » en dedans du pisiforme, prolongée dans l’axe de la troisième commissure. L’artère est dégagée après avoir incisé l’aponévrose et le palmaire cutané (fig 30). PATHOLOGIE ¶ Lésions – Elles sont dominées, là encore, par les traumatismes ouverts (plaie de l’artère radiale par engin tranchant, tentative d’autolyse) et par 12 les traumatismes fermés (thrombose ou rupture des artères radiales et cubitales après luxation rétrolunaire du carpe ou fracture du scaphoïde) (fig 31). Techniques chirurgicales Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) 32 Artériographie de la main montrant une occlusion des artères digitales par microembolies à partir d’une sténose radique de l’artère sous-clavière. 43-029-N – occlusion proximale d’une des artères de l’avant-bras avec une arcade palmaire non fonctionnelle ; – occlusion à double étage, palmaire et collatérale digitale. EXPLORATIONS – Le doppler permet, en l’absence de pouls, de mesurer la pression de perfusion et la qualité des suppléances. Il est surtout utile pour apprécier l’existence d’un flux pulpaire, la perméabilité des artères collatérales des doigts et le caractère fonctionnel ou non des arcades palmaires. Il suffit pour cela de placer le crayon doppler tour à tour sur l’une des artères du poignet et de comprimer l’autre. L’accélération du flux témoigne du caractère complet de l’arcade. – L’échographie couplée au doppler peut confirmer le diagnostic clinique d’anévrisme de l’artère cubitale. – La pléthysmographie digitale incite à proposer un geste de revascularisation quand elle montre un tracé plat ou franchement démodulé. – Une pathologie particulière est consécutive aux manipulations d’engins vibrants (marteau-piqueur ou scie circulaire) qui peuvent entraîner des thromboses des arcades palmaires ou des collatérales des doigts [27]. Les traumatismes isolés ou répétés de l’éminence hypothénar sont à l’origine de thromboses ou d’anévrismes emboligènes de l’artère cubitale, réalisant le syndrome du marteau hypothénar [27, 36]. Ce syndrome se développerait toutefois chez des patients porteurs d’une fibrodysplasie préexistante [8]. Certains anévrisme peuvent également être d’origine athéroscléreuse [22]. Les traumatismes peuvent également entraîner des fistules artérioveineuses aux dépens des artères et veines radiales ou cubitales. – L’insuffisance rénale terminale peut se compliquer d’ischémie de la main et des doigts d’origine multifactorielle : accès pour hémodialyse compliqué de thrombose distale ou phénomène de vol, athérosclérose accélérée, calcifications artérielles dans le cadre d’une calciphylaxie [28]. Les signes ischémiques sont parfois sévères avec nécrose digitale et gangrène nécessitant une amputation. Les douleurs en rapport avec une neuropathie monomélique ischémique associée peuvent persister après la revascularisation. – La maladie de Buerger dans laquelle l’atteinte des artères de la main est très fréquente, sinon constante au cours de cette maladie. Il s’agit d’oblitération des artères radiales ou cubitales, ou d’atteinte plus diffuse. – La sclérodermie et l’artérite rhumatoïde : les oblitérations artérielles sont rares. Elles aggravent l’ischémie tissulaire qui est habituellement due à une vascularite. – L’athérome mais aussi l’artérite radique [37] peuvent entraîner des oblitérations des artères digitales par occlusion ou par embolies provenant de l’artère sous-clavière (fig 32). – Les embolies vieillies chez les patients porteurs de cardiopathies emboligènes peuvent évoluer à bas bruit entraînant des gangrènes [2, 33] digitales . ¶ Physiopathologie Les suppléances au poignet et à la main en cas d’obstruction d’une artère radiale ou cubitale s’établissent facilement par l’intermédiaire des arcades palmaires profonde et superficielle. Cependant, ces suppléances ne sont pas fonctionnelles chez 22 % de la population générale [5]. Une ischémie sévère ne peut survenir que dans les cas suivants [2] : – occlusion des deux artères digitales palmaires propres ; – occlusion proximale des artères de l’avant-bras avec mauvaise collatéralité ; – La mesure transcutanée de la pression d’oxygène (TcPO 2 ) confirme la sévérité de l’ischémie et incite à opérer quand elle est inférieure à 20 mmHg. – L’artériographie, en cas d’ischémie, est effectuée comme décrit précédemment, c’est-à-dire avec l’étude de l’ensemble des artères du membre supérieur pour ne pas méconnaître une pathologie susjacente associée. PROCÉDÉS ¶ Gestes de revascularisation – La résection-suture en cas d’anévrisme de l’artère cubitale est rarement possible et un court pontage veineux est le plus souvent effectué [8, 28] afin d’éviter une embolisation dans les arcades palmaires et les collatérales digitales. En cas de thrombose de l’anévrisme, le risque embolique n’existe plus et la chirurgie n’est pas indiquée. – Les pontages radiopalmaire et cubitopalmaire superficiels : en cas d’obstruction des artères radiale et cubitale distale avec conservation d’une arcade palmaire superficielle, un court pontage sur l’arcade palmaire peut être effectué à partir de l’artère radiale ou de la cubitale. Comme greffon, on peut utiliser des veines du dos de la main, la veine radiale superficielle prélevée à l’avant-bras, la veine saphène interne prélevée à la cheville ou une veine du dos du pied. Cette technique, pour avoir des chances raisonnables d’être efficace, nécessite un entraînement à la microchirurgie (fig 33) [2, 21, 32]. Les anastomoses sont effectuées sous loupe binoculaire avec un monofilament 8/0. Dans le cadre de l’insuffisance rénale terminale, il est préférable d’effectuer une revascularisation de la main sans sacrifier l’accès pour hémodialyse. L’anastomose proximale peut être effectuée sur l’artère humérale ou sur une artère de l’avant-bras à distance de la fistule artérioveineuse [28]. ¶ Artérialisations veineuses En cas d’ischémie sévère du membre supérieur sans artère en distalité pouvant recevoir un pontage, une fistule artérioveineuse peut être effectuée dans le cadre d’un sauvetage de membre [17]. Le but de cette fistule est d’établir un flux artériel rétrograde dans la veine afin d’améliorer la perfusion tissulaire. L’anastomose est effectuée en latéral sur l’artère saine la plus distale et en terminal sur une veine superficielle après sa dévalvulation et sa ligature en aval. La fistule peut ainsi être créée entre l’artère humérale et une veine du pli du coude ou au poignet, entre l’artère radiale et la veine radiale (fig 34). Les résultats de cette technique sont peu documentés et son intérêt reste discuté. 13 43-029-N 33 Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) Techniques chirurgicales Pontage veineux entre l’artère cubitale et l’arcade palmaire superficielle. ¶ Sympathectomie thoracique Bien que contestée par certains [35], elle peut améliorer de façon parfois spectaculaire des situations graves [21, 38]. Menée par voie thoracoscopique, l’intervention est généralement bien tolérée, sans complication majeure, et la durée d’hospitalisation peut être limitée à 48 heures. Le risque de syndrome de Claude Bernard-Horner est faible si la limite supérieure de la résection est au niveau du croisement de la chaîne sympathique et de la première côte [1]. Elle peut être proposée en cas de douleurs ischémiques et de troubles 14 34 Schéma d’une fistule artérioveineuse créée au pli du coude entre l’artère humérale et la veine radiale superficielle. 1. Veine céphalique ; 2. veine cubitale intermédiaire ; 3. artère radiale ; 4. veine basilique ; 5. artère tumérale ; 6. veine radiale superficielle. trophiques après échec du traitement médical (vasodilatateurs, antagonistes du calcium, perfusions de prostaglandines) et quand il n’existe pas de possibilités de revascularisation. Techniques chirurgicales Chirurgie des artères du membre supérieur (anévrismes et ischémie aiguë exclus) 43-029-N Références [1] Ahn SS, Machledre HI, Conception B, Moore WS. Thoracoscopic cervicodorsal sympatectomy: preliminary results. J Vasc Surg 1994 ; 20 : 511-519 [2] Barral X, Favre JP, Gournier JP, Farcot M, Cambou S. Résultats tardifs des pontages palmaires pour troubles trophiques digitaux. Ann Chir Vasc 1992 ; 6 : 418-424 [3] Becquemin JP, Gastarino LF, Etienne G. Carotido-brachial artery bypass for radiation induced injury of the subclavian artery. The value of a lateral mid-arm approach. J Cardiovasc Surg 1994 ; 35 : 321-324 [4] Cohen ES, Holzman RB, Johnsons GW. Axillo-brachial artery bypass graft with ″ in situ ″ cephalic vein for axillary artery occlusion: a case report. J Vasc Surg 1989 ; 10 : 683-687 [5] Coleman SS, Anson BJ. Arterial patterns in the hand based upon a study of 650 specimens. Surg Gynecol Obstet 1961 ; 113 : 409-424 [6] Dalman RL, Olcott C, Alto P. Revascularisation du membre supérieur en amont du poignet. Ann Vasc Surg 1997 ; 11 : 643-650 [7] Erlandson EE, Forrest ME, Shields JJ et al. Discriminant arteriographic criteria in the management of forearm and hand ischemia. Surgery 1981 ; 90 : 1025-1036 [8] Ferris BL, Taylor LM, Oyama K, McLafferty RB, Edwards JM, Moneta GL et al. Hypothenar hammer syndrome: proposed etiology. J Vasc Surg 2000 ; 31 : 104-113 [9] Gelberman RH,, Nunley JA,, Koman LA, et al. The results of radial and ulnar arterial repair in the forearm. J Bone Joint Surg Am 1982 ; 64 : 383-387 [10] Greenberg RK, Waldman D. Endovascular and open surgical treatment of brachiocephalic arterial disease. Semin Vasc Surg 1998 ; 11 : 77-90 [11] Gros WS, Flanigan DP, Kraft RO, Stanley JC. Chronic upper extremity arterial insufficiency. Etiology, manifestations, and operative management. Arch Surg 1978 ; 113 : 419-423 [12] Gupta A, Rubin J. Carotid brachial bypass for treating proximal upper-extremity arterial occlusive disease. Am J Surg 1994 ; 168 : 210-213 [13] Harris RW, Andros G, Dulawa LB, Oblath RW, Salles-Cunha SX, Apyan R. Large-vessel arterial occlusive in symptomatic upper extremity. Arch Surg 1984 ; 119 : 1277-1282 [14] Holleman JH, Hardy JD, Williamson JW, Raju S, Neely WA. Arterial surgery for arm ischemia. A survey of 136 patients. Ann Surg 1980 ; 191 : 727-737 [15] Jain KM, Simoni EJ, Munn JS, Madson Jr DL. Long-term follow-up of bypasses to the brachial artery across the shoulder joint. Am J Surg 1996 ; 172 : 127-129 [16] Joseph S, Mandalam K, Rao V. Percutaneous transluminal angioplasty of the subclavian artery in nonspecific aortoarteritis: results of long-term follow-up. JVIR 1994 ; 5 : 573-580 [17] King TA, Marks J, Berrettoni BA, Seitz WH. Arteriovenous reversal for limb salvage in unreconstructible upper extremity arterial occlusive disease. J Vasc Surg 1993 ; 17 : 924-933 [18] Lee RE, Obeid FN, Horst HM, Bivins BA. Acute penetrating arterial injuries of the forearm. Ligation or repair ? Am Surg 1985 ; 51 : 318-324 [19] McCarty WJ, Flinn WR, Yao JR, William LR, Bergan JJ. Result of bypass grafting for upper limb ischemia. J Vasc Surg 1986 ; 3 : 741-746 [20] McFadden PM, Ochsner JL, Mills N. Management of thrombotic complications of invasive arterial monitoring of the upper extremity. J Cardiovasc Surg 1983 ; 24 : 35-39 [21] McNamara MF, Takaki HS, Yao JS, Bergan JJ. A systematic approach to severe hand ischemia. Surgery 1978 ; 83 : 1-11 [22] Malt S. An arteriosclerotic aneurysm of the hand. Arch Surg 1978 ; 113 : 762-763 [23] Melliere D, Bourgeois A, Becquemin JP, Danis RK. Les microembolies des membres supérieurs d’origine artérielle. Chirurgie 1981 ; 107 : 428-432 [24] Menzoian JO, Corson JD, Bush HL, Logerfo FW. Management of the upper extremity with absent pulses after cardiac catheterization. Am J Surg 1978 ; 135 : 484-487 [25] Mesh C, McCarty W, Pearce W, Flin WR, Shireman PK, Yao JS. Upper extremity bypass grafting. Arch Surg 1993 ; 128 : 795-802 [26] Mignard JP, Peyredieu G, Pere CH, Andreassian B. Traitement en urgence des lésions traumatiques des artères distales des membres. Ann Chir 1976 ; 30 : 245-248 [27] Millender LH, Nalebuff EA, Kasdon E. Aneurysms and thromboses of the unlar artery in the hand. Arch Surg 1972 ; 105 : 686-690 [28] Nehler MR, Dalman RL, Harris EJ, Taylor LM Jr, Porter JM. Upper extremity arterial bypass distal to the wrist. J Vasc Surg 1992 ; 16 : 633-642 [29] Rapp JH, Reilly LM, Goldstone J, Krupski WC, Ehrenfeld WK, Stoney RJ. Ischemia of the upper extremity: significance of proximal arterial disease. Am J Surg 1986; 152 : 122-126 [30] Ristow AV, Cury JM, Costa EL, Gardeazabal G, Sampaio MM, Peixoto CC. Revascularization of the ischaemic hand using in situ veins. Cardiovasc Surg 1996 ; 4 : 466-469 [31] Rostad H, Hall KV. Arterial occlusive disease of the upper extremity. Scand J Thorac Cardiovasc Surg 1980 ; 14 : 223-226 [32] Schmidt F, Hewitt RL. Severe upper limb ischemia. Arch Surg 1980 ; 115 : 1188-1191 [33] Silcott GR, Polich VL. Palmar arch arterial reconstruction for the salvage of ischemic fingers. Am J Surg 1981 ; 142 : 219-225 [34] Smith D, Mitchell D, Peterson G. Medial brachial fascial compartment syndrome: anatomic basis of neuropathy after transaxillary arteriography. Radiology 1989 ; 173 : 149-154 [35] Taylor LM, Baur GM, Porter JM. Finger gangrene caused by small artery occlusive disease. Ann Surg 1981 ; 193 : 453-461 [36] Vayssairat M, Debure C, Cormier JM, Bruneval P, Laurian C, Juillet Y. Hypothenar hammer syndrome: seventeen cases with long-term follow-up. J Vasc Surg 1987 ; 5 : 838-843 [37] Veyssier-Belot C, Emmerich J, Sapoval MR, Beyssen B, Hoffman O, Raynaud A et al. Percutaneous transluminal angioplasty for emboligenic arterial lesions after radiotherapy of axillary arteries (letters to the editors). J Vasc Surg 1995 ; 22 : 118-119 [38] Welling RE, Cranley JJ, Krause RJ, Hafner CD. Obliterative arterial disease of the upper extremity. Arch Surg 1981 ; 116 : 1593-1596 [39] Whitehouse WM, Zelenock GB, Wakefield TW, Graham LM, Lindenauer SM, Stanley JC. Arterial bypass grafts for upper extremity ischemia. J Vasc Surg 1986 ; 3 : 569-573 [40] Wilgis EF. Evaluation and treatment of chronic digital ischemia. Ann Surg 1981 ; 193 : 693-698 [41] Williams SJ. Chronic upper extremity ischemia: current concepts in management. Surg Clin North Am 1986 ; 66 : 355-375 [42] Withbread T, Clevelend TJ, Beard JD, Gaines PA. A combined approach to the treatment of proximal arterial occlusions of the upper limb with endovascular stents. Eur J Vasc Endovasc Surg 1998 ; 15 : 29-35 [43] Wood PB. Vein-graft bypass in axillary and brachial artery occlusions causing claudication. Br J Surg 1973 ; 60 : 29-30 15 ENCYCLOPÉDIE MÉDICO-CHIRURGICALE 43-029-Q 43-029-Q Chirurgie des syndromes de compression du défilé thoracobrachial P Patra JC Pillet P Chaillou R é s u m é. – Après un rappel anatomique des cinq espaces du défilé cervicothoracique où une compression ostéoarticulaire peut s’exercer sur les éléments vasculonerveux, ce travail expose : – les variations et les anomalies anatomiques des défilés ; – les éléments du diagnostic des formes neurologiques, artérielles ou veineuses ; – les différentes voies d’abord chirurgicales, en détaillant les voies axillaire et susclaviculaire les plus utilisées ; – les indications du traitement chirurgical et ses complications ; – les récidives et leur traitement. Introduction Les syndromes de la traversée cervicothoracobrachiale (STTB) résultent de la compression des structures vasculonerveuses, au niveau du défilé thoracobrachial. Cette compression provient en général de la présence d’une côte cervicale, de faisceaux scaléniques anormaux ou d’anomalies fibromusculaires. Le traitement des STTB fait l’objet de controverses. L’une d’entre elles concerne le principe de la résection systématique de la première côte. De 1910 à 1927, plusieurs résections costales, effectuées avec succès, ont été rapportées ; mais de 1927 à 1962, à la suite des publications d’Adson et Coffey, la scalénectomie isolée est devenue la technique de choix. À partir de 1962, devant les échecs de la scalénectomie, les résections de la première côte ont connu un nouvel essor. Plusieurs voies ont été décrites presque simultanément : postérieure par Clagett, thoracique par Servelle [39] et axillaire par Roos en 1966 [34]. Le débat a été relancé par Sanders en 1979 [38], puis par Dale en 1982 [12], à la suite de la publication de complications graves liées à la résection de la première côte [3]. Ce débat demeure d’actualité, ainsi que la question du choix de la voie d’abord. Données anatomiques Anatomie normale [29] La traversée cervicothoracobrachiale peut être définie comme la © Elsevier, Paris Philippe Patra : Professeur des Universités, praticien hospitalier. Jean-Christophe Pillet : Assistant-chef de clinique. Philippe Chaillou : Praticien hospitalier. Service de chirurgie vasculaire, centre hospitalier universitaire, hôpital Guillaume et René Laennec, boulevard Jean-Monod, Saint-Herblain, 44093 Nantes cedex 01, France. Toute référence à cet article doit porter la mention : Patra P, Pillet JC et Chaillou P. Chirurgie des syndromes de compression du défilé thoracobrachial. Encycl Méd Chir (Elsevier, Paris), Techniques chirurgicales – Chirurgie vasculaire, 43-029-Q, 1998, 12 p. 1 Traversée cervicothoracobrachiale. A : défilé intercostoscalénique ; B : canal costoclaviculaire ; C : tunnel sous-pectoral ; D : billot huméral ; SA : muscle scalène antérieur ; ACC : artère carotide commune ; PB : plexus brachial ; AS : artère subclavière ; VS : veine subclavière ; SM : muscle scalène moyen ; C : clavicule ; MS : muscle subclavier ; AA : artère axillaire ; PP : muscle petit pectoral. succession de cinq espaces parcourus par les éléments vasculonerveux (fig 1) : le défilé intercostoscalénique et préscalénique, le canal costoclaviculaire, le tunnel sous-pectoral et le billot huméral. Défilé intercostoscalénique C’est un espace prismatique triangulaire délimité par le bord postérieur du muscle scalène antérieur, le bord antérieur du muscle scalène moyen et la face supérieure de la première côte (fig 2). L’obliquité de la face supérieure de la première côte dépend de la morphologie du sujet. L’angle supérieur du défilé est très étroit (souvent inférieur à 20°) et le bord inférieur est comblé par des fibres arciformes émanant des muscles scalènes antérieur et moyen, et se perdant sur le périoste costal (fig 3, 4). 43-029-Q CHIRURGIE DES SYNDROMES DE COMPRESSION DU DÉFILÉ THORACOBRACHIAL 2 Vue antéroexterne du défilé intercostoscalénique droit. SA : tendon inférieur du muscle scalène antérieur ; C : première côte ; PB : plexus brachial ; SC : artère subclavière. Défilé intercostoscalénique C’est un espace prismatique triangulaire délimité par le bord postérieur du muscle scalène antérieur, le bord antérieur du muscle scalène moyen et la face supérieure de la première côte (fig 2). L’obliquité de la face supérieure de la première côte dépend de la morphologie du sujet. L’angle supérieur du défilé est très étroit (souvent inférieur à 20°) et le bord inférieur est comblé par des fibres arciformes émanant des muscles scalènes antérieur et moyen, et se perdant sur le périoste costal (fig 3, 4). Les trois muscles scalènes forment une masse unique en haut, mais se divisant en bas pour faire place aux organes de passage. Des anomalies de division musculaire expliquent la présence de formations musculaires qui peuvent rétrécir en permanence le défilé intercostoscalénique. On distingue : – les muscles interpédiculaires supérieurs (entre le muscle scalène moyen et antérieur, 2 % des sujets) ; Techniques chirurgicales – les muscles interpédiculaires inférieurs, correspondant au petit scalène de Winslow (présent chez 3 % des sujets) qui traverse les racines inférieures du plexus brachial ou s’interpose entre ces racines et l’artère sous-clavière. L’artère et les troncs nerveux sont amarrés par trois types de ponts fibreux infra-artériels (fig 4). Les premiers siègent au niveau de la berge interne du défilé. Ils relient les muscles scalènes antérieur et moyen. Cette formation n’adhère pas à l’artère. Les deuxièmes siègent au niveau de la berge externe du défilé. Ils sont très adhérents à l’artère. Les troisièmes sont plus constants, situés à l’intérieur même du défilé, ils fixent l’artère aux parois de ce dernier par un tissu cellulofibreux lâche, mais ferme. La méconnaissance de ces éléments fibreux, lors des sections des insertions costales des scalènes ou des résections de la première côte sans artériolyse, rend insuffisant le geste curateur et peut même aggraver une éventuelle compression artérielle. En effet, l’artère est alors soustendue par un anneau fibreux non amarré et soulevée par les muscles rétractés. De plus, les muscles scalènes tendent à se rapprocher une fois leurs attaches costales disparues. Des amarres fibreuses solidarisant les racines plexiques aux parois existent à tous les niveaux du défilé. Elles sont particulièrement denses à la partie haute du défilé. Il faut inciser cette expansion fibreuse pour découvrir et libérer les nerfs. Il existe également des attaches entre l’adventice artérielle, les muscles et le plexus brachial. L’artère sous-clavière chemine dans l’angle antéro-inférieur de l’espace interscalénique (fig 3). Les troncs nerveux ont une disposition très variable. Ils sont presque toujours aplatis selon un plan frontal, et non pas cylindriques ; d’autre part, la racine C7 a tendance à se placer audessus de l’artère, la racine C8-T1 étant en arrière. Le défilé préscalénique correspond au passage de la terminaison de la veine sous-clavière et se situe entre l’extrémité antérieure de la première côte, en bas, l’extrémité sternale de la clavicule doublée du muscle sousclavier et du tendon du scalène antérieur. Ce défilé se modifie considérablement avec les mouvements de la clavicule. Canal costoclaviculaire Ce canal est situé entre la face inférieure de la moitié interne de la clavicule et la face supérieure des segments moyen et antérieur de la première côte (fig 5). Les variations du muscle sous-clavier conditionnent la forme de son orifice antérieur. Dans 25 % des cas seulement, il s’agit d’un muscle peu épais, cylindrique. Il se présente, le plus souvent, comme une véritable lame musculaire, débordant vers l’avant la face inférieure de la clavicule (fig 5). Suivant son importance et sa longueur, le rebord tendineux inférieur du muscle transforme 1re côte 4 3 Vue externe du défilé intercostoscalénique droit. Le muscle scalène antérieur (SA) a été sectionné, ainsi que l’artère, pour montrer les fibres unissant les deux muscles scalènes (SM : muscle scalène moyen). On remarque la présence d’un fort ligament transversocostal (*). 3 page 2 4 Vue schématique des amarres artérielles et plexuelles. SM : scalène moyen ; SA : scalène antérieur ; Tnp : tronc veineux primaire du plexus brachial ; Hfia : hamac fibreux intra-artériel ; Sub : artère sous-clavière ; Pt fib : pont fibreux. Techniques chirurgicales CHIRURGIE DES SYNDROMES DE COMPRESSION DU DÉFILÉ THORACOBRACHIAL 43-029-Q 6 Vue antérieure du canal costoclaviculaire droit vidé de son contenu. Cette préparation souligne sa proximité par rapport au défilé intercostoscalénique. CL : clavicule ; MS : muscle sous-clavier ; C : première côte ; SA, SM : tendons du muscle scalène antérieur et moyen. 5 Vue antérieure du canal costoclaviculaire droit. CL : clavicule ; MS : muscle sous-clavier dont le tendon inférieur déborde en dehors sur le compartiment neuroartériel (flèche) ; PP : muscle petit pectoral sectionné ; SA : tendon du muscle scalène antérieur qui se projette sur le canal costoclaviculaire ; VS : veine sous-clavière sectionnée ; F : berge interne du canal comblé par des formations fibreuses ; AS : artère sous-clavière et ses attaches fibreuses à la première côte (C). l’orifice antérieur du canal costoclaviculaire en un orifice ostéotendineux pratiquement indéformable et vulnérant pour les éléments vasculonerveux qui viennent à son contact. Le canal costoclaviculaire est long et le muscle scalène antérieur glisse sous sa berge postérieure. Il est difficile de discerner une ligne de démarcation nette entre la berge externe du défilé intercostoscalénique et l’orifice postérieur du canal costoclaviculaire (fig 6). Le canal costoclaviculaire est divisé en un compartiment antéro-interne lymphoveineux et un compartiment postéroexterne neuroartériel. Ces deux compartiments ont un diamètre très réduit avec de grandes variations liées aux mouvements de la clavicule. La veine est surtout comprimée dans le compartiment antéro-interne, entre le muscle sousclavier et la première côte. Il existe en effet des adhérences constantes entre la gaine du muscle sous-clavier et la veine axillaire qui rendent celle-ci solidaire des mouvements de la clavicule. Il faut également noter la présence de valvules veineuses qui sont constantes et importantes, leur rôle hémodynamique pouvant expliquer en partie certaines thromboses veineuses du membre supérieur. Elles sont situées au croisement de la veine sous-clavière avec la première côte. Tunnel sous-pectoral Il est limité, en arrière, par la paroi dorsale de la fosse axillaire et, en avant, par le muscle petit pectoral (fig 7). Dans 15 % des cas, le bord externe du muscle petit pectoral est fibreux, épais et peut former un arceau ou un rebord rectiligne agressif pour les vaisseaux. Les branches du plexus brachial cheminent avec l’artère et la veine axillaires dans un espace relativement large, comblé par un tissu cellulograisseux et ganglionnaire. Ce tissu de glissement peut manquer chez les sujets maigres ou longilignes. Billot huméral En position indifférente, le paquet vasculonerveux occupe le grand axe du creux axillaire, demeurant ainsi à distance de la tête humérale. En abduction du bras, à partir de 90°, l’artère se plaque contre la tête humérale. Cette compression serait à l’origine d’un nombre sous-estimé de complications artérielles du STTB [15]. 7 Vue antérieure du tunnel sous-pectoral droit. PP : muscle petit pectoral et son bord externe (flèche) ; MS : muscle sous-clavier ; C : clavicule sectionnée ;A : artère axillaire ; V : veine axillaire ; M : nerf médian. La plus grande fréquence du syndrome de la traversée thoracobrachiale chez les femmes est plus difficile à expliquer. Il n’existe en effet que de discrètes différences dans les mensurations thoraciques entre les deux sexes. En revanche, l’imprégnation œstroprogestative chez la femme pourrait être responsable d’une laxité musculoligamentaire entraînant la chute de l’épaule. Les variations selon le type somatique sont plus évidentes. Chez les sujets longilignes, les clavicules sont nettement tombantes et le diamètre biacromial réduit, prédisposant ainsi aux syndromes de la traversée thoracobrachiale. À l’inverse, chez les brévilignes, le thorax est large, les clavicules sont horizontales ; le risque de compression serait moindre. Certains sportifs de haut niveau peuvent présenter un STTB, du fait de l’hypertrophie des muscles scalènes. C’est, notamment, le cas de nageurs de compétition [21]. Au repos, le paquet vasculonerveux franchit sans difficulté la traversée cervicothoracobrachiale ; il n’en va pas de même au cours des mouvements de la ceinture scapulaire et du membre thoracique. En abduction, la taille du canal costoclaviculaire diminue par rotation axiale de la clavicule, venant comprimer les éléments vasculonerveux contre la première côte. Les éléments vasculonerveux qui traversent cette région n’ont qu’un jeu physiologique très étroit, qui est encore réduit en cas d’anomalie musculoligamentaire ou osseuse. Certaines études anatomiques relèvent un taux d’anomalies de 70 % [20], mais elles ne sont pas toujours symptomatiques. Anomalies musculoligamentaires [23] Variations des défilés Au niveau du défilé intercostoscalénique L’âge joue un rôle évident, comme tendrait à le prouver la plus grande fréquence des compressions vasculonerveuses observées chez l’adulte jeune. La descente de la paroi antérieure du thorax, avec l’âge, entraînerait un déplacement postérieur et inférieur de la clavicule. De plus, la cage thoracique s’élargit transversalement à partir de la puberté, jusqu’à l’âge adulte. On constate également une convergence des deux mors de la pince costoclaviculaire. Les irrégularités de perforation de la masse scalénique par le pédicule vasculonerveux ont été évoquées plus haut. Elles expliquent les différentes possibilités de brides ou frondes interscaléniques pouvant passer dans le plexus brachial, au-dessus ou sous l’artère. Elles correspondent aux brides de type IV de Roos [36]. Les faisceaux fibreux interscaléniques situés au-dessus de la première côte peuvent être particulièrement développés et se prolonger jusqu’à la page 3 43-029-Q CHIRURGIE DES SYNDROMES DE COMPRESSION DU DÉFILÉ THORACOBRACHIAL 8 A B A 9 A. Côte cervicale unilatérale se terminant par une néoarthrose sur C1. B. Pièce de résection de la première côte (1) et de la côte cervicale (2) ; (3) : néoarthrose. B A. Côtes cervicales bilatérales vues de face. B. Compression et déviation du trajet artériel permanentes, dues à la côte cervicale gauche. jonction costo- ou chondrosternale, ce qui correspond aux brides de type VII et VIII de Roos [35]. Il s’agit, le plus souvent, d’un fort ligament transversocostal (type III de Roos) (fig 3). Au niveau du canal costoclaviculaire Le pédicule vasculonerveux n’est menacé dans le compartiment externe qu’en cas de prolongement hypertrophique du ligament coracoclaviculaire. Au niveau du compartiment interne, ce sont les anomalies du muscle sousclavier, évoquées plus haut, qui peuvent être en cause. Anomalies osseuses Congénitales De telles anomalies sont fréquentes (de l’ordre de 1 % des sujets), et sont en cause dans 10 % des STTB. Nous en retiendrons essentiellement trois. – Les côtes cervicales, présentes chez 0,6 à 5 ‰ des sujets, et bilatérales dans 50 % des cas (fig 8A, 9A). On distingue deux grands types de côtes cervicales : – les côtes complètes, se rattachant au manubrium sternal par un cartilage individualisé ou bien confondu avec celui de la première côte ; – les côtes incomplètes, pouvant présenter une extrémité libre qui flotte dans le creux sus-claviculaire ou être prolongée en avant par un trousseau fibreux qui s’attache à la première côte. page 4 Techniques chirurgicales En arrière, la côte cervicale peut être unie à la septième vertèbre par une articulation avec tête et tubercule costaux, ou par une soudure entre la vertèbre et la côte. Dans le premier cas, la libération de la côte se fait par désarticulation, et dans le second par section osseuse. – Les apophysomégalies de C7, plus fréquentes (1 % des sujets) et souvent associées à une côte cervicale. – Les anomalies de la première côte, présentes chez environ 3 % des sujets [14]. L’anomalie la plus fréquente est l’agénésie de l’arc antérieur de la première côte. Elle s’accompagne d’une surélévation de la première côte agénésique, de trousseaux fibreux qui prolongent la première côte et, dans la moitié des cas, d’une néoarthrose C1-C2 qui réalise un tubercule volumineux et rétrécit encore le défilé. Les exostoses et les synostoses sont plus rares. Seule une minorité de ces anomalies devient symptomatique ; 5 à 10 % des côtes cervicales seraient pathogènes [24]. La mise en cause d’une anomalie osseuse congénitale dans les STTB varie entre 10 et 20 % selon les auteurs [14]. Pathologie claviculaire Une étiologie claviculaire n’est retrouvée que dans 0,5 à 9 % des séries de STTB [4, 26] . Il s’agit essentiellement des conséquences de traumatismes, cal vicieux ou hypertrophiques, pseudarthroses après fractures, ainsi que de luxations sternoclaviculaires ou acromioclaviculaires. Des anomalies congénitales sont plus rarement en cause : Techniques chirurgicales CHIRURGIE DES SYNDROMES DE COMPRESSION DU DÉFILÉ THORACOBRACHIAL 43-029-Q pseudarthroses congénitales de la clavicule ou surélévations congénitales de l’omoplate. Il existe aussi des causes acquises diverses, exceptionnelles, publiées sous forme de cas isolés (tumeurs de la clavicule, hyperostose sternocostoclaviculaire ou encore ostéomyélite de la clavicule). Post-traumatique Le rôle favorisant ou déclenchant d’un traumatisme dans la survenue d’un STTB est signalé dans de nombreux travaux ; il varie entre 16 et 92 % des cas [6, 16, 18, 36, 38]. Les traumatismes minimes mais répétés peuvent avoir les mêmes conséquences [43]. En dehors des lésions osseuses envisagées plus haut, on peut retenir le rôle des lésions musculaires (étirement, déchirure, hématome, désinsertion) évoluant vers une fibrose cicatricielle. Le délai d’apparition de la symptomatologie peut toutefois être suffisamment long pour que la relation de causalité soit douteuse. Il se pose alors des problèmes médicolégaux et thérapeutiques qui doivent rendre prudent dans la conduite thérapeutique. De nombreuses formations anatomiques sont ainsi susceptibles de provoquer des compressions vasculonerveuses. Les syndromes de la traversée cervicothoracobrachiale apparaissent dès lors trop complexes pour être attribués à la seule première côte. Plutôt que de procéder systématiquement à une résection costale, il faudrait tenter de définir, par des explorations dynamiques, les éléments anatomiques compressifs responsables de la symptomatologie, et proposer une chirurgie « à la carte ». Données diagnostiques Le diagnostic de STTB repose essentiellement sur l’interrogatoire et l’examen clinique. La compression des structures vasculonerveuses provoque, le plus souvent, une symptomatologie neurologique. Ce syndrome comporte alors des douleurs et des paresthésies du cou, de l’épaule, du bras, de la main, de la paroi antérieure du thorax et de la région interscapulothoracique. Il s’agit, souvent, de signes bilatéraux. Il n’y a pas de symptomatologie tronculaire à la différence des compressions du nerf ulnaire, au coude, ou du nerf médian, au poignet, qui doivent être recherchées. La symptomatologie dépend du niveau de la compression radiculaire. On distingue les STTB hauts impliquant les racines C5, C6 et C7, et les STTB bas concernant plutôt les racines C7, C8 et T1. Des céphalées sont fréquemment décrites, dues à la contracture secondaire des muscles trapèze et paravertébraux [42]. Les symptômes sont déclenchés par des mouvements d’abduction et d’antépulsion prolongés, ou la position allongée. L’examen clinique cherche des troubles sensitifs ou une amyotrophie, en fait rares [42]. La palpation de la fosse sus-claviculaire et du triangle interscalénique peut déclencher la douleur. Un STTB est plus rarement le fait d’une compression artérielle qui, localisée et répétée, peut entraîner une sténose et parfois une dilatation poststénotique. L’altération de la paroi artérielle provoque l’apparition de microembolies digitales, d’embolies tronculaires graves ou une thrombose de l’artère sous-clavière [5, 13]. Les manifestations cliniques comprennent la claudication intermittente du membre supérieur, les douleurs de repos de la main et des doigts, la pâleur et le refroidissement de ceux-ci, la présence d’hémorragie sous les ongles, d’ulcères ou de gangrènes digitaux. Ces signes d’ischémie évoluée avec nécrose tissulaire sont, presque toujours, la conséquence d’épisodes emboliques multiples qui peuvent être évités par un diagnostic précoce. Moins de 5 % des ischémies aiguës du membre supérieur sont dues à un STTB [1]. Tous ces symptômes peuvent s’associer à un phénomène de Raynaud unilatéral, mais sans qu’un lien de cause à effet soit démontré [30]. Dans quelques cas, les symptômes du STTB peuvent avoir évolué jusqu’à ressembler à ceux d’une causalgie (dystrophie sympathique réflexe) avec vasospasme, œdème diffus et hypersensibilité [42]. Un STTB avec compression veineuse peut provoquer un œdème, une cyanose, une fatigabilité rapide de l’avant-bras à l’effort, en absence de toute lésion artérielle et des douleurs du membre supérieur. Une compression chronique peut aboutir à une thrombose, avec d’éventuelles séquelles postphlébitiques. Ces différents syndromes peuvent être associés chez un même sujet. L’examen clinique cherche à reproduire le phénomène de compression par les manœuvres classiques (Kalb, Roth, Wright...). La manœuvre 10 Sténose artérielle intermittente objectivée en abduction du bras. d’Adson (abolition du pouls radial en inspiration forcée et rotation cervicale opposée) met en évidence une compression artérielle. Elle est souvent positive en cas de STTB neurologique. La manœuvre du « chandelier » a la meilleure valeur diagnostique. Il est demandé au malade d’ouvrir et de fermer les poings de façon répétée, les bras en position « haut-les-mains ». Le test, pour être positif, doit reproduire rapidement la symptomatologie. Les examens doppler et échographique, artériel et veineux, complètent cet examen. Aucun examen paraclinique ou d’imagerie ne peut se substituer au diagnostic clinique de STTB. Les radiographies standards du rachis cervical et du thorax recherchent d’éventuelles anomalies osseuses (fig 8A, 9A). L’angiographie en abduction permet de faire le diagnostic de compression, mais elle est surtout réservée à l’exploration des complications artérielles (sténoses, anévrisme) (fig 9B, 10). La réalisation d’une tomodensitométrie (TDM) cervicale ou d’une imagerie par résonance magnétique (IRM) est généralement peu utile en cas de STTB neurologique. Ces examens permettent le diagnostic différentiel de discopathie, de cervicarthrose, voire de lésion du système nerveux central. L’étude comparative des images du scanner spiralé et des constatations anatomiques montre une bonne corrélation anatomoradiologique. Mais un aspect de compression n’est pas toujours pathologique [25]. La phlébographie dynamique est utile dans le bilan d’une compression veineuse. Elle peut montrer des images de compression ou de sténose avec dilatation d’amont. L’échographie endovasculaire donne des résultats comparables à ceux de la phlébographie, dans l’exploration des STTB veineux [9]. Les examens électrophysiologiques représentent une aide au diagnostic en montrant des signes positifs (atteinte motrice des petits muscles de la main, diminution du potentiel sensitif distal du cubital) et en éliminant des diagnostics différentiels (syndrome du canal carpien ou de compression du nerf cubital au coude). Il en est de même pour les potentiels évoqués somatosensitifs, qui permettent de mieux sélectionner les malades candidats à une intervention chirurgicale et d’en apprécier plus objectivement les résultats. La principale limite des examens électrophysiologiques est de présenter un taux élevé de faux négatifs [22]. Une large part doit être accordée au bilan psychologique si le diagnostic est douteux et les examens électrophysiologiques normaux [33]. Voies d’abord de la première côte (fig 11) Résection de la première côte par voie axillaire (technique de Roos) [10, 42] Instrumentation La résection de la première côte par voie axillaire nécessite une instrumentation spécifique (fig 12). Elle permet l’exposition de tous les éléments neurovasculaires dans un tunnel étayé par des valves, et au fond duquel la première côte est libérée et sectionnée à chacune de ses extrémités. page 5 43-029-Q CHIRURGIE DES SYNDROMES DE COMPRESSION DU DÉFILÉ THORACOBRACHIAL A B Techniques chirurgicales 12 Instrumentation pour la résection costale par voie axillaire. 1. Valves de Kocher ou Hosel ; 2, 3, 4. costotomes ; 5. costotome de Roos ; 6. écarteur à racine de Roos ; 7. pince gouge. 45° C D 13 Installation du malade pour une voie axillaire. Exposition 11 Voies d’abord de la première côte. E A. Voie axillaire. B. Voie sus-claviculaire. C. Voie sous-claviculaire. D. Voie postérieure extrapleurale. E. Voie antérolatérale transpleurale. Installation (fig 13) Le patient est immobilisé en décubitus latéral à 90° ou en position dite intermédiaire, entre 45 et 60°, selon la corpulence du sujet. Le travail à l’aide d’une lampe frontale ou de valves éclairantes est plus aisé qu’avec un éclairage par un scialytique plafonnier. Tout le membre supérieur est préparé pour être libre et permettre des manœuvres de traction qui ouvrent l’angle entre le paquet vasculonerveux du bras et la première côte. Pour une intervention à droite, l’aide en premier est placé à la droite de l’opérateur, l’aide en second à gauche. Le rôle de ce deuxième aide est important ; il exerce une traction sur le membre, qui doit être progressive pour ne pas provoquer des lésions d’étirement du plexus brachial. Cette traction est interrompue toutes les 5 minutes. Incision cutanée Elle est faite à la limite inférieure de la pilosité axillaire, soit transversalement, soit légèrement arciforme, à concavité supérieure. L’incision est arrêtée, en avant, sur la saillie du muscle grand pectoral et, en arrière, sur celle du bord externe du muscle grand dorsal. Une incision cutanée plus longue expose à la section des fibres musculaires et à des séquelles fonctionnelles et esthétiques sans améliorer pour autant la visibilité. page 6 La graisse sous-cutanée est traversée à l’aplomb jusqu’au fascia exothoracique. La dissection s’arrête sur le plan ostéomusculaire de la paroi thoracique avant le muscle grand dentelé (serratus anterior). La dissection est ensuite dirigée vers la première côte, après une progression de 15 à 20 cm. Le décollement se fait au doigt ou au tampon monté, dans le plan situé entre le fascia exothoracique et la face superficielle du muscle grand dentelé. Ce décollement est oblique, en haut et en avant, en arrière de la face postérieure du muscle grand pectoral (pectoral latéral). L’exposition est faite par une ou plusieurs valves de Kocher de différentes longueurs. La plus longue valve est positionnée dans l’angle, entre les faces supérieure et antérieure de la cavité. Une autre valve écarte le muscle grand pectoral et son nerf inférieur, ainsi que l’artère mammaire externe (thoracique externe) qui ne sont habituellement pas vus. En revanche, le nerf perforant est habituellement situé sur le trajet de la dissection. C’est une anastomose entre le deuxième nerf intercostal et le nerf accessoire du brachial cutané interne (nerf cutané médial du bras). Sa section provoque une anesthésie de la face interne du bras, le plus souvent définitive. Sa contusion lors des manœuvres d’écartement est source de séquelles temporaires à type d’anesthésie vraie, de dysesthésies ou d’hypoesthésie. Il faut éviter de faire une dissection ayant un trajet postérieur, suivant la face antérieure du muscle grand dorsal (thoracodorsal). Le danger serait alors de blesser le nerf du muscle grand dorsal ou l’artère thoracodorsale. Ce trajet se prolonge sur le nerf du muscle grand dentelé dont le traumatisme a pour conséquence un décollement de l’omoplate de la paroi thoracique (scapula alatae). Libération de la première côte (fig 14) La traction du membre supérieur est indispensable pour décoller le paquet vasculonerveux qui apparaît au-dessus du bord interne de la première côte. L’artère est d’abord contrôlée sur lacs, puis libérée de ses Techniques chirurgicales CHIRURGIE DES SYNDROMES DE COMPRESSION DU DÉFILÉ THORACOBRACHIAL 14 Voie axillaire : exposition du défilé interscalénique avant section des muscles scalènes. 1. Défilé interscalénique ; 2. artère axillaire ; 3. plexus brachial ; 4. veine axillaire ; 5. scalène antérieur ; 6. scalène moyen ; 7. première côte. 43-029-Q 15 Voie axillaire : exposition du pédicule artérionerveux après la résection costale. 1. Dôme pleural ; 2. artère axillaire ; 3. veine axillaire ; 4. plexus brachial. adhérences avec les muscles scalènes antérieur, moyen, et avec la première côte. Les derniers centimètres du muscle scalène antérieur sont disséqués. Le muscle est ensuite sectionné et un segment musculaire est réséqué [42], ainsi que d’éventuelles attaches avec les éléments de voisinage. La même manœuvre est réalisée pour le muscle scalène moyen. L’utilisation du rétracteur à racine de Roos permet de refouler la racine C8/T1. Les fibres musculaires des muscles intercostaux sont sectionnées en extrapériosté, sur toute la longueur du bord externe de la première côte ; la plèvre est décollée sous la face inférieure de la côte. Section costale (fig 15) Elle est habituellement commencée par la section antérieure au niveau de la jonction chondrocostale à l’aide d’un costotome droit de Roos, ou angulé à 45° de Maurer. L’arc antérieur de la côte est saisi à l’aide d’une pince type Museux, puis soulevée et latéralisée. La racine C8/T1 est réclinée et protégée. Un costotome à 90° est descendu le plus loin possible vers l’articulation costovertébrale. La résection doit être la plus complète possible. L’idéal est de réséquer l’arc postérieur de la première côte en totalité, jusqu’à l’articulation costovertébrale. La clef de la désarticulation est la section de la capsule de l’articulation transversocostale. Celle-ci peut être obtenue en poussant une rugine échancrée de Semb le long du bord externe de la première côte dans sa partie postérieure, tout en maintenant fermement l’arc postérieur de la côte. Il est ensuite relativement aisé de pratiquer la désarticulation costovertébrale, en exerçant sur l’arc postérieur de la côte des mouvements combinés de rotation et de traction. Les extrémités costales restantes doivent être parfaitement nettes. Les esquilles osseuses sont réséquées à la pince gouge. L’artère et de la racine C8/T1 doivent être parfaitement libres. D’éventuelles brides fibreuses et des faisceaux musculaires accessoires (scalène minor ou minimus) seraient sectionnés. Une petite brèche pleurale ne nécessite qu’une simple hyperpression d’insufflation pulmonaire, permettant le retour du poumon à la paroi. Une brèche plus importante peut amener à poser un drain thoracique n°16 ou 18 laissé en aspiration quelques heures. Fermeture et suites Un drain aspiratif de Redon est habituellement laissé en place pendant 24 ou 48 heures. Le tissu cellulaire sous-cutané est rapproché par quelques points de fil résorbable. La peau est refermée par un surjet sous-cutané. Cette voie d’abord est peu algique. Le lever est précoce. La gêne respiratoire est nulle. Le recours à une rééducation de l’épaule n’est pas systématique [42]. La reprise du travail varie, selon la profession du sujet, entre 3 et 4 semaines. 16 Sympathectomie dorsale par voie axillaire. Avantages et inconvénients Cette voie d’abord permet un certain nombre de gestes associés : ténotomie du muscle sous-clavier, résection d’une côte cervicale, sympathectomie dorsale supérieure (fig 16), gestes vasculaires complémentaires ou ténolyse du petit pectoral. Il faut cependant souligner la relative difficulté de l’intervention pour un chirurgien peu habitué à cette voie. Cette difficulté est majorée chez le sujet obèse ou musclé, ainsi qu’en présence d’une néoarthrose entre C1 et C2, ou entre une côte cervicale longue et la première côte. La résection d’une côte cervicale est parfois délicate, mais elle impose rarement le recours à une voie sus-claviculaire complémentaire pour éviter de laisser en place un moignon costal résiduel. Il faut enfin noter la difficulté, sinon l’impossibilité, de réaliser un geste vasculaire élaboré par cette voie. Voie sus-claviculaire [38] Installation Après intubation trachéale, le malade est installé en décubitus dorsal, avec un billot sous les épaules ou une alèse roulée. Il faut éviter de placer le cou en hyperextension, et plus encore, d’y associer une rotation controlatérale de la tête. Cette position met en effet en tension les racines plexiques pendant toute la durée de l’intervention. La tête doit donc être laissée en position indifférente, et pouvoir être mobilisée, le cas échéant, pour soulager une tension exercée temporairement sur les racines. Le membre supérieur peut être inclus dans le champ pour mobiliser le bras, afin d’apprécier la libération des éléments nerveux et de l’opportunité de la résection complémentaire de la première côte [43]. page 7 43-029-Q CHIRURGIE DES SYNDROMES DE COMPRESSION DU DÉFILÉ THORACOBRACHIAL Techniques chirurgicales Incision cutanée L’incision est faite 2 cm au-dessus de la clavicule ; elle débute à 1 cm de la ligne médiane et est longue de 8 à 10 cm. Son tracé doit être fait au minimum 2 cm au-dessus de la clavicule, car la cicatrice a tendance à migrer vers le bas de façon inesthétique. L’idéal est de repérer, sur le cou en flexion, le pli situé le plus bas (celui qui est choisi pour la chirurgie thyroïdienne) et d’inciser en regard sur une longueur de 6 à 8 cm. Exposition (fig 17) Les berges cutanées sont disséquées sous le muscle peaucier. Le bon plan de clivage est situé immédiatement à la surface du muscle sternocléidomastoïdien (SCM). Il est possible de sectionner le chef claviculaire du SCM, mais cela n’est habituellement pas nécessaire. La graisse préscalénique est sectionnée en regard du muscle scalène antérieur. Le nerf phrénique, qui siège à la surface du scalène antérieur, est disséqué avec précaution, puis récliné. Le muscle scalène antérieur est alors disséqué et réséqué au voisinage de son insertion sur la première côte. En haut, la dissection doit être menée jusqu’à l’insertion du muscle sur l’apophyse transverse de la sixième vertèbre cervicale. Les racines C5, C6 et C7 sont libérées. Le muscle scalène moyen, qui est situé en arrière, est ensuite réséqué progressivement en respectant le nerf du grand dentelé. Si une côte cervicale ou un ligament congénital sont présents, ils siègent généralement à ce niveau ; ils sont donc excisés à ce moment avec le muscle. 17 Voie sus-claviculaire : exposition du pédicule nerveux et artériel après section du muscle scalène antérieur (1), scalène moyen (2), artère sous-clavière (3), plexus brachial (4), nerf phrénique (5). Libération de la première côte (fig 18) La première côte est disséquée en extrapériosté. Le plexus brachial est récliné, puis le col de la côte est sectionné. Après avoir soulevé l’extrémité de la côte, les muscles intercostaux sont désinsérés au bord externe de la côte, à la rugine, et la plèvre libérée à sa face profonde. L’extrémité antérieure de la côte est ensuite libérée, puis sectionnée. Les esquilles osseuses au niveau des extrémités costales restantes sont réséquées à la pince gouge. Libération d’une côte cervicale La côte cervicale doit être identifiée, ainsi qu’un éventuel trousseau fibreux. Les racines plexiques sont mises sur lacs pour les mobiliser prudemment et permettre la dissection rétrograde de la côte cervicale. Il est souvent nécessaire, et plus aisé, de séparer le plexus en deux contingents, supérieur et inférieur, alternativement écartés pour faciliter la dissection. Le trousseau fibreux est ensuite réséqué ainsi que la côte jusqu’à sa base ou son éventuelle articulation. Fermeture et suites Un drain aspiratif est laissé en place en arrière du plexus, la graisse préscalénique est remise en place et l’incision est fermée en utilisant des fils résorbables, pour le plan sous-cutané, et un surjet intradermique. Avantages et inconvénients Cette voie d’abord est plus facile à réaliser que la voie axillaire, surtout pour un opérateur débutant. L’exposition des racines nerveuses, de l’artère sous-clavière et d’une éventuelle côte cervicale est meilleure que par voie axillaire [8]. En revanche, la résection de la partie antérieure de la première côte est plus difficile. La voie sus-claviculaire doit donc être évitée dans les cas où la symptomatologie veineuse est prédominante. Une sympathectomie cervicale est possible par cette voie [43]. Les traumatismes du nerf phrénique, de même que les plaies veineuses et celles du canal thoracique, sont plus fréquents par une voie susclaviculaire que par une voie axillaire [38]. Voies d’abord thoraciques [41] Voie antérieure sous-claviculaire Installation Le malade est en décubitus dorsal, la tête tournée vers le côté opposé, le bras en abduction avec surélévation de l’épaule par un billot. Cette position ouvre l’espace cléidocostal. page 8 18 Voie sus-claviculaire : exposition du pédicule nerveux et artériel après section du muscle scalène antérieur (1) et du muscle scalène moyen (2), artère sousclavière (3), plexus brachial (4), nerf phrénique (5), première côte (6). Incision L’incision horizontale, sous-claviculaire, débute dans la dépression située sous l’extrémité sternale de la clavicule et se termine plus ou moins loin vers le sillon deltopectoral, selon l’importance de la musculature du sujet. Les fibres du grand pectoral sont dissociées et le petit pectoral sectionné. Après clivage du tissu celluleux précostal, un écarteur récline les vaisseaux et le plexus brachial en dehors et en haut. Exposition et résection costale (fig 19) Les fibres du muscle grand pectoral sont réclinées et le muscle sousclavier sectionné. Les muscles intercostaux du premier espace sont ensuite désinsérés jusqu’à l’articulation chondrosternale. Après section des ligaments costoclaviculaires, la face profonde de l’extrémité antérieure de la côte est libérée, ainsi que son bord supérieur. La section est faite au niveau du cartilage costal. L’extrémité de la côte est mobilisée pour permettre la libération de sa face inférieure sous contrôle de la vue. L’abaissement de la côte éloigne les vaisseaux sousclaviers, en mettant en tension les muscles scalènes qui sont ensuite sectionnés. La libération de la côte est poursuivie, en la tirant en haut et en dedans, jusqu’au sommet de l’apophyse transverse, tout en protégeant la première racine dorsale. La côte est ensuite sectionnée à ce niveau. La fermeture est faite en rapprochant le muscle grand dorsal sur un drainage aspiratif. Techniques chirurgicales CHIRURGIE DES SYNDROMES DE COMPRESSION DU DÉFILÉ THORACOBRACHIAL 43-029-Q 19 Voie d’abord sous-claviculaire. 1. Pédicule artériel et nerveux ; 2. muscle scalène antérieur ; 3. muscle scalène moyen ; 4. première côte ; 5. clavicule. Gestes associés Une apicolyse peut être réalisée par cette voie, permettant une sympathectomie thoracique. Une restauration artérielle est possible en poursuivant l’incision dans le sillon deltopectoral. Une thrombectomie veineuse est aisément réalisée, la veine étant directement exposée et protégée par l’écarteur durant la libération et la résection costale. Avantages et inconvénients Cette voie permet une exérèse facile de l’arc antérieur de la première côte, mais il n’en va pas de même pour l’arc postérieur, ou une éventuelle côte cervicale, ou encore pour une apophysomégalie transverse. Elle permet un geste veineux, ainsi qu’un geste artériel et une sympathectomie thoracique. C’est une alternative à la voie axillaire dans les formes à symptomatologie veineuse. Voie postérieure extrapleurale Installation Le malade est installé en décubitus latéral incliné en avant, avec un billot, de façon à dégager et élargir au maximum l’espace interscapulovertébral. Incision et exposition (fig 20) L’incision est parallèle au bord spinal de l’omoplate et à la ligne des apophyses épineuses. Elle débute à la hauteur de l’épine de l’omoplate et ne dépasse pas la pointe. Les muscles trapèze et rhomboïde sont sectionnés près de la ligne des épineuses, afin de respecter le nerf spinal et l’artère scapulaire postérieure. On découvre ainsi un plan celluleux facile à cliver, qui permet de glisser un écarteur, de manière à soulever l’omoplate en dehors et en haut. La côte la plus haute que l’on voit et que l’on palpe est la deuxième côte. Elle est repérée par l’insertion du grand dentelé sur son bord externe et sa face supérieure. La section des premières digitations supérieures du grand dentelé accentue l’écartement de l’omoplate, exposant la partie haute de la cage thoracique. La première côte est masquée par différentes formations musculaires : scalène postérieur, masse latérovertébrale, faisceau supérieur du grand dentelé. Elle est incluse à l’intérieur de l’arc de la deuxième côte, profondément enfouie. Selon la conformation du thorax, la résection préalable de la deuxième côte peut être nécessaire. Résection costale La dissection de la côte est menée successivement le long de son bord externe et à sa face inférieure, depuis le col jusqu’au cartilage. La face supérieure est libérée prudemment en commençant par l’extrémité postérieure de la côte sur 2 ou 3 cm près du col. La côte est sectionnée en arrière à la pointe de l’apophyse transverse. L’extrémité de l’arc costal est abaissée pour éloigner le paquet vasculonerveux. La face supérieure et le bord interne sont ruginés et les muscles scalènes sectionnés. Le ligament costoclaviculaire est désinséré en avant, puis la côte est sectionnée à la jonction chondrocostale. 20 Voie postérieure extrapleurale : abord postérieur de la première côte (1). Variantes La voie postérolatérale de Johnson (voie interscapulovertébrale prolongée en bas vers l’aisselle) associe une section du muscle grand dorsal et une résection sous-périostée de la côte. Après ablation de la côte, un clivage est effectué en avant, entre la veine sous-clavière et le lit périosté qui est plus épais à ce niveau. Le périoste et les attaches des muscles scalènes sont ensuite mobilisés vers le bas et réséqués. Gestes associés L’excellente exposition des racines nerveuses permet une neurolyse complète. Il est également facile de pratiquer une résection complète de la première côte, d’une côte cervicale, d’anomalies osseuses ainsi que des tractus fibromusculaires ou ligamentaires. Une sympathectomie dorsale peut également être réalisée par cette voie en sectionnant un court segment postérieur de la deuxième côte. Avantages et inconvénients Cette voie permet une exérèse facile de l’arc postérieur de la première côte, d’une côte cervicale ou d’une apophysomégalie, moins aisée de l’arc antérieur. Un geste vasculaire est difficilement réalisable. Le préjudice esthétique est minime. Voie antérolatérale transpleurale Installation et incision Le malade est installé en décubitus latéral, légèrement dorsal, avec le membre supérieur suspendu au-dessus de la tête. L’incision cutanée se fait sous le bord inférieur du muscle grand pectoral chez l’homme. Elle est latéro- et sous-mammaire chez la femme. La thoracotomie antérolatérale, courte, s’effectue dans le troisième espace intercostal, au bord supérieur de la quatrième côte. Exposition (fig 21A) Le poumon est récliné vers le bas. La plèvre du dôme pleural, qui masque le pédicule sous-clavier, est incisée sur la côte, dans sa moitié page 9 43-029-Q CHIRURGIE DES SYNDROMES DE COMPRESSION DU DÉFILÉ THORACOBRACHIAL 21 A antérieure, en débordant à peine sur le cartilage. En arrière, l’incision pleurale descend vers le col de la deuxième côte. À partir de cette incision pleurale, le plan extrapleural est ouvert en progressant de manière concentrique jusqu’à 1 cm du bord inscrit, en avant et jusqu’au col de la première côte en arrière. Ce geste éloigne la veine, libère la racine T1 de l’arc postérieur et met en évidence la portion intrascalénique de l’artère. Résection costale (fig 21B) Le tiers postérieur du bord inférieur de la côte est dégagé en repoussant, vers le haut, la lèvre supérieure de l’incision pleurale. Il faut rester au contact de l’os, entre la racine et la plèvre, en refoulant T1 et C8. Le premier espace intercostal est ouvert après avoir sectionné l’insertion du muscle scalène moyen. La section costale est effectuée en prenant soin de refouler les racines nerveuses vers l’avant. La côte est abaissée pour mettre en tension le scalène antérieur et écarter l’artère vers le haut. Le scalène est alors sectionné. L’incision est poursuivie vers l’avant pour dégager la veine et la refouler, au tampon monté, à la face supérieure de la côte. Le costotome est poussé en avant pour sectionner la côte au niveau du cartilage. Le fragment postérieur est recoupé au contact de l’apophyse transverse. Une partie des muscles scalènes est réséquée, et l’on réalise une libération de l’artère et de la veine, ainsi qu’une exploration complète à la recherche d’anomalies fibroligamentaires. Variante technique La résection peut être menée d’avant en arrière. Le geste clé reste l’abaissement de la côte et la mise en tension du scalène antérieur. Le bord supéro-interne de l’arc costal antérieur est libéré au tampon monté, refoulant la veine sous-clavière. La côte sectionnée au niveau du cartilage est ensuite abaissée et le scalène antérieur sectionné après avoir écarté l’artère. Le segment postérieur de la côte est isolé, puis sectionné après avoir récliné les racines vers le haut. Gestes associés La résection d’une côte cervicale est possible par cette voie, ainsi que celle d’une première côte anormale ou celle d’anomalies fibromusculaires. Une réparation de l’artère sous-clavière est possible. La sympathectomie thoracique est facilement réalisable, l’accès direct permettant l’exérèse des premiers ganglions, en respectant le ganglion stellaire pour éviter un syndrome de Claude Bernard-Horner. Avantages et inconvénients La voie transpleurale est techniquement simple et rapide. L’ouverture de la plèvre n’entraîne aucun risque supplémentaire, si ce n’est sa contre-indication, en cas de séquelles pleurales ou de lésions pulmonaires anciennes du sommet. L’ablation complète de l’extrémité postérieure est moins aisée, mais l’exérèse d’une côte cervicale ou d’anomalies est possible. La cicatrice est peu visible, aussi bien chez l’homme que chez la femme. page 10 B Techniques chirurgicales Voie antérolatérale transpleurale. A. Avant résection de la première côte (1). B. Après résection de la première côte, pédicule artériel et nerveux (1). Indications L’indication d’une résection de la première côte ne doit pas être univoque, mais choisie en fonction de deux facteurs : la symptomatologie prédominante (artérielle, veineuse ou nerveuse) et les gestes qui doivent y être associés (résection de côte cervicale ou d’apophysomégalie transverse, ligament fibromusculaire cervical, désobstruction artérielle ou veineuse sous-clavière, restauration artérielle pour oblitération ou anévrysme, sympathectomie thoracique). De façon générale, l’intervention chirurgicale n’est décidée qu’après échec d’une gymnastique rééducative de la ceinture scapulaire menée pendant 3 à 6 mois. Cette physiothérapie, proposée initialement par Peet, a pour but de développer les muscles « ouvrant » la traversée thoracobrachiale (faisceaux supérieur et moyen du trapèze, élévateurs de l’épaule, sternocléidomastoïdien et rhomboïde) [2]. Les indications peuvent se résumer de plusieurs façons. – Pour les formes nerveuses, et lorsqu’il existe des anomalies ostéoligamentaires : voie sus-claviculaire [19]. La voie postérieure peut être envisagée dans les récidives des manifestations nerveuses et dans les échecs d’interventions incomplètes menées par d’autres abords. – Pour les formes vasculaires non compliquées (compression veineuse et/ou artérielle sans lésions pariétales) : voie axillaire avec résection de l’aponévrose du muscle sous-clavier et de son tendon. – Pour les formes veineuses compliquées : si la thrombose veineuse aiguë sous-clavière est vue précocement, elle peut être traitée par thrombectomie ou fibrinolyse. Dans les formes chroniques, la reconstitution directe de la veine sous-clavière est décevante [7]. La résection costale peut être menée par voie antérieure sous-claviculaire, de préférence à une voie axillaire, en raison du risque nerveux iatrogène moindre (traumatisme des racines, élongation plexique), surtout chez le sujet obèse ou musclé. Cette voie est particulièrement utile en cas de récidive veineuse après résection costale axillaire [27]. Il est possible d’utiliser une voie combinée sus- et sous-claviculaire [43]. Une éventuelle sténose veineuse résiduelle peut être traitée par angioplastie transluminale après la décompression chirurgicale. La question se pose également de l’indication opératoire préventive controlatérale, qui serait justifiée s’il existe des signes de compression veineuse [32]. – Pour les formes artérielles compliquées : – anévrysme, ulcération, thrombose : la voie sus-claviculaire est la plus utilisée [13] pour faire la résection costale et la réparation vasculaire. Une courte voie sous-claviculaire peut être nécessaire, selon l’étendue de la lésion artérielle [43]. La zone pathologique est réséquée et la continuité artérielle est rétablie en interposant un greffon saphène ou prothétique, voire un greffon autogène artériel [43] ; – lésions distales (embolies, troubles vasomoteurs) : les tentatives d’embolectomies tardives et les pontages distaux sur les artères de l’avant-bras donnent des résultats décevants. On peut alors avoir recours à une sympathectomie dorsale supérieure. La résection costale est menée par une voie axillaire ou thoracique transpleurale. La question se pose également de savoir s’il faut toujours réséquer la première côte [3, 13]. La résection est systématique en cas d’anomalie de la première côte, de défilé osseux étroit, de sténose de la veine sousclavière, de récidive après scalénectomie ou après résection isolée d’une Techniques chirurgicales CHIRURGIE DES SYNDROMES DE COMPRESSION DU DÉFILÉ THORACOBRACHIAL côte cervicale. La conservation de la première côte est possible en cas de compression plexique haute isolée [17], de compression par le muscle petit pectoral, ou encore d’une pathologie claviculaire imposant une cléidectomie. La discussion reste ouverte dans deux cas : – en présence d’une côte cervicale, la conservation de la première côte peut être systématique, avec un taux de récidive qui paraît faible [3], ou sélective, si la côte cervicale est très volumineuse et si le défilé est bien libéré après son exérèse. La résection de la première côte peut aussi être systématique, surtout en cas de geste de revascularisation artérielle, pour prévenir une récidive qui serait difficile à traiter ; – en présence d’une compression plexique basse sans anomalie osseuse, trois attitudes sont possibles : – une attitude minimaliste, qui consiste à effectuer une scalénectomie et une résection des éléments compressifs (avec un risque de récidive de 15 à 20 %). Cette attitude peut être systématique [12] ou réservée aux syndromes post-traumatiques qui répondent positivement aux tests d’infiltration du scalène antérieur [38] ; – une attitude maximaliste, qui comporte la résection systématique de la première côte et des scalènes ; – une attitude intermédiaire, qui préconise la résection de la première côte, avec résection d ’une partie des scalènes par voie axillaire, en cas de compression plexique basse. La résection de la première côte avec scalénectomie est réservée aux compressions plexiques diffuses, en utilisant une double voie sus-claviculaire et axillaire [3]. Seule une étude randomisée permettrait de dégager les meilleures indications opératoires, mais sa réalisation se heurtera à l’absence de tests diagnostiques objectifs et à l’influence de la technique sur les résultats. Complications Cette chirurgie, réputée bénigne, peut être source de complications mineures comme des dysesthésies transitoires, des brèches pleurales ou des hémothorax qui peuvent nécessiter un drainage. Mais il a aussi été rapporté des complications graves, qu’il s’agisse de plaies veineuses, artérielles, ou de traumatismes du plexus brachial, du nerf du grand dentelé ou encore du nerf phrénique. Il est à noter que les complications vasculaires sont plus fréquentes par la voie axillaire. Il peut être nécessaire, en cas de plaie artérielle impossible à contrôler rapidement, de clamper l’artère en amont par une voie sus-claviculaire. La voie susclaviculaire expose davantage à des blessures de la veine sous-clavière, mal exposée par cette voie, ou du nerf phrénique [6, 26]. Résultat Les résultats chirurgicaux sont habituellement bons pour des indications de compression artérielle ou veineuse. Une amélioration est apportée dans 70 à 90 % des cas [19] . Il n’en va pas de même lorsque la symptomatologie initiale prédominante est neurologique [31] . Des facteurs psychopathologiques influencent l’appréciation des résultats chirurgicaux. Il est donc important de bien sélectionner les malades avant de proposer une intervention chirurgicale. Récidives Elles posent de difficiles problèmes diagnostiques et thérapeutiques. Leur fréquence, diversement appréciée, serait de l’ordre de 10 % des cas [36]. Leur délai d’apparition varie de quelques semaines à plusieurs années après l’intervention. Les signes peuvent survenir à la suite d’un facteur déclenchant, tel un traumatisme de l’épaule, du cou ou du bras. Comme lors du bilan initial, il faut rechercher les diagnostics différentiels possibles : compression des nerfs ulnaire ou médian, pathologies cervicarthrosiques, lésions du système nerveux central, voire un angor ou un syndrome de Pancoast et Tobias. Diagnostic Deux formes cliniques de récidive neurologique (haute et basse) prédominent. La récidive plexique haute intéresse les racines supérieures (C5, C6 et C7) du plexus brachial. Elle est due à la 43-029-Q persistance des adhérences ou à une fibrose cicatricielle solidarisant le muscle scalène antérieur au fascia endothoracique, à l’artère sousclavière ou au plexus brachial. Elle entraîne des douleurs des régions cervicale latérale, interscapulohumérale, sus-scapulaire, de la partie externe de l’épaule et du bras dans le territoire du nerf radial, irradiant parfois vers l’oreille. La récidive plexique basse concerne les racines plexiques inférieures (C8 et T1) et est due à la formation d’une fibrose cicatricielle sur le fascia endothoracique du dôme pleural. Elle s’accompagne également de douleurs de la région interscapulovertébrale, du creux sus-claviculaire, du creux axillaire, de paresthésies dans le territoire du nerf ulnaire. Certaines récidives associent les deux types d’atteinte plexique. La majeure partie de l’innervation sympathique du membre supérieur chemine avec le nerf ulnaire, ce qui explique l’existence de causalgies associant des douleurs à type de brûlure à une hypersensibilité cutanée du creux axillaire, de la partie interne du bras et de la main. Certains malades présentent un aspect de neuroalgodystrophie du membre supérieur. La récidive postopératoire n’intéresse qu’exceptionnellement l’artère et la veine sous-clavière, si l’obstacle anatomique a été totalement levé lors de la première intervention. L’examen clinique retrouve une douleur à la palpation du creux susclaviculaire, ou à la pression du nerf ulnaire. Il existe des parésies du triceps et des muscles interosseux dans les formes basses, et des muscles deltoïde, biceps et extenseurs du poignet dans les formes hautes. L’artériographie et la phlébographie, de même que l’exploration échodoppler des vaisseaux sus-claviculaires, sont le plus souvent inutiles. Les explorations électromyographiques n’apportent que peu d’arguments diagnostiques. En revanche, les radiographies du rachis cervical, le scanner ou l’IRM peuvent retrouver un moignon postérieur costal proéminent ou une côte surnuméraire insuffisamment réséquée. Un résidu osseux ou une fibrose existent dans 40 % des cas de récidive [8], mais sans relation de cause à effet clinique évidente. Une résection insuffisante du muscle scalène antérieur, une hémorragie perou postopératoire, une infection, une lymphorrhée et une reprise précoce de la rééducation (avant 3 mois) sont des facteurs prédisposant à la récidive. Traitement Pour les récidives plexiques hautes, le but de la réintervention est de réaliser une neurolyse des racines plexiques hautes, de réséquer complètement le muscle scalène antérieur et un éventuel moignon costal thoracique ou cervical trop long. Certains préconisent également la résection du muscle scalène moyen [8]. La voie d’abord sus-claviculaire permet un bon contrôle des racines hautes du plexus brachial et du muscle scalène antérieur. Ce muscle doit être abordé à l’union de son tiers moyen et de son tiers supérieur afin de ne pas traumatiser le nerf phrénique. La partie inférieure du scalène antérieur est réclinée vers le bas et progressivement libérée de ses attaches fibreuses. Il faut réséquer entièrement le pseudotendon fibreux qui le solidarise généralement avec les racines plexiques. La partie supérieure du muscle est ensuite réséquée. Chaque racine du plexus est libérée sur toute sa longueur jusqu’au foramen rachidien. La prévention d’une nouvelle récidive implique une hémostase et une lymphostase rigoureuses, complétées par un lavage du creux sus-claviculaire et l’interposition de la graisse préscalénique sur les troncs nerveux disséqués. En cas de récidive plexique inférieure, la réintervention doit libérer les racines C8 et T1 du tissu fibreux cicatriciel, situé surtout au niveau du moignon de la première côte, au voisinage du foramen de T1, sur le dôme pleural jusqu’au niveau de la deuxième côte. La neurolyse est poursuivie jusqu’au niveau du foramen, avec ablation du tissu cicatriciel et libération de l’artère sous-clavière. La voie axillaire serait la mieux adaptée [28, 37]. La reprise de l’incision axillaire conduit directement sur le gril costal. La dissection est poursuivie vers le haut, au doigt, le long du plan costal jusqu’au tissu cicatriciel. Il faut alors libérer au ciseau, prudemment, l’artère axillaire, ainsi que le tronc primaire inférieur jusqu’au foramen de la racine T1. Il n’est pas nécessaire, et même dangereux, de libérer la veine axillaire. Il est possible de réaliser une pleurectomie apicale afin d’améliorer l’exposition, faciliter la dissection de T1 et permettre une sympathectomie élective du ganglion T2, en cas de causalgie ou d’algodystrophie. Il faut réséquer toutes les adhérences fibreuses attachées à la racine T1 jusqu’à son foramen. Le moignon costal doit être réséqué s’il dépasse la taille de 1 cm [28]. Il est possible, page 11 43-029-Q CHIRURGIE DES SYNDROMES DE COMPRESSION DU DÉFILÉ THORACOBRACHIAL par cette voie, de réséquer le scalène antérieur si cela n’a pas été fait au cours de la première intervention. Il en est de même pour une éventuelle fibrose du scalène moyen. Les précautions évoquées pour éviter une nouvelle récidive sont respectées et certains auteurs [37] conseillent l’interposition d’un lambeau graisseux pédiculé à partir du tissu graisseux axillaire. Ce pédicule débute au niveau du fascia sous-cutané, au niveau de la partie supérieure de la cicatrice axillaire. Il doit avoir une dizaine de centimètres de long pour pouvoir être placé, sans tension, en arrière et en dessous de la racine T1. En cas de causalgie ulnaire, une sympathectomie du ganglion T2 peut être réalisée avant la confection du lambeau graisseux pédiculé. Il faut, auparavant, réaliser une pleurectomie apicale et repérer le ganglion stellaire, situé juste au-dessus du col de la deuxième côte, entre la racine T1 et l’artère sous-clavière. Si la symptomatologie évoque un syndrome complet, il est prudent d’installer le malade de sorte qu’un abord sus-claviculaire et axillaire puisse être réalisé. Résultats Ces réinterventions sont plus difficiles. Leur résultats sont moins bons que ceux des interventions de première intention. Les succès immédiats sont évalués à 70 %, avec un bon résultat clinique dans 45 % des cas après 18 mois [8]. L’ablation d’une anomalie anatomique, osseuse ou Techniques chirurgicales tissulaire, incomplètement réséquée au cours de la première intervention, est un facteur de bon pronostic. Les complications des réinterventions sont à la fois plus fréquentes et plus graves. Il s’agit de pneumothorax, lymphorrhée, lésions graves des nerfs plexiques, paralysie récurrentielle ou phrénique. La prévention de ces récidives consiste à faire une résection extrapériostée [28] de la première côte, tout en laissant un moignon costal aussi court que possible, à réséquer toutes les formations musculoaponévrotiques anormales, à faire une hémostase parfaite, laver soigneusement la plaie avant la fermeture et, enfin, à limiter les mouvements de l’épaule et du bras pendant 3 mois après l’intervention. • • • Les principales difficultés diagnostiques des syndromes de la traversée thoracobrachiale se rencontrent dans les formes neurologiques. L’acte chirurgical est bien codifié et généralement bénin. Les suites, en revanche, sont souvent longues avant l’obtention d’un résultat définitif, et responsables d’arrêts de travail prolongés. Les échecs ou les récidives observés dans les syndromes neurologiques ne doivent pas remettre en question le bien-fondé de ces interventions. Elles doivent surtout inciter à poursuivre les efforts tendant à améliorer les performances des examens complémentaires, les techniques opératoires et la sélection des malades qui doivent être opérés [19]. Références [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] Aburahma AF, White JF. Thoracic outlet syndrome with arm ischemia as a complication of cervical rib. W V Med J 1995 ; 91 : 92-94 Aligne C, Barral X. La rééducation des syndromes de la traversée thoracobrachiale. Ann Chir Vasc 1992 ; 6 : 381-389 Bacourt F. Chirurgie des syndromes de la traversée thoracobrachiale : faut-il toujours enlever la première côte ? In : Kieffer E ed. Les syndromes de la traversée thoracobrachiale. Paris : AERCV, 1989 : 143-147 Bahnini A, Kieffer E. Pathologie de la clavicule et syndromes de la traversée thoracobrachiale. In : Kieffer E ed. Les syndromes de la traversée thoracobrachiale. Paris : AERCV, 1989 : 93-102 Banis JC Jr, Rich N, Wehlan TJ Jr. Ischemia of the upper extremity due to noncardiac emboly. Am J Surg 1977 ; 134 : 131-139 Batt M, Griffet J, Scotti L, Lebas P. Le syndrome de la traversée cervicobrachiale. J Chir 1983 ; 120 : 687-691 Bergan JJ, McCarthy WJ, Vogelzang R, Peck JJ. Thromboses veineuses axillo-sous-clavières : place de la thrombolyse et de l’angioplastie In : Kieffer E ed. Les syndromes de la traversée thoracobrachiale. Paris : AERCV, 1989 : 199-206 Cheng SW, Stoney RJ. Supraclavicular reoperation for neurogenic thoracic outlet syndrome. J Vasc Surg 1994 ; 19 : 565-572 Chengelis DL, Glover JL, Bendick P, Ellwood R, Kirsch M, Fornatoro D. The use of intravascular ultrasound in the management of thoracic outlet syndrome. Am Surg 1994 ; 60 : 592-596 Chevalier JM, Enon B, Lescalie F, Afifi A, Reigner B, Peret M. Traitement des syndromes de la traversée thoracobrachiale par voie axillaire. In : Kieffer E ed. Les syndromes de la traversée thoracobrachiale. Paris : AERCV, 1989 : 115-123 Clagett OT. Research and prosearch. J Thorac Surg 1962 ; 44 : 153-166 Dale WA. Thoracic outlet compression syndrome. Arch Surg 1982 ; 117 : 1437-1445 Desai Y, Robbs JV. Arterial complications of the thoracic outlet syndrome. Eur J Vasc Endovasc Surg 1995 ; 10 : 362-365 Dumeige F, Flageat J, Bauchu JY, Schoenenberger P, Paris E, Rignault D. Les anomalies osseuses congénitales de la traversée thoracobrachiale. In : Kieffer E ed. Les syndromes de la traversée thoracobrachiale. Paris : AERCV, 1989 : 81-91 Durham JR, Yao JS, Pearce WH, Nuber GM, McCarthy WJ. Arterial injuries in the thoracic outlet syndrome. J Vasc Surg 1995 ; 21 : 57-69 page 12 [16] Ellison DW, Wood VE. Trauma-related thoracic outlet syndrome. J Hand Surg 1994 ; 19B : 424-426 [17] Fantini GA. Reserving supravascular first rib resection for vascular complications of thoracic outlet syndrome. Am J Surg 1996 ; 172 : 200-204 Fieve G. Les syndromes post-traumatiques de la traversée thoracobrachiale. In : Kieffer E ed. Les syndromes de la traversée thoraco-brachiale. Paris : AERCV, 1989 : 103-112 Hempel GK, Shultze WP, Anderson JF, Bukhari HI. Résection de la première côte par voie sus-claviculaire pour syndrome de la traversée thoracobrachiale : 770 cas consécutifs. Ann Chir Vasc 1996 ; 10 : 456-463 Juvonen T, Satta J, Laitala P, Luukkonen K, Nissinen J. Anomalies at the thoracic outlet are frequent in the general population. Am J Surg 1995 ; 170 : 33-37 Katirji B, Hardy RW Jr. Classic neurogenic thoracic outlet syndrome in a competitive swimmer: a true scalenus anticus syndrome. Muscle Nerve 1995 ; 18 : 229-233 Komanetsky RM, Novak CB, Mc Kinnon SE, Russo MH, Padberg AM, Louis S. Somatosensory evoked potentials fails to diagnose thoracic outlet syndrome. J Hand Surg 1996 ; 21A : 662-666 Koskas F, Kieffer E. Anomalies musculo-ligamentaires de la traversée thoracobrachiale. In : Kieffer E ed. Les syndromes de la traversée thoracobrachiale. Paris : AERCV, 1989 : 57-67 Lagneau P, Vayssairat M. La chirurgie dans le syndrome de la traversée thoracobrachiale. Rev Prat 1981 ; 31 : 2067-2078 Matsumara JS, Rilling WS, Pearce WH, Nemeek AA, Vogelzang RL, Yao JS. Helical computed tomography of the normal thoracic outlet. J Vasc Surg 1997 ; 26 : 776-783 Melliere D, Becquemin JP, Etienne E. Les complications de la chirurgie des défilés thoracocervicobrachiaux. J Chir 1985 ; 122 : 151-157 Mercier C, Huguet JF, Piquet P. Syndrome de compression intermittente de la veine sous-clavière. In : Kieffer E ed. Les syndromes de la traversée thoracobrachiale. Paris : AERCV, 1989 : 183-187 Mingoli A, Feldhaus RJ, Farina C, Cavallari N, Sapienza P, Di Marzo L et al. Long-term outcome after transaxillary approach for thoracic outlet syndrome. Surgery 1995 ; 118 : 840-844 Patra PH, Brunet C, Di Marino V. Anatomie normale de la traversée cervicothoracobrachiale. In : Kieffer E ed. Les syndromes de la traversée thoracobrachiale. Paris : AERCV, 1989 : 21-32 [18] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36] [37] [38] [39] [40] [41] [42] [43] [44] Pistorius MA, Planchon B. Incidence of thoracic outlet syndrome on the epidemiology and clinical presention of apparently primary Raynaud’s phenomenon. A prospective study in 570 patients. Int Angiol 1995 ; 14 : 60-64 Porter JM, Wilbourn AJ. Syndromes neurologiques de la traversée thoracobrachiale : la controverse. In : Kieffer E ed. Les syndromes de la traversée thoracobrachiale. Paris : AERCV, 1989 : 263-273 Priollet P. Thrombose de la veine sous-clavière : traitement médical. J Mal Vasc 1994 ; 19 : 44-47 Rancurel G, Cormier F, Kieffer E, Lazareth JP, Catala M, Lepercq M. Troubles psychopathologiques et résultats de la chirurgie des syndromes neurologiques de la traversée thoracobrachiale. In : Kieffer E ed. Les syndromes de la traversée thoracobrachiale. Paris : AERCV, 1989 : 301-308 Roos RB. Transaxillary approach for first rib resection to relieve a thoracic outlet syndrome. Ann Surg 1966 ; 163 : 354-358 Roos DB. Congenital anomalies associated with thoracic outlet syndrome: anatomy, diagnosis and treatment. Am J Surg 1976 ; 132 : 771-778 Roos DB. Thoracic outlet syndromes: update. Am J Surg 1987 ; 154 : 568-573 Roos DB. Récidives postopératoires des syndromes de la traversée thoracobrachiale. In : Kieffer E ed. Les syndromes de la traversée thoracobrachiale. Paris : AERCV, 1989 : 317-328 Sanders RJ, Monsour JW, Gerber WF. Scalenectomy versus first rib resection for treatment of thoracic outlet syndrome. Surgery 1979 ; 85 : 109-120 Servelle M, Perdu AM, Bacourt F. Complications vasculaires des côtes cervicales. Paris : Masson, 1970 Stallworth JM, Horne JB. Diagnosis and management of thoracic outlet syndrome. Arch Surg 1984 ; 119 : 1149-1151 Thevenet A. Voies d’abord thoraciques de la traversée thoracocervicobrachiale. In : Kieffer E ed. Les syndromes de la traversée thoracobrachiale. Paris : AERCV, 1989 : 135-142 Thompson RW, Petrinec D. Traitement chirurgical des syndromes de la traversée thoracobrachiale : problèmes diagnostiques et technique de résection de la première côte par voie axillaire. Ann Chir Vasc 1997 ; 11 : 315-323 Thompson RW, Petrinec D, Toursarkissian B. Traitement chirurgical des syndromes de la traversée thoracobrachiale : exploration et reconstruction vasculaire par voie sus-claviculaire. Ann Chir Vasc 1997 ; 11 : 442-451 Yang J, Letts M. Thoracic outlet syndrome in children. J Pediatr Orthop 1996 ; 16 : 514-517 Encyclopédie Médico-Chirurgicale 43-029-V 43-029-V Sympathectomie lombaire X Chaufour J Cau JP Bossavy A Barret Résumé. – L’indication de la sympathectomie lombaire est limitée à l’heure actuelle au traitement de l’ischémie chronique des membres inférieurs des patients ne pouvant pas bénéficier d’un geste de revascularisation directe. Elle peut être réalisée avec une morbidité très faible et permet d’améliorer, dans certains cas, l’évolution naturelle de l’insuffisance artérielle. La sympathectomie lombaire réalisée sous vidéoscopie est une alternative à la sympathectomie conventionnelle ou à la neurolyse chimique. © 2001 Editions Scientifiques et Médicales Elsevier SAS. Tous droits réservés. Mots-clés : sympathectomie lombaire, vidéoscopie, artériopathie oblitérante chronique, neurolyse chimique. Principes Depuis le développement de la chirurgie artérielle restauratrice, la sympathectomie lombaire a été reléguée au second plan. La sympathectomie périartérielle a été décrite par Jaboulay en 1899, puis étudiée sur le plan expérimental par Leriche en 1913 et fut une première étape avant la sympathectomie lombaire. Leriche et Fontaine ont montré que la sympathectomie périartérielle n’agit pas par interruption des voies motrices sympathiques mais par section des fibres sensitives ou centripètes, permettant d’obtenir une vasodilatation artérielle d’amont et d’aval [31]. Julio Diez pratiqua la première sympathectomie lombaire pour artérite en 1925, alors que 1 an auparavant Leriche et Wertheimer avaient essayé sans succès la section des rameaux sympathiques communicants lombaires. L’effet vasodilatateur de la sympathectomie a été démontré expérimentalement, il y a de nombreuses années, par Claude Bernard lors de la résection du ganglion cervical supérieur. L’augmentation de température aux membres inférieurs, après sympathectomie lombaire, a été objectivée par Gonzalès Aquilar en 1931. L’augmentation de calibre artériel, après sympathectomie lombaire, a été objectivée par Fontaine après comparaison de clichés artériographiques en 1933. Si l’effet vasodilatateur de la sympathectomie a pu être démontré rapidement, le niveau anatomique de la sympathectomie, pour obtenir une vasodilatation optimale, a longtemps été controversé par de nombreux auteurs ; certains auteurs préconisent des résections sympathiques thoracolombaires, d’autres des résections sympathiques lombosacrées. Albert et Dumont constatent, en 1936, que la section de la chaîne sympathique juste sous le premier ganglion lombaire permet d’obtenir une vasodilatation artérielle maximale des membres inférieurs ; les sections sous-jacentes et sus-jacentes ajoutent peu à cette vasodilatation. Les travaux de White et Smithwick, en 1947, confirment ces données et démontrent que l’efficacité optimale de la sympathectomie lombaire pour artérite est obtenue lorsque les deuxième et troisième ganglions lombaires sont réséqués [31]. Pour les patients présentant une artériopathie oblitérante symptomatique des membres inférieurs et ne pouvant bénéficier d’un geste de revascularisation par méthode chirurgicale ou endovasculaire, la sympathectomie lombaire a des indications. Elle permet d’augmenter la vasodilatation artérielle par diminution du vasospasme, en supprimant l’effet hypertonique du système sympathique. Ces indications restent limitées aux douleurs de décubitus et à l’ischémie critique avec troubles trophiques superficiels très limités. Il existe des tests préopératoires qui permettent d’évaluer la fonction sympathique et de prédire ou non une amélioration de la vascularisation cutanée après sympathectomie. Tests fonctionnels prédictifs positifs : – l’index de pression bras/cheville est supérieur à 0,30 et/ou une pression systolique à l’orteil supérieure à 30 mmHg [1, 24, 29] ; – le test cutané à la sueur à l’acétylcholine est positif : il permet de prédire le succès de la procédure en testant en préopératoire l’intégrité du système autonome sympathique. C’est un test simple et efficace [2] ; – le test de Hillestad est positif si la courbe de pléthysmographie est multipliée par deux après la levée du garrot jambier [5, 18] ; – l’anesthésie péridurale qui a permis de réchauffer les téguments [23] ; – le test électrophysiologique d’activité cutanée sympathique est positif [19]. Techniques CHIRURGICALE Xavier Chaufour : Chef de clinique-assistant des Hôpitaux. André Barret : Professeur de chirurgie vasculaire. Jérôme Cau : Interne des hôpitaux de Toulouse. Jean Pierre Bossavy : Professeur agrégé de chirurgie vasculaire. Hôpital Purpan, place du Docteur Baylac, 31059 Toulouse cedex, France. ¶ Conventionnelle Les grandes voies d’abord latérales, décrites autrefois, pour l’abord de la chaîne sympathique lombaire sont maintenant abandonnées. Toute référence à cet article doit porter la mention : Chaufour X, Cau J, Bertin F, Bossavy JP et Barret A. Sympathectomie lombaire. Encycl Méd Chir (Editions Scientifiques et Médicales Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales - Chirurgie vasculaire, 43-029-V, 2001, 7 p. Sympathectomie lombaire 43-029-V Techniques chirurgicales 1 Patient installé en décubitus dorsal pour une sympathectomie droite par voie rétropéritonéale. 2 Incision cutanée. 3 Les fibres musculaires du grand oblique et du petit oblique sont discisées. Le bord externe de l’aponévrose antérieure du muscle grand droit est incisé. 1. Muscle grand oblique ; 2. muscle petit oblique ; 3. muscle transverse. Seul l’abord rétropéritonéal doit être envisagé, par une courte voie antéroexterne sus-ombilicale à la hauteur de la 11e côte, elle permet un abord sous-péritonéal suffisant. La sympathectomie par voie transpéritonéale ne peut être envisagée qu’en association à une chirurgie restauratrice aorto-iliaque transpéritonéale. Voie rétropéritonéale Le malade sous anesthésie générale ou anesthésie locorégionale est en décubitus dorsal, un billot sous la fosse lombaire, le genou demifléchi pour détendre le psoas (fig 1). On réalise une incision horizontale externe qui est étendue sur 5 à 8 cm du bord externe du muscle grand droit en direction de l’extrémité de la 11e côte. Il vaut mieux prendre comme repère les éléments osseux que l’ombilic, car ce dernier peut être abaissé chez un malade obèse ou amaigri (fig 2). Le feuillet antérieur de la gaine du muscle grand droit est incisé sur sa moitié externe, respectant le muscle. Les fibres du muscle grand oblique, dirigées en bas et en dedans sont dissociées et écartées sans section. Le deuxième plan est celui du petit oblique ; ses fibres, dirigées en haut et en dedans, sont dissociées et écartées (fig 3). On accède ainsi à l’aponévrose du muscle transverse qui est incisée prudemment transversalement. L’incision aponévrotique se poursuit transversalement en dehors dans les fibres musculaires et en dedans vers la gaine postérieure du grand droit (fig 4). Le péritoine est décollé progressivement ; il est fragile en dedans et peut être ouvert accidentellement ; la brèche sera fermée immédiatement par un point au Vicrylt 2/0. En cas de péritoine extrêmement fragile, ce dernier sera réparé en fin d’intervention au fil serti, en prenant à la fois le feuillet aponévrotique de la gaine du droit et le péritoine. Le décollement péritonéal se fait soit au tampon monté, soit au doigt et progresse vers la fosse iliaque, il est plus aisé de débuter le décollement de haut en bas. En profondeur, le repère est constitué 2 4 Incision de l’aponévrose du muscle transverse en avant et discision des fibres musculaires en arrière. Le sac péritonéal est visible, il sera décollé et refoulé en dedans. 1. Muscle grand oblique ; 2. muscle petit oblique ; 3. muscle transverse ; 4. péritoine. par le muscle psoas ; dès que le doigt le perçoit, il va cheminer à sa face antérieure, refoulant en dedans le sac péritonéal sans aller en profondeur vers le muscle carré des lombes. Le muscle psoas conduit au plan vertébral (fig 5). Techniques chirurgicales Sympathectomie lombaire 43-029-V 5 Le sac péritonéal est refoulé en dedans lors d’un abord rétropéritonéal droit. 1. Veine cave inférieure ; 2. aorte abdominale ; 3. chaîne sympathique gauche ; 4. chaîne sympathique droite. Le sac péritonéal est maintenu en dedans par deux valves de Leriche ; il est impératif que l’aide récline le péritoine de manière efficace afin d’exposer la chaîne sympathique, repérée contre le plan vertébral, dans l’angle dièdre formé par la vertèbre et le muscle psoas en refoulant en dedans le sac péritonéal. La chaîne sympathique est un cordon dur, qui ne se laisse pas écraser, renflé par endroits, solidement plaqué contre la vertèbre. Ces caractères le différencient des ganglions lymphatiques moins fermes, des nerfs abdominogénitaux, génitocrural et fémorocutanés plus externes. Les valves de Leriche doivent être maintenues fermement, mais sans à-coups pour ne pas léser les structures anatomiques, veineuses en particulier. À droite, il est nécessaire de prendre prudemment sous les valves la veine cave inférieure qui cache la chaîne sympathique (fig 6). La chaîne sympathique doit être libérée sur une hauteur de deux ganglions (L2-L3). La dissection est facilitée par l’utilisation d’un crochet de Leriche, qui permet de soulever la chaîne sympathique (fig 7). Les deuxième et troisième ganglions sont les plus accessibles et les mieux individualisés ; plus bas, le quatrième ganglion est derrière les vaisseaux iliaques ; plus haut, le premier ganglion est caché par les piliers du diaphragme. Il faut enlever le deuxième et le troisième ganglion, ainsi que les rameaux communicants. La chaîne sympathique est sectionnée au ciseau, ou éventuellement entre deux clips ; le fragment prélevé est envoyé au laboratoire pour examen anatomopathologique. Les dangers ne sont représentés que par les vaisseaux lombaires qui croisent, en arrière le plus souvent, mais parfois en avant, la chaîne sympathique ; en cas de plaie veineuse, l’hémostase est réalisée au mieux à l’aide d’un fil Prolènet 5/0 serti. Si l’uretère a été laissé au contact du péritoine sous les valves, il n’y a pas réellement de risque de traumatisme. Les lésions d’arthrose vertébrale peuvent compliquer l’intervention en modifiant les repères anatomiques. Le contrôle de l’hémostase doit être soigneux dans la fosse lombaire, sous les valves de Leriche qui sont relâchées progressivement. Ce contrôle dispense d’un drainage. La paroi est fermée plan par plan par rapprochement des fibres musculaires par points séparés au fil résorbable. Les suites opératoires sont en général très simples ; les boissons peuvent êtres reprises dès le lendemain, l’alimentation solide au deuxième jour. La sympathectomie lombaire bilatérale en un temps est tout à fait possible puisque le patient est installé en décubitus dorsal, elle est réalisée par deux incisions rétropéritonéales droite et gauche. 6 Décollement péritonéal en dedans sur la face antérieure du muscle psoas. 1. Uretère ; 2. muscle psoas ; 3. nerf génitocrural ; 4. muscle carré des lombes. ¶ Sympathectomie lombaire sous vidéoscopie par voie rétropéritonéale (rétropéritonéoscopie ou lomboscopie) L’intervention sous vidéoscopie conserve les mêmes exigences techniques que l’intervention classique : exérèse de la chaîne sympathique lombaire emportant au moins deux ganglions, par voie rétropéritonéale exclusive. Cette technique a pour but de diminuer les douleurs postopératoires, la durée d’hospitalisation et de permettre la reprise précoce du transit. Instrumentation L’instrumentation varie selon les équipes. Nous utilisons une instrumentation standard utilisée couramment en thoracoscopie ou en cœlioscopie. Elle comprend une optique de 0°-10 mm et une optique de 30°-10 mm, un trocart de 10 mm pour le système optique, deux trocarts de 5 mm, deux pinces à préhension de 5 mm, un ciseau coagulateur, un crochet droit coagulateur, un aspirateur-laveur, un tampon monté. Il est nécessaire d’utiliser une caméra endoscopique de bonne qualité afin de faciliter le geste opératoire, une source de lumière froide et un insufflateur électronique. Installation Elle varie selon les auteurs et selon les techniques d’approche. • Décubitus latéral C’est l’installation utilisée le plus fréquemment. Sous anesthésie générale, le patient est installé en décubitus latéral, avec mise en place d’un billot au niveau du flanc. L’opérateur principal est du côté de l’ombilic, l’aide opératoire est en face, du côté du rachis, l’instrumentiste est du même côté que l’opérateur. Le moniteur est positionné en face de l’opérateur. Une table à pont est installée audessus des cuisses du patient (fig 8, 9). • Décubitus dorsal Le patient est installé en décubitus dorsal avec un billot au niveau de la charnière dorsolombaire et une rotation du tronc de 30° du 3 43-029-V Sympathectomie lombaire Techniques chirurgicales 9 Patient installé en décubitus latéral gauche pour une sympathectomie droite par voie rétropéritonéale sous vidéoscopie avec position des trocarts. 7 La chaîne sympathique est soulevée par le crochet. 1. Muscle des piliers du diaphragme ; 2. veine lombaire. 10 Vue cœlioscopique du champ opératoire. 1. Le muscle psoas est en haut ; 2. le sac péritonéal est en bas, l’uretère reste accolé au sac. côté opposé au côté opéré. L’opérateur principal est installé du côté opposé au côté opéré, l’aide opératoire est en face, l’instrumentiste est du même côté que l’opérateur. Dissection 8 Disposition de l’opérateur, de l’aide, de l’instrumentiste et des moniteurs. 1. Aide ; 2. opérateur. 4 On réalise une incision (de 30 mm) située sur la ligne entre l’aile iliaque et le bord inférieur de la 12e côte dans le flanc (le billot permet d’ouvrir cet angle). On incise l’aponévrose du grand oblique sur 30 mm, on dissocie les trois plans musculaires (cf supra), puis on amorce au doigt le décollement rétropéritonéal. On positionne un trocart à ballonnet de 10 mm (trocart avec ballon d’étanchéité) qui permet d’introduire l’optique. Certaines équipes s’aident d’un ballon dissecteur pour créer l’espace de décollement rétropéritonéal [3]. On insuffle progressivement afin d’obtenir le rétropneumopéritoine et l’on complète le décollement à l’aide de l’optique, puis on positionne sous contrôle de la vue les deux autres trocarts opérateurs de 5 mm. Les deux trocarts opérateurs sont placés en triangulation à 3-4 cm en dehors du bord externe des muscles grands droits. Les trocarts opérateurs ne doivent pas être positionnés trop en dedans, car le péritoine reste accolé au bord externe des droits, il existe donc un risque de brèche péritonéale et donc de pneumopéritoine (fig 9). Une des difficultés, lors de la période d’apprentissage, est que la vue opératoire est inversée par rapport à la chirurgie conventionnelle, puisque l’opérateur est placé du côté de l’ombilic ; le psoas apparaît à l’écran, en haut, le sac péritonéal en bas (fig 10). La dissection s’effectue de proche en proche au tampon monté et à la pince fenêtrée dans la direction de l’angle dièdre formé par le Techniques chirurgicales Sympathectomie lombaire 11 Le sac péritonéal est refoulé en dedans par le rétropneumopéritoine. 1. Muscle psoas ; 2. chaîne sympathique ; 3. sac péritonéal. rachis et le muscle psoas en refoulant en dedans le sac péritonéal. Le rétropneumopéritoine et la position du malade en décubitus latéral contribuent au refoulement des anses intestinales. L’uretère est laissé au contact du péritoine. La chaîne sympathique est repérée au contact du rachis, le muscle psoas doit être récliné car il surplombe le nerf sympathique (fig 11). La dissection doit être minutieuse afin d’éviter l’une des principales difficultés techniques de cette intervention sous laparoscopie qui est le saignement des vaisseaux lombaires qui peuvent croiser par en avant la chaîne sympathique. En cas de psoas proéminent, il est préférable d’utiliser une optique à 30°, ce qui permet de mieux visualiser la chaîne sympathique. À l’aide du crochet, on soulève le nerf sympathique, ce qui facilite sa dissection vers le haut et vers le bas (fig 12). Après avoir libéré le nerf sympathique sur une hauteur suffisante (2e et 3e ganglions lombaires), on coagule et on sectionne l’extrémité supérieure du sympathique (certains opérateurs préfèrent utiliser des endoclips). Le bord libre de la chaîne sympathique, tenu par une pince, est récliné vers le bas, ce qui permet de sectionner au crochet coagulateur les rameaux collatéraux sur une distance de trois métamères (fig 13). L’extrémité inférieure de la chaîne sympathique est sectionnée et retirée par le canal opérateur de 5 mm pour examen anatomopathologique. On vérifie soigneusement l’hémostase avant de réaliser l’exsufflation du rétropneumopéritoine. Les muscles, au niveau de l’orifice du trocart de 10 mm, sont refermés par deux points séparés au fil résorbable. Le drainage n’est pas nécessaire. La fermeture cutanée des orifices de trocarts de 5 mm est assurée par des Stéri-Stript. Variantes techniques • Technique de Dulucq Le patient est installé en décubitus dorsal. On ponctionne en suspubien à l’aiguille de Palmer l’espace de Retzius afin d’insuffler 1,5 L de CO2 pour créer un rétropneumopéritoine. Puis on introduit un trocart de 5 mm en sous-ombilical pour insérer une optique de 0°5 mm. On réalise la dissection rétropéritonéale avec l’optique d’un espace suffisant au niveau du flanc pour permettre l’introduction de deux trocarts de 5 mm en triangulation (pince fenêtrée et crochet coagulateur). La dissection et la résection de la chaîne sympathique sont poursuivies comme précédemment décrit. Parfois l’introduction d’un quatrième trocart de 5 mm est nécessaire pour réaliser au mieux l’exposition de la chaîne sympathique. Cette technique est dérivée de la technique des cures de hernie inguinale par voie rétropéritonéale ; elle nécessite une grande expérience de la chirurgie laparoscopique [10, 32]. 43-029-V 12 La chaîne sympathique est tenue par une pince, le crochet permet de poursuivre la dissection. 1. muscle psoas ; 2. chaîne sympathique ; 3. pince ; 4. crochet coagulateur. 13 La chaîne sympathique a été sectionnée en haut et est réclinée vers le bas par une pince. 1. Muscle psoas ; 2. troisième ganglion lombaire sympathique ; 3. crochet coagulateur. Dans la littérature, une équipe préconise la sympathectomie par cœlioscopie transpéritonéale, ce qui nécessite un décollement colique [30]. Nous ne recommandons pas cette voie d’abord. SYMPATHECTOMIE CHIMIQUE Les techniques parachirurgicales de phénolisation ou d’alcoolisation sympathique, sous contrôle tomodensitométrique, sont réalisées en première intention par certaines équipes [14, 17, 20]. La neurolyse sympathique chimique est faite sous ponction guidée par tomodensitométrie. La ponction à l’aveugle ou sous échographie ne doit plus être réalisée. La plupart des scanners permettent de pratiquer ce geste, à condition de pouvoir opérer sous asepsie stricte. Sous anesthésie locale, on ponctionne le troisième ganglion lombaire à l’aide d’une aiguille fine. L’injection d’un mélange de Xylocaïnet et de produit de contraste permet de tester l’efficacité du blocage sympathique avant d’effectuer l’injection définitive par un mélange de 96 % d’éthanol et de Xylocaïnet. Cette première injection test permet de réduire le risque de blocage inefficace et de diminuer le 5 Sympathectomie lombaire 43-029-V taux de complications [25]. Certaines équipes proposent de réaliser la neurolyse sympathique à l’aide d’une sonde de radiofréquence selon la même technique de ponction guidée [13]. Résultats Techniques chirurgicales Abcès rétropéritonéal Il complique généralement un hématome rétropéritonéal. Cette complication est décrite après abord chirurgical, mais aussi après sympathectomie chimique [12, 14]. Syndrome douloureux postsympathectomie Chez les patients présentant des tests préopératoires fonctionnels prédictifs positifs, la sympathectomie permet d’obtenir de bons résultats avec amélioration clinique significative et cicatrisation des troubles trophiques [1, 4, 15]. Les résultats sont comparables chez les patients diabétiques et non diabétiques [8, 15]. Le choix de la technique dépend essentiellement des équipes médicochirurgicales. Il n’existe pas d’étude randomisée démontrant la supériorité d’une technique par rapport à l’autre. Certaines équipes préconisent la sympathectomie sous vidéoscopie [9], d’autres équipes ne trouvent pas d’avantage à cette technique par rapport à la chirurgie conventionnelle [16] ; la courbe d’apprentissage de cette nouvelle technique peut expliquer que les résultats ne soient pas, pour l’instant, significativement différents. L’intérêt de la neurolyse chimique versus chirurgie n’a jamais été démontré, bien que certaines équipes préfèrent cette technique moins invasive [6, 8, 14, 26]. Pour beaucoup d’auteurs, le succès de la sympathectomie chimique est de moindre efficacité que la sympathectomie chirurgicale ; la sympathectomie chimique doit être réalisée uniquement par des équipes entraînées, afin d’obtenir une neurolyse complète et efficace de la chaîne sympathique lombaire [ 1 4 , 2 5 ] . Cette méthode radiochirurgicale n’est pas dénuée de complications, elle doit être réservée aux patients à risques anesthésiques importants. Ce syndrome débute toujours après une phase de latence de 2 jours à plusieurs semaines. Son début est brutal, les douleurs sont à type de brûlure ou de déchirement, sa topographie métamérique se projette sur les dermatomes sensitifs L1-L2, sa durée est très variable, de quelques jours à plusieurs semaines. Les troubles disparaissent toujours sans laisser de séquelle après un traitement antalgique. Sa fréquence varierait de 2 à 65 % des cas dans une enquête effectuée en 1986 auprès d’un groupe de chirurgiens vasculaires français. Gangrènes paradoxales Elles seraient provoquées par l’ouverture des shunts artérioveineux précapillaires, aux dépens du réseau capillaire. Le fait que ces aggravations ischémiques soient plus importantes chez les malades qui ont un index de cheville systolique inférieur à 0,30 irait dans ce sens. Certains pensent que l’ischémie serait plutôt due à l’acte opératoire et non à la sympathectomie, soit par bas débit cardiaque peropératoire à l’origine de la thrombose distale, soit par embolies peropératoires par traumatisme de l’aorte ou des vaisseaux iliaques, soit encore par section d’une artère lombaire volumineuse vicariante. Troubles sexuels postsympathectomie Complications COMPLICATIONS PEROPÉRATOIRES Plaie des veines lombaires C’est la complication la plus fréquente ; l’hémostase en est parfois délicate car ces veines se rétractent rapidement en arrière vers le rachis. On préférera ligaturer au fil ou aux clips ces veines que les électrocoaguler. Le saignement peut être minimisé en vidéoscopie, lorsque l’on travaille en pression d’insufflation élevée. Traumatisme ou plaie urétérale Les adhérences de l’uretère au péritoine pariétal postérieur ne doivent pas être libérées, afin que l’uretère soit récliné en même temps que le sac péritonéal et soit protégé sous les valves de Leriche. D’après les travaux de Smithwick en 1951, 54 % des patients bénéficiant d’une sympathectomie bilatérale emportant le premier ganglion lombaire présenteraient une dyséjaculation. En pratique, les variations anatomiques de la chaîne sympathique ne permettent pas de prévoir strictement la survenue ou non de troubles sexuels ; aussi vaut-il mieux toujours prévenir les sujets jeunes de la possibilité de cette complication lors de sympathectomie bilatérale. Sténose urétérale Une sténose urétérale extrinsèque après neurolyse chimique a été décrite par plusieurs auteurs après sympathectomie chimique [12, 14]. Ernst préconise une échographie rénale à 3 mois chez tous les patients ayant bénéficié d’une neurolyse chimique afin de détecter cette complication [12]. Conversion chirurgicale sous cœlioscopie Paraplégie Elle varie de 0 à 25 % des cas dans la littérature [3, 9, 27]. La conversion est principalement due à un saignement non contrôlable des vaisseaux lombaires, à l’existence d’un pneumopéritoine fermant la cavité opératoire, à un muscle psoas hypertrophique empêchant une bonne visualisation de la chaîne sympathique. L’obésité est aussi un facteur de conversion lors de la phase d’apprentissage. Un cas de paraplégie transitoire lors d’une sympathectomie chimique a été décrit [11]. Pneumopéritoine L’apparition d’un pneumopéritoine après abord rétropéritonéal sous vidéoscopie (par brèche péritonéale ou par diffusion) va venir fermer la zone de décollement rétropéritonéal et donc la cavité opératoire [3]. Il n’y a pas d’intérêt à refermer les brèches péritonéales (difficile et souvent inefficace), il faut préférer le positionnement d’une aiguille de Palmer dans l’hypocondre afin d’exsuffler le pneumopéritoine. COMPLICATIONS PRÉCOCES Indications actuelles L’indication actuelle de la sympathectomie lombaire, pour le traitement de l’artériopathie chronique oblitérante des membres inférieurs, est limitée aux patients ne pouvant pas bénéficier d’un geste de revascularisation directe, par méthode chirurgicale conventionnelle ou endovasculaire. Les indications sont limitées strictement aux douleurs de décubitus ou aux troubles trophiques limités ; les tests fonctionnels prédictifs permettent de sélectionner les patients qui vont répondre à ce traitement. D’autres indications plus rares sont à connaître : – l’hyperhidrose invalidante [21] ; Hématome rétropéritonéal – les gelures [28] ; C’est la complication la plus fréquente, due généralement à un décollement excessif de l’espace rétropéritonéal et à un défaut d’hémostase. Ces hématomes sont à l’origine d’une majoration des douleurs postopératoires et du temps de séjour hospitalier. – la maladie de Raynaud sévère [7] ; 6 – la maladie de Buerger [22] ; – algodystrophie. Sympathectomie lombaire Techniques chirurgicales Les rapports du TASC 2000 (TransAtlantic Inter-Society Concensus), pour les maladies artérielles périphériques, ne recommandent pas la sympathectomie lombaire pour le traitement des ischémies critiques. Il n’existe pas, à ce jour, de tests scientifiques suffisamment fiables pour sélectionner les patients, en ischémies critiques, qui pourraient bénéficier d’une sympathectomie lombaire. Pour le TASC, les indications restent limitées aux patients ne pouvant pas être revascularisés et présentant une artériopathie avec des douleurs de décubitus ou une artériopathie avec des troubles trophiques superficiels limités aux orteils et montrant les critères suivants : – un index de pression bras/cheville supérieur à 0,30 ; – une absence de neuropathie périphérique ; 43-029-V – une amélioration clinique après une rachianesthésie ; – un risque chirurgical acceptable pour une voie rétropéritonéale. Conclusion La sympathectomie lombaire est une intervention simple dont la morbidité-mortalité ne doit pas dépasser 1 %. Le succès clinique postopératoire dépend essentiellement de la bonne sélection des indications, en s’aidant des tests fonctionnels prédictifs. La sympathectomie lombaire vidéoassistée est une technique simple, rapide, dont la faisabilité a été démontrée. L’apprentissage de cette technique cœlioscopique n’est pas très difficile et permet au chirurgien vasculaire de se familiariser avec les techniques de vidéoscopie. Références [1] Aburahma AF, Robinson PA. Clinical parameters for predicting response to lumbar sympathectomy in patients with severe lower limb ischemia. J Cardiovasc Surg 1990 ; 31 : 101-106 [2] Altomare DF, Regina G, Lovreglio R, Memeo V. Acetylcholine sweat test: an effective way to select patients for lumbar sympathectomy. Lancet 1994 ; 344 : 976-978 [3] Avrahami R, Stelman E, Haddad M, Koren A, Dahn J, Hiss Y et al. Retroperitoneal endoscopic lumbar sympathectomy with balloon dissection: experience with a cadaveric model. Surg Laparosc Endosc 1998 ; 8 : 197-199 [4] Baker DM, Lamerton AJ. Operative lumbar sympathectomy for severe lower limb ischaemia: still a valuable treatment option. Ann R Coll Surg Engl 1994 ; 76 : 50-53 [5] Becker F, Demerciere JF, Perrin M. Clinical results of lumbar sympathectomy as a function of the amplification factor of Hillestad’s reactive hyperemia test. Apropos of a series of 72 cases of isolated lumbar sympathectomies. J Mal Vasc 1985 ; 10 (suppl A) : 77-83 [6] Becquemin JP, Kassab M, Bellouard A, Brugiere P, Melliere D. Lumbar sympathectomy in the aged subject: surgery or phenolization? Prospective study of early results. J Mal Vasc 1989 ; 14 : 327-333 [7] Belch JJ, Ho M. Pharmacotherapy of Raynaud’s phenomenon. Drugs 1996 ; 52 : 682-695 [8] Cross FW, Cotton LT. Chemical lumbar sympathectomy for ischemic rest pain. A randomized, prospective controlled clinical trial. Am J Surg 1985 ; 150 : 341-345 [9] Debing E, Simoens C, Van Den Brande. Retroperitoneoscopic lumbar sympathectomy with balloon dissection: clinical experience. J Laparoendosc Adv Surg Tech A 2000 ; 10 : 101-104 [10] Dulucq JL. Sympathectomie lombaire par laparoscopie voie sous-péritonéale. Cœliochirurgie 1993 ; 7 : 30-31 [11] Echenique Elizondo M, Gurutz Linazasoro C. Reversible partial paraplegia after sympathetic lumbar block. Neurologia 1995 ; 10 : 101-103 [12] Ernst S, Heindel W, Fischbach R, Gawenda M, Langen HJ, Neubauer S et al. Complications of CT guided lumbar sympathectomy: our own experiences and literature review. Rofo Fortschr Geb Rontgenstr Neuen Bildgeb Verfahr 1998 ; 168 : 77-83 [22] O’Connor KJ, Grady JF, Moore CJ, Axe TM, Shumaker JM. Hallux amputation in combination with a lumbar sympathectomy for treatment of anon-healing ulceration in a patient with Buerger’s disease. J Foot Ankle Surg 1996 ; 35 : 339-343 [13] Haynsworth RF Jr, Noe CE. Percutaneous lumbar sympathectomy: a comparison of radiofrequency denervation versus phenol neurolysis. Anesthesiology 1991 ; 74 : 459-463 [23] Petriccione Di Vadi P, Hamann W. Continuous lumbar sympathetic block. Clin J Pain 1991 ; 7 : 230-231 [14] Heindel W, Ernst S, Manshausen G, Gawenda M, Siemens P, Krahe T et al. CT-guided lumbar sympathectomy: results and analysis of factors influencing the outcome. Cardiovasc Intervent Radiol 1998 ; 21 : 319-323 [15] Holiday FA, Barendregt WB, Slappendel R, Crul BJ, Buskens FG, Van der Vliet JA. Lumbar sympathectomy in critical limb ischaemia: surgical, chemical or not at all? Cardiovasc Surg 1999 ; 7 : 200-202 [16] Lacroix H, Vander Velpen G, Penninckx F, Nevelsteen A, Suy R. Technique and early results of videoscopic lumbar sympathectomy. Acta Chir Belg 1996 ; 96 : 11-14 [17] Lantsberg L, Goldman M, Khoda J. Should chemical sympathectomy precede below knee amputation? Int Surg 1996 ; 81 : 85-87 [18] Le Heron D, Le Heron G, Serise JM, Tingaud R. Predictive value of the reactive hyperemia test as an indicator for lumbar sympathectomy. J Mal Vasc 1985 ; 10 (suppl A) : 72-76 [19] Lefaucheur JP, Becquemin JP, Brugieres P, Verroust J. Assessment of sympathetic nerve activity in the practice of lumbar sympatholysis: interest of sympathetic skin responses. J Auton Nerv Syst 1996 ; 60 : 56-60 [24] Repelaer van Driel OJ, van Bockel JH, van Schilfgaarde R. Lumbar sympathectomy for severe lower limb ischaemia: results and analysis of factors influencing the outcome. J Cardiovasc Surg 1988 ; 29 : 310-314 [25] Schneider B, Richter GM, Roeren T, Kauffmann GW. CT-guided neurolysis. Status of the technique and current results. Radiologe 1996 ; 36 : 692-699 [26] Seow CS, Doughty JC, Byrne DS. Chemical lumbar sympathectomy revisited: survey of the current practice of vascular surgeons in Scotland. Eur J Surg 2000 ; 166 : 380-382 [27] Soury P, Cailleux N, Plissonnier D, Peillon C, Liberge N, Roullee N et al. Lumbar sympathectomy by retroperitoneal endoscopy: feasibility study. J Mal Vasc 1997 ; 22 : 200-202 [28] Taylor MS. Lumbar epidural sympathectomy for frostbite injuries of the feet. Milit Med 1999 ; 164 : 566-567 [29] Vayssairat M, Gouny P, Baudot N, Gaitz JP, Nussaume O. Distal arteritis of the legs: lumbar sympathectomy. J Mal Vasc 1994 ; 19 (suppl A) : 174-177 [30] Wattanasirichaigoon S, Ngaorungsri U, Wanishayathanakorn A, Hutachoke T, Chulakamontri T. Laparoscopic transperitoneal lumbar sympathectomy: a new approach. J Med Assoc Thai 1997 ; 80 : 275-281 [20] Mashiah A, Soroker D, Pasik S, Mashiah T. Phenol lumbar sympathetic block in diabetic lower limb ischemia. J Cardiovasc Risk 1995 ; 2 : 467-469 [31] Wertheimer P, Sautot J. Pathologie vasculaire des membres. Paris : Masson, 1958 [21] Moran KT, Brady MP. Surgical management of primary hyperhidrosis. Br J Surg 1991 ; 78 : 279-283 [32] Wronski J. Lumbar sympathectomy performed by means of videoscopy. Cardiovasc Surg 1998 ; 6 : 453-456 7 Encyclopédie Médico-Chirurgicale 43-037 43-037 Pontage aortofémoral vidéoassisté JN Fabiani Résumé. – La chirurgie vidéoassistée permet de réaliser des pontages aortofémoraux par une courte incision et plusieurs accès par trocarts. Plusieurs techniques sont possibles pour faciliter les différents temps opératoires et particulièrement la suture : l’utilisation de prothèse spéciale fixée à l’aide de clips et la suture assistée par ordinateur. Les résultats à court et moyen termes sont bons, comparables à ceux obtenus avec une exposition classique. Cependant, les suites sont beaucoup plus rapides et beaucoup plus simples, permettant la sortie du patient vers le quatrième jour postopératoire. © 2000 Editions Scientifiques et Médicales Elsevier SAS. Tous droits réservés. Mots-clés : chirurgie vidéoassistée, chirurgie mini-invasive, chirurgie robotique. Introduction Ce n’est qu’après d’autres spécialités que la chirurgie vasculaire développe des techniques de chirurgie mini-invasive et vidéoassistée. L’avantage majeur de ces nouvelles opérations est de réduire l’abord chirurgical à une effraction pariétale limitée, afin de permettre des suites moins douloureuses et des hospitalisations plus courtes. Réaliser un pontage aortobifémoral sans ouvrir largement l’abdomen, et insérer sur l’aorte abdominale une prothèse synthétique bifurquée pouvait sembler, il y a encore peu de temps, une gageure. Pourtant, les progrès de l’instrumentation, l’entraînement des équipes chirurgicales et l’évolution des idées, nous ont permis de réaliser, à ce jour, cette opération chez plus de 50 patients. Il nous semble clair que la nécessité de trouver des solutions au défi technique ainsi lancé, va également permettre de proposer des améliorations à une chirurgie très efficace à long terme, battue en brèche par la simplicité apparente et les résultats à court terme de la chirurgie endovasculaire Le matériel utilisé dérive directement de celui employé en chirurgie digestive ou thoracique : colonne avec caméra vidéo munie si possible d’un zoom, comportant un angle à 0 ou à 30°, instruments longs permettant la coagulation et l’aspiration, rétracteur téléscopique pouvant être introduit par un simple trocart ou suspenseurs pariétaux… Cependant, de nouveaux instruments sont déjà disponibles : écarteurs intrapéritonéaux (type fish retractors), clamps largables... Technique chirurgicale du pontage aortobifémoral par voie transpéritonéale Après préparation intestinale, le patient est anesthésié et installé en décubitus dorsal, les lombes soulevées par un fort billot. Une Jean-Noël Fabiani : Professeur, chef de service, département de chirurgie cardiovasculaire et de transplantation d’organes, Hôpital Européen Georges Pompidou, 20, rue Leblanc, 75015 Paris, France. insufflation d’air à l’aiguille de Palmer est alors commencée, après simple ponction périombilicale, jusqu’à atteindre une pression intraabdominale de 13 mmHg. Trois trocarts avec valve antireflux sont alors installés par des incisions de 1 cm : l’un en sous-costal droit pour introduire un rétracteur télescopique, les deux autres en pararectal gauche pour introduire l’optique, la lumière froide et les instruments (fig 1). Le premier temps opératoire consiste à exposer l’aorte derrière le péritoine pariétal postérieur, c’est-à-dire à récliner les anses grêles. Ce temps est délicat ; le résultat est obtenu par la mise en Trendelenburg du patient, tout en l’inclinant vers la droite. Le rétracteur télescopique est alors mis en place pour assurer la stabilité du champ opératoire. Certaines équipes ont étudié des écarteurs spécifiques pour assurer la stabilité du champ intestinal, type fish retractor. La dissection du péritoine pariétal postérieur est alors menée aux ciseaux de cœliochirurgie sur lesquels une coagulation est possible. Le but est de dénuder largement l’aorte sur 5 cm, afin de permettre l’installation du clamp latéral en toute sécurité. Pendant ce temps, l’absence de calcification pariétale est vérifiée ; leur existence, gênant le clampage, pourrait être une contre-indication à la technique, nécessitant la conversion. Tout ce temps opératoire est effectué sous insufflation péritonéale. Les temps suivants sont effectués après une courte laparotomie et l’on perd le bénéfice de la distension péritonéale. Un cadre suspenseur autostatique (cadre de Moret ou Laparolifty) peut alors être avantageusement installé pour maintenir un espace de travail intra-abdominal suffisant. Un clamp moyen de Satinsky est alors introduit par la laparotomie sus-ombilicale de 3 cm. Sa parfaite mise en place sur l’aorte est assurée sous contrôle cœlioscopique. Les anneaux de ce clamp restent en extra-abdominal, émergeant de l’incision, permettant au chirurgien une action permanente et directe sur l’instrument en cas de nécessité. L’aortotomie longitudinale est alors menée prudemment s’assurant tout d’abord de la parfaite étanchéité du clampage. On injecte alors l’héparine à la dose de 0,5 mg/kg par voie intraveineuse. La prothèse en Dacront tissé est entièrement préparée avant son introduction intra-abdominale : les recoupes sont effectuées au thermocautère pour éviter l’effilochage et un matériel précoagulé est indispensable. Cette prothèse est introduite par un des abords après Toute référence à cet article doit porter la mention : Fabiani JN. Pontage aortofémoral vidéoassisté. Encycl Méd Chir (Editions Scientifiques et Médicales Elsevier SAS, Paris, tous droits réservés), Techniques chirurgicales — Chirurgie vasculaire, 43-037, 2000, 4 p. 43-037 Pontage aortofémoral vidéoassisté Techniques chirurgicales Technique chirurgicale du pontage aortofémoral par voie rétropéritonéale Une incision de 3 cm est effectuée au bord externe du muscle grand droit sur la ligne joignant l’ombilic à l’épine iliaque antérosupérieure. Le péritoine est ensuite décollé en utilisant soit un tampon monté, soit un ballon gonflable, jusqu’aux vaisseaux. Un rétracteur téléscopique est alors mis en place et retient le sac péritonéal, soit par la même petite incision, soit par un trocart. Deux trocarts sont alors mis en place pour introduire la caméra et les instruments. L’aorte est alors disséquée sous contrôle de la vue, puis le clamp est mis en place comme décrit (cf supra). L’intervention est alors menée selon les mêmes principes. Il est, bien sûr, possible d’effectuer un pontage au niveau de l’aorte ou sur l’iliaque primitive selon les lésions. Réalisation de la suture vasculaire et utilisation d’une prothèse sans suture 1 Voies d’abord. 1. Minilaparotomie ; 2. canal caméra ; 3. canal opérateur ; 4. mise en place du rétracteur télescopique ; 5. écran de contrôle. l’avoir vrillée pour limiter l’encombrement, surtout si elle est introduite par un trocart. Elle est déplissée soigneusement dans l’abdomen sous vidéoscopie et présentée en position de suture. Il est parfois nécessaire, pour ne pas être gêné, de réaliser d’emblée les tunnels sous-péritonéaux et de mettre en place la prothèse jusqu’aux triangles de Scarpa, évitant ainsi la gêne des coudures des jambages dans un espace de travail restreint. La suture terminoterminale est menée au surjet, utilisant un fil monobrin 4/0 et un porte-aiguille long et fin. Chaque point est mené successivement dans la prothèse, puis dans la paroi artérielle ; le surjet est tendu grâce à un aide par l’intermédiaire d’un crochet introduit dans l’abdomen par la laparotomie médiane. Le nœud qui termine le surjet est descendu et serré à l’aide d’un pousse-nœud qui applique fermement les boucles inversées. Une variante technique permet de réaliser le surjet avec une aiguillée de 7 cm de long, qui facilite les manœuvres intra-abdominales. En revanche, le nœud peut être de réalisation délicate en l’absence de système robotisé. L’abord des triangles de Scarpa est effectué à ciel ouvert et la tunnellisation des branches est réalisée à l’aveugle, comme habituellement. Chaque branche de la prothèse est rattrapée sous contrôle cœlioscopique et amenée en position fémorale en vérifiant l’absence de torsion et la bonne tension du montage. Le clamp peut être prudemment relâché pour vérifier l’hémostase. Un reclampage pour ajouter un point complémentaire est possible. Les anastomoses fémorales et les purges sont effectuées. Puis, le grand épiploon est amené et suturé sur la prothèse pour la séparer du tube digestif. 2 Le temps le plus long et le plus délicat de l’intervention est celui de la suture. Deux choix sont possibles : utiliser une suture de longueur normale et se pose alors le problème de la tension du surjet, ou travailler avec une aiguillée raccourcie et le problème vient alors du nœud. Quand on travaille avec une suture habituelle de longueur normale, il est difficile d’assurer la traction du surjet dans l’espace de travail cœlioscopique. On propose alors de récupérer chaque boucle par l’intermédiaire d’un crochet qui peut être tendu par l’aide, soit par la minilaparotomie, soit par un trocart. Le contrôle de la tension peut donc se faire à la main et à la vue, grâce à la vision endoscopique. Le nœud est facile à descendre par l’intermédiaire d’un pousse-nœud prenant appui sur des brins suffisamment longs. Le plus facile est de réaliser le surjet prothèse-vaisseau, à l’aide d’une aiguillée volontairement raccourcie à une longueur de 7-10 cm, car la traction se fait alors aisément dans l’espace délimité par le cadre suspenseur. Cependant, le nœud doit alors être fait à la pince, ce qui peut être délicat, sauf si l’on dispose d’un robot dont la virtuosité dans ce domaine est reconnue. Afin d’éviter cette suture, nous avons décrit un nouveau type de prothèse, que l’on peut fixer par l’intermédiaire de clips. Cette prothèse-collerette s’introduit dans le vaisseau soit en position terminale, soit en position latérale et permet l’introduction d’une rangée de clips pour appliquer la prothèse sur la face intimale de la paroi. Une large zone de contact est ainsi réalisée pour assurer l’hémostase. L’étude expérimentale a permis de prouver l’efficacité de la technique, l’absence de réaction inflammatoire à long terme et l’absence de faux anévrismes. Chirurgie assistée par ordinateur Plusieurs systèmes de chirurgie assistée par ordinateur, applicables à la chirurgie vasculaire, sont maintenant disponibles : il s’agit des systèmes d’Intuitive Surgical ou de Computer Motion. Notre expérience est celle du robot Da Vinci d’Intuituive Surgical. Des bras armés par un outil-instrument sont introduits dans la cavité abdominale par l’intermédiaire de trocarts (fig 2). L’avantage de ces outils est la possibilité de travailler sur tous les plans de l’espace grâce à une articulation intracavitaire, contrairement à la chirurgie laparoscopique par instruments classiques, dont l’axe de travail est imposé. Le chirurgien se trouve placé devant une console de visualisation (fig 3) dont la situation géographique est indifférente (il peut se tenir dans une pièce différente de la salle d’opération). La vision obtenue est en trois dimensions et le chirurgien pilote les brasinstruments par l’intermédiaire de manettes dans lesquelles les doigts sont glissés. L’interface informatique permet de réaliser un Pontage aortofémoral vidéoassisté Techniques chirurgicales 43-037 3 Console de visualisation et manettes de mobilisation des instruments à distance. 2 Chirurgie assistée par ordinateur : mise en place des instruments. certain nombre de fonctions (lissage du mouvement, démultiplication …). Il est ainsi possible de réaliser dans de bonnes conditions des sutures terminoterminale ou terminolatérale entre l’aorte et une prothèse de Dacront, car l’apprentissage en est assez rapide. La limite de ces systèmes est l’impossibilité actuelle d’obtenir un rendu de sensibilité au niveau des manettes de la console du chirurgien, si bien que le seul élément de contrôle de la tension du surjet, de la résistance de suture ou bien du serrage d’un nœud n’est effectué que par la vision. Cependant, des progrès dans les programmes informatiques permettront de réaliser dans un proche avenir des tâches plus sophistiquées comme la réalisation automatique de nœuds ou l’immobilisation visuelle du champ opératoire... Résultats Cinquante patients ont été opérés par nous-mêmes en utilisant ces techniques. Deux patients ont nécessité une conversion à une laparotomie classique : l’un pour des difficultés d’exposition lors d’un abord transpéritonéal et l’autre pour une aorte trop calcifiée pour être aisément clampable par une voie d’abord limitée. Chez les autres patients, l’abord a été sept fois transpéritonéal pour pontage aortobifémoral et 43 fois rétropéritonéal pour pontage unilatéral. En cas de pontage transpéritonéal, la mise en place de trois trocarts et la confection d’une minilaparotomie de 3 cm ont été nécessaires. La voie rétropéritonéale a nécessité une incision de 5 cm et la mise en place d’un ou de deux trocarts. Toutes les interventions ont été menées sous anesthésie générale. Des prothèse en Dacront LPI ont été cousues sur l’aorte à l’aide de surjet de Prolènet 4/0. Dans trois cas, la suture proximale a été menée par ordinateur. Le saignement total de ce groupe de malades (saignement peropératoire et drainage) a été de 273 mL, un malade a été repris le lendemain pour hématome rétropéritonéal par la même voie d’abord. Le temps moyen de ces opérations a été de 172 minutes (1 heure 30 minutes à 4 heures). Un seul patient dont la fraction d’éjection était altérée a séjourné en réanimation, les autres ont regagné leur chambre le soir même de l’intervention. La reprise du transit a été obtenue après 48 heures. La sortie de ces malades a été décidée entre le quatrième et le septième jour postopératoire. Des complications postopératoires ont été notées : un sus-décalage de ST sans infarctus, une lymphorrée au niveau d’un triangle de Scarpa et une hématurie minime et régressive. Le résultat vasculaire, contrôlé par doppler et chez deux patients par artériographie, s’est avéré excellent dans tous les cas (fig 4). Dans un cas, une occlusion de branche prothétique a été reprise dans les suites hospitalières. 4 Aspect pré- et postopératoire en angiographie : pontage aortobifémoral par voie mini-invasive transpéritonéale. * A * B 3 Pontage aortofémoral vidéoassisté 43-037 Techniques chirurgicales Commentaires 5 Pontage aortobifémoral transpéritonéal : aspect de la cicatrice. Ces techniques, qui ne sont que des pontages réalisés par de petites incisions, permettent de poser sous un jour nouveau les éléments de comparaison entre pontage et angioplastie. INDICATIONS DE LA TECHNIQUE L’angioplastie des artères iliaques est devenue une des techniques de choix dans le traitement des sténoses iliaques, surtout quand elles sont limitées à un segment (sténose unilatérale, touchant l’iliaque primitive). Ses résultats sont moins bons quand il s’agit d’une occlusion nécessitant la recanalisation et la mise en place d’un stent. Les résultats des perméabilités primaires et secondaires de ces techniques endovasculaires commencent à être connues, à 5 ans, par des études randomisées correctement conduites, comparant l’angioplastie simple à l’angioplastie associée à une endoprothèse. Cependant, le pontage aortofémoral donne actuellement les meilleurs résultats à long terme (92,7 % de perméabilité secondaire à 20 ans dans les stades II) et reste la technique de référence, au prix, il est vrai, d’une hospitalisation plus longue et de douleurs non négligeables dans la période périopératoire. D’une façon générale, on peut résumer nos indications de la façon suivante : – angioplastie simple ou mise en place d’une endoprothèse, si l’atteinte est unilatérale et ne touche qu’un segment artériel ; – recanalisation plus endoprothèse en cas d’occlusion courte d’un segment iliaque ; – pontage en cas d’atteinte aorto-iliaque bilatérale ou d’atteinte complexe d’un axe iliaque (primitive et externe). Les indications du pontage vidéoassisté sont évidemment les mêmes que celles de tous les pontages aortofémoraux, seule change la voie d’abord et l’instrumentation nécessaire à la dissection des vaisseaux et à la réalisation des sutures. CONTRE-INDICATIONS Elles naissent de cette première expérience, certaines rejoignent les complications de toute cœliochirurgie. – L’obésité et les antécédents de chirurgie abdominale rendent l’abord des vaisseaux rétropéritonéaux malaisé et la dissection difficile ou hémorragique. – L’existence d’une aorte très calcifiée peut rendre périlleux le clampage. Il est clair que le clamp, une fois mis en place, peut difficilement être mobilisé et que tout saignement incontrôlé peut rapidement devenir dramatique en l’absence de laparotomie. – Enfin, en cas de mauvaise fonction ventriculaire gauche, l’insufflation associée à la position de Trendelenburg peut augmenter de façon dangereuse la précharge cardiaque et favoriser une décompensation. AVANTAGES DE LA TECHNIQUE Ils sont évidents : l’absence de cicatrice et les douleurs très modérées permettent d’éviter le séjour en réanimation et autorisent la sortie du patient 1 à 2 jours après la reprise du transit (fig 5). À plus long terme, on peut espérer l’absence de complication pariétale, assez fréquente chez ces malades. DISCUSSION DE LA VOIE D’ABORD En chirurgie vasculaire par abord classique, la voie rétropéritonéale est souvent pratiquée et ses avantages, quant aux suites immédiates et à la qualité de la cicatrisation secondaire sont souvent vantés [2]. 4 En vidéochirurgie la voie transpéritonéale pose incontestablement un problème d’exposition, obligeant à un pneumopéritoine efficace pour qu’existe un espace libre de travail tout en réclinant le grêle. La difficulté à maintenir ce pneumopéritoine efficace pendant toute la suture a été notée par plusieurs auteurs. Dion [4] dans son étude expérimentale chez le porc, et Berens [1] dans le cas de pontage effectué chez l’homme, ont préféré se tourner vers un rétracteur abdominal (Laparolifty) qui, en soulevant l’abdomen, délimite un espace de travail quand l’insufflation ne suffit plus. Chen [3] , rapportant un cas d’anévrisme de l’aorte abdominale, opéré chez un homme de 62 ans, utilise la voie intrapéritonéale, mais effectue une laparotomie de 10 cm, complétée par la mise en place de neuf trocarts. Le bénéfice de la technique devient alors discutable par rapport à une voie classique rétro- et même intrapéritonéale. Cependant, dans l’état actuel de notre instrumentation, nous pensons comme Dion [4], que la voie rétropéritonéale est plus simple et plus sûre RISQUE HÉMORRAGIQUE Les instruments de vidéochirurgie permettent une dissection simple et rapide du péritoine pariétal postérieur et la coagulation peut être menée pas à pas. Le seul vrai problème est celui du clampage qui doit être sûr, sous peine de risquer une situation périlleuse ; c’est pourquoi nous avons préféré convertir les patients dont l’aorte calcifiée ne permettait pas un clampage aisé. Nous avons également utilisé un clamp classique dont la mise en place se fait par la caméra vidéo, mais dont le contrôle des branches reste à la main du chirurgien traversant la paroi abdominale par une courte laparotomie. La mise au point de nouveaux instruments permettra sans doute dans l’avenir de pallier cet inconvénient. Conclusion À la lumière de cette première expérience de pontages aortofémoraux vidéoassistés, on peut penser que cette technique peut fournir des résultats immédiats comparables à ceux de la technique classique. Elle peut vraisemblablement faciliter les suites immédiates et limiter le temps d’hospitalisation. Les indications actuelles se limitent à une population choisie, exempte des contre-indications suivantes : obésité, antécédents chirurgicaux abdominaux, aorte calcifiée et mauvaise fonction ventriculaire gauche. Références [1] Berens ES, Herde JR. Laparoscopic vascular surgery: four case-reports. J Vasc Surg 1995 ; 22 : 73-79 [2] Cambria RP, Brewster DC, Abbott WM, Freehan M, Megerman J, Lamuraglia G et al. Transperitoneal versus retroperitoneal approach for aortic reconstruction: a randomized prospective study. J Vasc Surg 1990 ; 11 : 314-325 [3] Chen MH, Murphy EA, Halphern V, Faust GR, Cosgrove JM, Cohen JR. Laparoscopic-assisted abdominal aortic aneurysm repair. Surg Endosc 1995 ; 9 : 905-907 [4] Dion YM, Chin AK, Thompson TA. Experimental laparoscopic aortobifemoral bypass. Surg Endosc 1995 ; 9 : 894-897 ENCYCLOPÉDIE MÉDICO-CHIRURGICALE 43-038-A 43-038-A Chirurgie restauratrice aorto-iliaque : revascularisations endovasculaires (I) J Marzelle X Chaufour F Luizy G Franco JM Fichelle D Guez F Cormier JM Cormier R é s u m é. – La chirurgie endovasculaire a changé en quelques années les indications de revascularisation à l’étage aorto-iliaque : diminution du nombre de pontages aortofémoraux, aide au maintien de la perméabilité des revascularisations extra-anatomiques, et surtout élargissement des indications de première intention grâce aux endoprothèses. Les résultats à long terme des techniques endoluminales incitent à discuter les revascularisations endoluminales par rapport à la chirurgie classique dans la plupart des situations cliniques et des lésions anatomiques, sténoses et occlusions. Une bonne connaissance des modalités techniques est donc indispensable au chirurgien vasculaire d’aujourd’hui : cathéters et guides, ballons et endoprothèses, voies d’abord homo- et controlatérales. Les indications et la technique commencent à être bien codifiées, même si des progrès restent à faire, en particulier dans le domaine des endoprothèses et des endopontages. Introduction Les résultats à long terme des techniques endoluminales sont maintenant disponibles, exprimés dans nombre de cas avec la même rigueur que les résultats de la chirurgie conventionnelle [61] : ils incitent à discuter les revascularisations endoluminales par rapport à la chirurgie classique dans la plupart des situations cliniques et des lésions anatomiques rencontrées à l’échelon aorto-iliaque. Une bonne connaissance des modalités techniques est donc indispensable au chirurgien vasculaire d’aujourd’hui. Matériel Imagerie peropératoire Nous ne reviendrons pas sur la nécessité d’une imagerie de qualité au sein du bloc opératoire : elle permet d’avoir des résultats équivalents à ceux des procédures endoluminales réalisées en salle d’angiographie [18]. Les principes sont développés dans le chapitre consacré à l’imagerie peropératoire auquel nous nous référons [41]. Artériographie Amplificateur de brillance L’amplificateur doit être muni au minimum d’un arceau mobile permettant de faire des clichés de face et profil, et de déplacer l’appareil © Elsevier, Paris Jean Marzelle : Chirurgien vasculaire. Xavier Chaufour : Interne des hôpitaux de Paris. François Luizy : Angiologue. Gilbert Franco : Angiologue. Jean-Marc Fichelle : Chirurgien vasculaire. David Guez : Chirurgien vasculaire. François Cormier : Chirurgien vasculaire. Jean-Michel Cormier : Chirurgien vasculaire. Clinique de la Défense, 16, boulevard Emile-Zola, 92000 Nanterre, France. Toute référence à cet article doit porter la mention : Marzelle J, Chaufour X, Luizy F, Franco G, Fichelle JM, Guez D, Cormier F et Cormier JM. Chirurgie restauratrice aorto-iliaque : revascularisations endovasculaires. Encycl Méd Chir (Elsevier, Paris), Techniques chirurgicales – Chirurgie vasculaire, 43-038-A, 1998, 15 p. vers le haut et le bas, et le long de la table. Une configuration à deux écrans permet de garder une image choisie comme référence, ou de visualiser sur un écran l’image en soustraction, et sur l’autre l’image des repères osseux. Le champ des appareils actuels couvre de 23 à 32 cm de large, le champ maximal étant obtenu en plaçant la source aussi loin que possible du patient. La mémoire de l’appareil permet de stocker des images pour rappeler un résultat intermédiaire, mais un disque dur est souhaitable pour permettre l’acquisition de séquences d’images à une cadence moyenne de 4 images/s. En dehors des séquences d’angiographie conventionnelle et en soustraction digitale (DSA ou digital substraction angiogram), le traitement de l’image permet une sommation ou la constitution d’un masque (roadmapping ou tracé artériel). Les images de la procédure peuvent être conservées sur papier ou sur film, mais également sur support informatique. Injecteur L’injecteur est un élément indispensable afin d’obtenir des séquences d’artériographie, surtout à l’étage aortique, et pour les contrôles en fin de procédure, une fois le flux rétabli. La quantité de produit de contraste nécessaire à une image de qualité est ainsi réduite. La quantité de produit injecté varie entre 10 et 20 mL par injection. On peut également faire varier le temps d’injection. Radioprotection C’est un élément mal connu des chirurgiens, mais qui mérite une attention spéciale, car si l’effet des radiations ionisantes est très atténué au-delà de 1 mètre de la source de rayons X, la protection des utilisateurs 43-038-A CHIRURGIE RESTAURATRICE AORTO-ILIAQUE (I) fait partie des obligations légales : protège-thyroïde, tablier léger mais efficace et donc homologué, lunettes plombées et gants stériles de protection pour l’opérateur et son instrumentiste, port du dosifilm. Règles élémentaires Nous insistons ici sur des points fondamentaux, que nous reverrons au fur et à mesure des techniques. Il importe de vérifier ces points avant de débuter une procédure, de la même façon qu’il faut vérifier que l’on dispose du matériel suffisant, non seulement pour réaliser une procédure simple, mais également pour faire face à ses complications, par technique endovasculaire aussi bien que par une chirurgie de conversion. Le problème de la radio-opacité des tables d’opération justifie une adaptation des tables existantes, voire l’acquisition d’une table totalement radiotransparente compatible avec des interventions de chirurgie traditionnelle. Dans tous les cas, on doit vérifier que l’installation du patient, avant de débuter la procédure, autorise la prise de clichés sous plusieurs incidences (au moins face et obliques) et la visualisation de l’arbre artériel de l’aorte jusqu’à la distalité, sans être gêné par le pied de la table ou par son armature métallique. Une règle radio-opaque placée sous le patient ou collée sur la peau, parallèlement à la lumière artérielle, est utile au repérage du niveau d’une lésion, et au calcul de ses dimensions, mais il faut garder à l’esprit qu’il existe un facteur de grossissement, source d’erreurs de parallaxe, et il est parfois utile d’avoir recours à des guides ou des sondes d’angiographie calibrées par des marqueurs radio-opaques. Le caractère excentré d’une sténose et le calcul du degré de sténose ne peuvent être déterminés que si l’on réalise des opacifications sous plusieurs incidences. Lorsqu’on franchit une lésion au guide, il faut toujours vérifier par une artériographie le positionnement correct du guide dans la lumière artérielle. Un guide en place ne doit jamais être retiré avant d’avoir décidé de la fin de la procédure : sa surveillance doit être confiée à l’aide ou à l’instrumentiste. Compte tenu de la longueur des guides et des cathéters, on peut avoir intérêt à positionner la table d’instruments dans le prolongement des pieds du patient. Des études récentes montrent que la sensibilité de l’angiographie dans l’interprétation du résultat après angioplastie est insuffisante : la mesure du gradient de pression transsténotique [54] , voire l’échographie endovasculaire [55], prendraient ici toute leur valeur. Doppler - Échographie Depuis l’avènement du doppler, exploration hémodynamique, l’amélioration de l’échographie a permis une exploration morphologique fine de la paroi des vaisseaux et de leur contenu. Avec le couplage des deux techniques, on dispose d’une approche non invasive pour le bilan préopératoire, éventuellement peropératoire, et le suivi postopératoire [11]. Il nous a paru logique de ne pas dissocier exploration hémodynamique et morphologique. Doppler continu Le doppler continu n’a pas de résolution spatiale et, de ce fait, tous les vaisseaux se trouvant sur le parcours du faisceau ultrasonore donneront une réponse simultanée, ce qui peut être source de confusion entre le vaisseau étudié et les vaisseaux sous-jacents. Le crayon doppler utilisé en peropératoire permet de guider la ponction fémorale lorsque le pouls est faiblement perçu. Doppler pulsé Contrairement au doppler continu, le doppler pulsé n’est pas aveugle et il est possible de déplacer un volume de mesure dont on peut faire varier taille et profondeur : on peut ainsi choisir avec précision le vaisseau et la zone à explorer. Il peut être utilisé seul, sans couplage à l’imagerie. Échotomographie L’échotomographie mode B en temps réel utilise des sondes à haute fréquence (7 à 10 MHz), pour contrôler la qualité d’une désobstruction ou rechercher des anomalies morphologiques, géométriques, des fautes techniques telles que des flaps, des ressauts intimaux ou des dissections. Couplage doppler-échographie Le doppler pulsé peut être couplé à l’échotomographie en temps réel mode B (duplex). Plus récemment, il a été associé au doppler couleur (triplex). Le maniement est plus délicat pour des opérateurs peu page 2 Techniques chirurgicales entraînés à la technique, et le concours d’une tierce personne spécialisée s’avère nécessaire. C’est l’examen de référence en préopératoire [16] et pour le suivi postopératoire, il permet d’explorer la qualité du trépied fémoral avant toute ponction et analyse la lésion artérielle à traiter tant sur le plan morphologique qu’hémodynamique. L’échographie doppler reste l’examen non invasif de référence pour le suivi des patients. En cas de ponction difficile (patient obèse, trépied fémoral pathologique), une ponction guidée est possible en enveloppant barrette et câble dans un manchon stérile. Manométrie artérielle Cette méthode permet de mesurer la pression de perfusion artérielle. Sa réalisation technique, avec les appareils de monitoring des pressions des anesthésistes, ne pose pas de problème. Le cathéter d’angiographie, et le port latéral de l’introducteur sont reliés par une tubulure à un capteur électronique de pression. La pression s’affiche en temps réel sur un moniteur et peut éventuellement être comparée à la pression radiale : le rapport des deux représente l’index de pression. La prise des pressions en amont et en aval d’une sténose et le calcul de gradient de pression sont des moyens d’évaluer le caractère significatif de cette sténose. L’index est calculé avant et après l’angioplastie transluminale, car l’artériographie de contrôle sous-estime souvent le degré de sténose résiduelle. La persistance d’un gradient de pression supérieur à 0,10 constitue donc l’indication à un geste complémentaire, nouvelle angioplastie ou mise en place d’une endoprothèse [53]. La prise de pressions est réalisée par l’intermédiaire d’une sonde 5F positionnée juste en amont de la sténose, puis en aval de la sténose. Échographie endovasculaire C’est une technologie récente qui permet d’apprécier l’état de la lumière artérielle, d’évaluer la morphologie de l’intima, de la média, et de l’adventice, leur épaisseur et leur structure, et de mesurer de façon précise le diamètre luminal de l’artère et contrôler l’efficacité d’une angioplastie ou la bonne expansion d’une endoprothèse [1]. Sondes Les plus petits cathéters ont un calibre de 3,5 F. Tous doivent être montés sur guide (0,014 à 0,035 inches) pour réaliser la procédure. Ce système de guide a le mérite de limiter les traumatismes pariétaux. Diverses fréquences de sondes sont disponibles, et leur pénétration (rayon maximal accessible à l’exploration) varie de manière inversement proportionnelle à leur fréquence : à l’étage aorto-iliaque, ce sont les sondes de 10 MHz et de 20 MHz qui sont le plus adaptées à la résolution spatiale : leur résolution axiale et latérale est de l’ordre du dixième de millimètre. Source L’extrémité proximale du cathéter est reliée à l’échographe. La console d’échographie comprend un moniteur TV, un magnétoscope, et un tableau de réglage qui permet la mesure du calibre artériel et de la surface de la lumière par un système de curseurs. Des rapports de surface peuvent être calculés automatiquement, pour déterminer le pourcentage de sténose. Le rapport de surface est un reflet plus exact du degré de sténose que le rapport de diamètre, qui, comme l’artériographie, ne prend en compte qu’un seul plan, au risque de surestimer ou de sousestimer la sténose selon le plan. Le centre de l’image est occupé par l’image circulaire de la sonde d’échographie, qui, selon la sinuosité des artères et le trajet du guide, est plus ou moins centrée par rapport à la lumière. Une plaque calcifiée, très dense, entraîne une ombre portée en arrière (cône d’ombre) qui peut masquer la média et l’adventice à son niveau. Une dissection se matérialise par l’image d’un double chenal pulsatile, le lambeau de dissection flottant dans la lumière qu’il sépare du faux chenal. L’étendue de la dissection est facilement appréciée par la longueur du retrait du cathéter et la projection sous scopie de la sonde endovasculaire. Pour l’instant, le principal inconvénient de cet outil reste le coût d’utilisation, car les sondes d’échographie endovasculaires sont à usage unique. Dans un avenir proche, des sondes d’échographie couplées au ballon d’angioplastie, autoriseront dans le même temps un bilan lésionnel morphologique, la dilatation, un contrôle du geste effectué, un dépistage des complications pariétales et leur correction immédiate. Techniques chirurgicales CHIRURGIE RESTAURATRICE AORTO-ILIAQUE (I) 43-038-A A B C D E F G H J I 1 Différentes sondes d’approche. A. Cathéter droit. B. Cathéter multipurpose. C. Cathéter en crosse de hockey. D. Cathéter en J. E. Cathéter « vertébral ». Matériel d’angioplastie Nous ne détaillerons pas ici les différentes caractéristiques du matériel [40] , mais nous insisterons sur le matériel spécifique aux recanalisations aorto-iliaques. Guides On dispose maintenant de guides fins, flexibles (floppy), effilés (tapered), orientables (steerable), faciles à diriger (torquable), hydrophiles dont le revêtement minimise les frictions avec la paroi vasculaire. Dans toutes les recanalisations, la lésion est d’abord franchie par un guide, laissé en place pendant toute la procédure afin d’être sûr qu’une fois la sténose ou l’occlusion levée, la continuité de la vraie lumière artérielle sera préservée : en effet, le franchissement itératif de la lésion, la fracture de plaque induite par la dilatation risquent de créer un faux chenal qui exposerait à une occlusion de l’artère en aval du site traité. Parmi la multitude de guides disponibles, un choix doit être fait : il faut des guides téflonés et hydrophiles, à extrémité droite ou angulée à 30° et des guides en J, de diamètres différents : 0,035, 0,020, 0,018 inches. Le franchissement de certaines occlusions par un guide fin (0,014 ou 0,018), analogue à ceux utilisés dans les coronaires, soutenu par un cathéter d’angiographie, est parfois nécessaire. Il faut choisir un guide de longueur suffisante (en tenant compte de la taille des cathéters que l’on compte utiliser). Il existe des guides de rigidités différentes : normale, stiff, superstiff, extrastiff (type Amplatz). Les guides rigides sont surtout indiqués pour les procédures controlatérales (cross over), de façon à assurer le franchissement du carrefour aortique par le cathéter à ballonnet ou le stent. Si les guides hydrophiles permettent de franchir plus facilement les occlusions thrombotiques [21] , ils présentent l’inconvénient de s’engager dans des plans de dissection sans que l’on sente de « ressaut », ce qui rend réservé sur leur utilisation comme guides de première intention. La progression du guide doit être suivie en scopie, de façon à l’orienter et à adapter sa progression aux sinuosités de l’arbre artériel. F. Cathéter « cérébral » modifié par Burke. G. Cathéter Cobra. H. Cathéter headhunter. I. Cathéter Sidewinder ou Simmons. J. Cathéter pigtail. Introducteurs Il s’agit d’introducteurs à valve de différentes tailles, depuis 5 F jusqu’au 12F pour certains stents aortiques, qui sont disponibles en trois longueurs : 10 cm, 23 cm, 40 cm. Le changement pour un introducteur long, voire courbe [33] (Cook, Arrow) franchissant la bifurcation aortique, dans les cas de cathétérisme controlatéral, permet de laisser en place un accès aisé à l’artère iliaque controlatérale, et de faciliter le passage de la bifurcation aortique par des cathéters ou des stents rigides. Les introducteurs longs ont par ailleurs l’intérêt de permettre la progression « protégée » des endoprothèses serties sur ballonnet à travers des artères sinueuses et rétrécies : ils sont surtout utiles en cas de stenting primaire, c’est-à-dire sans angioplastie préalable. Une fois le stent positionné au niveau de la lésion, la gaine de l’introducteur est retirée et le stent peut être déployé. Cathéters Sondes d’angiographies Les sondes de type queue de cochon (pigtail) permettent de réaliser les artériographies. Il peut être intéressant d’utiliser des sondes calibrées radiomarquées pour réaliser des mesures précises de la longueur d’une lésion et du diamètre des artères iliaques et de l’aorte. Sondes d’approche Elles permettent de réaliser un cathétérisme sélectif des artères ou permettent de rigidifier le guide, de l’orienter et de le diriger de façon plus aisée. Un certain nombre d’orientations sont décrites dans la figure 1. On peut également utiliser les cathéters comme cathéters d’échange : une fois la lésion franchie par un premier guide, le cathéter d’angiographie franchit la lésion sur le guide ; ce guide est ensuite retiré et un deuxième guide, plus rigide, est passé par le cathéter laissé en place ; ce procédé est utile quand le premier guide, choisi comme le plus adapté pour franchir la lésion, a été abîmé ou ne peut être utilisé avec le cathéter d’angioplastie pour des raisons de calibre. page 3 43-038-A CHIRURGIE RESTAURATRICE AORTO-ILIAQUE (I) Techniques chirurgicales Sondes de thrombolyse sélective Des sondes multiperforées, type Katzen et Mewissen, permettent l’administration in situ de thrombolytiques, soit en injection continue, soit en injection discontinue ou pulsée (pulse spray thrombolysis). La thrombolyse est d’autant plus efficace que la lésion a pu être franchie par un guide hydrophile. Le cathéter est alors placé au sein du thrombus. Les doses et la durée de thrombolyse peuvent être réduites en suivant la progression de la thrombolyse de façon à adapter la position du cathéter. Sondes de prise de pressions Ce sont des sondes à un ou deux chenaux permettant de calculer le gradient de pressions de part et d’autre de la sténose avant et après la procédure. Le plus souvent, on peut réaliser la prise de pression en amont à travers un cathéter droit qui a franchi la lésion, et en aval par l’introducteur. Ballons Choix du ballon La plupart des ballons sont fabriqués à partir des cinq classes principales de polymères du plastique : chlorure de polyvinyle (PVC), polyéthylène (PE), polyéthylène teraphtalate (PET), Nylon, et polyuréthane (PU) renforcé [40]. La plupart des cathéters actuellement disponibles ont un corps de 5 F. Des progrès considérables ont été réalisés dans le « profil » des ballonnets. On sélectionnera le type du cathéter essentiellement en fonction du caractère compliant ou non du ballon. Taille du ballon Le diamètre et la longueur du ballon d’angioplastie doivent être adaptés à la lésion à traiter afin d’obtenir des résultats satisfaisants ; le risque de surdilatation et d’angioplastie débordant sur une artère saine doit rester présent à l’esprit lors de toute angioplastie ; d’ou l’intérêt d’utiliser en peropératoire une sonde d’angiographie calibrée ou une règle radioopaque pour connaître avec précision le diamètre et la longueur des lésions. Bien que cette attitude ne soit pas validée, le traitement des occlusions par sous-dilatation à l’aide d’un ballonnet de calibre nominal inférieur de 1 ou 2 mm au calibre théorique de l’artère limiterait le risque de rupture artérielle, en particulier sur les lésions calcifiées. Par ailleurs, l’utilisation de ballonnets compliants permet théoriquement une certaine marge dans la taille des ballons, ce qui évite d’avoir recours à un deuxième cathéter en cas de résultat incomplet. Ce type de ballonnet a l’inconvénient d’avoir une pression de rupture nettement inférieure à celle des ballons non compliants, et de faire courir le risque de surdilatation de l’artère en amont et en aval de la sténose, lorsque celle-ci ne cède pas malgré une augmentation de la pression d’inflation. Endoprothèses Principes des endoprothèses La mise en place d’une prothèse endoluminale (stent, d’après le nom du dentiste Charles Stent) permet de maintenir, après angioplastie, le calibre artériel à une valeur prédéterminée, d’impacter les fragments de paroi en laissant une lumière circulante cylindrique sans turbulences. Les endoprothèses couramment utilisées sont des treillis métalliques, suffisamment radio-opaques pour permettre leur pose sous contrôle scopique, qui exercent sur la paroi un certain degré de force radiaire pour maintenir la lumière vasculaire ouverte. Leur expansion peut être assurée par l’intermédiaire d’un ballon ou en leur laissant reprendre leur diamètre nominal en les larguant à l’aide d’un cathéter dans lequel elles sont repliées : on parle dans ce dernier cas d’endoprothèses autoexpansibles. Parmi celles-ci, un certain nombre sont faites dans un métal à mémoire de forme, le Nitinol, qui permet à l’endoprothèse de reprendre son calibre nominal à la température du corps. Un certain nombre de facteurs ont été pris en compte lors du développement des endoprothèses. – Thrombogénicité : bien qu’une endothélialisation se produise en quelques semaines, la thrombose précoce est une complication non négligeable de cette technique. Sa fréquence est limitée par l’emploi d’un métal non thrombogène, par une architecture laissant aussi peu de page 4 2 Couverture de l’ostium hypogastrique par une endoprothèse de Palmaz (A), placée à cheval sur l’iliaque primitive et l’iliaque externe. Le contrôle à 2 ans (B) montre le maintien de sa perméabilité (courtoisie du Dr JM Cardon, clinique des Franciscaines, Nîmes). métal que possible en contact avec le sang circulant, et par un traitement anticoagulant dont les modalités (antiagrégants, héparine) et la durée ont été simplifiées à la suite des études réalisées surtout en pathologie coronaire. – Resténose : un mécanisme d’hyperplasie intimale a été décrit, la paroi réagissant aux forces radiaires exercées contre elle lors de l’angioplastie mais également par l’endoprothèse qui reste en place. Cette réaction pariétale entraîne une resténose d’autant plus significative que l’endoprothèse a été placée dans un vaisseau de petit calibre. Un certain nombre de resténoses aux extrémités de l’endoprothèse ont été décrites dans les semaines ou les mois qui suivaient sa mise en place : bien que l’on puisse évoquer une hyperplasie myo-intimale favorisée par le changement de compliance de la paroi artérielle [2], il est probable qu’un certain nombre de ces sténoses sont dues à une couverture incomplète de la lésion à traiter : les dissections induites par l’angioplastie transluminale sont souvent plus longues que la lésion initiale, et l’angiographie est un moyen insuffisant d’appréciation. La constatation d’une sténose plus longue que prévue ou se prolongeant au-delà du stent est l’indication formelle à la mise en place d’un stent complémentaire, en réalisant un chevauchement de quelques millimètres, pour être sûr de couvrir la totalité de la lésion. – Rigidité : les partisans des stents les plus rigides arguent du fait que moins un vaisseau est rendu compliant, moins importante sera l’hyperplasie intimale. En outre, une endoprothèse rigide maintient avec plus de force (force radiaire) le calibre que l’on veut imposer à l’artère. Cependant, la rigidité d’une endoprothèse gêne sa pose au niveau des vaisseaux sinueux. – Irrégularités de calibre : il ne faut pas se fier à l’aspect du ballon, rempli de sérum mélangé à du produit de contraste, ou à l’angiographie de contrôle pour juger du caractère complet de l’expansion de l’endoprothèse. Les contrôles en échographie endovasculaire montrent souvent des irrégularités de calibre : il ne faut pas hésiter à réaliser une angioplastie complémentaire (même en cas de prothèse autoexpansible) pour obtenir un calibre homogène sur toute la longueur de l’endoprothèse. – Perméabilité des collatérales : la faible proportion de paroi artérielle couverte est un gage théorique de maintien de la perméabilité des collatérales, et la couverture de l’artère hypogastrique par des stents à larges mailles ne semble pas avoir donné lieu à des complications à moyen terme (fig 2). – Sepsis : il ne faut pas oublier que la mise en place d’endoprothèse est la seule technique endoluminale où on laisse un corps étranger à l’intérieur de l’artère. Même si les cas rapportés sont rares, les précautions d’asepsie lors de l’implantation doivent être rigoureuses. Endoprothèses déployées par ballon Stents de Palmaz L’endoprothèse de Palmaz (Cordis) est un tube d’acier inoxydable percé d’encoches rectangulaires disposées en quinconce le long du tube. Une fois déployée, les fenestrations prennent un aspect losangique alors que l’endoprothèse se raccourcit d’autant plus que son calibre augmente. Ces endoprothèses peuvent être serties à la main ou utilisées « préserties ». Ce sont elles qui ont été le plus étudiées dans la littérature [26, 43, 45]. Techniques chirurgicales CHIRURGIE RESTAURATRICE AORTO-ILIAQUE (I) Les endoprothèses de la gamme « Medium » sont adaptées aux artères de 4 à 9 mm de diamètre et passent dans des introducteurs de 7 F à l’aide d’un « passe valve » métallique (ou 6F sans passe valve, si l’on fait attention lors du passage de la valve par le stent). Elles existent en longueurs variables, de 10 à 39 mm, avec un raccourcissement qui ne dépasse pas 15 % pour une expansion complète à 9 mm de diamètre. Les endoprothèses de la gamme « Large » sont adaptées aux artères de 8 à 12 mm de diamètre et existent en trois longueurs : 12 mm, 18 mm et 30 mm. Les endoprothèses de la gamme « Extra-Large » ont été développées pour le stenting aortique, permettant une expansion de 12 à 25 mm et existent en deux longueurs : 40 et 50 mm. Pour pallier la rigidité du stent de Palmaz, qui peut être un handicap lors d’un stenting long, des endoprothèses articulées « Long Medium » ont été développées : elles sont composées de plusieurs segments articulés par une pièce métallique qui assure leur continuité et permettent de couvrir des lésions de 42 mm à 78 mm de long. Autres endoprothèses De nombreuses autres endoprothèses ont été développées, et nous nous limiterons à citer celles qui présentent une conception nettement différente de celle du stent de Palmaz, sans prétendre être ici exhaustif. Les endoprothèses de Strecker (Meditech) sont constituées d’un treillis de monofilament de tantale qui se raccourcit peu pendant son expansion. Elles sont préserties et ont une grande flexibilité qui permet leur utilisation dans les procédures controlatérales, nécessitant un cross over [36]. On leur reproche d’assurer une impaction insuffisante en cas de lésion dure ou épaisse. Ces endoprothèses existent en différentes tailles, de 4 à 11 mm de diamètre, en 40 et en 80 mm de long. Les endoprothèses Perflex (Cordis) seraient plus flexibles que les endoprothèses longues de Palmaz, et, comme toutes les endoprothèses « préserties », devraient être plus fiables que les endoprothèses serties manuellement, en particulier pour le stenting primaire. Endoprothèses autoexpansibles Wallstent Le Wallstent (Schneider) est une endoprothèse composée de l’entrelacement de 14 à 20 filaments d’acier trempé, dont les points de croisement ne sont pas scellés, mais libres de s’articuler les uns par rapport aux autres. On peut ainsi étirer l’endoprothèse pour lui conférer le diamètre le plus étroit possible, et elle reprend son calibre et sa longueur initiaux quand on la relâche. Dans le système de pose initial, elle était placée dans son calibre le plus fin à l’intérieur du cathéter qui 43-038-A servait à la mettre en place, entourée d’une membrane que l’on dépliait progressivement lors du largage. Récemment, un système de largage a été mis au point, dérivé de celui des stents biliaires : il permet un déploiement plus aisé par retrait d’une gaine externe, qui autorise par ailleurs un meilleur ajustement du stent lors du largage, un repositionnement du stent dans sa gaine étant possible au début du largage. C’est une endoprothèse plus fine que le stent de Strecker : comme lui, elle est plus flexible que le stent de Palmaz. Différents calibres (de 7 à 16 mm pour des artères de 6 à 14 mm) et différentes longueurs de Wallstent (de 33 à 100 mm) sont disponibles pour implantation iliaque [15, 44]. Endoprothèses en Nitinol Les endoprothèses autoexpansibles à mémoire thermique utilisent la propriété du Nitinol, alliage de nickel et de titane, de reprendre sa forme à la température du corps. Elles se rétractent au froid et peuvent être préchargées dans un système de gaines passant sur guides. Une fois positionnées en regard de la lésion, la gaine est retirée par un système de poussoir ou de gâchette, et l’endoprothèse est progressivement déployée. De nombreuses endoprothèses en Nitinol ont été développées : Memotherm (Bard), Symphony (Meditech), Cragg [22] (Meditech), Instent (Medtronic), Optimed, Vascucoil [25] (Medtronic)… Endoprothèses couvertes La couverture des endoprothèses métalliques par un matériau étanche a pour but d’éviter une réocclusion ou une resténose par passage de matériel athéromateux, de thrombus ou d’hyperplasie myo-intimale évolutive dans les mailles de la prothèse. La seule endoprothèse couverte pour laquelle le recul existe est l’Endopro/Passager (Mintec/Boston Scientific Corp) : il s’agit d’un stent de Cragg à mémoire de forme, en Nitinol, couvert d’un polyester à paroi mince [46]. Les résultats préliminaires dans le traitement d’occlusions athéromateuses à l’étage iliaque semblent prometteurs. Deux concepts s’opposent actuellement dans la conception du matériel : les stent-grafts utilisent une prothèse classique (polyester ou PTFE) dont la fixation est assurée par un stent ou par un système d’amarrage aux deux extrémités ; les endoprothèses couvertes proprement dites sont constituées par un treillis métallique continu, recouvert d’un matériau étanche à paroi ultramince : polyester, PTFE (Hemobahn, Prograft), PU (Corvita). Il n’existe pas actuellement d’étude comparative prouvant le bénéfice indiscutable des endoprothèses couvertes par rapport aux endoprothèses non couvertes dans le traitement des occlusions athéromateuses, même si les séries préliminaires sont encourageantes. Techniques Abord Abord percutané Il est pratiqué avec les même règles d’asepsie qu’un abord chirurgical (rasage, badigeonnage avec un antiseptique, mise en place de champs stériles). Après repérage du pouls artériel entre deux doigts, on infiltre d’anesthésique local le derme et l’hypoderme. On peut utiliser une aiguille de ponction 16 G avec mandrin métallique ou un trocart de ponction type Seldinger. On ponctionne la peau à quelques centimètres du pouls que l’on perçoit et l’on introduit l’aiguille à 45° jusqu’au contact de l’artère. Lors d’une ponction rétrograde, vers l’axe iliaque, il faut se méfier de ne pas ponctionner la fémorale commune trop haut. Une ponction de l’iliaque externe en arrière de l’arcade crurale exposerait en effet à un hématome rétropéritonéal extensif en postopératoire. Si on utilise la technique de Seldinger, on pousse l’aiguille jusqu’à traverser les deux parois (antérieure et postérieure) de l’artère, puis on retire doucement l’aiguille jusqu’à obtenir un reflux de sang artériel. Cette technique a comme inconvénient d’exposer à un saignement au niveau de la sortie de l’aiguille à la face postérieure de l’artère, où siège souvent une épaisse plaque athéromateuse, à une fistule artérioveineuse si on ponctionne la veine adjacente au contact de l’artère. Au niveau fémoral, une ponction trop profonde expose également à une lésion de l’artère fémorale profonde. Si l’on veut éviter ce type d’incident, on a intérêt à ne ponctionner que la paroi antérieure de l’artère : dès qu’on obtient un reflux de sang artériel, on arrête la progression de l’aiguille. L’inconvénient de cette dernière technique est de risquer de s’engager dans un faux chenal : le décollement d’une plaque par l’aiguille peut entraîner une dissection localisée circulante (avec parfois un reflux sanguin trompeur) ; on risque, en injectant dans ce plan, d’aggraver la dissection. Il est donc prudent, une fois le reflux obtenu, d’injecter quelques millilitres de produit de contraste pour vérifier que l’aiguille est bien dans la vraie lumière et que le produit injecté ne stagne pas dans la paroi artérielle. Cette injection test a, de plus, l’intérêt de situer avec précision le point de ponction, en particulier au niveau du trépied fémoral, ce qui évite, dans les ponctions antérogrades de la fémorale commune, de s’engager dans la fémorale profonde. On retire alors le mandrin en maintenant l’aiguille en place et on passe un guide à travers l’aiguille dans la lumière artérielle. Lorsque le guide est avancé suffisamment loin dans l’artère pour ne pas risquer de ressortir lors d’une fausse manœuvre, on retire l’aiguille et on élargit l’orifice de ponction cutané d’une moucheture au bistouri pour ne pas abîmer le bout des cathéters que l’on va introduire le long du guide. page 5 43-038-A CHIRURGIE RESTAURATRICE AORTO-ILIAQUE (I) Plusieurs artifices de ponction peuvent être utilisés : – lorsque le pouls est faiblement senti, l’utilisation d’un brassard à tension gonflé temporairement à la racine de la cuisse peut faciliter la ponction ; – la ponction première de la veine (souvent involontaire) qui permet une injection de produit de contraste et une ponction de l’artère en dehors de la veine opacifiée ; – la ponction sous roadmapping : un masque créé par artériographie à partir d’une sonde positionnée dans l’aorte en amont des lésions par voie controlatérale ou brachiale, permet de se repérer, mais la ponction peut être rendue difficile par une artère mobile, qui « roule » sous l’aiguille ; – la ponction première de l’artère par une aiguille fine transfixiant l’artère et laissée en place permet d’immobiliser l’artère pour ponctionner ensuite à l’aiguille 16 G habituelle ; – l’utilisation d’un mini-doppler stérile lorsque le pouls n’est pas palpable, peut aider à guider la ponction ; – enfin, plus sophistiquée car demandant un apprentissage, la ponction sous doppler-échographie permet de guider précisément la ponction, mais a un intérêt majeur pour choisir le site de ponction sur un trépied fémoral très pathologique. Des hématomes volumineux peuvent être observés après abord percutané, ce qui justifie une compression d’au moins 10 minutes après retrait des cathéters et de l’introducteur, la surveillance prolongée du point d’introduction, et parfois le recours à un brassard gonflable de contrepression. Techniques chirurgicales est alors passé le long du guide. L’abord de la fémorale superficielle à la pointe du Scarpa peut être utilisé même en cas d’occlusion à son origine. L’intérêt de la voie chirurgicale est d’éviter tout hématome postopératoire, et d’autoriser ainsi une héparinisation postopératoire identique à celle de la chirurgie conventionnelle. Il est néanmoins prudent de refermer l’incision sur un drain de Redon aspiratif laissé en place 24 heures pour éviter tout suintement postopératoire. Site de ponction Voie fémorale homolatérale C’est la voie la plus utilisée. La ponction rétrograde permet l’accès à l’artère iliaque. Elle est possible même en cas d’occlusion longue de l’artère iliaque externe car l’artère fémorale commune est le plus souvent perméable, du fait de la réentrée par les branches de l’hypogastrique. La perméabilité de la fémorale commune est affirmée par les temps tardifs de l’artériographie et par le doppler-échographie préopératoire. Néanmoins, en cas d’occlusion proche de la jonction iliofémorale, la ponction à proximité de la lésion rendra difficile l’inflation du ballonnet, car la gaine de l’introducteur risque de couvrir la lésion à traiter. C’est dans ces cas que se discute une voie controlatérale ou un abord homolatéral plus bas, fémoral superficiel, voire, pour certains, poplité [6]. Voie fémorale controlatérale Abord chirurgical L’abord limité de la fémorale est certes moins esthétique que la ponction percutanée, mais l’abord chirurgical du point de ponction présente plusieurs avantages. – Il permet de ponctionner l’artère en zone « saine », après palpation de celle-ci au besoin sur plusieurs centimètres. – Il autorise la mise en place d’un introducteur de taille importante (au-dessus de 10 F), par une artériotomie ou par ponction sous contrôle de la vue, et d’assurer après retrait de l’introducteur une hémostase chirurgicale, soit par une bourse ne prenant que l’adventice autour du point de ponction, soit à points séparés de Prolènet chargeant toute l’épaisseur de la paroi artérielle, de façon à fixer le ressaut créé par la ponction au niveau d’une paroi souvent athéromateuse. – Il permet de faire une hémostase chirurgicale après thrombolyse locorégionale, ce qui est une alternative intéressante à la solution qui consisterait à laisser l’introducteur en place le temps que les paramètres d’hémostase se normalisent. Cette dernière solution présente en effet le risque de formation de thrombus sur l’introducteur laissé en place. Cet abord limité peut être réalisé sous anesthésie locale. Un court abord dans le pli inguinal peut être utilisé lorsqu’on veut ponctionner la fémorale commune. Cet abord est insuffisant quand on veut réaliser dans le même temps une chirurgie du trépied fémoral et on doit alors pratiquer une incision verticale « classique » du Scarpa. On peut également avoir recours à un abord de la fémorale superficielle à la pointe du Scarpa, c’est-à-dire sous le niveau de la lame ganglionnaire : après une courte incision cutanée (2 à 3 travers de doigt), suffisante pour mettre en place un écarteur de Beckmann, on incise l’aponévrose du couturier que l’on écarte en dehors en ayant soin de respecter les branches nerveuses. L’aiguille de ponction artérielle est introduite par voie percutanée, le plus souvent à quelques centimètres de l’abord chirurgical de façon à percer l’artère avec un angle de 45°, pour éviter toute coudure de l’introducteur. La technique de mise en place de l’introducteur est dès lors la même que pour un abord percutané. Quand la taille de l’introducteur semble trop importante par rapport au calibre de l’artère et que l’on craint des complications de la ponction artérielle (fausse route en cas d’artère très infiltrée, suture sténosante d’un orifice de ponction trop large), on peut préférer la mise en place de l’introducteur à travers une véritable artériotomie transversale à la face antérieure de l’artère, car une artériotomie longitudinale exposerait à une suture sténosante ou imposerait une fermeture par patch ; le guide est introduit dans l’artère après vérification du reflux et l’introducteur page 6 Cette voie est utile pour traiter des lésions iliaques complexes, des lésions hypogastriques, ou des lésions descendant sur la terminaison de l’iliaque externe où un abord de la fémorale commune homolatérale fait courir un risque de dissection dès le point d’entrée [30]. Elle suppose un matériel particulier pour franchir la bifurcation aortique (cathéter d’angiographie angulé Cobra, voire Sidewinder), et un guide suffisamment rigide pour assurer la progression des cathéters au niveau du cross over de la bifurcation aortique, en évitant une plicature (guides super-stiff). Lorsque le guide peut être poussé suffisamment loin dans la fémorale superficielle ou dans la fémorale profonde, il peut suffire à assurer la progression du cathéter d’angioplastie ou de l’endoprothèse. En revanche, quand le guide ne peut pas progresser au-delà du trépied fémoral ou qu’il se loge dans l’hypogastrique, le recours à un introducteur courbe franchissant la bifurcation aortique peut être nécessaire. L’inconvénient de la voie controlatérale est d’exposer aux complications de la ponction artérielle du côté asymptomatique. Voie humérale En cas d’impossibilité de cathétériser les trépieds fémoraux, l’accès artériel ne peut être assuré que par ponction des artères du membre supérieur. Elle est facile du fait du caractère superficiel de l’artère quelques centimètres au-dessus du pli du coude, mais présente plusieurs inconvénients : la taille des introducteurs est limitée du fait du calibre de l’artère (ce qui peut justifier un court abord chirurgical), la longueur du trajet jusqu’aux artères des membres inférieurs oblige à prévoir des guides et cathéters plus longs, et enfin, le guidage de la procédure est plus difficile en raison de l’éloignement et des courbures artérielles franchies (origine des sous-clavières, crosse aortique). On a souvent intérêt à s’aider, comme en angioplastie coronaire, d’un cathéter-guide amené à proximité de la lésion pour permettre aux mouvements de torsion et de poussée imprimés au guide d’être transmis de façon efficace. Recanalisation iliaque Recanalisation par voie homolatérale La voie d’abord est le plus souvent percutanée et, généralement, homolatérale de première intention si l’artère fémorale commune est ponctionnable. On utilise le plus souvent un introducteur 7 F, car il permet l’utilisation de la majorité des techniques interventionnelles et l’implantation de la plupart des endoprothèses. Un guide hydrophile Techniques chirurgicales CHIRURGIE RESTAURATRICE AORTO-ILIAQUE (I) 0,035 droit ou courbe est alors monté avec précaution à travers l’occlusion. La désobstruction peut parfois être facile et le guide retrouver rapidement la lumière aortique. Ailleurs, le guide est trop flexible et bute au niveau de l’occlusion : on peut alors s’aider d’un cathéter 5 F, droit ou courbe, pour faciliter la poussée sur le guide ou pour l’orienter (« torquer »), et lui permettre de franchir une lésion excentrée et de retrouver le « bon chenal ». Il faudra s’assurer de sa bonne position dans cette lumière aortique, et non dans la paroi, en injectant du produit de contraste à travers le cathéter 5 F qui a suivi le guide, après retrait de celui-ci. Une fois certain que l’on a franchi la lésion, on remet en place le guide jusqu’au niveau aortique, et ce guide devra rester en place jusqu’à la fin de la procédure, car c’est ce que Cardon a appelé la « ligne de vie » : une perte d’accès en cours de procédure expose à l’impossibilité de cathétériser à nouveau la lésion et au passage du guide dans un plan de dissection. Outre l’impossibilité de terminer la procédure, cette perte d’accès empêche de traiter rapidement certaines complications, dissection mais surtout rupture artérielle, nous le reverrons. La surveillance du guide doit être confiée à l’aide ou à l’instrumentiste. La désobstruction peut en revanche être plus difficile, le guide butant sur des plaques fibreuses ou calcifiées et il peut facilement passer dans la paroi artérielle en position sous-intimale, voire sous-adventicielle, récupérant parfois plus en aval la bonne lumière artérielle mais cheminant dans certains cas dans la paroi aortique et entraînant une dissection plus ou moins étendue. C’est un des dangers des guides hydrophiles qui, s’ils sont particulièrement indiqués pour franchir des occlusions thrombotiques, peuvent être dangereux dans les occlusions athéromateuses où ils empruntent un mauvais plan sans qu’on ait la sensation tactile d’un ressaut lors du passage dans l’épaisseur de la paroi. – Il est important de faire le diagnostic de localisation sous-intimale du guide de manière à ne pas faire d’angioplastie et à ne pas placer de prothèse dans ce faux chenal, ce qui pourrait entraîner des lésions et des complications sévères. – Si la désobstruction par voie homolatérale s’avère impossible, on utilise alors la voie controlatérale. Une des caractéristiques de l’occlusion iliaque est de pouvoir être abordée par ses deux extrémités dans le sens antérograde et rétrograde. Recanalisation par voie controlatérale Les cathéters pigtail, ou les cathéters adaptés (Sidewinder, Cobra) permettent généralement de faire franchir au guide la bifurcation aortique. Le cathéter Sidewinder a pour inconvénient de nécessiter souvent un positionnement haut, au niveau de l’aorte thoracique, pour reprendre sa forme en crosse ; outre l’inconfort de la manipulation, il peut lors de sa « descente » vers la bifurcation aortique, s’accrocher dans une plaque ou mobiliser du matériel athéromateux, ce qui nécessite un suivi en scopie de sa progression. Une fois le cathéter courbe positionné au-dessus de la bifurcation aortique, une rotation permet de positionner son extrémité dans l’ostium de l’iliaque primitive controlatérale et on assure la progression du guide suffisamment loin vers l’hypogastrique ou la fémorale controlatérale. En effet, l’extrémité du guide étant souple, on risque de déloger celui-ci lors du retrait du cathéter. Dans certaines lésions de franchissement difficile par le guide seul, on a intérêt, une fois le cross over réalisé, à faire progresser le cathéter sur le guide dans l’iliaque controlatérale pour permettre d’orienter (« torquer ») l’extrémité du guide face à la lésion. Il est important d’avoir un bon support de manière à avoir un « push » suffisant pour franchir la sténose ou l’occlusion, d’où l’intérêt dans certains cas d’utiliser des introducteurs longs et courbes qui passent la bifurcation aortique. Une fois la recanalisation obtenue, il est également important de s’assurer que le guide est dans la lumière artérielle par une injection de produit de contraste. Dès lors, l’angioplastie avec ou sans mise en place d’endoprothèse peut être réalisée à partir de l’introducteur controlatéral, à condition de suivre le franchissement de la bifurcation aortique, lors duquel on risque un déplacement du guide. Dans certains cas, on peut préférer le recours à une voie homolatérale : le guide est alors récupéré dans l’introducteur situé du côté de la lésion, soit directement, soit avec un lasso ou une pince à préhension afin de le faire ressortir à travers la valve [17]. On peut alors laisser le guide entre les deux introducteurs (technique du « téléphérique ») [20], ce qui permet de faire progresser sur le guide les systèmes les plus rigides, ou le retirer de l’introducteur controlatéral en le positionnant dans l’aorte. Ce rétablissement de la voie homolatérale a également un intérêt en cas d’angioplastie simultanée de 43-038-A la bifurcation iliaque (kissing balloons) : l’angioplastie iliaque primitive ou iliaque externe est réalisée sur le guide homolatéral, l’angioplastie hypogastrique étant réalisée par le guide controlatéral. Recanalisation par voie humérale La voie brachiale peut être intéressante en cas de lésions bilatérales qui rendraient impossible le cathétérisme par voie basse, mais elle limite la taille des introducteurs et ne permet pas l’implantation de certaines prothèses. Elle devra souvent être complétée par une voie fémorale après recanalisation du vaisseau, le guide pouvant être récupéré de la même façon que précédemment dans l’introducteur fémoral. En cas de difficulté de mise en place de l’introducteur fémoral, on peut s’aider d’une angiographie par voie haute. Recanalisation mécanique En cas d’échec de recanalisation, même avec un guide hydrophile, la conversion chirurgicale est licite. Certains auteurs ont néanmoins recours à d’autres techniques [4] : laser, athérectomie (Rotacs, Rotablator), thromboaspiration, voire thrombectomie mécanique (Hydrolyser...). Ces techniques n’ont pas fait la preuve de leur supériorité par rapport aux recanalisations au guide [35], mais peuvent être tentées lorsque le franchissement de la lésion s’avère impossible. Il est possible, dans le but d’éviter des embolies distales, de mettre en place un garrot au niveau fémoral ou distal. Ce garrot sera gonflé pendant les procédures de recanalisation mécanique. Cette précaution peut être importante chez des malades extrêmement fragiles chez qui la thrombolyse ou le traitement des complications de type embolie distale risquent d’être aléatoires. Dans tous les cas, une angiographie en fin de procédure devra s’assurer de l’absence d’embolie distale au niveau des deux membres inférieurs. Recanalisation précédée d’une thrombolyse Elle était préconisée par beaucoup d’auteurs avant l’avènement des stents. Pour Hausegger, elle facilite la recanalisation dans les occlusions « récentes » de moins de 3 mois. Elle semble se compliquer plus volontiers d’embolies distales que les autres techniques [42], et son risque hémorragique incite à la réserver à des indications bien ciblées [50]. La technique la plus employée est le protocole de MacNamara (4 000 U d’urokinase/min pendant 2 heures puis 2 000 U/min les heures suivantes). Un contrôle angiographique répété est effectué pour vérifier la réouverture du vaisseau. La durée de la thrombolyse varie de 6 à 24 heures selon le résultat angiographique. Un cathéter est placé au contact du thrombus, généralement par voie controlatérale. On peut essayer de le faire pénétrer dans la partie haute de l’occlusion à l’aide d’un guide hydrophile pour avoir un meilleur contact du thrombolytique avec le matériel thrombotique. Les injections pulsées augmenteraient pour certains l’efficacité et la rapidité de la thrombolyse. À côté du protocole de MacNamara, d’autres protocoles ont été décrits avec l’urokinase à 50 000 U/h ou le rt-PA (recombinant tissue type plasminogen activator) 2,5 mg/h [8]. Dans certains cas, après thrombolyse ou après franchissement du guide, on constate l’existence d’images intraluminales évoquant des thrombi résiduels. On peut dans ce cas, procéder avant toute angioplastie à ballon, à une thromboaspiration par cathéter ou à l’aide d’un système de thrombectomie hydrodynamique. Cette méthode limiterait le risque d’embolie distale. Une alternative semble être la mise en place d’une endoprothèse, dont le risque d’embolie à travers les mailles du stent semble faible dans la littérature [3]. Angioplastie aorto-iliaque par ballonnet Taille du ballonnet La prévision du calibre du ballonnet du cathéter d’angioplastie se fait par rapport à la taille de la lumière de l’artère en amont du segment à traiter. Les notions anatomiques sur la taille des artères iliaques non athéromateuses peuvent conduire à surestimer la taille du ballonnet. Cette taille est moindre au niveau des artères athéromateuses, qui, même à distance des lésions sténosantes, sont le siège d’une endartérite diffuse. page 7 43-038-A CHIRURGIE RESTAURATRICE AORTO-ILIAQUE (I) Ainsi, les angioplasties iliaques primitives nécessitent des ballonnets de 7 à 10 mm le plus souvent. Au niveau des iliaques externes, on utilisera des ballonnets de 5 à 8 mm. C’est au niveau de l’aorte que l’on doit se méfier le plus, et la mesure préopératoire par doppler-échographie ou par angioscanner apporte souvent des renseignements précieux. En effet, le calibre des terminaisons aortiques athéromateuses dépasse rarement 15 mm. Il faut avoir cette notion avant de réaliser une angioplastie aortique et surtout avant de réaliser une angioplastie par kissing balloons de l’origine des deux iliaques primitives, en raison du risque d’induire des lésions de la terminaison aortique par surdilatation. Il est toujours préférable de sous-dilater les lésions occlusives, quitte à choisir un ballonnet de taille supérieure en cas de résultat incomplet ou de gradient de pression résiduel. L’évaluation de la taille du ballonnet par l’angiographie impose la prise en compte d’un facteur de correction, lié à l’amplification de l’image. On peut le calculer en se référant à la taille de repères osseux comme les vertèbres, ou utiliser une référence radioopaque que l’on pose à proximité de l’artère. La mesure peropératoire la plus précise repose sur l’échographie endovasculaire, ou à défaut l’utilisation de guides ou de cathéters calibrés par des marqueurs radio-opaques. En cas d’angioplastie des lésions de la terminaison aortique, on a le choix entre la technique des kissing balloons, placés à cheval sur l’aorte et l’ostium de l’iliaque primitive, et une angioplastie aortique isolée. Cette dernière, si elle est indiquée pour des lésions aortiques à distance de la bifurcation, présente le risque de lésion de l’ostium de l’iliaque car la terminaison du ballonnet risque d’être gonflée dans l’ostium de l’iliaque primitive, et de produire une surdilatation. Il existe maintenant des ballonnets dont l’extrémité est moins fusiforme que les ballonnets classiques, et qui permettent une angioplastie de la terminaison aortique. Enfin, il nous apparaît important d’insister sur les pressions d’inflation : le rapport entre la pression d’inflation, mesurée par le manomètre branché sur le port latéral du cathéter, et la pression réellement exercée sur la paroi a été détaillé dans le chapitre consacré aux techniques de chirurgie endovasculaire. La pression d’inflation doit être d’autant moins importante que le calibre de l’artère est élevé. Ainsi, une angioplastie aortique ne doit pas être réalisée avec des pressions supérieures à 4 atmosphères, et une angioplastie iliaque est réalisée le plus souvent avec des pressions de 4 à 6 atmosphères. Mieux vaut attendre que la sténose cède progressivement à une pression basse que de procéder à une inflation rapide atteignant d’emblée des pressions élevées. Ce n’est qu’en cas de persistance de la sténose que l’on est en droit d’augmenter progressivement la pression d’inflation. Pour certains, les artères calcifiées présenteraient un risque plus important de rupture au cours de l’angioplastie. Pour d’autres, la mise en place d’une endoprothèse de première intention permettrait de limiter le risque de rupture artérielle à l’occasion d’inflations à plus forte pression. Tactique opératoire Voie homolatérale C’est la voie de référence pour toutes les sténoses simples et les occlusions courtes. Dans les occlusions longues, certains privilégient la voie homolatérale car elle permet de mettre en place les systèmes d’endoprothèses les plus rigides, qui auraient du mal à franchir la bifurcation aortique en cross over. Nous avons vu plus haut comment « retrouver » la voie homolatérale, même en cas de franchissement de la lésion par voie controlatérale. Voie controlatérale (fig 3) Elle est utilisée dans les occlusions longues, en cas d’impossibilité de franchir le segment proximal de la lésion par voie homolatérale. La plus grande facilité à franchir certaines occlusions dans un bon plan par voie controlatérale peut être expliquée par l’existence d’une thrombose en amont de la lésion athéromateuse causale. La voie controlatérale est préférable en cas de lésions proches de la jonction iliofémorale. Dans les sténoses hypogastriques, l’angle de l’artère oblige le plus souvent à un cathétérisme controlatéral. Voie bilatérale Les lésions ostiales bilatérales des iliaques primitives nécessitent le recours à la technique des kissing balloons : il s’agit de réaliser l’angioplastie simultanée des deux artères. Outre le risque de sténose page 8 Techniques chirurgicales A 4 B A. Stenting d’une lésion ostiale de l’iliaque primitive gauche. L’impaction de la plaque détermine une sténose controlatérale. B. Indication à un kissing balloon (courtoisie du Dr JM Cardon, clinique des Franciscaines, Nîmes). résiduelle, l’angioplastie unilatérale expose en effet à la survenue d’une sténose controlatérale (fig 4) par bascule de la plaque d’athérome (qui est en règle une plaque aorto-iliaque). Cette technique limite également le risque d’embolie controlatérale. En cas de lésion de la terminaison de l’iliaque primitive ou de l’origine de l’iliaque externe, le cathétérisme de l’hypogastrique est systématique pour certains, pour deux raisons : le risque de sténoser l’ostium hypogastrique, et la forte probabilité d’avoir une récidive de la sténose iliaque dès la déflation du ballonnet, celui-ci s’étant appuyé sur l’hypogastrique lors de l’inflation. On peut soit mettre en place un guide dans l’hypogastrique (qui serait plus difficile à positionner en cas de sténose ostiale ou de dissection après angioplastie), soit réaliser d’emblée une angioplastie en kissing balloon (fig 5). Contrôle du résultat Il repose de toute façon sur l’artériographie, mais dans de nombreux cas, on aura intérêt à s’aider de la prise des pressions, voire de l’échographie endovasculaire. L’interprétation du résultat après recanalisation artérielle doit prendre en compte quatre facteurs. – Le degré de sténose résiduelle : celui-ci est le rapport du diamètre de l’artère traitée par rapport à l’artère sus-jacente. Il est admis qu’une sténose résiduelle de plus de 30 % expose à une plus forte probabilité de resténose. Le calibre de l’artère traitée doit être calculé sur au moins deux incidences, car il n’est pas rare que l’absence de sténose résiduelle sur le cliché de face masque une sténose de plus de 50 % sur le cliché de profil. Une sténose de l’artère d’amont ou d’aval est parfois notée. À côté des complications pariétales que nous détaillons plus loin, il peut s’agir d’un spasme, qui réalise une image de sténose concentrique, régulière et peut intéresser une assez grande longueur d’artère. Il disparaît souvent en quelques minutes, au besoin après injection in situ de vasodilatateurs. Une sténose résiduelle après mise en place d’une endoprothèse doit être recherchée, même si on a l’impression que le ballonnet sur lequel l’endoprothèse a été expandue s’est complètement ouvert, et même si l’artériographie de contrôle est rassurante : la visualisation de l’endoprothèse, qui est radio-opaque, retrouve parfois un défaut d’expansion à une extrémité, ou une sténose en diabolo, qui sont l’indication d’une angioplastie itérative. Il est maintenant acquis que le critère le plus fiable, et surtout le plus reproductible pour conclure à l’absence de sténose résiduelle significative, est l’absence de gradient de pression transsténotique. – L’existence d’anomalies pariétales ou endoluminales : la survenue d’une dissection artérielle au décours de l’angioplastie laisse en place un faux chenal périphérique, dans lequel existe un flux circulant, visible en angiographie, ou du thrombus, non opacifié, mais responsable d’une 43-038-A CHIRURGIE RESTAURATRICE AORTO-ILIAQUE (I) Techniques chirurgicales A C B D E 3 Techniques de recanalisation aorto-iliaque par voie controlatérale. A. Cathétérisme par une sonde Sidewinder. B. Angioplastie transluminale simple sur un guide descendu dans la fémorale controlatérale. L’utilisation d’un guide rigide permet également la mise en place de certains stents par cette technique. C. Extériorisation du guide par l’introducteur controlatéral à l’aide d’une sonde « lasso » (on peut aussi utiliser une pince à préhension, ou une sonde de Dormia). D. Technique du « téléphérique » : le contrôle du guide par les deux introducteurs permet le franchissement de la bifurcation aortique par des cathéters et des stents plus rigides. E. Repositionnement du guide dans la lumière aortique, une fois la lésion franchie par voie controlatérale. On se retrouve ainsi dans les conditions d’un abord homolatéral. F. Introducteur long par voie controlatérale : il permet d’assurer la progression de stents rigides au niveau de la bifurcation aortique. F page 9 43-038-A CHIRURGIE RESTAURATRICE AORTO-ILIAQUE (I) A B C D 5 E sténose avec décrochage au niveau de la paroi artérielle, le rétrécissement se prolongeant souvent sur plusieurs centimètres. Dans les deux cas, le vrai chenal est rétréci, et il faut considérer qu’il existe une sténose résiduelle, indication à une angioplastie répétée ou, en cas de persistance, à la mise en place d’une endoprothèse. L’existence de ces anomalies pariétales, même en l’absence de gradient de pression résiduel, pose le problème de leur devenir évolutif, car rien ne prouve page 10 Techniques chirurgicales A. Lésions bilatérales des carrefours iliaques. B. Du côté droit : cathétérisme de l’axe iliaque par voie homolatérale et de l’hypogastrique par voie controlatérale. C. Résultat après angioplastie par kissing balloons. D, E. Du côté gauche : l’instabilité du guide dans l’hypogastrique a obligé à l’utilisation d’un introducteur long et courbe Balkin (Cook), pour réaliser l’angioplastie, avec un contrôle satisfaisant. que la lésion « non significative » initiale ne se majore pas par accrétion de thrombus, par réorganisation de la paroi, voire par sclérose évolutive de toutes les tuniques de la paroi (remodeling, qui a surtout été documenté en pathologie coronaire). Ces arguments incitent nombre d’auteurs à recommander la mise en place d’endoprothèses de façon systématique lors des recanalisations d’occlusions, ou à la constatation de la moindre anomalie résiduelle lors du contrôle. Techniques chirurgicales CHIRURGIE RESTAURATRICE AORTO-ILIAQUE (I) F 5 G 43-038-A H (suite). Schémas des alternatives pour la mise en place de guides. F. Deux guides. G. Guide homolatéral et introducteur long controlatéral. H. Introduction long controlatéral : la mise en place des deux guides est possible par cette voie mais la taille de l’introducteur (8 ou 9 F) impose le recours à des cathéters d’angioplastie coronaire. – Un ralentissement du flux artériel en scopie peut faire suspecter une sténose ou une dissection non visible lors de la première opacification. C’est une invitation à répéter les clichés sous plusieurs incidences pour préciser la lésion responsable et déterminer son extension en hauteur. – L’état du lit d’aval : en dehors de lésions préexistantes, mal définies par l’artériographie préopératoire, et qui peuvent justifier une angioplastie complémentaire, l’étude du lit d’aval permet de dépister une dissection avec sténose en aval d’une occlusion recanalisée, le guide étant « réentré » dans la vraie lumière artérielle, parfois plusieurs centimètres après la fin de l’occlusion. Elle peut également montrer des lésions pariétales créées à distance par le passage du guide. Enfin, les embolies distales doivent être systématiquement recherchées : elles ne sont pas toujours symptomatiques, mais exposent à une détérioration du résultat, alors que, dépistées au cours de la procédure, on peut les traiter immédiatement par thromboaspiration ou par thrombolyse. Angioplastie associée à une endoprothèse Certains profils lésionnels sont responsables d’échecs techniques initiaux de l’angioplastie ou de détérioration du résultat à court ou moyen terme. C’est dans ces indications que le recours aux endoprothèses est nécessaire. Mise en place La taille du ballon, ou la taille de l’endoprothèse, en cas de stent autoexpansible, doit correspondre au calibre souhaité en cas d’endoprothèse rigide, ou être surdimensionnée de 1 mm en cas d’endoprothèse plus flexible qui a tendance à se resserrer un peu après déploiement (recoil). C’est pourquoi il est souvent recommandé d’utiliser une endoprothèse d’un calibre de 1 à 2 mm de plus que le calibre nominal de l’artère. Certaines endoprothèses autoexpansibles n’atteindraient leur pleine expansion qu’après plusieurs heures ou plusieurs jours. Ce phénomène est loin d’être constant dans notre expérience, et nous recommandons au moindre doute de compléter l’expansion par une angioplastie au ballonnet. Il faut néanmoins prendre garde à ne pas surdilater les endoprothèses articulées de calibre fixe, car on risque des fractures du système métallique. Même s’il existe une forte probabilité d’avoir recours à une endoprothèse dès le début de la procédure (par exemple recanalisation d’occlusion), de nombreux auteurs recommandent de commencer par une angioplastie transluminale simple : la mise en place de l’endoprothèse sans angioplastie préalable nécessiterait de la part du ballon une force suffisante pour à la fois dilater la lésion et assurer l’expansion de l’endoprothèse, ce qui est très aléatoire. De plus, le passage de l’endoprothèse à frottement dur contre la paroi artérielle exposerait à sa migration le long du ballon. En revanche, d’autres auteurs recommandent le stenting primaire des occlusions, de façon à minimiser le risque embolique. Lorsqu’on doit franchir des artères sinueuses, ce qui est souvent le cas à l’étage iliaque, le cathéter risque de frotter contre la paroi en provoquant une migration de l’endoprothèse par rapport au ballon : il vaut mieux dans ce cas utiliser un introducteur long que l’on positionne à proximité de la lésion à traiter ; encore faut-il s’assurer avant inflation que le ballon sort de plusieurs centimètres de l’introducteur pour éviter le largage de l’extrémité proximale de l’endoprothèse dans l’introducteur. Si on doit couvrir une lésion longue par plusieurs endoprothèses, il vaut mieux commencer par couvrir la lésion la plus à distance de l’introducteur pour éviter le passage répété du cathéter d’angioplastie qui risquerait de déloger l’endoprothèse. Le largage des endoprothèses montées sur ballon doit se faire par une inflation progressive à faible pression pour éviter une rupture du ballon : le plus souvent 6 bars pour les endoprothèses de moins de 8 mm, moins pour les endoprothèses de calibre supérieur. En cas de rupture du ballon alors que l’endoprothèse est incomplètement déployée, on peut essayer de sauver la situation en gonflant à forte pression le ballon pour obtenir la meilleure expansion possible, puis dégonfler le ballon le mieux possible. L’inflation du ballon par du produit de contraste pur, plus visqueux, permet souvent une expansion partielle. Une autre solution est d’utiliser une inflation rapide, au besoin à l’aide d’un injecteur. Une fois l’expansion, au moins partielle, obtenue, on retire prudemment le ballon en laissant le guide en place sous contrôle scopique : si l’endoprothèse, radio-opaque, a tendance à migrer lors du retrait du cathéter, on peut tenter une nouvelle inflation, mais il faut surtout dégonfler patiemment le ballon et essayer de le « décrocher » de l’endoprothèse par de petits mouvements de va-et-vient. Une fois le cathéter retiré, il faut repasser page 11 43-038-A CHIRURGIE RESTAURATRICE AORTO-ILIAQUE (I) A B C Techniques chirurgicales D 6 Sténose aortique par bourgeon calcaire et sténose du carrefour aortique et de l’origine des deux iliaques primitives visible à l’artériographie (A, B) et au scanner (C, D) préopératoires. Échographie endovasculaire préopératoire mesurant avec précision le calibre aortique en amont de la lésion (E), montrant le bourgeon calcaire aortique (F), et la sténose du carrefour aortique (G), et mesurant le calibre de l’iliaque primitive en aval de la sténose (H). La procédure comporte, après mise en place de guides 0,035 à travers les différentes sténoses à l’aide d’un cathéter angulé type « vertébral », une angioplastie première par kissing balloons de 6 et 7 mm de diamètre de la sténose aortique (I), et du carrefour aortique (J). Les deux ballonnets sont gonflés simultanément et progressivement jusqu’à 2 atmosphères, en surveillant la tension artérielle du patient. Dans un deuxième temps, implantation d’un stent de Palmaz en position aortique (K) sur un cathéter à ballonnet de 12 mm de diamètre, et de deux stents de Palmaz en kissing (L) au niveau de la bifurcation aortique. Les ballonnets sont g