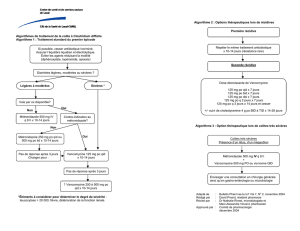
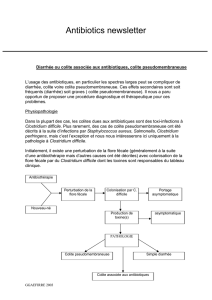
Clostridium difficile - Hôtel Dieu de France

Pr Raymond Sayegh
Chef de service de Gastro-Entérologie
Hôtel-Dieu de France
Faculté de médecine , Université Saint
Joseph

Clostridium difficile:
Diarrhées consécutives à une prise d'antibiotiques
colites pseudo-membraneuses
1ère cause de diarrhées infectieuses
nosocomiales chez les adultes
survenant volontiers sous forme d’épidémies
services à risque (réanimation, maladies infectieuses,
hématologie, gériatrie)
Incidence hospitalière:
1 à 10 pour 1 000 admissions.

Augmentation de l’incidence des ICD durant les
dernières années
Augmentation de la sévérité des formes cliniques
Evolution liée à l’émergence et à la dissémination
rapide sous forme épidémique d’un clone
particulièrement virulent de C. difficile, dénommé
027 en référence à son profil par PCR-ribotypage.
Au Liban : même impression ?

Bacille gram+ anaérobie sporulée très répandu dans
l’environnement surtout hospitalier
Spores: inactives métaboliquement, résistantes à la
chaleur, à l’acidité et aux antibiotiques, responsables des
récidives
Dans le colon, les spores se transforment en formes
végétatives:
Souches toxinogènes (pathogènes):
Production des toxines A (entérotoxine) et/ou B
(cytotoxine);
Production simultanée mais un faible pourcentage des souches
ne produisent que la toxine B
Souches non toxinogènes (non pathogènes)

Bactérie non invasive
Les toxines A et B produites par la bactérie:
- pénètrent dans l’entérocyte inactivent les protéines
de la superfamille Rho désorganisation du
cytosquelette et altération des jonctions serrées inter-
cellulaires
- induisent la production de cytokines pro-inflammatoires
(TNFα, IL1, IL6…) lésions de colite de gravité variée
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
1
/
38
100%