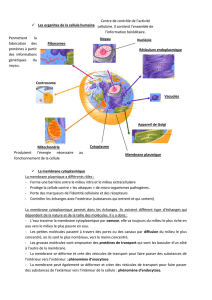
Tissus mous

1
Jason® membrane
collprotect® membrane
Membranes de collagène naturel pour la technique ROG/RTG
Preuves scientifiques et cliniques
Du PD Dr. Dr. Daniel Rothamel et collab.
Tissus mous
naturelle
fiable
résorbable
botiss
biomaterials
dental
bone &
tissue
regeneration

2
F
l
e
x
i
b
il
i
t
é
D
é
g
r
a
d
a
t
i
o
n
c
o
n
t
r
ô
l
é
e
P
o
t
e
n
t
i
e
l
b
i
o
l
o
g
i
q
u
e
F
o
r
m
a
t
i
o
n
c
l
i
n
i
q
u
e
c
o
n
t
i
n
u
e
A
c
ti
v
a
ti
o
n
mucoderm®
collprotect®
membrane
Jason®
membrane
Jason® fleece
collacone®.
Tissus durs
cerabone®
maxresorb®
Straumann®
BoneCeramic
™
maxresorb®
inject
maxgraft® bonering
maxgraft® bonebuilder
maxgraft®
EDUCATION
RECHERCHE
CLINIQUE
6 - 9
mois
6 - 9
mois
6
mois
4 - 6
mois
4 - 6
mois
3 - 4
mois
6 - 9
mois
3 - 4
mois
2 - 4
semaines
Régénération
Augmentation
Préservation
Cicatrisation
Intégration Intégration
Barrière
Résorption
2 - 3
mois
3 - 6
mois
bovin
synthétique
humain
collagène natif
collacone®..max*
Tissus mous
botiss regeneration system
cerabone®maxresorb®
inject
maxgraft®
bonering
synthétique + collagène natif
maxgraft®
bonebuilder
Bloc osseux allogénique
fait sur mesure
maxgraft®
Greffe allogénique
traitée
Pâte osseuse injectable
synthétique
maxresorb®
Phosphate de calcium
biphasique synthétique
Straumann®
BoneCeramic™
Phosphate de calcium
biphasique synthétique
Os naturel d'origine
bovine Anneau osseux
allogénique
maxresorb®
flexbone*
Bloc flexible
(Composite de
CaP / Collagène)
Straumann®
Emdogain®
Protéines de la matrice
amélaire
collacone®
max*
Cône alvéolaire
(Composite de
CaP / Collagène)
mucoderm®
Matrice tridimensionnelle
de collagène natif
Jason®
membrane
Membrane de
collagène natif issue du
péricarde porcin
collprotect®
membrane
Membrane de
collagène natif issue
du derme porcin
Jason
®
fleece /
collacone®......
Éponge de collagène
Cône de collagène
botiss academy bone & tissue days
6 - 12
mois
Régénération
Protéines de la matrice amélaire
Straumann® Emdogain®
*Prochainement disponible
maxresorb® flexbone*

3
PD Dr. Dr. Daniel Rothamel
PD Dr. med. Dr. med. dent.
Daniel Rothamel
Département de chirurgie buccale et maxillo-faciale ,
Université de Cologne,
.................................................
- En 2013, reconnaissance comme médecin spécialisé en
chirurgie maxillo-faciale
- Depuis 2010 Professeur adjoint au Département de chirurgie
buccale et maxillo-faciale, et à la polyclinique interdisciplinaire
pour la chirurgie orale et l'implantologie (Univ.-Prof. Dr. Dr.
Zöller), clinique universitaire de Cologne
- Obtention du Venia legendi pour la spécialisation « médecine
dentaire, buccale et maxillaire » à l'université de Cologne.
Titre de l'habilitation : « Thérapie des défauts du procès
alvéolaire avec blocs osseux artificiels, avec et sans utilisation
de facteurs de croissance recombinants. Examens
histomorphométriques sur modèle animal. »
- En 2008, promotion comme Dr. med., magna cum laude,
université Heinrich-Heine, Düsseldorf
Titre : « Biocompatibilité, dégradation et aspects angiogéniques
des membranes de collagène pour la régénération tissulaire
guidée»
- En 2007, reconnaissance comme médecin spécialisé en
chirurgie orale
- 2004, promotion comme Dr. med. dent., magna cum laude,
université Heinrich-Heine, Düsseldorf
Titre : « Établissement d'une nouvelle méthode de
quantification de la hypersensibilité dentinaire. »
Dès ses études de médecine, le PD Dr. Dr. Daniel Rothamel a abordé
les questions scientifiques du domaine de régénération osseuse et
d'implantologie. Il a publié plus de 80 articles dont plusieurs dans des
journaux scientifiques de renommée internationale. Il est un relecteur
pour différents journaux et participe régulièrement en tant que confé-
rencier à des congrès et des formations en Allemagne et à l'étranger.
Ses recherches et ses exposés se concentrent sur des thèmes tels
que la régénération osseuse guidée (ROG), la préservation alvéolaire,
les surfaces d'implants, les membranes de collagène, les greffes
osseuses, les facteurs de croissance, les traumatismes du visage, la
rééducation post-cancer et l'hémostase.

4
Le collagène -
une protéine polyvalente
Types de collagène
Le collagène de type I est le plus largement répandu et a la plus grande
proportion quantitative dans le corps. C'est une protéine fibrillaire du
tissu conjonctif qui est présente le plus souvent dans la peau, les os,
les tendons, les ligaments et les fibrocartilages mais également dans
les organes internes et leurs enveloppes de tissu conjonctif comme par
ex. le sac péricardique (péricarde) ou la membrane abdominale (péri-
toine). Le tissu conjonctif gingival se compose d’env. 60% de collagène
de type I. Les autres principaux collagènes sont les collagènes de type
II, III et IV. Le collagène de type II est une composante importante de
la matrice extracellulaire des cartilages hyalins et élastiques. Le colla-
gène de type III est également appelé élastine et est responsable des
propriétés élastiques des vaisseaux sanguins et de nombreux tissus
tels que la peau et les tissus pulmonaires. Le collagène de type IV est
l'élément structurel le plus important de la lame basale.
Une coloration histologique de la peau montre le
réseau dense de fibres de collagène
Réseau des fibres de collagène d'une
éponge de collagène en derme d'origine
porcine
Les collagènes sont une famille de protéines structurelles de la ma-
trice extracellulaire. Ils forment la composante principale de la peau,
des vaisseaux sanguins, des tendons, des cartilages, des os et des
dents. 25% des protéines du corps sont des collagènes. Dans les
tissus conjonctifs, ils composent à eux seuls 80% des protéines.
On connaît env. 28 types de collagène différents se différenciant
dans la séquence primaire de leurs chaînes peptidiques1.
Les chaînes peptidiques se lient par trois en une triple hélice et for-
ment une fibrille de collagène. La liaison de plusieurs de ces fibrilles
crée les fibres de collagène. Ces fibres ont une grande résistance à
la déchirure ; la résistance à la traction des tendons et les propriétés
flexibles de l'os reposent sur la stabilité des fibres de collagène. Les
collagènes sont synthétisés par des cellules spécialisées telles que
les fibroblastes et les ostéoblastes.
Présence des collagènes les plus répandus
Collagène de type I Peau, os, tendons
ligaments, fibrocartilages et cornée
Collagène de type II Tendons (hyalins et élastiques),
disques intervertébraux et corps vitré
Collagène de type III Peau et système cardio-vasculaire
Collagène de type IV Lame basale
1 Brown JC, Timpl R.,The collagen superfamily.
Int Arch Allergy Immunol. 1995 Aug;107(4):484-90.

5
La technique ROG/RTG
Membranes de collagène
pour la ROG et la RTG
Les membranes de collagènes sont employée depuis de nombreuses années déjà
dans la régénération tissulaire guidée (RTG) et la régénération osseuse guidée (ROG).
Le principe de cette technique repose sur le placement d'une membrane-barrière afin
de séparer les cellules régénératives à prolifération lente telles que les ostéoblastes et
les cellules parodontales, des cellules d'épithélium et du tissu conjonctif á prolifération
rapide et ainsi de permettre une régénération prévisible des tissus perdus.
1 Brown JC, Timpl R.,The collagen superfamily.
Int Arch Allergy Immunol. 1995 Aug;107(4):484-90.
2 Rothamel D, Schwarz F, Sager M, Herten M, Sculean A, Becker J. Biodegradation of differently cross-linked colla-
gen membranes: an experimental study in the rat. Clin Oral Implants Res 2005;16:369-78
La technique RTG sert à régénérer le parodonte. La mise en place d'une membrane-
barrière entre l'épithélium et la dent permet de donner du temps et de l'espace à la
régénération des cellules du ligament parodontal. Pour la technique ROG, les mem-
branes sont la plupart du temps utilisées avec des greffes osseuses. La membrane
est placée sur un défaut osseux et celui-ci est comblé avec une greffe osseuse em-
pêchant l'effondrement de la membrane dans le défaut et servant d’échafaudage
ostéoconducteur pour la croissance des cellules osseuses (ou cellules précurseurs
de l’os). Cette membrane-barrière empêche la pénétration des tissus mous dans
l'espace du défaut et l’encapsulation de la greffe osseuse dans des tissus conjonctifs
et permet ainsi une régénération osseuse complète du défaut.
Régénération tissulaire guidée (RTG) Régénération osseuse guidée (ROG)
Types de membranes
Exigences concernant les
membranes-barrières
- Biocompatibilité
- Intégration de tissus
- Occlusion cellulaire
- Stabilité dimensionnelle
- Manipulation aisée
La première génération de membranes-barrières se composait de
matériaux non résorbables comme le polytétrafluoroéthylène expansé
(ePTFE) et l'acétate de cellulose ou le titane. Ces membranes ont per-
mis d'obtenir de bons résultats prédictibles, mais leur emploi nécessi-
tant une deuxième intervention chirurgicale pour retirer la membrane,
la demande d'une membrane résorbable se fit bientôt entendre. Des
polymères synthétiques comme le polyglycolique et le polylactide ainsi
que des membranes à base de polymère naturel et de collagène fu-
rent utilisés comme matériaux résorbables pour la fabrication de mem-
branes. Aujourd'hui, les nombreuses propriétés positives et naturelles
du collagène ont permis d'imposer distinctement l'utilisation de mem-
branes en collagène par rapport aux autres membranes2.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
1
/
24
100%