A quick introduction to the hands-on training

TRAVAUX PRATIQUES
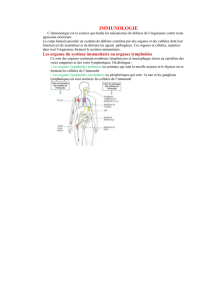
Etude transcriptomique des organes lymphoïdes chez la souris
Parmi les organes lymphoïdes on distingue (i) les organes lymphoïdes primaires, dans
lesquels les cellules du système immunitaire se développent (moelle et thymus) et (ii) les organes
lymphoïdes secondaires qui sont le siège de l'activation des lymphocytes par les antigènes (e.g. ;
ganglions lymphatiques, amygdales, rate). Au cours de ce TP, nous vous proposons de comparer les
transcriptomes de deux organes lymphoïdes : le thymus et la rate. Nous chercherons par l'analyse
transcriptomique à révéler les particularités fonctionnelles de ces deux organes.
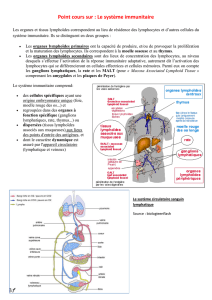
Le thymus est un organe lymphoïde primaire où se déroule la maturation lymphocytaire T. Il
coordonne les événements qui conduisent à la formation d’un répertoire de lymphocytes T
fonctionnels à partir de cellules souches hématopoïétiques. La maturation lymphocytaire T est sous
l’étroit contrôle du micro-environnement thymique constitué de cellules stromales appelées aussi
cellules « résidentes ». Ces cellules constituent une population hétérogène, formée de cellules
épithéliales, cellules dendritiques, macrophages et fibroblastes, organisée sous forme d’un réseau
tridimensionnel (van Ewijkk et al. 1999). Elles expriment de nombreux marqueurs de surface et
sécrètent des cytokines nécessaires au développement et à la maturation orientée (de la sous capsule
vers la médulla) des cellules T (Norment et al. 2000; Anderson et al. 2000). Ainsi, les thymocytes
interagissent étroitement avec les cellules du stroma thymique. De façon réciproque, le maintien et le
développement de ce microenvironnement sont contrôlés par la présence des cellules T, ce
phénomène est appelé « crosstalk » (Holländer et al. 1995). Au cours de leur migration dans le
thymus, les thymocytes subissent de nombreuses étapes de différenciation caractérisées par des
changements phénotypiques successifs. Ainsi, la différenciation des thymocytes est définie
principalement par l’expression des marqueurs CD4 et CD8 et le degré de réarrangement des
différents gènes codant pour le TCR (T cell receptor). Dans le thymus adulte, on peut définir trois
grandes populations cellulaires: CD4-CD8- (double négatif DN, 5% du pool total des thymocytes),
CD4+CD8+ (double positif DP, 80%) et CD4+ ou CD8+ (simple positif SP, 15%) (Fig 1).
La structure et l'organisation de la rate diffère par de nombreux aspect des autres organes
lymphoïdes secondaires. Ces différences sont liées notamment au fonctions complexes associées à
cet organe : filtration sanguine et rôle de sentinelle vis à vis des pathogènes. La rate contient des
éléments tissulaires lymphoïdes compartimentés (la pulpe blanche) dont l'organisation ressemble à
celle des ganglions lymphatiques. Au contraire, la pulpe rouge est un système très vascularisé riche
en macrophages qui joue un rôle important dans l'élimination des érythrocytes (notamment dans des
conditions pathologiques).
L 'analyse sera réalisée à l'aide de microarrays Agilent qui permettent de mesurer
l'abondance des mRNAs mais aussi d'une autre catégorie de transcrits, les LncRNAs (Long Non
Coding. Par ailleurs, nous contrôlerons les résultats obtenus par microarrays à l'aide d'une PCR en
temps réel. Le contrôle choisi est le gène TBata/Spatial connu pour être fortement exprimé dans le
thymus.
1

PLANNING
9h-12h 13h-18h
Lundi - Présentation du TP
- Présentation des locaux
- Extraction ARNs
- Lecture protocole hybridation microarrays
- DO ARNs.
- Migration sur gel .
- Contrôle qualité au Bioanalyzer
- Lecture protocole hybridation microarrays
Mardi - Préparation des Spikes (M)
- Denaturation, annealing (M)
- Rétro-transcription ARNs (M).
- Transcription in vitro (M)
- Rétro-transcription ARNs (Q).
- Arrêt transcription in vitro (M, congélation)
Mercredi - Purification de la sonde.
- Contrôle d'incorporation
- Hybridation
- Analyse des données de microarrays.
- Introduction à R.
- Lecture des fichiers de quantification
- Normalisation.
- Diagrammes avec R.
- Analyse fonctionnelle.
Jeudi - PCR en temps réel (Q).
- Scan et quantification (M)
- Principes de l'analyse des résultats (Q).
Vendredi - Analyse des résultats (M) - Préparation du rapport.
REFERENCES BIBLIOGRAPHIQUES
Anderson G, Harman BC, Hare KJ and Jenkinson EJ. Microenvironmental regulation of T cell
development in the thymus. Semin.Immunol 2000; 12: 457-464.
Holländer GA, Wang B, Nichogiannopoulou A et al. Developmental control point in induction of thymic
cortex regulated by a subpopulation of prothymocytes. Nature 1995; 373: 350-353.
Norment AM and Bevan MJ. Role of chemokines in thymocyte development. Semin.Immunol 2000;
12: 445-455.
Van Ewijk W, Wang B, Holländer G et al. Thymic microenvironment, 3-D versus 2-D? .
Semin.Immunol 1999; 11: 57-64.
2
1
/
2
100%