Revision de Noël

Exercices de révision pour l’examen de Noël - Chimie 534
1. Donnez la masse molaire des gaz suivants :
Diazote : _______________ Dioxygène : _______________
Difluor : _______________ Ammoniac : _______________
Dioxyde de soufre : _______________ Dioxyde de carbone : _______________
2. Qu’appelle-t-on volume molaire ?
3. Transformer en degrés Kevin (K) une température évaluée à 60° C.
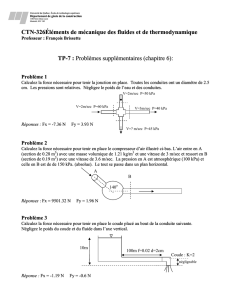
4. Un récipient contient 5,00 mol de diazote, N2, 3,00 mol de dioxyde de carbone, CO2, et 2,00
mol de dioxygène, O2. La pression totale du mélange gazeux est de 125 kPa. Quelle est la pression
partielle exercée par le dioxygène, O2 ?
5. Un cylindre contient 1 mole de dihydrogène, H2, et 3 moles d’hélium, He. La pression partielle
de H2 est de 100 kPa. Quelle est la pression totale du mélange gazeux ?
a) 250 kPa c) 400 kPa
b) 133 kPa d) 700 kPa
6. Quel est le nombre de moles de HF(g) occupant un volume de 400 ml à 320 K et à la pression
de 250 kPa ?
7. Un ballon contient un mélange formé de 4,00 mol de dioxyde de carbone, CO2, et 1,00 mol de
krypton, Kr, gazeux. Si la pression totale du mélange est de 76 kPa, quelle est la pression partielle
exercée par le krypton ?
a) 15,2 kPa c) 19,0 kPa
b) 60,8 kPa d) 38,0 kPa
8. Un ballon contient 4 moles de CO2(g), 32 grammes de O2(g) et 3 x 1023 molécules de
Cl2(g). Le manomètre indique une pression totale de 220 kPa. Quelle est la pression partielle du dichlore
?
9. Pourquoi faut-il réchauffer le gaz dans le ballon de la montgolfière ?
10. a) Qu’est-ce que la diffusion d’un gaz ?
b) Quelle est l’influence d’une augmentation de la température sur la vitesse de diffusion
d’un gaz ?
11. a) Quel sera le volume occupé par 0,2 mole d’hélium (He) gazeux à une température de
100°C et à une pression de 300 kPa ? (R = 8,31 kPa 1/mol K)
b) Énumérer les facteurs qui influencent le volume d’un gaz.
12. Quelle est la masse molaire de 5,4 g d’un gaz occupant un volume de 4,8 litres à 30°C et
soumis à une pression de 50 kPa ?

13. Le volume molaire d’un gaz parfait à 25°C et 101 kPa est de 24,5 litres. Quel sera le volume
de ce gaz à 0°C et 101,325 kPa ?
14. Quelles sortes de mouvements moléculaires trouve-t-on
a) À l’état gazeux ?
b) À l’état liquide ?
15. Le volume d’un gaz dans un ballon est de 1200 ml à une pression et à une température
absolue données. Quelle sera la pression si le volume diminue de moitié, que la température absolue
triple et qu’on laisse échapper la moitié des molécules du ballon ?
16. Combien de moles de gaz méthane, CH4, occuperont un volume de 500 ml à la température
de 25°C et à la pression de référence (101,325 kPa) ? (R = 8,314 kPa 1/mol K)
17. Une masse de 24 g d’un gaz ayant une masse molaire de 72 g occupe un volume de 650 ml à
la température de 50°C. Quelle est la valeur de la pression à ces conditions ? (R = 8,314 kPa l / mol
K)
18. a) Quel sera le volume molaire d’un gaz à 323 °K et à la pression de 202 kPa ?
b) Combien de molécules du gaz trouve-t-on à ces conditions ?
19. Un réservoir en acier contient 150 mol d’argon, à 25°C et à 7,5 MPa. Après avoir utilisé une
certaine quantité d’argon, on note que la pression est réduite à 2,0 MPa et la température, à 19°C.
Quelle masse d’argon reste-t-il dans le réservoir ?
20. Un ballon de 5,0 l contient 0,6 g de O2, à 22°C. Quelle est la pression (en kPa) dans le ballon?
21. Un ballon de 2,0 l contient de l’hélium, à 91,3 kPa et à 0°C. Quelle est la pression dans le
ballon lorsque :
a) La température monte à 150°C ?
b) La température baisse à 77 K?
22. Un cylindre de gaz comprimé, à 13,7 MPa et à 27°C, est situé dans une pièce où un incendie
fait rage. La température monte à 477°C. Quelle est la nouvelle pression dans le cylindre ?
23. On gonfle le pneu d’une bicyclette avec de l’air à une pression de 610 kPa, à une température
de 19°C. En circulant à bicyclette sur l’asphalte par une journée chaude, on fait augmenter la
température du pneu à 58°C. Le volume du pneu augmente de 4%. Quelle est la nouvelle pression
dans le pneu ?
24. En 1983, la production annuelle d’ammoniac aux Etats-Unis fut de 1,24 x 1010 kg (Chemical
and Engineering News, 7 mai 1984). En supposant que le rendement soit de 100%, calculer les volumes
de N2 et de H2, mesurés dans les conditions TPN, nécessaires pour qu’il y ait production d’une telle
quantité d’ammoniac. La réaction est la suivante :
N2(g) + 3 H2(g) 2 NH3(g)

25. Pour produire du dioxygène, Joseph Priestley utilisa la réaction de décomposition thermique de l’oxyde
de mercure (II).
2 HgO(s) 2 Hg(l) + O2(g)
Quel volume de dioxygène, mesuré à 30°C et 96,7 kPa, peut-on produire grâce à la décomposition
complète de 4,1 g d’oxyde de mercure ?
26. Quel est le volume d’ammoniac formé à 360 K sous une pression de 109 kPa lorsqu’on fait
réagir 0,12 gramme de dihydrogène avec du diazote (si la réaction a lieu à 100%) ?
N2(g) + 3 H2(g) 2 NH3(g)
27. Au cours d’une transformation qui a eu lieue dans un bécher contenant 1 litre d’eau, il y a eu élévation de 30 à
35°C de la température. Calculez la chaleur de la réaction qui s’est produite.
28. Pour s’amorcer, une réaction chimique donnée a besoin de 12 KJ. Une fois commencée, la
réaction dégage 136 KJ/mol.
a) Est-ce une réaction exothermique ou endothermique ?
b) L’enthalpie des réactifs est-elle supérieure ou inférieure à celle des produits ?
29. On dissout 2,14 g de NH4 CL(s) dans 400 ml d’eau . On note une baisse de température de
2,0°C. La capacité thermique de l’eau est de 4,19 J/g °C. Calculer la quantité de chaleur absorbée au
cours de la dissolution d’une mole de NH4Cl(s).
30. Lesquelles des données suivantes caractérisent une réaction endothermique ?
a) Un ΔH négatif
b) Un dégagement de chaleur
c) H réactifs H produits
d) Une absorption de chaleur
e) H produits H réactifs
31. Qu’est-ce que l’enthalpie d’une substance ?
32. Qu’est-ce que la chaleur molaire de dissolution d’une substance ?
33. Dans une éprouvette, on fait dissoudre une substance granuleuse blanche dans l’eau. Au
toucher, l’éprouvette est froide. Que peut-on conclure ?
34. Vincent plonge un bloc de 50,0 g d’argent chauffé à 95,0 °C dans 250 ml d’eau à 20,0 °C. Si l’on considère que le
système est isolé, quelle sera la température de l’eau après quelques minutes ?
35. Trouvez la variation d’enthalpie des équations thermochimiques des réactions suivantes.
a) C3H8(g) + 5 O2(g) 3CO2(g) + 4 H2O(g)
b) C8H18(l) + 25/2 O2(g) 8 CO2(g) + 9 H2O(g)
36. La combustion de l’éthane (C2H6(g)) donne du dioxyde de carbone (CO2(g)) et de l’eau (H2O(g)).
A. Écrivez l’équation balancée de cette réaction.
B. Quelle est la chaleur impliquée dans cette réaction ?

37. Gaëlle dépose un morceau de glace sèche ayant une masse de 1,60 g dans une boîte de styromousse de 25 L aux
conditions ambiantes de température et de pression. La glace sèche a la particularité de se sublimer selon l’équation
suivante :
CO2(s) → CO2(g) ∆H = +25,2 kJ
Quelle sera la température finale de l’air dans la boîte lorsque toute la glace sèche se sera sublimée ? (On considère
qu’il n’y a pas d’échange d’énergie avec le milieu environnant.)
Masse volumique de l’air : 0,0013 g/ml
Capacité thermique massique de l’air : 1,00 J/g°C
Réponses
1. Diazote :28g Dioxygène : 32g
Difluor : 38g
Ammoniac : 17g
Dioxyde de soufre : 64g Dioxyde
de carbone : 44g
2. Le volume d’une mole d’une substance
3. 333 0K
4. 25 kPa
5. c
6. 0,038 mol
7. a
8. 20 kPa
9. En le chauffant, le gaz augmente de volume.
Comme le nombre de molécule ne change
pas, le gaz devient moins dense. Il devient
donc plus léger que l’air plus froid autour et il
s’élève.
10. a) Un déplacement sous forme de translation
des molécules de ce gaz.
b) Plus la température est élevée, plus les gaz
se déplacent rapidement.
11. a) 2,07 litres
b) La température, la pression, le nombre de
mole
12. 56,66 g/mol
13. 22,37 litres
14. a) translation, rotation et vibration
b) rotation, vibration et un peu de translation
15. 3 fois plus grande
16. 0,02 mol
17. 1376,48 kPa
18. a) 13,29 L/mol
b) 6,023 x 1023 molécules
19. 40,8 mol 1630,8 g
20. 9.19 kPa
21. a) 141,46 kPa b) 25,75 kPa
22. 34,25 Mpa
23. 664,8 kPa
24. H2 = 2,44 x 10
11 litres N
2 = 8,06 x 10
10
litres
25. 0,247 litres
26. 1,09 litres
27. -20,95 kJ
28. a) Exothermique b) supérieur
29. 83,8 kJ
30. d, e
31. La quantité de chaleur contenue dans la
substance.
32. La quantité de chaleur qui est transférée lors
de la dissolution d’une mole de substance.
33. La dissolution est une réaction
endothermique. Le système a enlevé de la
chaleur au milieu.
34. 20,8 0C
35. a) –1686 kj
b) –4166 kj
36. a) 2 C2H6(g) + 7 O2(g) 4 CO2(g) + 6 H20(g)
b) –2380 kj
37. La température finale de l’air dans la boîte sera de
–3,2 °C.
1
/
4
100%