L’index de pression systolique : marqueur de risque cardiovasculaire ?

Correspondances
en Risque CardioVasculaire
Directeur de la publication
Claudie Damour-Terrasson
Directeur scientifique
Michel Komajda
Rédacteur en chef
Philippe-Gabriel Steg
Rédacteur en chef adjoint
Farzin Beygui
Web editor
P. Henry
Comité de rédaction
P. Abastado • A. Avignon • T. Simon
D. Chemla • T. Couffinhal • M. Elbaz
J. Julien • F. Philippe • C. Piot
Conseillers scientifiques
P. Amarenco • E. Bruckert
B. Charbonnel • M. Farnier • X. Girerd
A. Grimaldi • H. Hanaire-Broutin
D. Thomas
Société éditrice : DaTeBe SAS
Président-directeur général
Claudie Damour-Terrasson
Rédaction
Secrétaire générale de la rédaction :
Magali Pelleau
Première secrétaire de rédaction :
Laurence Ménardais
Secrétaire de rédaction :
Maylis Voitellier
Rédactrices-réviseuses : Cécile Clerc,
Sylvie Duverger, Muriel Lejeune,
Odile Prébin
Infographie
Premier rédacteur graphiste :
Didier Arnoult
Responsable technique :
Virginie Malicot
Rédacteurs graphistes :
Mathilde Aimée, Christine Brianchon,
Rémy Tranchant
Dessinatrices d’exécution :
Stéphanie Dairain, Christelle Ochin
Commercial
Directeur du développement commercial :
Sophia Huleux-Netchevitch
Directeur des ventes : Chantal Géribi
Directeur d’unité : Nathalie Bastide
Régie publicitaire
et annonces professionnelles
Valérie Glatin
Tél. : 01 46 67 62 77 – Fax : 01 46 67 63 10
Abonnements
Florence Lebreton (tél. : 01 46 67 62 87)
2, rue Sainte-Marie, 92418 Courbevoie Cedex
Tél. : 01 46 67 63 00 – Fax : 01 46 67 63 10
E-mail : [email protected]
Site Internet : http://www.edimark.fr
Photos : © Wangler - © Gautier Willaume - DR
Correspondances en Risque CardioVasculaire - Vol. VI - n° 1 - janvier-février-mars 2008
3
éditorial
L’index de pression
systolique :
marqueur de risque
cardiovasculaire ?
1
The ankle-brachial index as a marker
of cardiovascular disease mortality
❒ C. Mounier-Vehier*, G. Rosey*, P. Marboeuf*, M. Gras*,
J.P. Beregi**, S. Haulon***
1 © La Lettre du Cardiologue 2007;409:3-6.
* Service de médecine vasculaire et HTA.
** Service de radiologie vasculaire.
*** Service de chirurgie vasculaire.
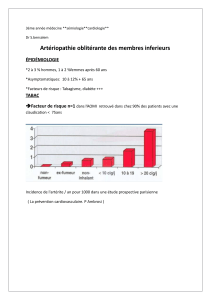
L’artériopathie oblitérante des membres inférieurs (AOMI) est un authen-
tique marqueur de mortalité cardiovasculaire
(1-4)
. Elle est largement
sous-estimée, en raison de la part importante de patients (entre 60 et
80 %) ne présentant aucun symptôme apparent. Sa prévalence ajustée à l’âge est
d’environ 12 % ; elle augmente avec l’âge, concernant 18 % des plus de 65 ans
(1-4).
Comparativement à des sujets témoins, les claudicants ont une diminution de leur
espérance de vie de 50 % à 10 ans ; leur pronostic est conditionné principalement
par les accidents coronaires (RR infarctus du myocarde x 4 ; 55 % des décès), les
accidents vasculaires cérébraux (AVC) (RR x 2-3 ; 15 % des décès) ou néoplasiques
(25 % des décès)
[1-3]
. L’objectif du dépistage est de diminuer les conséquences
locales altérant la qualité de vie et d’enrayer la progression de la maladie générale
par un traitement approprié.
L’index de pression systolique à la cheville :
outil d’évaluation du risque cardiovasculaire
Les recommandations de la Haute autorité de santé (HAS)
[5]
ainsi que les recom-
mandations américaines
(6)
préconisent l’utilisation de la mesure des index de
pression systolique (IPS) à la cheville comme outil de dépistage précoce, fi able, peu
onéreux et accessible. La mesure des IPS permet d’évaluer le degré de sévérité de
l’AOMI avec une corrélation constante entre l’IPS et la sévérité des lésions. La mesure
de l’IPS permet aussi une évaluation pertinente du pronostic des patients à risque,

Figure 1. Technique de mesure des index de pression systolique à la
cheville.
Enregistrement du pouls huméral
Enregistrement
des pouls jambiers
Tensiomètre posé juste
au-dessus des malléoles
• Prendre 3 fois la mesure
• Faire la moyenne
Correspondances en Risque CardioVasculaire - Vol. VI - n° 1 - janvier-février-mars 2008
4
éditorial
bien avant l’apparition de la claudication artérielle (CA). La mesure de l’IPS est
réalisée avec un appareil doppler continu et un appareil de mesure tensionnelle
classique (sphygmomanomètre anéroïde ou à mercure). Chez un patient en position
couchée, le brassard est gonfl é au-dessus des malléoles, au-dessus de la valeur
de la pression artérielle systolique (PAS), le fl ux ayant été repéré au préalable à la
sonde doppler. À la levée de la compression du brassard, on repère à quel niveau de
PAS réapparaît le fl ux. Trois mesures sont nécessaires, avec le calcul de la moyenne
des deux dernières mesures sur les deux sites : tibial postérieur et pédieux. Seule
la valeur la plus élevée est retenue. La PAS humérale est mesurée aux deux bras
selon la même méthodologie, en retenant la valeur moyenne la plus élevée. L’IPS
correspond au rapport entre la PAS à la cheville et la PAS humérale (fi gure 1). L’IPS
est une variable physiologique fl uctuant dans une certaine fourchette de valeurs
dont la normale est de 1,10 ±± 0,10. Les seuils de normalité sont 0,9 et 1,3 (tableau).
Tableau. Classification hémodynamique tenant compte de la mesure de
l’IPS.
IPS Interprétation clinique
> 1,3
0,9-1,3
0,75-0,9
0,4-0,75
< 0,4
Médiacalcose
État normal sur le plan hémodynamique
AOMI compensée
AOMI décompensée
Ischémie chronique critique
IPS : index de pression systolique.
AOMI : artériopathie oblitérante des membres inférieurs.
Un rapport inférieur à 0,9 signe une AOMI avec une sensi-
bilité de 95 % et une spécifi cité voisine de 100 % ; une valeur
supérieure à 1,3 témoigne d’artères incompressibles et
défi nit une médiacalcose jambière partielle, fréquemment
observée chez le sujet diabétique, âgé ou encore insuffi -
sant rénal. Un IPS inférieur à 0,40 indique, dans la majorité des cas, la nécessité
d’un geste de revascularisation. La combinaison de signaux doppler normaux et
d’un IPS à la cheville normal exclut une AOMI avec une fi abilité supérieure à 90 %.
D’un examen à l’autre, une variation de l’IPS inférieure à 15 % peut être due à une
erreur de mesure ou à une variation physiologique. En revanche, une variation
supérieure ou égale à 30 % est hautement signifi cative. La mesure des IPS reste
sous-utilisée, conduisant à un diagnostic tardif de l’AOMI ou à sa méconnais-
sance
(2, 7)
. Son utilisation plus systématique permettrait de dépister cinq fois
plus d’AOMI, notamment chez les patients âgés et sédentaires. L’examen clinique
classique sous-estime la prévalence de l’AOMI. Celle-ci, défi nie par un IPS inférieur
à 0,90, est de l’ordre de 20 % des sujets âgés de plus de 50 ans dans la population
générale. Elle augmente avec l’âge (multipliée par 5 après 65 ans), avec le diabète,
et chez l’insuffi sant rénal
(4, 5, 7).

4
3
2
1
0
IDM Angor ICC AVC AIT
Risque relatif
< 0,9-1,0 < 0,8-0,9 < 0,8
Newman AB et al. Circulation 1993;88:837-45.
Figure 2. Risque relatif d’événements cardiovasculaires en fonction des
valeurs d’IPS.
1,0
0,9
0,8
0,7
0,6
0,5
0,4
0,3
010 20 30 40 50 60
Survie en mois
Survie cumulée
IPS
0,50-0,91
0,31-0,49
≤ 0,30
Mc Dermott MM et al. J Gen Intern Med 1994;9:445-9.
Figure 3. Index de pression systolique à la cheville et mortalité.
Correspondances en Risque CardioVasculaire - Vol. VI - n° 1 - janvier-février-mars 2008
5
L’IPS permet aussi de classifi er le risque cardiovasculaire (RCV). L’IPS est également
un marqueur d’athéromatose diffuse et d’événements cardiovasculaires (fi gure 2)
[8-10]
. Il existe une relation linéaire signifi cative entre la sévérité de l’AOMI défi nie
par l’IPS et la mortalité (fi gure 3)
[10]
. Dans la Cardiovascular Health Study, 5 714 sujets
âgés de 65 ans ont été suivis pendant 6 ans ; le risque de maladie cardiovascu-
laire était d’autant plus important que l’IPS était faible. Les sujets ayant un IPS
inférieur à 0,8 versus les sujets dont l’indice était compris entre 1,0 et 1,5 avaient
deux fois plus souvent un antécédent d’IDM, d’angor, d’insuffi sance cardiaque,
d’AVC ou d’accident ischémique transitoire
(8)
. Dans l’étude CAPRIE, l’analyse des
2 180 patients atteints d’une AOMI symptomatique rapporte qu’un faible IPS est
un indicateur important du risque de survenue d’un événement cardiovasculaire
(AVC ischémique, IDM ou décès d’origine vasculaire) ; chaque diminution de 0,1 de
l’indice s’accompagne d’une augmentation signifi cative de 10,2 % du risque relatif
d’événements cardiovasculaires. Pour un indice inférieur à 0,5, le taux annuel
d’événements cardio-vasculaires est de 5,4 % versus 4,1 % pour un indice compris
entre 0,5 et 0,85
(11).
Des études récentes, fondées sur des échantillons représentatifs de la population
générale, ont montré que l’existence d’une AOMI asymptomatique avec un IPS
inférieur à 0,90 témoignait d’un risque vital d’accident cardiovasculaire analogue
à celui d’un patient claudicant de même IPS
(2)
.
La mortalité cardiovasculaire annuelle était de 2 % avec une incidence annuelle
d’IDM de 3 % et d’AVC de 1 à 2 % chez les patients ayant un IPS inférieur à 0,90. L’inci-
dence annuelle de mortalité cardiovasculaire était de 3 à 4 % pour un IPS inférieur
à 0,70 (2). Cependant, un IPS supérieur à 1,3 était aussi associé à un risque accru
d’événements cardiovasculaires (3, 5, 6
,
9). Il y a ainsi une véritable courbe en U
entre l’IPS et les événements cardiovasculaires entre les valeurs-seuils de 0,9 et

Correspondances en Risque CardioVasculaire - Vol. VI - n° 1 - janvier-février-mars 2008
6
éditorial
de 1,3
(9)
[fi gures 2 et 3]. La classifi cation du RCV chez le sujet artériopathe repose
aussi sur l’évaluation des facteurs de risque cardiovasculaire (FRCV) classiques
et sur un bilan d’extension vasculaire a minima
(3, 5, 6)
. L’existence d’une AOMI
implique la recherche d’antécédents, de symptômes ou de signes cliniques cérébro-
vasculaires ou coronariens qui auraient pu passer inaperçus. Une échographie de
l’aorte abdominale (recherche d’un anévrysme) et un ECG de repos sont justifi és. Un
test coronaire non invasif est souhaitable chez le sujet avec FRCV. Un écho-doppler
cervical peut être proposé à la recherche d’une sténose asymptomatique de degré
supérieur à 60 % pouvant relever d’une indication chirurgicale
(5)
.
Les conséquences thérapeutiques d’un IPS altéré
Une AOMI doit être prise en compte au même titre qu’une atteinte coronaire ou
cérébrovasculaire. Il s’agit d’optimiser la prise en charge des FRCV. Ces mesures
nécessitent une contractualisation dans le temps avec le patient sur les objectifs
thérapeutiques à atteindre :
arrêt du tabac, qui nécessite une évaluation du degré des dépendances physique
et psycho-comportementale avec une approche comportementale, complétée si
besoin par une aide pharmacologique ;
surcharge pondérale : prise en charge spécifi que pour un index de masse corpo-
relle inférieur à 25 kg/m2 ;
diabète : équilibre glycémique (HbA1c < 6,5 %) ;
dyslipidémie : régime adapté, instauration ou adaptation posologique d’un
traitement par statines (LDL-cholestérol ≤ 1 g/l) ;
HTA : PA inférieure à 140/90 mmHg, inférieure à 130/80 mmHg en cas de diabète ou
d’insuffi sance rénale, inférieure à 125/75 mmHg en cas de protéinurie associée ;
pratique d’une activité physique quotidienne d’intensité modérée (marche)
pendant au moins 30 mn.
La mise en place d’une éducation thérapeutique structurée est justifi ée par la
nécessité de changements de mode de vie importants, d’une bonne observance aux
traitements et du diagnostic précoce des autres localisations cardiovasculaires ;
dans l’idéal, celle-ci s’intègrera dans un réseau de santé, comme c’est le cas dans
le Nord-Pas-de-Calais avec HTA Vasc
(5)
.
Le RCV étant comparable, que l’AOMI soit symptomatique ou non, la HAS recom-
mande d’“instaurer un traitement médicamenteux au long cours afi n de prévenir
la survenue d’événements cardiovasculaires, bien que les données disponibles
dans la littérature ne permettent pas de préciser dans quelles conditions l’asso-
ciation des différents traitements peut être recommandée”. Celui-ci comportera
au minimum : antiagrégant plaquettaire (aspirine à faible dose : 75 à 160 mg/j, ou
clopidogrel : 75 mg/j, qui est le seul à avoir l’AMM pour l’AOMI) ; statine (simvas-
tatine : 40 mg/j) ; inhibiteur de l’enzyme de conversion de l’angiotensine (IEC)
(ramipril à 10 mg/j) d’instauration progressive par paliers de 2 à 4 semaines sous
➤
➤
➤
➤
➤
➤

Correspondances en Risque CardioVasculaire - Vol. VI - n° 1 - janvier-février-mars 2008
7
surveillance de la pression artérielle et de la créatininémie. En cas d’intolérance
aux IEC, les antagonistes des récepteurs à l’angiotensine 2 pourront être utilisés
(4)
. Les bêtabloquants, prescrits dans le cadre du traitement BASIC chez le sujet
athéromateux, ne sont pas contre-indiqués dans l’AOMI compensée
(12)
.
Conclusion
Symptomatique ou non, l’AOMI, diagnostiquée par la mesure de l’IPS, doit être
considérée comme un véritable marqueur de RCV, plaçant ces patients en situation
de prévention secondaire. La majorité des patients va décéder d’une complication
cardiovasculaire ou d’une affection tumorale favorisée par le tabac. L’IPS remplit
toutes les conditions d’un test fi able de dépistage et est aussi un marqueur pronos-
tique. L’IPS doit être réalisé chez toute personne, homme ou femme, présentant un
ou plusieurs des FRCV suivants : âge supérieur à 65 ans, HTA, tabac, diabète, dysli-
pidémie
(13)
. Une première campagne d’information grand public s’est déroulée en
2006-2007 sur le diagnostic de l’AOMI à l’initiative de la Société française de médecine
vasculaire, avec le soutien de l’Institut de l’athérothrombose. La deuxième campagne
démarrera le 8 novembre 2007 pour informer l’usager des facteurs de risque de
l’AOMI, devant l’inciter à un test de dépistage (mesure de l’IPS) en présence d’un
ou plusieurs d’entre eux. Informer, dépister, éduquer et traiter sont les challenges
forts de la prévention cardiovasculaire en 2007 chez tout patient à risque. ■
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Ciminiello C. Peripheral arterial disease. Epidemiology and pathophysiology. Thromb Res 2002;106(6):V295-V301.
2. Carpentier PH, Boissier C, Vanzetto G et al. Épidémiologie de l’artériopathie oblitérante des membres inférieurs. Arch
Mal Cœur et vaiss 2005;98(Special IV):55-64.
3.
Adam DJ, Bradbury AW. TASC II document on the management of peripheral arterial disease. Eur J Vasc Endovasc
Surg 2007;33(1):1-2.
4. Murabito JM, D’Agostino RB, Silbershatz H, Wilson WF. Intermittent claudication. A risk profi le from The Framingham
Heart Study. Circulation 1997;96(1):44-9.
5. Recommandations pour la pratique clinique. Prise en charge de l’artériopathie chronique oblitérante athéroscléreuse
des membres inférieurs (indications médicamenteuses, de revascularisation et de rééducation). www.has-sante.fr
6.
ACC/AHA 2005. Task force on practice guidelines for the management of patients with peripheral arterial disease.
www.acc.org
7. Boccalon H, Lehert P, Mosnier M. Assessment of the prevalence of atherosclerotic lower limb arteriopathy in France as
a systolic index in a vascular risk population. J Mal Vasc 2000;25(1):38-46.
8. Newman AB, Siscovick DS, Manolio TA et al. Ankle-arm index as a marker of atherosclerosis in the Cardiovascular
Health Study. Cardiovascular Heart Study (CHS) Collaborative Research Group. Circulation 1993;88:837-45.
9. Resnick HE, Lindsay RS, Mc Dermott MM et al. Relationship of high and low ankle brachial index to all-cause and
cardiovascular disease mortality: the Strong Heart Study. Circulation 2004;109:733-9.
10. Mc Dermott MM, Feinglass J, Slavensky R, Pearce WH. The ankle-brachial index as a predictor of survival in patients
with peripheral vascular disease. J Gen Intern Med 1994;9:445-9.
11. Caro JJ, Migliaccio-Walle K. Generalizing the results of clinical trials to actual practice: the example of clopidogrel
therapy for the prevention of vascular events. CAPRA (Caprie Actual Practice Rates Analysis) study group. Clopidogrel
versus aspirin in patients at risk of ischaemic events. Am J Med 1999;107(6):568-72.
12.
De Backer G, Ambrosioni E, Borch-Johnsen K et al. European guidelines on cardiovascular disease prevention in
clinical practice. European Heart Journal 2003;24:1601-10.
13. Kuvin JT, Mammen A, Mooney P et al. Assessment of peripheral vascular endothelial function in the ambulatory
setting. Vasc Med 2007;12(1):13-6.
1
/
5
100%