D o s s i e r t h...

Dossier thématique
Dossier thématique
44
La Lettre de l’Hépato-gastroentérologue - Vol. XI - n°2 - mars-avril 2008
POINTS FORTS
Le traitement diurétique (spironolactone) mérite toujours
d’être tenté dans l’ascite néoplasique, car il suffit pour
contrôler les symptômes dans un tiers des cas.
Le traitement médicamenteux bien conduit (morphine +
butyl-bromure de scopolamine + halopéridol et/ou octréo-
tide) ore une qualité de vie supérieure ou égale à la chirurgie
dans l’occlusion sur carcinose péritonéale, permettant le plus
souvent d’éviter l’aspiration nasogastrique et l’hydratation
parentérale.
L’occlusion intestinale n’est pas une contre-indication à la
morphine ni à l’alimentation et à l’hydratation orales.
La sonde nasogastrique est un instrument de torture qui
doit être proscrit chaque fois que possible en n de vie. En
cas de nécessité absolue, son utilisation doit être limitée à
une durée maximale de 3 jours.
Les corticoïdes ne sont pas plus ecaces qu’un placebo
dans l’occlusion néoplasique… Leur utilisation doit se limiter
à un test thérapeutique de courte durée (5 jours).
Mots-clés : Ascite – Occlusion intestinale – Cancer abdomi-
nal – Cancer pelvien – Soins palliatifs.
Keywords: Ascites – Intestinal obstruction – Abdominal neo-
plasms – Pelvic neoplasms – Palliative care.
L
a carcinose péritonéale (CP) témoigne d’une maladie
évoluée et est associée à une survie souvent limitée. Son
pronostic dépend de la tumeur d’origine, qui détermine
les deux principaux facteurs pronostiques, l’évolutivité et la
chimiosensibilité. Avec une survie médiane de 4 à 7 mois, le
pronostic des CP d’origine colorectale est meilleur que celui des
CP d’origine gastrique ou pancréatique (1 à 3 mois).
Cet exposé est dédié au traitement symptomatique palliatif des
CP, auquel il est nécessaire de recourir en fin de vie lorsque les
traitements précédents ont échoué et que surviennent ascite ou
occlusion. Il a fait l’objet de mises au point récentes (1-3).
ASCITE
Physiopathologie, pronostic
L’ascite est la conséquence de deux principaux facteurs: l’obs-
truction tumorale lymphatique et l’augmentation de la perméabi-
lité vasculaire à l’albumine. Plus rarement, en cas de métastases
hépatiques diffuses associées à la CP, elle est la conséquence
de l’hypertension portale, comme dans la cirrhose. La présence
d’une ascite est un facteur de mauvais pronostic dans un contexte
de CP. Elle est associée à une médiane de survie de 1,4 mois en
cas de primitif gastrique ou pancréatique et de 3,7 mois en cas
de primitif colorectal.
Traitement
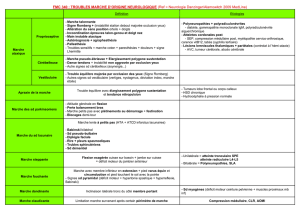
L’ascite ne doit être traitée que si elle est symptomatique. Le
traitement n’est pas codifié. La figure 1 résume la stratégie
thérapeutique proposée.
Traitement diurétique
On considère habituellement que les diurétiques sont moins
efficaces dans l’ascite néoplasique que dans l’ascite cirrhotique.
En fait, le contrôle de l’ascite par diurétiques est possible chez
environ un tiers des malades (4). Les chances de succès sont
d’autant plus importantes qu’il existe des métastases hépatiques
ou des œdèmes associés. Cette stratégie mérite toujours d’être
tentée. Elle repose principalement sur la spironolactone (100
à 200 mg/j, et jusqu’à 450 mg/j), éventuellement associée au
furosémide (4). L’efficacité et la tolérance sont évaluées par la
mesure quotidienne du poids et du périmètre abdominal, la
surveillance des effets indésirables, en particulier la soif et la
déshydratation, de l’ionogramme sanguin et de la fonction rénale.
Le traitement doit être interrompu en cas d’échec au bout de 2 à
3 semaines ou d’effets indésirables. Le régime désodé est abusif,
mais il faut éviter les apports excessifs de sodium.
Ponctions d’ascite
Si le traitement diurétique échoue, les ponctions d’ascite à la
demande sont nécessaires. En cas de CP diffuse ou d’ascite cloi-
sonnée, un guidage échographique peut s’avérer nécessaire. Les
ponctions de gros volumes permettent de soulager rapidement
le patient et de réduire la durée d’hospitalisation. Elles peuvent
cependant se compliquer d’hypovolémie, d’insuffisance rénale
et d’hyponatrémie. De plus, les ponctions itératives font courir
un risque infectieux et conduisent à une déplétion protéique
avec aggravation de la dénutrition. La perfusion systématique
Traitement symptomatique de la carcinose péritonéale
d’origine digestive
Palliative treatment for peritoneal carcinomatosis
# Bernard Denis, Gilles Breysacher, Pascale Chiappa*
* Médecine A, hôpital Pasteur, Colmar.
HGE 2(XI) MARS AVRIL 2008.indd 44 14/04/08 16:03:27

Dossier thématique
Dossier thématique
45
Figure 1.
Stratégie thérapeutique proposée pour l’ascite
néoplasique.
Ponction d’ascite diagnostique et évacuatrice
Et initier parallèlement
- Spironolactone 100 à 150 mg/j ± furosémide
- Éviter les apports excessifs de sodium
Arrêt du traitement diurétique
Ponctions d’ascite à la demande
Drainage péritonéal
Ponctions
itératives
Évaluer
l’ecacité et la tolérance
Échec
ou intolérance Succès
Ponctions
peu fréquentes
Survie estimée
< 3 mois Survie estimée
> 3 mois
Poursuite du
traitement diurétique
Ponctions
fréquentes
Shunt péritonéo-veineux
La Lettre de l’Hépato-gastroentérologue - Vol. XI - n°2 - mars-avril 2008
d’albumine (6 à 8 g par litre d’ascite évacuée) n’a pas été évaluée
dans ce contexte. Elle est inutile si la durée de vie prévisible est
inférieure à 3 mois, mais permet probablement de limiter les
effets délétères des ponctions dans le cas contraire.
Drainage péritonéal
Pour éviter des ponctions trop fréquentes, on peut laisser un
cathéter intrapéritonéal en place afin d’évacuer périodiquement
l’ascite à domicile (5). Ce type de cathéter peut être posé sous
anesthésie locale, sous contrôle échographique et radioscopique.
Certains utilisent un cathéter de drainage pleural (5), d’autres
un cathéter de dialyse péritonéale tunnellisé. Ces cathéters sont
verrouillés et drainés périodiquement par gravité dans un sac
stérile chaque fois que nécessaire. La durée de perméabilité
du drain varie de 1 à 2 mois. Ce type de drainage fait courir
un risque infectieux, qui peut être diminué grâce à la tunnel-
lisation du cathéter, sa protection par un sachet d’urostomie,
l’utilisation d’une antibioprophylaxie lors de la pose et le respect
de règles strictes d’asepsie lors de la pose et des manipulations
itératives.
Dérivation péritonéo-veineuse
La dérivation péritonéo-veineuse par valve de Le Veen ou de
Denver a été proposée (6). Ce type de dérivation chirurgicale
est peu réalisé en France. Il permet de soulager durablement les
symptômes dus à l’ascite dans 64 à 77 % des cas. La mortalité
périopératoire est non négligeable, évaluée entre 5 et 23 %, et la
morbidité est de 25% (6). La plupart s’accordent pour limiter la
place de la dérivation péritonéo-veineuse à de rares indications
en cas d’échec des autres traitements chez des patients dont
l’ascite est invalidante et dont l’espérance de vie est supérieure
à 3 mois. Cela exclut a priori les ascites consécutives à un cancer
gastrique ou pancréatique. Cette approche est contre-indiquée
en cas d’ascite mucineuse, hémorragique ou cloisonnée.
OCCLUSION
Diagnostic
Même lorsque la maladie néoplasique est évoluée, avec présence
d’une récidive régionale ou de métastases à distance, la fréquence
des occlusions non néoplasiques est non négligeable, voisine
de 15% (2). Les investigations nécessaires pour préciser la nature
et le niveau de l’obstacle ne doivent être réalisées que si l’état du
patient permet d’envisager un traitement désobstructif, chirurgical
ou non. Les clichés d’abdomen sans préparation (ASP) n’ont aucun
intérêt. Le scanner est l’examen de choix. Il permet le diagnostic
d’occlusion et souvent de préciser le siège et la nature de cette
occlusion. Lorsqu’elle est plus ou moins chronique, incomplète,
il permet de guider le choix des explorations ultérieures, endos-
copiques ou radiologiques, hautes ou basses. Les explorations
radiologiques (lavement opaque et transit du grêle) sont parti-
culièrement utiles en cas d’occlusion incomplète ou douteuse,
d’occlusion colique ou d’occlusion grêle proximale. L’entéroscanner
tend actuellement à supplanter les opacifications intestinales.
Traitement
Le traitement chirurgical est abordé ailleurs. Toutes les études
publiées sont convergentes et démontrent qu’un traitement
médical bien conduit offre dans la grande majorité des cas une
qualité de vie supérieure ou égale à un traitement chirurgical
(7). Il ne faut cependant pas que les progrès du contrôle médi-
camenteux des symptômes d’occlusion conduisent à oublier la
chirurgie en cas de cause accessible à un geste chirurgical simple
(8). Un avis chirurgical, qui doit être donné par un chirurgien
senior ayant examiné le patient est donc indispensable : un avis
sur dossier n’a pas lieu d’être ! Il n’y a pas de critère absolu qui
permette de sélectionner les patients qui vont tirer bénéfice d’un
geste chirurgical. Le choix doit tenir compte du désir du patient
et de sa famille. La figure 2 résume la stratégie thérapeutique
proposée lors de l’installation du syndrome occlusif.
Prothèses gastro-intestinales
Le traitement désobstructif endoscopique repose sur l’utilisa-
tion de prothèses. Il concerne les sténoses unifocales et acces-
sibles. Dans un contexte de CP, l’obstacle est souvent multifocal
ou sur le grêle. Aussi est-il nécessaire d’explorer au préalable
la totalité du tube digestif, en particulier le grêle par transit
baryté ou entéroscanner, pour s’assurer de l’absence d’obstacle
multifocal associé. Les résultats des prothèses ont été surévalués
HGE 2(XI) MARS AVRIL 2008.indd 45 14/04/08 16:03:29

Dossier thématique
Dossier thématique
46
Figure 2.
Stratégie thérapeutique proposée
lors de l’installation du syndrome occlusif.
État général conservé
(performance status OMS: 0 ou 1)
Geste désobstructif non exclu a priori
Sonde nasogastrique en aspiration
3 jours au maximum
+ Traitement médicamenteux
symptomatique (gure 3)
+ Corticoïdes i.v. 5 jours au maximum
Geste de
désobstruction
Oui Non
TDM abdomino-pelvien
Traitement médicamenteux
symptomatique (gure 3)
–
Pas de sonde nasogastrique
Le syndrome occlusif se lève :
arrêt du traitement
Le syndrome occlusif ne se lève pas
ou récidive rapidement
Poursuite du traitement médicamenteux symptomatique
+ réalisation rapide du bilan morphologique endoscopique ou radiologique
Traitement médicamenteux
symptomatique (gure 3)
Avis du patient et de sa famille
Arguments en faveur d’une cause
bénigne d’occlusion ou doute/récidive
néoplasique non connue
Facteurs de bon pronostic (absence
d’ascite, de masse palpable ou de
carcinose diuse)
+
Obstacle unique accessible à prothèse
Oui
Prothèse Non
Chirurgie
La Lettre de l’Hépato-gastroentérologue - Vol. XI - n°2 - mars-avril 2008
dans l’enthousiasme des premières séries publiées. La seule
étude contrôlée randomisée évaluant prothèse endoscopique
contre chirurgie pour le traitement palliatif d’une occlusion
sur cancer colique gauche a dû être prématurément inter-
rompue en raison d’un nombre élevé de complications dans le
groupe endoscopie (9). Les résultats fonctionnels sont moins
bons dans les lésions métastatiques. Les prothèses assurent
un contrôle définitif des symptômes d’occlusion chez environ
60% des patients (2). Ces résultats vont-ils s’améliorer grâce
au progrès technique ou se dégrader en raison de leur plus
grande diffusion ? Quoi qu’il en soit, leur place est restreinte
dans un contexte de CP.
Nutrition et hydratation
L’alimentation orale n’est pas contre-indiquée en cas d’occlusion,
surtout si celle-ci est distale ! Avec un traitement symptomatique
bien conduit, la plupart des patients peuvent boire et manger
de petites quantités d’aliments sans résidus, principalement
lisses (8). Ils sont absorbés dans le tube digestif proximal et
permettent un apport calorique suffisant. L’objectif n’est évidem-
ment pas d’apporter 1800 kcal/j, mais de conserver au patient
le plaisir gustatif d’ingérer quelques aliments choisis. L’utilité
d’une nutrition parentérale dans ce contexte est controversée.
Elle est inutile lorsque la durée de survie prévisible est courte.
Elle n’est indiquée que chez un petit nombre de patients jeunes,
en bon état général (performance status OMS < 2, ou score de
Karnofsky > 50), dont la durée de survie prévisible est supérieure
à 3 mois (10).
La question de l’hydratation est elle aussi controversée. Les
besoins hydriques en fin de vie sont réduits: 500 ml à un litre
par jour suffisent. Les patients qui peuvent boire ne nécessitent
pas d’hydratation parentérale. Celle-ci ne prolonge pas la survie,
mais accentue les problèmes de rétention et de sécrétions bron-
chiques, et donc les besoins d’aspiration. De plus, l’intensité de
la soif et de la sécheresse de la bouche n’est pas influencée par
le volume d’hydratation orale ou parentérale (11). Il faut donc
maintenir le patient sur un versant sec et contrôler la sécheresse
de la bouche par la boisson, par l’utilisation de petits moyens
comme des glaçons à sucer ou des morceaux d’ananas, et surtout
par la réalisation systématique et fréquente, idéalement toutes les
2 heures, de soins de bouche avec une solution de bicarbonate
de sodium à 14 ‰ (8).
Traitement médicamenteux
Le traitement médicamenteux permet de soulager les symp-
tômes d’occlusion et d’éviter dans la plupart des cas l’aspiration
nasogastrique et l’hydratation parentérale (12). Il doit être ajusté
quotidiennement en fonction des symptômes qui doivent être
eux-mêmes évalués systématiquement plusieurs fois par jour.
Il n’est pas standardisé. Il fait appel à l’association de plusieurs
médicaments, en moyenne trois, administrés par voie parentérale
à l’aide d’une pompe portable sur un accès veineux central ou par
voie sous-cutanée. La figure 3 résume les modalités pratiques
de conduite du traitement médicamenteux.
Contrôle de la douleur : le traitement de la douleur n’est pas
spécifique. Il obéit aux règles habituelles: évaluation régulière,
prescription à intervalles réguliers et non “à la demande”, paliers
OMS, prévention des effets indésirables, etc. La morphine n’est
pas contre-indiquée en cas d’occlusion! L’association à un anti-
spasmodique est souvent nécessaire (8). Le butyl-bromure de
scopolamine ou de hyoscine (Scoburen
®
ampoules à 20 mg,
60 à 380 mg/j) est l’antispasmodique de choix, du fait de son effet
mixte antipéristaltique et antisécrétoire. Il ne faut pas utiliser
l’hydrobromure de scopolamine (Scopolamine
®
, Scopoderm
®
),
aux effets centraux gênants.
Contrôle des nausées et des vomissements : les nausées et
les vomissements sont les symptômes les plus pénibles et les
plus difficiles à contrôler. L’objectif est l’absence de nausées et la
HGE 2(XI) MARS AVRIL 2008.indd 46 14/04/08 16:03:31

Dossier thématique
Dossier thématique
47
Figure 3.
Stratégie thérapeutique médicamenteuse proposée
pour l’occlusion intestinale.
*Traitement initial au pousse-seringue électrique (PSE) [les trois produits
peuvent être mélangés] :
– morphine 30 mg/j;
– butyl-bromure de scopolamine 60 mg/j;
– halopéridol 5 mg/j.
* En cas d’inefficacité sur la douleur:
1. Augmenter la posologie de morphine par titration ;
2. En cas de coliques intestinales:
° augmenter le butyl-bromure de scopolamine (maximum 380 mg/j) ;
° voire introduire l’octréotide s.c. au PSE à 0,3 mg/j.
* En cas d’inefficacité sur les nausées et vomissements:
1. Augmenter les posologies de:
– butyl-bromure de scopolamine (maximum 380 mg/j),
– halopéridol (maximum 15 mg/j).
2. Associer ranitidine (i.m., i.v.) 150 mg/j ;
3. En cas d’échec, après 5 jours: octréotide par voie s.c. au PSE
commencer par 0,3 mg/j et titrer jusqu’à 0,6 mg/j maximum;
4. En cas d’échec : pose provisoire d’une sonde nasogastrique en
aspiration, dans l’attente de la réalisation rapide d’une gastrostomie
de décharge.
La Lettre de l’Hépato-gastroentérologue - Vol. XI - n°2 - mars-avril 2008
réduction des vomissements à un épisode ou moins par jour. Sur
le plan diététique, les aliments froids et lisses en petites quantités
sont mieux supportés, et il faut éviter les odeurs alimentaires trop
envahissantes. Certains facteurs associés tels qu’hypercalcémie,
insuffisance rénale, ascite importante, infection, hypertension
intracrânienne, douleur ou anxiété doivent être recherchés et
traités. L’association de plusieurs molécules aux modes d’action
différents est souvent nécessaire. Les molécules les plus intéres-
santes sont l’halopéridol, la lévomépromazine, le métoclopra-
mide, le butyl-bromure de scopolamine et l’octréotide (2).
Prokinétiques : le métoclopramide (Primpéran
®
) stimule la
motricité gastrique et intestinale. Il faut l’éviter en cas d’occlu-
sion complète, car il peut induire des coliques intestinales. La
posologie optimale est atteinte par titration (60 à 240 mg/j), soit
par injections toutes les 4 heures, soit, mieux, par perfusion
continue à l’aide d’une pompe.
Neuroleptiques : l’halopéridol (Haldol
®
) a un effet anti-
émétique puissant. Il est utilisé par voie sous-cutanée à la dose
de 5 à 15 mg/j.
Antisécrétoires : les antisécrétoires, qu’il s’agisse du butyl-
bromure de scopolamine ou de l’octréotide, ont un effet anti-
émétique. L’intérêt de ces deux molécules est leur action mixte,
antiémétique et antalgique. Le butyl-bromure de scopolamine
est utilisé à la dose de 40 à 120 mg/j. L’octréotide est admi-
nistré par voie sous-cutanée ou intraveineuse, soit par injections
toutes les 12 heures, soit par perfusion continue. La dose initiale
est de 0,3 mg/j; la posologie est augmentée progressivement
jusqu’à l’obtention d’un contrôle satisfaisant des symptômes
(8). Certains optent pour une stratégie inverse, avec une dose
initiale de 0,6 mg/j suivie d’une diminution progressive de la
posologie à la recherche de la dose minimale efficace. La dose
–
–
–
habituellement nécessaire s’élève entre 0,15 et 0,6 mg/j. Des
doses plus importantes n’apportent pas de bénéfice (13). Le
contrôle des vomissements est rapide, satisfaisant ou complet
dans 75% à 100 % des cas. Il permet l’ablation de la sonde naso-
gastrique chez deux patients sur trois. Il peut être utilisé seul ou
en association avec le traitement antiémétique conventionnel,
éventuellement mélangé dans le même pousse-seringue (8).
Deux essais randomisés contrôlés ont montré que l’octréotide
était significativement plus efficace que le butyl-bromure de
scopolamine pour le contrôle des nausées et des vomissements
(11, 14). Lorsque les vomissements ne sont pas contrôlés par
l’une de ces deux molécules, on peut les associer, puisque leurs
mécanismes d’action sont différents. La place de l’octréotide
reste à définir: première ligne ou deuxième intention lorsque le
traitement antiémétique conventionnel échoue ou occasionne
des effets indésirables gênants? Deux essais contrôlés rando-
misés sont en cours pour l’évaluation des dérivés retards de la
somatostatine dans cette indication.
Les antihistaminiques H2 induisent une réduction du volume
de sécrétion gastrique supérieure ou égale à celle causée par
les inhibiteurs de la pompe à protons. La ranitidine peut être
administrée par voie intramusculaire ou intraveineuse à la dose
quotidienne de 150 mg (2).
Corticoïdes : l’efficacité des corticoïdes n’est pas prouvée. Leur
usage repose sur des études non contrôlées qui ne permettent
de conclure ni sur leur efficacité ni sur leur posologie optimale.
Deux essais contrôlés n’ont pas montré de différence significa-
tive entre corticoïdes et placebo (15, 16). Dans ces essais, une
résolution spontanée de l’occlusion survenait dans 33 % à 60%
des cas sous placebo. Les posologies recommandées sont très
variables, de 8 à 100 mg/j de dexaméthasone, et de 50 mg/j de
prednisone à 1 000 mg/j de méthyl-prednisolone. On peut les
utiliser à titre de test thérapeutique de courte durée (5 jours)
en pratique à la dose de 6 à 16 mg/j de dexaméthasone ou de 1
à 2 mg/kg/j de méthyl-prednisolone (17).
Laxatifs: les laxatifs peuvent être utiles en cas d’occlusion
incomplète sur obstacle colique ou rectal. Les macrogols, le
docusate sodique, l’huile de paraffine et l’hydroxyde de magné-
sium sont les laxatifs recommandés par les équipes spécialisées
en soins palliatifs. Les laxatifs stimulants doivent être évités, car
ils risquent d’induire des coliques intestinales (8).
Aspiration nasogastrique
L’aspiration nasogastrique est inadaptée en fin de vie. Elle est
source d’un inconfort important et de complications. Elle ne doit
être utilisée que pour de courtes durées, inférieures à 3 jours,
dans deux situations:
Lors de l’installation de l’occlusion : l’aspiration nasogas-
trique entraîne la levée, le plus souvent transitoire, de l’occlusion
dans moins de 20% des cas (8). Lorsque l’occlusion se lève sous
simple aspiration nasogastrique, le délai est habituellement
inférieur à 3 jours. Il ne faut pas prolonger l’aspiration au-delà
de 3 jours. Lorsqu’un traitement désobstructif est exclu d’emblée,
il ne faut pas poser d’aspiration nasogastrique, mais instaurer
le traitement médicamenteux des symptômes.
HGE 2(XI) MARS AVRIL 2008.indd 47 14/04/08 16:03:32

Dossier thématique
Dossier thématique
48
La Lettre de l’Hépato-gastroentérologue - Vol. XI - n°2 - mars-avril 2008
Lorsque l’occlusion est installée : l’aspiration nasogastrique
est posée en cas d’échec du contrôle médicamenteux des symp-
tômes, le plus souvent en cas d’occlusion haute, dans l’attente de
la réalisation rapide d’une gastrostomie de décharge (2).
Gastrostomie et jéjunostomie de décharge
La gastrostomie permet, en dernier recours, d’éviter l’inconfort
de l’aspiration nasogastrique. Elle est réalisée par voie percutanée
endoscopique, radiologique ou mixte. La présence d’une ascite
néoplasique ou d’une CP n’est pas une contre-indication, mais
rend le geste plus difficile. En cas d’ascite, il suffit de drainer,
même partiellement, l’épanchement avant le geste. L’impossibilité
d’obtenir une transillumination correcte empêche le recours à
la technique perendoscopique. Le geste peut alors, particulière-
ment en cas de CP ou d’antécédents chirurgicaux, être guidé par
échographie ou par scanner. Avec une gastrostomie, la plupart
des patients peuvent ingérer des boissons et des aliments mixés.
La sonde de gastrostomie est clampée pendant les repas et le
reste ensuite aussi longtemps que le patient le tolère. Lorsque
les symptômes réapparaissent, la sonde est déclampée, mise en
décharge par simple gravité sur un sac, sans aspiration (8).
CONCLUSION
Malgré les progrès récents, la prise en charge symptomatique
palliative de la CP reste difficile. Les niveaux de preuve des diffé-
rents traitements proposés sont faibles, fondés sur des études
non randomisées ou des avis d’experts. Les travaux publiés
démontrent cependant qu’il est possible de contrôler efficace-
ment les symptômes d’occlusion à domicile, par un traitement
médicamenteux, sans avoir recours à une sonde nasogastrique
ou à un traitement désobstructif, chirurgical ou non. De même,
une ascite néoplasique peut être prise en charge à domicile.
Le gastroentérologue ne doit pas oublier qu’autour du tube
digestif il y a une personne et son entourage! Il doit prendre en
compte l’ensemble des symptômes, digestifs ou non, mais aussi
les problèmes psychiques et sociaux rencontrés par le patient
et sa famille. La prise en charge des symptômes spécifiques à
la CP s’intègre dans une prise en charge active et globale, qui
se doit d’être réellement multidisciplinaire. N
RÉFÉRENCES BIBLIOGRAPHIQUES
1. Denis B, Elias D. Prise en charge symptomatique de la carcinose péritonéale.
Gastroenterol Clin Biol 2004;28:D17-D25.
2. Denis B, Ollier JC. Occlusion intestinale et cancer abdomino-pelvien évolué.
Gastroenterol Clin Biol 2002;26:372-85.
3. Ripamonti C, Twycross R, Baines M et al. Clinical-practice recommenda-
tions for the management of bowel obstruction in patients with end-stage cancer.
Support Care Cancer 2001;9:223-33.
4. Greenway B, Johnson PJ, Williams R. Control of malignant ascites with spiro-
nolactone. Br J Surg 1982;69:441-2.
5. Sartori S, Nielsen I, Trevisani L et al. Sonographically guided peritoneal
catheter placement in the palliation of malignant ascites in end-stage malignan-
cies. Am J Roentgenol 2002;179:1618-20.
6. Zanon C, Grosso M, Apra F et al. Palliative treatment of malignant refractory
ascites by positioning of Denver peritoneovenous shunt. Tumori 2002;88:123-7.
7. Woolfson RG, Jennings K, Whalen GF. Management of bowel obstruction in
patients with abdominal cancer. Arch Surg 1997;132:1093-7.
8. Baines MJ. e pathophysiology and management of malignant intestinal
obstruction. In: Doyle D, Hanks G, Mac Donald N (eds). Oxford textbook of
palliative medicine. 2nd Ed. Oxford. Oxford: University Press, 1998:526-33.
9. Van Hooft J, Fockens P, Marinelli A et al. Premature closure of the Dutch
Stent-in I Trial: colonic stenting vs. surgery in left-sided colonic obstruction for
incurable colorectal cancer. Gastrointest Endosc 2007;65:AB253 (abstract).
10. Bozzetti F, Amadori D, Bruera E et al. Guidelines on artificial nutrition
versus hydration in terminal cancer patients. European Association for Pallia-
tive Care. Nutrition 1996;12:163-7.
11. Mercadante S, Ripamonti C, Casuccio A et al. Comparison of octreotide and
hyoscine butylbromide in controlling gastrointestinal symptoms due to mali-
gnant inoperable bowel obstruction. Support Care Cancer 2000;8:188-91.
12. Baines M, Oliver DJ, Carter RL. Medical management of intestinal obstruc-
tion in patients with advanced malignant disease. A clinical and pathological
study. Lancet 1985;2:990-3.
13. Khoo D, Hall E, Motson R et al. Palliation of malignant intestinal obstruc-
tion using octreotide. Eur J Cancer 1994;30A:28-30.
14. Mystakidou K, Tsilika E, Kalaidopoulou O et al. Comparison of octreotide
administation vs conservative treatment in the management of inoperable bowel
obstruction in patients with far advanced cancer: a randomized, double-blind,
controlled clinical trial. Anticancer Res 2002;22:1187-92.
15. Laval G, Girardier J, Lassaunière JM et al. e use of steroids in the mana-
gement of inoperable intestinal obstruction in terminal cancer patients: do they
remove the obstruction? Palliat Med 2000;14:3-10.
16. Hardy J, Ling J, Mansi J et al. Pitfalls in placebo-controlled trials in pallia-
tive care: dexamethasone for the palliation of malignant bowel obstruction.
Palliat Med 1998;12:437-42.
17. Feuer DJ, Broadley KE. Corticosteroids fort the resolution of malignant bowel
obstruction in advanced gynaecological and gastrointestinal cancer. Cochrane
Database Syst Rev 2000;(2):CD001219.
LAB’INFOS
Baraclude® disponible
en solution buvable
L’entécavir (Baraclude®) est maintenant
disponible sous une forme buvable dosée
à 0,05 mg/ml à côté des comprimés pelli-
culés à 0,5 et 1 mg.
Cette forme trouve tout son intérêt chez
l’insuffisant rénal lorsque la clairance à
la créatinine est inférieure à 50 ml/mn, y
compris chez les patients hémodialysés
ou traités par dialyse péritonéale ambu-
latoire.
Rappelons que Baraclude® est indiqué dans
le traitement de l’infection chronique par
le virus B, infection touchant 300000 per-
sonnes en France.
>>>
HGE 2(XI) MARS AVRIL 2008.indd 48 14/04/08 16:03:34
1
/
5
100%