Chloroplastes et Mitochondries : Structure et Biogenèse

C o u r s M a s t e r 1 – C h l o r o p l a s t e e t M i t o c h o n d r i e – E n s e i g n a n t : M r K H E L O U F I A b d e n o u r ( U n i v e r s i t é d e B a t n a -2).
1
Chloroplastes et Mitochondries
A- Structure, ultrastructure, composition biochimique et biogenèse des chloroplastes
1. Introduction : Les plastes
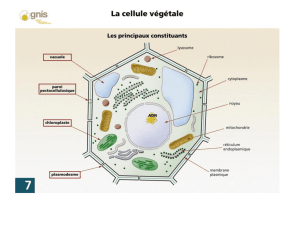
Certains organes des plantes renferment des plastes qui sont des organites limitées par une
double membrane. Parmi ces plastes, on distingue celles qui renferment des pigments
photosynthétiques capables de transformer l’énergie solaire en énergie chimique par un processus
nommé « Photosynthèse ».
Tous les organes végétaux renferment des plastes, qui sont issues des proplastes qui sont de
structure simple et non différenciés que l’on trouve généralement dans les méristèmes. Le plaste est
un organite cellulaire possédant un ADN propre, il est di semi-autonome. Un plaste possède une
membrane interne et une membrane externe qui forment l’enveloppe plastidiale. On le rencontre
dans les cellules eucaryotes de tous les végétaux chlorophylliens (algues et plantes).
• Les proplastes sont des petits organites spécifiques des cellules végétales de structure
simple et non différenciés que l'on trouve généralement dans les méristèmes.
• Les chloroplastes sont des organites présents dans le cytoplasme des cellules végétales. Ils
sont sensibles aux expositions des différentes ondes du spectre lumineux. Par l'intermédiaire de la
chlorophylle qu'ils possèdent.
• Les étioplastes sont soit des chloroplastes pas encore différenciés, soit des chloroplastes
étiolés par manque de lumière. Ils sont généralement rencontrés dans les plantes ayant poussé à
l'obscurité.
• Un chromoplaste est un organite observé dans les cellules des organes végétaux riches en
pigments non chlorophylliens, comme les xanthophylles, les carotènes, colorés de jaune à orange
(par exemple les cellules de pétales de fleurs).

C o u r s M a s t e r 1 – C h l o r o p l a s t e e t M i t o c h o n d r i e – E n s e i g n a n t : M r K H E L O U F I A b d e n o u r ( U n i v e r s i t é d e B a t n a -2).
2
• Les leucoplastes représentent une catégorie de plastes, N'ayant pas de pigments, les
leucoplastes ne sont pas verts, ce qui suggère une localisation dans les racines et dans les tissus non
photosynthétiques. Ils peuvent se spécialiser pour stocker des réserves d'amidon, de lipides ou de
protéines, ils sont alors respectivement appelés amyloplastes, oléoplastes, ou protéinoplastes.
• Un amyloplaste est un plaste qui s'est spécialisé dans le stockage de l'amidon. Il est
présent en particulier dans les cellules des organes de réserves, comme les tiges souterraines
hypertrophiées (tubercules) de pomme de terre.
• Les oléoplastes sont des organites spécifiques des cellules végétales spécialisés dans le
stockage des lipides, essentiellement sous forme de plastoglobules (gouttelettes lipidiques
sphériques).
• Les protéinoplastes (parfois appelés protéoplastes, aleuroplastes, ou aleuronaplastes)
sont des organites spécialisés et spécifiques des cellules végétales. Ils contiennent des corps
cristallins de protéines dont certaines peuvent être des enzymes. Les protéinoplastes sont présents
dans de nombreuses graines, telles que les cacahuètes.
L’interconversion plastidiale
Un plaste peut changer de type. C’est le processus d’interconversion plastidiale. Par
exemple : Un leucoplaste de pomme de terre peut se transformer en chloroplaste à la lumière ; un
chloroplaste de citron devient chromoplaste au cours aturation du fruit.

C o u r s M a s t e r 1 – C h l o r o p l a s t e e t M i t o c h o n d r i e – E n s e i g n a n t : M r K H E L O U F I A b d e n o u r ( U n i v e r s i t é d e B a t n a -2).
3
2. Les chloroplastes
Schéma Chloroplastes
Le chloroplaste est un organite semi-autonome de la cellule végétale, il possède donc,
comme la mitochondrie, son propre matériel génétique, ainsi qu’une double membrane
phospholipidique (membrane externe et membrane interne).
La membrane externe est une double couche phospholipidique formée comme toute
membrane biologique de phospholipides et de protéines. Elle a la propriété d’être relativement
perméable.
La membrane interne a, contrairement à la précédente, la propriété d’être peu perméable et
de présenter des replis appelés des thylakoïdes. Ces replis sont soit empilés et forment des granas
(un granum = thylakoïde granaire), soit isolés (= thylakoïde somatique). La membrane interne est
la plus intéressante pour la photosynthèse et délimite la partie interne du chloroplaste, le stroma.
La membrane présente des acides gras insaturés qui assurent la fluidité membranaire, et des
pigments (chlorophylle et caroténoïde) souvent associés à des protéines. Des structures
transmembranaires permettent la formation de complexes protéiques associés à la chlorophylle que
l’on appelle des photosystèmes (PSI et PSII).

C o u r s M a s t e r 1 – C h l o r o p l a s t e e t M i t o c h o n d r i e – E n s e i g n a n t : M r K H E L O U F I A b d e n o u r ( U n i v e r s i t é d e B a t n a -2).
4
3. Isolement et purification des chloroplastes - Fractionnement des chloroplastes
3.1. Isolement et purification des chloroplastes
L'étude du chloroplaste entier "in vivo" ne permet pas d'analyser avec précision leur
fonctionnement et leur composition biochimique. Aussi, est-il nécessaire d'isoler des fractions pures
de chloroplastes en bon état pour éviter toute contamination par d'autres organites (mitochondries,
par exemple).
Protocole schématique d'isolement de chloroplastes.
A partir de ce protocole, diverses procédures de purification permettent de séparer les
chloroplastes "cassés" des chloroplastes intacts, physiologiquement actifs.

C o u r s M a s t e r 1 – C h l o r o p l a s t e e t M i t o c h o n d r i e – E n s e i g n a n t : M r K H E L O U F I A b d e n o u r ( U n i v e r s i t é d e B a t n a -2).
5
Fraction brute de chloroplastes isolés observés en contraste de phase.
Les chloroplastes intacts pourvus de leur enveloppe apparaissent brillants. Les chloroplastes
"cassés" dépourvus de leur enveloppe apparaissent sombres.
La séparation des chloroplastes intacts et "cassés" peut se faire sur le principe suivant, en
utilisant leur différence de densité.
Le culot de la fraction brute de chloroplastes est remis en suspension dans le tampon. On prépare
des tubes à centrifugation contenant deux couches de saccharose de concentration différente (46 et
50%). La suspension de chloroplastes est ajoutée et les tubes sont centrifugés. Les chloroplastes
"cassés" et intacts se séparent selon leur densité.
Chloroplastes "cassés".
Ils ont perdu leur intégrité. En particulier, leur
enveloppe a disparu.
Chloroplastes intacts.
Leur ultrastructure est semblable à celle qu'ils
avaient "in situ".
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
1
/
31
100%