ds e ph ellingham psi

1
CPGE A.SAHLAOUI
PSI 2014-2015
Diagramme d’ Ellingham : Pyrométallurgie
Diagramme E_pH : Hydrométallurgie
Si, au cours de l'épreuve, un candidat repère ce qui lui semble être une erreur d'énoncé, il le
signale sur sa copie et poursuit sa composition en indiquant les raisons des initiatives qu'il est
amené à prendre.
Dans tout le problème, on rappelle la constante des gaz parfaits R = 8,314 J.mol–1.K–1, les gaz
sont supposés parfaits et la pression de référence est la pression standard P° = 1 bar.
fH0
Enthalpie standard de formation et S°m entropie molaire standard à 25°C.
O2(g)
C(s)
CO(g)
Si(s)
SiO2(s)
fH0
en kJ. mol-1
0
0
- 110,5
0
- 910,9
S°m en J.K-1.mol-1
205
5,7
197,6
18,8
41,8
Potentiels standard redox E°(V).
SiO2 (S) / SiO(S) :
E V
1
0097 ,
; SiO(S) / Si(S) :
E V
2
0081 ,
;
Si
FSi
6
2/
(S) :
E V
3
0120 ,
.
2 3 006
,,
RT
F
V à 25°C.
Remarque : HF est un acide faible de pKa = 3,2.
I-Préparation du silicium :
1- Métallurgie :
Le minerai est la silice (SiO2) sous forme de quartz
et le réducteur utilisé le coke (carbone C).
1.1. Ecrire les réactions de formation des oxydes SiO2/Si et CO/C relatives à une demi-mole de
dioxygène. Calculer leur enthalpie libre standard en sachant que SiO2, Si et C restent à l'état
condensé entre 0°C et 2000°C.
1.2. Représenter le diagramme d'Ellingham
rG
( T) = f (T) pour ces deux couples. Écrire la réaction
(R) de préparation du silicium et déduire sa température d'inversion Ti.
1.3. Justifier que (R) est favorisée par une température élevée.
Dans l’industrie, on fixe pourtant la température à 1700°C. Pourquoi ?

2
1.4. On peut opérer à température plus basse mais en faisant le vide dans le four.
a) A 1300°C, calculer la constante K° de (R). Commenter.
b) En déduire la pression partielle maximale que l'on peut tolérer dans le four pour que (R) soit totale
dans le sens direct ? Comment y parvient-on ?
2- Propriétés redox :
On donne à 298 K, en solution aqueuse, les potentiels standard redox de divers couples faisant
intervenir uniquement SiO2(S) , SiO(S) et Si (S).
2.1. On se propose d'établir le diagramme potentiel standard apparent en fonction du pH.
On rappelle que toute espèce a une activité égale à l'unité, à l'exception de H3O+.
a) Préciser les divers nombres d'oxydation des corps étudiés.
b) Écrire les demi-équations redox en milieu acide et déduire les expressions Ei = fi (pH).
c) Tracer un diagramme et conclure quant à la stabilité ou la dismutation de l'hypothétique "SiO". En
déduire le diagramme définitif.
d) En pratique, le silicium ne réagit pas en présence de dioxygène, d'eau ou des acides usuels. Quelle
raison voyez-vous ?
2.2. Le silicium est seulement attaqué par l'acide fluorhydrique HF pour conduire à l'hexafluorure de
silicium
SiF6
2
et du dihydrogène.
a) Donner une structure de Lewis puis la géométrie selon Gillespie d'un tel édifice.
b) Écrire l'équation redox d'oxydation du silicium par HF (à pH = 0), et calculer sa constante d'équilibre.
II- Obtention du métal par pyrométallurgie :
On s’intéresse dans cette partie à la préparation du magnésium par le procédé « Magnétherm » dans
lequel l’oxyde de magnésium est réduit par le silicium.
Afin de déterminer les conditions optimales de réduction de l’oxyde de magnésium (choix du réducteur,
température, pression), on utilise un diagramme d’Ellingham.
1- Rappeler en quoi consiste l’approximation d’Ellingham.
2- Écrire les équations des réactions associées aux couples MgO/Mg et SiO2/Si.
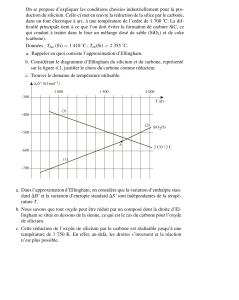
Le diagramme suivant représente les courbes relatives aux couples MgO/Mg et SiO2/Si entre 300 K et
2000 K.
Les températures de fusion du silicium et du magnésium sont de 1685 K et 923 K respectivement. La
température d’ébullition du magnésium est de 1378 K.

3
-1,2 106
-1,1 106
-1 106
-9 105
-8 105
-7 105
-6 105
-5 105
400 600 800 1000 1200 1400 1600 1800 2000
Enthalpie libre standard
(J.mol-1)
T(K)
SiO2 / Si
MgO / Mg Te(Mg)
Tf(Mg)
Tf(Si)
3- La réduction de MgO par Si est-elle possible dans un domaine de température où tous les
constituants physico-chimiques sont solides ? Justifier.
On considère la réaction représentée par l’équation suivante, à 1600 K et sous pression réduite :
Si (s) + 2 MgO (s) SiO2 (s) + 2 Mg (g)
3- Calculer la variance d’un système à l’équilibre contenant Si(s), SiO2 (s), MgO(s) et Mg(g). Conclure.
5- Donner l’expression de l’affinité chimique de cette réaction en fonction de la pression totale P et de
Péq, pression partielle du magnésium à l’équilibre. En déduire dans quelle gamme de pression la
réaction se produit dans le sens souhaité. Conclure.

4
III-Magnésium en solution aqueuse :
Le diagramme potentiel-pH du magnésium est tracé ci-dessous pour une concentration de travail
ctr = 10–2 mol.L–1.
-2,42
9,5
E (V)
pH
Mg2+ (aq) Mg(OH)2
Mg
1- Déterminer le potentiel standard du couple Mg2+/Mg(s) d’après le diagramme potentiel-pH.
2- Calculer le produit de solubilité Ks de l’hydroxyde de magnésium Mg(OH)2(s).
Une canalisation en fonte (alliage à base de fer) est enterrée dans le sol. Pour la protéger de la corrosion
on la relie à une électrode de magnésium elle aussi enterrée.
3- La canalisation en fonte est-elle ainsi protégée de la corrosion et, si oui, comment s’appelle ce mode
de protection ? On donne E°(Fe2+/Fe(s)) = – 0,44 V.
4- Quel rôle joue l’électrode de magnésium : est-elle anode ou cathode ? Pourquoi ? Écrire la demi-
équation électronique correspondante.
sous-sol
magnésium
canalisation
en fonte
1
/
4
100%