L Traitement moderne de la cardiomyopathie hypertrophique

L
a card i o myo p athie hy p e rt roph ique (CMH), ou myo-
cardiopathie hypertrophique,est caractérisée par une
hypertrophie du ventricule gauche, typiquement asy-
métrique, prédominant sur le septum interventriculaire (1, 2), et
une obstruction intraventriculaire gauche est associée dans envi-
ron 25 % des cas. La prévalence de la maladie a été étudiée pros-
pectivement et évaluée à 1/500 dans la population générale. La
CMH se transmet génétiquement selon un mode autosomique
dominant. Des mutations ont été identifiées dans une dizaine de
gènes codant des protéines du sarc o m è re ( 3 ) . L’ hy p e rt r o p h i e
apparaît typiquement chez l’adolescent ou le jeune adulte, puis
viennent les symptômes (dy s p n é e,s y n c o p e ,p a l p i t at i o n s , d o u -
leurs thoraciques), avec quelques années de décalage. Il existe en
fait une grande hétérogénéité dans l’ex p ression de la maladie,
avec un âge de début va ri abl e,des symptômes plus ou moins inva-
l i d a n t s , c e rta ins patients pouvant rester asymptomatiques ou
pauci-symptomatiques toute leur vie (1). De même, le risque de
complications est éminemment différent d’un patient à l’autre.
G l o b a l e m e n t , la mortalité card i ova s c u l a i re a été révisée à la baisse
ces dernières années : 1 à 2 % par an (1, 2, 4, 5).
FRÉQUENCE DES COMPLICATIONS
ET FACTEURS DE RISQUE
La mort subite demeure la complication redoutée de la maladie
( e nv i ron 1 % par an), du fait de sa gravité et de son cara c t è r e
imprévisible ; elle peut en constituer la première manifestation
(42 % des cas) (6, 7). Elle est habituellement en relation avec une
t a chya rythmie ve n t ri c u l a i r e, le stimulus initial pouvant être
va ri abl e. Elle frappe souvent le sujet jeune (50 % entre 10 et
25 ans) (6), et survient volontiers au cours ou au décours immé-
diat d’un effort physique important (40 % des cas) (6), même si
elle peut aussi survenir en dehors de ce contexte. Ainsi, la mala-
die constitue aux États-Unis la première cause de décès chez le
sportif de moins de 35 ans. La stratification du risque doit faire
l’objet d’un bilan minutieux et s’appuie sur l’interrogatoire, ainsi
que sur des examens non invasifs. Les principaux fa c t e u rs de
risque reconnus figurent dans le tableau I (1-4, 8, 9). D’autres
Traitement moderne de la cardiomyopathie
hypertrophique
Update on the treatment of hypertrophic cardiomyopathy
●
Ph. Charron*
■
La cardiomyopathie hypertrophique (CMH) est carac-
térisée par une grande hétérogénéité d’expression (âge de
début, sévérité), avec un risque de mort subite d’environ
1% par an qui justifie une prise en charge individualisée
et régulièrement réévaluée.
■
Le sport de compétition est proscrit dans tous les cas.
Une pro p hylaxie anti-oslérienne est recommandée dans
les formes obstructives.
■
Chez le patient à haut risque de mort subite, l’implan-
tation d’un défibrillateur automatique doit être proposée,
la difficulté consistant à cerner les indications en préven-
tion pri m a i re (à considérer à partir de deux fa c t e u rs de
risque majeurs).
■
Chez le patient très symptomatique résistant au tra i t e m e n t
médicamenteux (bêtabl o q u a n t s , v é rap a m i l , d i s o p y r a m i d e )
et porteur d’une obstruction intrave n t r i c u l a i r e, la ch i ru rgi e
de myo t o m i e - myectomie est la strat é gie de référe n c e.
■
Deux stratégies alternatives ont été récemment propo-
sées : la stimulation cardiaque DDD (associée à une amé-
l i o ration signifi c at ive des symptômes) et la réduction sep-
tale par injection intra c o ro n a i r e d’alcool (associée, e n
o u t re, à une amélioration objective portant sur la durée
d’effort ou la VO
2
max).
■
Chez le patient asymptomatique et sans facteur de ri s q u e
de mort subite, aucun traitement médicamenteux n’est fo r-
mellement recommandé.
M o t s - c l é s :C a r d i o m yo p a thie hy p e rt r ophique - Mort
subite - Traitement.
Key wo rd s : H y p e rt rophic card i o m yo p at hy - Sudden deat h -
Treatment.
P o i n t s f o r t s
M
I S E A U P O I N T
La Lettre du Cardiologue - n° 375 - mai 2004
34
*Département de cardiologie, CHU Pitié-Salpêtrière, Paris.

La Lettre du Cardiologue - n° 375 - mai 2004
35
M
I S E A U P O I N T
facteurs ont été suggérés, mais sont controversés et/ou reposent
sur des études de petite taille (réserve coronaire abaissée, isché-
mie myo c a rd i q u e,pont myo c a rd i q u e, gradient intrave n t ri c u l a i re,
a rythmie ve n t ri c u l a i re induite par la SVP, ECG endocav i t a i re
fragmenté…) (1-3, 10). Un seul des facteurs de risque majeurs
n’a que peu de valeur prédictive positive, et c’est l’association de
plusieurs d’entre eux qui doit être considérée. Ainsi, le suivi de
630 patients a permis d’observer que la présence de 0, 1, 2 ou
3fa c t e u rs parmi les 4 principaux était associée à une survie à
5 ans de 97 %, 93 %, 87 % et 75 % respectivement (8).
Le décès par insuffisance cardiaque est presque aussi fréquent
(0,5 % à 1 % par an) et habituellement en relation avec une dys-
fonction systolique (10 % à 10 ans) (1-3). Il survient plus volon-
tiers après l’âge de 35 ans (7), chez un patient avec gradient intra-
ventriculaire (11) et en fibrillation auriculaire (12).
L’accident vasculaire cérébral complique la maladie,avec une
incidence de 0,8 % par an (13). Il est lié à l’âge (après 50 ans), à
la présence d’une fibrillation auriculaire(elle-même ayant une
incidence de 2 % par an) (12), et à une insuffisance cardiaque.
Une greffe infectieuse avec endocardite est rare. L’incidence est
évaluée à 1,4 pour 100 000 patients par an et le risque apparaît
comme étant confiné aux formes obstructives de la maladie (14).
STRATÉGIE GÉNÉRALE DE TRAITEMENT
Du fait de l’hétérogénéité des symptômes et du risque évolutif,
le traitement des patients atteints de CMH doit absolument être
i n d i vidualisé et régulièrement réévalué. Trois éléments sont à
c o n s i d é re r : la présence ou non de symptômes,d’un gradient intra-
ventriculaire gauche, de facteurs de risque de mort subite. Diffé-
rentes situations schématiques en découlent et vont être revues
(figure 1).
Tableau I. Les principaux facteurs de risque de mort subite.
Prévention secondaire
✓Arrêt cardiaque récupéré
✓Tachycardie ventriculaire soutenue
Prévention primaire (quatre facteurs majeurs)
✓Histoire familiale de mort subite prématurée ( 2 cas)
✓Syncopes répétées (surtout chez l’enfant, à l’effort,
ou inexpliquées)
✓Réponse anormale de la PA à l’effort (ΔPAS < 20-25 mmHg,
surtout avant 50 ans)
✓Tachycardie ventriculaire non soutenue (surtout si répétée
ou prolongée)
Prévention primaire (deux autres facteurs importants)
✓Mutation maligne (celles du gène Troponine T, R403Q
du gène MYH7...)
✓Hypertrophie importante (paroi 30 mm)
Figure 1.
Schématisation
de la stratégie thérapeutique
de la CMH.

Le traitement de la CMH reste encore largement empirique du
fait de l’absence d’études contrôlées et randomisées visant à éva-
luer les différentes options thérapeutiques (1, 15). Les données
disponibles ainsi que l’expérience de divers experts ont cepen-
dant permis de proposer récemment diverses recommandations
en la matière (4, 16).
Dans tous les cas, le sport de compétition est proscrit (17). L’ac-
t ivité sport ive intensive de loisir est découragée ( 4 ) , mais cela
peut être modulé selon le type d’activité et le niveau de risque
individuel.
Le risque d’endocardite bactérienne justifie les mesures de p ro-
phylaxie anti-oslérienne dans les formes obstructives (4, 18).
Concernant le patient asymptomatique et ne présentant pas
de facteur de risque de mort subite,une surveillance régulière
se révèle suffisante dans la plupart des cas, sans traitement médi-
camenteux. En effe t , les traitements médicamenteux n’ont pas
montré d’action sur la prévention des symptômes ni sur le pro-
nostic des patients. De plus, une part notable de ces patients a une
espérance de vie normale. Quelques situations particulières peu-
vent amener à déroger à cette re c o m m a n d a tion selon cert a i n s
auteurs, en cas de gradient de pression majeur ou d’hypertrophie
ventriculaire massive ( 35 mm) (15).
TRAITEMENT MÉDICAL DES SYMPTÔMES
La présence de symptômes conduit à la prescription d’un traite-
ment médicamenteux, qui est efficace dans la grande majorité
des cas.
Les b ê t abl o q u a n t s sont pre s c rits en pre m i è re intention chez les
patients symptomatiques. Ils sont efficaces sur les principaux
symptômes de la maladie,qu’un gradient de pression soit pré-
sent ou non, avec une réponse obtenue dans plus de la moitié
des cas (1, 2, 4). Le médicament habituellement utilisé est le
propranolol, à des doses augmentées progressivement jusqu’à
160 à 320 mg par jour. L’action des bêtabloquants semble liée
à la bradycardie (amélioration du temps de remplissage) ainsi
qu’à l’effet inotrope négatif (attesté par la diminution du gra-
dient de pre s s i o n ) , sans qu’une action directe sur la fo n c t i o n
diastolique ait pu être retrouvée.
Au sein des inhibiteurs calciques, le vérapamil s’est révélé effi-
cace dans le traitement des symptômes de la maladie (dans 60 %
des cas environ), notamment en cas d’angor ou en cas d’échec
des bêtabloquants (1, 2, 4). La dose recommandée est de 240 à
3 6 0 mg par jour. L’action du médicament est liée à ses effe t s
inotropes et chronotropes négatifs, ainsi qu’à une action spéci-
fique sur la fonction diastolique (amélioration de la relaxation
et du re m p l i s s a ge). Des effets indésirables ont cependant été
notés (œdème pulmonaire, hypotension, bloc auriculoventricu-
laire, dysfonction sinusale), en cas de pression capillaire élevée
combinée à un gradient de pression au repos. L’administration
doit être très prudente dans cette situation.
Le disopyramide peut être proposé dans la CMH obstructive
(600 à 800 mg par jour), car il présente,outre son activité anti-
arythmique, un effet inotrope négatif qui réduit le gradient de
p ression et améliore les symptômes de la maladie ( 1 9 ) . R é c e m -
m e n t , la c i b e n zo l i n e a également été proposée en raison de
son efficacité pour la réduction du gradient de pression intra-
ventriculaire.
Chez le patient résistant à une première classe médicamenteuse,
et lorsqu’il existe un gra d i e n t , le disopy ramide peut utilement être
associé au bêtabloquant. En revanche, il n’y a pas de données en
faveur d’une association vérapamil-bêtabloquant.
TRAITEMENT DES SYMPTÔMES SÉVÈRES
DE LA CMH OBSTRUCTIVE
La persistance de symptômes sévères malgré un traitement médi-
camenteux bien conduit, et en présence d’une obstruction signi-
fi c at ive (gradient maximal > 50 m m H g ) , conduit à env i s a ge r
d’autres stratégies thérapeutiques (ce qui concerne environ 5 %
des patients). L’intervention chirurgicale constitue l’option clas-
sique, alors que deux stratégies alternatives ont été récemment
proposées (les indications sont ici un peu plus larges, concernant
des patients avec gradient maximal > 3 0 mmHg au repos et aussi,
pour certains auteurs, les patients avec gradient absent au repos
mais apparaissant après provocation).
Traitement chirurgical. La chirurgie de la CMH est proposée
depuis 1958. L’intervention habituelle est la myotomie-myec-
tomie de Morrow, qui consiste en une résection d’une partie du
septum basal au travers d’une aortotomie (proposée habituel-
lement lorsque l’épaisseur septale dépasse 18 mm) (1, 2, 4). La
simple myotomie (pro c é d u r e de Bige l ow) avec incision du
bourrelet septal sans résection est rarement effectuée. Un rem-
placement va l v u l a i re mitral prothétique est parfois pro p o s é , s o i t
comme geste associé, soit comme alternative à la myotomie-
myectomie en cas d’hy p e r t rophie peu marquée et de fuite
mitrale importante sur malformation de l’appareil valvulaire.
E n fi n , la myectomie est parfois combinée à un geste sur la
grande valve mitrale (plicature ou extension), avec un meilleur
r é s u l t at postopérat o i re. La mortalité péri o p é rat o i re est hab i-
tuellement de 5 à 8 %(1, 2, 20), et tombe à moins de 3 % dans
les centres les plus spécialisés (1, 15). La chirurgie abolit ou
diminue significativement le gradient de pression dans plus de
9 0 % des cas, et l’amélioration persistante des symptômes à
cinq ans est notée dans 70 % des cas (20). Les effets de la chi-
rurgie sur la prévention de la mort subite sont mal connus, et
l’intervention ne doit pas être pratiquée dans cette indication.
Les mécanismes de l’amélioration clinique impliquent la dimi-
nution marquée du gradient de pression, ainsi qu’une diminu-
tion de la pression télédiastolique du ventricule gauche, avec
des conséquences favorables sur le remplissage ventriculaire et
l’ischémie myocardique.
S t i m u l ati on cardiaque double ch a m b re. Les pre m i è res éva-
l u ations de cette technique (stimu l ateur en mode DDD),dès 1992,
ont montré une diminution importante du gradient intraventricu-
l a i r e, ainsi qu’une nette amélioration des symptômes et de la qua-
lité de vie (21). La procédure nécessite une optimisation du délai
auriculoventriculaire pour permettre à la fois une capture ventri-
c u l a i re complète (délai AV programmé habituellement entre 40 e t
90 ms) et un temps de remplissage suffisant (obtenu par ralen-
La Lettre du Cardiologue - n° 375 - mai 2004
36
M
I S E A U P O I N T

La Lettre du Cardiologue - n° 375 - mai 2004
37
M
I S E A U P O I N T
tissement de la conduction nodale, p h a rm a c o l ogiquement ou par-
fois par abl ation du faisceau de His). Les études randomisées ulté-
rieures (en cross-over) ont tempéré l’enthousiasme initial. Elles
ne montraient souvent pas d’amélioration objective de la capa-
cité d’effort et suggéraient que l’amélioration clinique était liée
en bonne partie à un effet placebo (22-24). Malgré une efficacité
clinique souvent nette, la place exacte du stimu l ate ur doubl e
chambre ainsi que les sous-groupes qui en bénéficient le plus res-
tent à préciser (la stimulation dans la CMH est une indication de
classe IIB pour les sociétés savantes américaines).
Réduction septale non ch i r u rgi c a l e .La réduction non ch i-
ru rgicale du septum par injection d’alcool dans la pre m i è r e
a rt è re coro n a i re septale est la plus récente (1995) et sans doute
la plus fructueuse des altern a t ives à la ch i ru rgi e de mye c t o m i e
(25). La sélection de l’art è re cible bénéficie de l’éch o grap h i e
de contraste (26). L’injection d’éthanol 95 % crée un mini-
i n fa r ctus (élévation des CPK entre 400 et 1 0 0 0 U/l) au nive a u
du septum basal en rega rd de la zone d’obstruction et conduit
à un re m o d e l age de la ch a m b re de ch a s s e,qui s’élargit en même
temps que le septum s’amincit. De nombreuses petites études
de suivi de cohortes (effectif entre 40 et 100 patients) montre n t
que la pro c é d u r e aboutit à une diminution importante du gra-
dient intrave n t ri c u l a i re ( f i g u r e 2), à une amélioration des symp-
tômes (stade NYHA), mais aussi à une amélioration de la
VO
2
max ou de la durée d’effo rt ( 2 6 - 2 8 ) . Une amélioration de
la fonction diastolique a également été rap p o rt é e . L’ e f fi c a c i t é
se maintient à distance. A i n s i , après trois ans de suivi ch e z
6 4 p a t i e n t s , le gradient au repos est de 16 mmHg (contre
6 4 mmHg en prépro c é d u r e ) , et la VO
2
max est de 30 m l / k g / m n
( c o n t r e 16 en prépro c é d u re) ( 2 8 ) . Le principal effet secondaire
de la pro c é d u r e est l’ap p a rition d’un bloc auri c u l ove n t r i c u l a i re
c o m p l e t , très fréquent à la phase aiguë (env i ron 50 % des cas),
mais habituellement régressif en quelques heures ou jours .
L’ i m p l a n t ation d’un pacemaker définitif se révèle nécessaire
dans 15 à 25 % des cas (25-28). La deuxième complication est
la surve nue possible d’une arythmie ve n t ri c u l a i re à la phase
aiguë de la pro c é d u r e, j u s t i fiant une surveillance monitorée
p r o l o n g é e. La mortalité hospitalière ap p a r aît comme fa i bl e,d e
1 à 3 % (1,7 % dans une série allemande de 404 p a tients) ( 2 5 ) ,
en rap p o r t avec des complications rythmiques ou thro m b o e m -
boliques et favo risée par la comorbidité importante des pat i e n t s
i n c lus initialement. A i n s i , cette technique nouvelle ap p a r a î t
aussi efficace que la ch i ru rgi e , tout en s’accompagnant d’une
m o i n d r e morbimortalité. Le bénéfice exact de la tech n i q u e
d e v r a cependant être précisé par des études portant sur des
e ffectifs plus importants et avec un suivi plus long.
PRÉVENTION DE LA MORT SUBITE
O u t r e les re s t ric tions concernant l’activité sport ive ,rap p e l é e s
plus haut, la prévention de la mort subite a consisté pendant long-
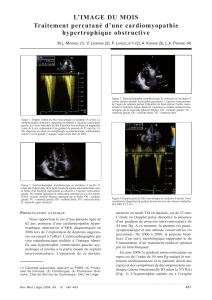
Figure 2. Alcoolisation coronaire septale.
Une patiente de 74 ans était adressée pour dyspnée d’effort de stade IV NYHA et malaises lipothymiques d’effort. L’hypertrophie septale basale était de 24 mm
et le gradient de 95 mmHg en échographie doppler. Une injection d’éthanol a été réalisée dans la première artère septale après test d’occlusion du ballonnet
et injection de produit de contraste intracoronaire pour vérifier le territoire de l’artère cible. Le gradient de pression pic à pic est immédiatement passé de
81 mmHg à 19 mmHg (hôpital de la Pitié-Salpêtrière).

La Lettre du Cardiologue - n° 375 - mai 2004
38
M
I S E A U P O I N T
temps à pre s c ri re de l ’ a m i o d a ro n e . Les autres classes médica-
menteuses comme les bêtabloquants ou les antiarythmiques de
classe I n’avaient pas fait la pre u ve de leur intérêt. L’ e fficacité de
l ’ a m i o d a ro n e elle-même (dose d’entretien re c o m m a n d é e : 100 à
300 mg/jour) demeure controve r s é e . Le suivi rétrospectif de
c o h o r tes a suggéré une réduction de la mort subite dans cert a i n e s
é t u d e s , mais pas dans d’autre s ( 1 , 2 , 4 , 2 9 ) . Les données sont en
fait limitées par les fa i ble s effe c t i f s , et surtout par le cara c t è r e
r é t rospectif et non randomisé des études, s o u r ce de nombre u x
biais potentiels.
Chez le patient à haut risque de mort subite, la prise en ch a rge
fait désormais appel au d é f i b r i l l ateur automatique implan-
t a bl e . La principale étude est rétro s p e c t ive et concern e
1 2 8 p a tients âgés de 40 ans en moyenne suivis pendant
t ro i s ans ( 3 0 ) . En pré vention secondaire (après arrêt card i a q u e
récupéré ou tachy c a rdie ve n t ri c u l a i re soutenu e, n = 4 3 p a t i e n t s ) ,
le taux de choc ap p r o p rié était de 11 % par an. En préve n t i o n
p rim a i re (devant des fa c t e u rs de ri s q u e , n = 8 5 p at i e n t s ) , l e
taux était de 5 % par an. Il n’y a eu aucun événement cl i n i q u e
grave qui n’ait été associé à un choc ap p r o p rié et à une ary t h -
mie ve n t r i c u l a i r e documentée. Cela confi r me que le méca-
nisme prédominant de mort subite dans la CMH est bien ry t h -
mique et ve n t ri c u l a i re.
Toute la discussion en situation de prévention pri m a i r e est de
p a rve nir à définir le groupe de patients à haut risque de mort
subite qui doit bénéficier du défi b r i l l at e u r. La Société euro-
péenne de card i o l o gie a récemment proposé l’implantation à
p a rtir de la présence de deux fa c t e u rs de risque (indication de
type IIA) (16). D ’ a u t r es auteurs américains la discutent à par-
tir d’un seul facteur de ri s q u e , dans un souci de protection maxi-
male qui peut ap p a r a î t re dispro p o r tionné eu éga rd au ri s q u e
fa i ble de ces pat i e n t s , et peu compat i ble avec les impérat i f s
économiques de la plupart des pays européens. Pour les pat i e n t s
qui ne présentent qu’un seul facteur de risque majeur, la pre s-
c ription d’amiodarone représente une altern at ive ra i s o n n a bl e
( i n d i c a tion IIB) ( 1 6 ) .
AUTRES SITUATIONS
Au stade le plus précoce de la maladie,chez le porteur de muta-
tion qui n’a pas encore développé l’hypertrophie, aucune mesure
thérapeutique immédiate ne semble justifiée. Des restrictions des
pratiques sportives peuvent cependant se discuter dès ce stade en
fonction du profil pronostique de la famille et de la nature de la
mutation. Dans tous les cas, une surveillance cardiologique régu-
lière (ECG et échographie) est initiée pour dépister précocement
l’hypertrophie, approfondir alors le bilan pronostique et discuter
la mise en route d’un traitement (31). Chez l’adolescent, la pré-
sence de la mu t ation pourra aussi influencer l’ori e n t ati on pro-
fessionnelle, lorsqu’une carrière sportive ou assimilée était envi-
sagée.
La fi b ri l l ation auri c u l a i reconstitue souvent un tournant évo-
lutif dans l’histoire du patient (en raison de ses conséquences
h é m o d ynamiques et thromboemboliques) et doit être prise en
ch a rge énergi q u e m e n t , avec card i o ve rsion rapide et maintien
du rythme sinusal par amiodarone plutôt que par sotalol. L’ a bl a-
tion du nœud auri c u l ove n t ri c u l a i r e et l’implantation d’un sti-
mu l ateur se discutent parfois pour mieux contrôler la cadence
ve n t ri c u l a i r e.
Les signes d’insuffisance cardiaque congestive conduisent, en
l’absence de gradient de pression, à la prescription de diurétiques
(en association avec les bêtabloquants si la fonction systolique
est conservée), voire d’inhibiteurs de l’enzyme de conversion, de
s p i ro n o l a c t o n e ou de digitaliques si la fonction systolique est alté-
rée ( 1 , 4 ) . L’ i n s u f fisance cardiaque réfra c t a i re peut conduire à
proposer une transplantation cardiaque.
■
B i b l i o g r a p h i e
1.
Maron BJ. Hypertrophic cardiomyopathy, a systematic review. JAMA 2002;
287:1308-20.
2.
Charron P, Komajda M. Cardiomyopathie hypertrophique. Encycl Med Chir
Cardiologie. Paris : Elsevier,1999;11-020-A-10.
3.
Marian AJ, Roberts R. The molecular genetic basis for hypertrophic cardio-
myopathy. J Mol Cell Cardiol 2001;33:655-70.
4 .
M a ron BJ, M c Ken na W J , Danielson GK et al. A m e rican College of
C a rd i o l ogy / E u r opean Society of Card i o l ogy : Clinical Expert Consensus
Document on Hypertrophic Cardiomyopathy. Eur Heart J 2003;24(21):1965-91.
5.
Kofflard MJ, Ten Cate FJ, van der Lee C, van Domburg RT. Hypertrophic car-
diomyopathy in a large community-based population: clinical outcome and iden-
tification of risk factors for sudden cardiac death and clinical deterioration. J Am
Coll Cardiol 2003;41(6):987-93.
6.
Maron BJ, Roberts WC, Epstein SE. Sudden death in hypertrophic cardiomyo-
pathy: a profile of 78 patients. Circulation 1982;65:1388-94.
7.
Maron BJ,Olivotto I, Spirito P et al. Epidemiology of hypertrophic cardio-
myopathy-related death: revisited in a large non-referral-based patient popula-
tion. Circulation 2000;102(8):858-64.
8.
Elliott PM, Gimeno Blanes JR, Mahon NG, Poloniecki JD,McKenna WJ.
Relation between severity of left-ventricular hypertrophy and prognosis in
patients with hypertrophic cardiomyopathy. Lancet 2001;357(9254):420-4.
9.
Monserrat L, Elliott PM, Gimeno JR et al. Non-sustained ventricular tachy-
cardia in hypertrophic cardiomyopathy: an independent marker of sudden death
risk in young patients. J Am Coll Cardiol 2003;42(5):873-9.
10.
Cecchi F, Olivotto I, Gistri R et al. Coronary microvascular dysfunction and
prognosis in hypertrophic cardiomyopathy. N Engl J Med 2003;349(11):1027-35.
11.
Maron MS, Olivotto I, Betocchi S et al. Effect of left ventricular outflow tract
obstruction on clinical outcome in hypertrophic cardiomyopathy. N Engl J Med
2003;348(4):295-303.
12.
Olivotto I, Cecchi F, Casey SA et al. Impact of atrial fibrillation on the clini-
cal course of hypertrophic cardiomyopathy. Circulation 2001;104(21):2517-24.
13.
Maron BJ, Olivotto I, Bellone P et al. Clinical profile of stroke in 900 patients
with hypertrophic cardiomyopathy. J Am Coll Cardiol 2002;39(2):301-7.
14.
Spirito P,Rapezzi C, Bellone P et al. Infective endocarditis in hypertrophic
cardiomyopathy: prevalence,incidence,and indications for antibiotic prophy-
laxis. Circulation 1999;99:2132-7.
 6
6
1
/
6
100%