Lire l'article complet

Le Courrier des addictions (9) – n° 1 – janvier-février-mars 2007
29
'
J
D
I
F
'
J
D
I
F
'
J
D
I
F
'
J
D
I
F
'
J
D
I
F
'
J
D
I
F
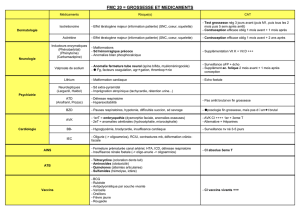
Fiche
pratique
N° 29
Sous la responsabilité de leurs auteurs
Un préalable : les dangers éventuels ne se limitent ni aux anomalies morphotératogènes, ni à la prescription de
psychotropes, mais quelquefois aussi à leur arrêt intempestif.
Le bon usage des psychotropes au cours de la grossesse ou de l’allaitement est de plus en plus renseigné et les conduites
à tenir mieux formalisées. L’équilibre psychique de la mère doit rester la pierre de touche d’un soin global, lorsque les
psychotropes ne sont pas formellement contre-indiqués. Un changement de traitement réalisé par crainte peut être plus
dangereux que le maintien de celui que l’on considère comme potentiellement néfaste. De plus, l’attitude consistant à
“s’abriter” derrière des contre-indications de principe risque d’aboutir à une grossesse contre l’avis de psychiatre et hors de
tout suivi… La cohérence des discours et comportements des différents intervenants (psychiatre, gynécologue obstétricien,
sage-femme, pédiatre) est essentielle à une prise en charge adaptée et à sa stabilité dans le temps. Reste que le “mauvais psy-
chotrope” sera toujours moins dangereux pour l’enfant et sa mère qu’une consommation d’alcool, de cannabis ou de tabac ,
beaucoup plus fréquente et peu prise en charge. Reste aussi que : tous les psychotropes passent la “barrière” placentaire qui
est une surface d’échange que tout médicament peut franchir d’autant plus facilement qu’il a un faible poids moléculaire,
une faible ionisation et une grande liposolubilité. Tous les organes du fœtus peuvent être touchés par un traitement pris par
la mère, car son métabolisme et ses particularités anatomiques (court-circuit de la circulation pulmonaire, shunt partiel du
foie…) le fragilisent dans sa globalité.
Troubles psychotiques. À noter : il y aurait 5 fois moins de décompensations psychotiques pendant la grossesse que
pendant le reste de la vie. La survenue d’une grossesse, chez une patiente psychotique, souvent tardive du fait de l’aménor-
rhée liée aux neuroleptiques, n’en reste pas moins un moment critique : mauvaise adhésion au suivi obstétrical, conduites
addictives associées, mauvaises conditions socio-économiques, prise de médicaments psychotropes…
Troubles thymiques (3, 4). Un effet protecteur de la grossesse est également décrit pour les troubles bipolaires, mais des
études récentes indiquent que 50 % des patientes bipolaires sont symptomatiques pendant la grossesse. Par ailleurs, le post-
partum représente une période de grande vulnérabilité pour la patiente bipolaire avec un risque de rechute de 20 à 80 %
pendant les 6 premiers mois suivant l’accouchement, et un risque de psychose puerpérale de 10 à 20 % (contre 0,1 à 0,2 %
dans la population générale). La grossesse ne protège pas non plus des rechutes dépressives en cas d’un éventuel arrêt de
traitement antidépresseur préalable.
Troubles anxieux. On note une amélioration des troubles paniques alors que les TOC ont tendance à s’aggraver. À noter
la possibilité d’un épisode de stress post-traumatique (PTSD) en cas de complications obstétricales.
Il est impératif de ne pas interrompre un traitement antidépresseur bien conduit pendant la grossesse en raison du ris-
que de rechute très important. Antidépresseurs de référence : les molécules les plus anciennes, car nous avons le recul pour
affirmer qu’ils n’entraînent pas d’augmentation du risque malformatif. De préférence : les imipraminiques comme l’ami-
triptyline (Laroxyl®), la clomipramine (Anafranil®) ou l’imipramine (Tofranil®). Privilégier les molécules ayant le moins
d’effet anticholinergiques et le moins susceptibles d’entraîner une hypotension orthostatique. Les inhibiteurs de la recapture
de la sérotonine sont de plus en plus utilisés en première intention. À ce jour, aucune étude ne suggère d’augmentation du
risque tératogène pour la majorité d’entre eux (fluoxétine, sertraline, citalopram, escitalopram et fluvoxamine). Récemment,
la paroxétine (Deroxat®) à été suspectée d’augmenter le risque de malformations cardiaques. À éviter chez la femme en-
ceinte. En postnatal, quelques effets indésirables sans gravité sont retrouvés chez l’enfant pour les imipraminiques. Réduire
les doses en fin de grossesse. En ce qui concerne l’allaitement, tous les tricycliques sont excrétés dans le lait maternel. À
l’exception de la doxépine (Quitaxon®) aucun effet secondaire n’a été rapporté chez l’enfant. L’usage de ces traitements est
donc sûr. Pour les IRS, également excrétés dans le lait maternel, on note très peu d’effets secondaires. Préférer la sertraline
(Zoloft®), la fluoxétine (Prozac®), excrétée à des taux élevés, semblant entraîner des baisses significatives de la courbe de
poids chez les enfants (3-5, 7, 11, 15).
C’est le traitement de référence pour les troubles bipolaires. Problème : il existe un risque de malformations cardiaques,
notamment la maladie d’Ebstein (hypoplasie ventriculaire droite, malformations de la valve tricuspide et souvent malfor-
mations septales) : 10 à 20 fois le risque de la population générale, selon les dernières méta-analyses. D’autres cardiopathies
sont retrouvées dans 7 % des cas. Impératif : la surveillance échographique cardiaque fœtale à 22-24 SA, puis cardiaque
du nouveau-né et le dosage du lithium dans le cordon. Ce traitement peut provoquer un floppy baby syndrome (hypotonie,
mauvaise régulation de la température, diminution du réflexe de succion et de déglutition, faible score d’Apgar), des ano-
malies thyroïdiennes ou un diabète insipide. Comme ces effets secondaires sont dose-dépendants et régressifs en quelques
jours, envisager d’arrêter le lithium 2 jours avant le déclenchement prévu ou au moment du début du travail. Doser plus
fréquemment, la lithémie chez la mère avec des valeurs cibles plus faibles. Éventuellement, réajuster les doses en fin de
grossesse pour pallier un risque de sous-dosage par augmentation de la clairance rénale. Le passage du lithium dans le lait
maternel provoquant de nombreux effets secondaires, ne pas allaiter.
À éviter à tout prix chez la jeune femme en âge de procréer : l’acide valproïque (Depakote®, Depamide®) a un
potentiel tératogène important (risque de malformation multiplié par 4 surtout pour les doses supérieurs à 1 g par
jour). Il est responsable du valproate fœtal syndrome (VPS) associant anomalies de la fermeture du tube neural,
malformations cardiaques, hypospadias, dysmorphies faciales, anomalies des membres, craniosténose. Chez le
nouveau-né, risque de troubles de l’hémostase, de la fonction hépatique et d’hypoglycémie, fréquence accrue de
troubles envahissant du développement.
Peur ou croyances,
mauvaises conseillères.
Grossesse et troubles
psychiatriques.
Les antidépresseurs
Psychotropes et traitements de substitution
au cours de la grossesse et de l’allaitement
S. Pezzolo*, J.-Ph. Lang*, M. Weil**, M. Reichert**
* CH d’Erstein secteur psychiatri-
que, 67 G11, 67150 Erstein.
** Réseau maternité et addiction.
CMCO SIHCUS, 67300.
Le lithium
L’acide valproïque

Le Courrier des addictions (9) – n° 1 – janvier-février-mars 2007
30
Fiche
pratique
N° 29
Sous la responsabilité de leurs auteurs
La carbamazépine (Tegretol®) est également responsable d’anomalies de la fermeture du tube neural (0,5 à 1 %), de
fentes labio-palatines, de malformations cardiaques, des membres et du système urogénital. Après la naissance, elle
peut entraîner des troubles de la coagulation (hémorragie néonatale précoce), prévenues par l’administration de vitamine
K chez la mère et l’enfant après la naissance. Le valproate et la carbamazépine sont considérés par l’American academy of
pediatrics commitee on drugs comme compatibles avec l’allaitement.
La lamotrigine (Lamictal®) apparaît moins à risque que les autres antiépileptiques sur le plan de la tératogénicité. Le
passage dans le lait maternel est important, et même si pour l’instant aucun effet secondaire n’a été décrit, le risque de rash
cutané existe. Il doit être sérieusement pris en compte. Pour le topiramate (Epitomax®), la gabapentine (Neurontin®) et
l’oxcarbazépine (Trilpetal®) les données sont insuffisantes (1, 4-6, 8, 10, 11, 15).
Tous sont utilisables s’ils sont indispensables à l’équilibre psychique de la mère. Les molécules de première intention sont
la chlorpromazine (Largactil®), l’halopéridol (Haldol®), et la fluphénazine (Moditen®). Privilégier ces deux derniers pour
leur peu d’effets secondaires sédatifs et cardiovasculaires et surtout leur faible action sur le système nerveux autonome. En
effet, le risque majeur encouru par le fœtus est lié à l’effet hypotenseur des neuroleptiques, qui peut être responsable d’une
hypoperfusion placentaire et donc d’une souffrance hypoxique. Pour le nouveau-né, risque d’effets extrapyramidaux (qui
pourrait être prévenu par une réduction de dose en fin de grossesse) ou de syndrome de sevrage. Allaitement déconseillé
du fait du risque de sédation et d’effets secondaires neurodeveloppementaux encore mal évalués. La loxapine (Loxapac®)
semble également facile d’utilisation. Les premières données concernant la rispéridone (Risperdal®), et surtout l’olanzapine
(Zyprexa®) sont rassurantes. Il n’y aurait pas d’augmentation du risque tératogène, mais une fréquence accrue des cas de
diabète gestationnel. À signaler les réserves concernant l’aripirazole (Abilify®) pour lequel a été observée une tératogénicité
chez l’animal (surveiller le diaphragme du fœtus. Tératogénicité animale également pour la ziprasidone (Zeldox®) et la que-
tiapine (Seroquel®). Chez le nouveau-né, pas d’effet secondaire, sauf pour la clozapine (Leponex®) : risque de convulsions
et de neutropénie. L’allaitement ne semble pas poser de problème sous Risperdal® et surtout sous Zyprexa® (excrétion dans
le lait maternel faible). Sous Clozapine®, surveiller la NFS du bébé (1, 11, 15).
La référence en cours de grossesse : l’oxazépam (Séresta®) en raison de ses caractéristiques pharmacodynamiques et
pharmacocinétiques (demi-vie courte). Les dernières méta-analyses confirment que la fréquence de fente labo-palatines est
multipliée par 2, mais ce risque reste faible (11, 15). Chez le nouveau-né : risque de floppy baby syndrome et de syndrome de
sevrage. Surveiller le risque de dépression du SNC et d’apnée. En cours d’allaitement, éviter les benzodiazépines sauf si elles
sont absolument nécessaires (prescription de courte durée et prise après la tétée). Les traitements médicamenteux de fond des
troubles anxieux sont les antidépresseurs pour lesquels la prescription en cours d’allaitement est moins préjudiciable.
L’électroconvulsivo-thérapie (ECT) en première intention durant la grossesse est une indication d’urgence, soit parce
que le pronostic vital est mis en jeu, soit dans des situations où l’utilisation des médicaments est hasardeuse. En fait, sous
réserve de quelques précautions, elle est une pratique relativement sûre et très efficace (4).
Encourager les femmes à arrêter tôt : avant le troisième trimestre, il n’y aura quasiment aucun effet délétère du tabagisme
sur le fœtus (2, 14, 15). Privilégier une prise en charge psychologique et/ou comportementale. En cas de dépendance (test de
Fagerström), ne pas hésiter à recourir aux TSN, même si la nicotine pourrait avoir des effets nocifs sur l’hémodynamique
du fœtus : la nicotinémie après prise de TSN est 2 à 3 fois moins élevée que celle liée au tabagisme. Recourir d’emblée à
des doses élevées (métabolisme de la femme enceinte). Associer une forme orale et un dispositif transdermique. En cas
de nausées ou de vomissements, préférer les patchs à libération sur 16 h plutôt que sur 24 h afin de limiter l’exposition du
fœtus. Déconseillé : le bupropion (Zyban®) reste déconseillé. L’allaitement est possible avec des TSN : utiliser les formes
orales et espacer prises et tétées.
D’un côté, de nombreuses données rassurantes concernant la sécurité d’utilisation de la méthadone ou de la buprénor-
phine haut dosage (Subutex®) au premier trimestre. De l’autre côté, un risque majeur et morbide pour le fœtus de présenter
des signes de sevrage in utero (avec risque de fausse couche au premier trimestre et menace d’accouchement prématuré au
troisième trimestre) en cas d’arrêt intempestif pendant la grossesse. Ils facilitent la survenue de grossesses en régularisant les
ovulations et les cycles. Ils contribuent à améliorer les conditions de vie des femmes traitées, permettent une amélioration
de la surveillance obstétricale et de là, une amélioration des paramètres du bébé à la naissance. Problème principal : risque
de syndrome de sevrage dans les heures ou les jours suivant la naissance nécessitant une prise en charge adaptée en milieu
spécialisé, actuellement bien codifiée. Il peut être nécessaire d’augmenter et/ou de fractionner les doses de méthadone en cours
de grossesse afin de maintenir une efficacité constante. Certaines études suggèrent un moindre passage transplacentaire de
la buprénorphine, et un syndrome de sevrage du nouveau-né plus tardif et prolongé pour la méthadone. L’allaitement
n’est pas spécifiquement recommandé. Il est possible sous buprénorphine ou méthadone (sous réserve de l’absence de
séropositivité VIH ou de consommation de toxiques) du fait de l’excrétion lactée faible de ces molécules.
n
La carbamazépine
Autres antiépileptiques
Les antipsychotiques
Les benzodiazépines
La sismothérapie
Les traitements substitutifs
nicotiniques
Les traitements de
substitution des pharmaco-
dépendances aux opiacés
Références bibliographiques
1. Aubry JM, Ferrero F, Schaad N. Pharmacothérapie des troubles bipolaires. 2004.
2. Boscher C. Pour une prise en charge précoce des futures mères qui fument. Le
Courrier des addictions 2005;4,7.
3. Cohen LS et al. Relapse of major depression during pregnancy in women who
maintain or discontinue antidepressant treatment. JAMA 2006;295,5.
4. Eberhard-Gran M et al. Treating mood disorders during pregnancy, drug safety.
2005;28(8).
5. Eberhard-Gran M et al. Use of psychotropic medications in treating mood di-
sorders during lactation. CNS Drugs 2006;20(3):187-98.
(6) Elefant E. et al. Grossesse, troubles bipolaires et thymorégulateurs sont-ils
compatibles ? Les nouvelles du CRAT, 2004,8.
7. Elefant E et al. Antidépresseurs et grossesse. Les nouvelles du CRAT, 2005;15.
8. Elefant E et al. Mise à jour sur les effets tératogène du valproate. Les nouvelles
du CRAT, 2005,17.
9. Mac Carthy JJ et al. Methadone levels in human milk. JHL 2000;16(2)115-20.
10. Newport DJ et al. Lithium placental passage and obstetrical outcome: im-
plications for clinical management during late pregnancy. Am J Psychiatry
2005;162:11.
11. Taylor D, Paton C, Kerwin R. The Maudsley 2005-2006 prescribing guidelines
8th Edition, 2005.
12. Touzeau D. Médicaments de substitution : un vrai bénéfice pour elle ! Le Cour-
rier des addictions 2005;4,7.
13. Umans JG. Precipitated opiate abstinence in utero. Am J Obstet Gynecol
1985.151(4):441-4.
14. Conférence de Consensus ANAES, 7-8/10/04 : Grossesse et tabac.
15. Site Internet du Centre de renseignements sur les agents tératogènes (CRAT) :
www.lecrat.org.
1
/
2
100%