Sténose aortique valvulaire chez l`adulte. 2e partie. Traitement

Quintessence
쎲A l’heure actuelle, le seul traitement efficace de la sténose aortique sévère
reste le traitement chirurgical.
쎲Des progrès ont pu être réalisés dans la prise en charge des patients avec
une sténose aortique par l’utilisation du test d’effort, qui permet de poser
l’indication opératoire chez un sous-groupe de patients asymptomatiques.
De même, l’échocardiographie à la dobutamine réalise une meilleure stratifica-
tion des patients présentant une sténose aortique à bas gradient, en identifiant
les patients qui bénéficieront d’un remplacement valvulaire aortique.
쎲On place actuellement un grand espoir dans les nouvelles approches d’im-
plantation percutanée d’une valve aortique, qui pourraient soulager des patients
inopérables dans un proche avenir.
Summary
Adult aortic valvular stenosis. Part 2. Treatment
쎲At present surgery remains the only effective treatment for severe aortic
stenosis.
쎲Progress has been made in the care of patients with aortic stenosis by the
use of exercise testing, which has widened the surgical indication to a subgroup
of asymptomatic patients. Similarly, dobutamine echocardiography achieves
a better stratification of patients with low-gradient aortic stenosis, by identi-
fying patients who will benefit from valve replacement .
쎲Percutaneous aortic valve implantation is a promising new therapeutic
approach, which could afford relief for inoperable patients in the near future.
CURRICULUM Forum Med Suisse 2006;6:647–651 647
Sténose aortique valvulaire chez l’adulte
2epartie. Traitement
Thomas Christena, b, René Lercha, Pedro Trigo Trindadea, c
aService de Cardiologie, Hôpitaux Universitaires de Genève
bCenter of Vascular Biology, Brigham and Women’s Hospital, Boston
cKlinik für Kardiologie, UniversitätsSpital Zürich
Vous trouverez les questions à choix multiple concernant cet article à la page 637 ou sur internet sous www.smf-cme.ch.
Indication au remplacement
valvulaire chirurgical
La sténose aortique sévère symptomatique
Le seul traitement efficace de la sténose aortique
(SA) est le traitement chirurgical. Il existe plu-
sieurs recommandations pour choisir le moment
optimal d’un remplacement valvulaire aortique
(RVA). Sans correction chirurgicale, les patients
présentant un ou plusieurs des symptômes car-
dinaux ont un mauvais pronostic. Le RVA amé-
liore les symptômes et augmente la survie [17].
Dans une étude rétrospective de 144 patients
symptomatiques, la survie à trois ans était de
87% chez les 125 patients ayant subi un rempla-
cement valvulaire tandis qu’elle n’était que de
21% pour les 19 patients qui n’avaient pas eu
de chirurgie [17]. A la lumière de ces résultats,
tous les patients symptomatiques souffrant d’une
SA sévère devraient bénéficier d’un remplace-
ment valvulaire (fig. 3 x).
La sténose aortique sévère asymptomatique
L’indication opératoire est plus difficile à poser
chez les patients asymptomatiques. En absence
de SA sévère, c’est-à-dire si la surface valvulaire
est de >1 cm2ou de >0,6 cm2/m2, un RVA n’est
pas indiqué et un suivi clinique et échocardiogra-
phique est suffisant (fig. 3). Il en va autrement
chez le sous-groupe de patients asymptomati-
ques présentant une SA sévère (surface valvu-
laire <1 cm2ou <0,6 cm2/m2). Dans une étude
récente, la mort subite était rare avant l’appari-
tion de symptômes (environ 1% par année), ce
qui suggère que le RVA n’est pas indiqué chez les
patients asymptomatiques. Cependant, un sous-
groupe de patients asymptomatiques à risque
élevé était exclu, à savoir les patients âgés et avec
une vitesse aortique maximale élevée qui avaient
subi le RVA avant l’apparition de symptômes. Un
registre européen récent montre également
que beaucoup de cardiologues optent pour le
RVA quand les patients sont encore asymptoma-
tiques [18].
Afin de stratifier les patients asymptomatiques
à risque, le test d’effort s’est avéré être l’examen
de choix. En se basant sur des études récentes,
la Société européenne de cardiologie a publié
des recommandations pour la prise en charge de
patients asymptomatiques. Le patient asympto-
matique est défini comme étant capable d’attein-
dre 80% de la fréquence cardiaque maximale
théorique sans développer de symptômes. Chez
les patients avec SA sévère, un RVA est recom-
mandé dans trois situations: 1. en présence
d’une réponse à l’effort pathologique (test clini-
quement positif, non élévation ou chute de la ten-
sion artérielle, ou capacité d’effort faible); 2. lors
de calcifications sévères de la valve aortique, une
vitesse aortique maximale >4 m/s, ou une pro-
gression de cette vitesse de >0,3 m/s par année;
3. en présence d’une fraction d’éjection de <50%,
ce qui est rare chez des patients asymptoma-
tiques (fig. 3). Bien que l’évidence soit moins
forte, la chirurgie est également recommandée

décédés dans les cinq premières années après
l’intervention [20]. Malgré ces résultats, une opé-
ration est recommandée chez la majorité de
ces patients puisque les résultats chirurgicaux
restent meilleurs que ceux obtenus par un trai-
tement conservateur [21]. Par conséquent, il
importe de stratifier les patients selon le risque
et le bénéfice opératoire en évaluant la sévérité
de la sténose, la réserve contractile du myocarde,
et la présence d’une maladie coronarienne asso-
ciée.
L’échocardiographie de stress à la dobutamine
est actuellement l’examen de choix pour effec-
tuer cette stratification (fig. 3). En effet, si sous
dobutamine le débit cardiaque et le gradient
transvalvulaire augmentent proportionnelle-
ment, il existe réellement une SA sévère fixe, et
un RVA est indiqué. Par contre, une augmenta-
tion du débit cardiaque sans changement du gra-
dient signifie que l’orifice augmente lors d’un
débit élevé, ce qui réfute la présomption d’une
sténose valvulaire sévère (souvent appelé «pseu-
dosténose» dans la littérature). Chez ces pa-
tients, un RVA n’est pas indiqué et un suivi par
échocardiographie et un test fonctionnel suffi-
sent. Dans le dernier groupe de patients, finale-
ment, on n’observe ni augmentation du débit
CURRICULUM Forum Med Suisse 2006;6:647–651 648
en présence d’une hypertrophie sévère (épais-
seur pariétale du ventricule gauche >15 mm) en
absence d’hypertension artérielle ou d’arythmie
ventriculaire sévère.
Il est probable que ces recommandations seront
modifiées au fur et à mesure qu’on gagnera
de l’expérience avec le test d’effort chez ces pa-
tients. Pour la stratification de ces patients, on
place également beaucoup d’espoir dans le pep-
tide natriurétique BNP (brain natriuretic pep-
tide), parce que son taux sérique semble aug-
menter avec l’apparition des symptômes [19].
La sténose aortique sévère et à bas gradient
Comme déjà mentionné plus haut, les patients
avec une SA et une dysfonction ventriculaire gau-
che (fraction d’éjection <35%) peuvent avoir un
gradient transvalvulaire bas, même en présence
d’un rétrécissement sévère (moins de 30 mm Hg
pour une surface valvulaire <1 cm2ou <0,6 cm2/
m2). Les patients avec une SA sévère et un bas
gradient ont une mortalité péri- et postopéra-
toire plus élevée; par ailleurs, plus le gradient est
bas, moins il y a lieu d’espérer une amélioration
clinique après le remplacement valvulaire. Dans
une étude comportant 52 patients, la mortalité
opératoire était de 21%, et 50% des patients sont
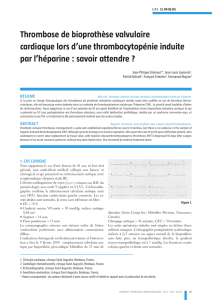
Oui
Remplacement valvulaire aortique
TE pathologique
– Symptômes
– Non élévation/ baisse de la TA
– Capacité fonctionnelle <80%
Echo dobutamine
SA sévère à bas gradient
2 Débit cardiaque
2 Gradient transvalvulaire
3 Vraie SA sévère
2 Débit cardiaque
Gradient transvalvulaire stable
SA sévère
Non
SA non sévère
Echo, TE
1x/année
Symptômes
Echo [4]
– V max aortique >4 m/s
– Progression >0,3 m/s/année
– Calcification au moins modérée
– FE <50%
SA sévère
ou
Débit cardiaque stable
Gradient transvalvulaire stable
3 Pas de réserve myocardique,
risque opératoire trop élevé
Echo, TE
1x/année
Figure 3
Indication opératoire chez un patient avec sténose aortique. L’indication opératoire est donnée en cas de SA
sévère symptomatique. Chez la SA sévère asymptomatique, le test d’effort et des caractéristiques échocardio-
graphiques permettent de cibler les patients qui vont bénéficier d’un RVA. En cas de SA à bas gradient, c’est
à l’aide de l’échocardiographie sous dobutamine que les patients avec vraie SA sévère sont identifiés [19].
Note: la sévérité de la SA est basée sur le calcul de la surface valvulaire aortique.
Abréviations: SA = sténose aortique, TE = test d’effort, TA = tension artérielle,
FE = fraction d’éjection ventriculaire gauche, RVA = remplacement valvulaire aortique.

post-sténotique de la racine aortique/aorte as-
cendante ou une maladie coronarienne. Il est éga-
lement important de connaître la fonction ventri-
culaire gauche, même si une diminution sévère
de la contractilité n’est en soi pas un obstacle pour
un RVA car elle augmente le risque opératoire. Le
bilan préopératoire doit aussi inclure des fonc-
tions pulmonaires, un écho Doppler des vais-
seaux du cou pour la recherche de sténoses caro-
tidiennes, et l’évaluation de la fonction rénale.
Finalement, il faut rechercher systématiquement
des foyers infectieux, notamment dentaires et
dans la sphère otorhinolaryngologique.
Les patients avec dysfonction ventriculaire gau-
che et décompensation cardiaque, et ceux avec
un angor instable peuvent présenter une insta-
bilité hémodynamique et sont à haut risque de
mortalité opératoire. C’est exactement chez ces
patients que toute intervention médicamenteuse
risque d’aggraver la décompensation. Une étude
de 25 patients avec SA sévère et dysfonction ven-
triculaire gauche a montré une augmentation
significative de l’index cardiaque et de la fraction
d’éjection après administration de nitroprusside,
ainsi qu’une diminution de la résistance vascu-
laire systémique [26]. Cette stratégie nécessite
une surveillance hémodynamique étroite à cause
du risque d’hypotension et de collapsus hémody-
namique. On ne sait pas si cette approche amé-
liore les résultats chirurgicaux.
Une valvuloplastie aortique percutanée par bal-
lonnet, décrite par Cribier et al. [27], diminue
le gradient aortique et peut améliorer les symp-
tômes avant le RVA chirurgical chez des patients
avec SA et choc cardiogène, mais ce geste com-
porte un risque de complications d’environ
10–20% incluant l’accident vasculaire cérébral,
l’infarctus du myocarde et la régurgitation aor-
tique importante. Ce geste ne peut remplacer
un RVA chez des patients adultes mais peut ser-
vir «de pont» avant la chirurgie, ou dans un
contexte palliatif, chez des patients inopérables.
Récemment, l’implantation percutanée d’une
valve artificielle à l’endroit de la valve native sté-
nosante a été proposée [28]. Chez huit patients
inopérables avec SA sévère et symptomatique
qui ont subi cette procédure, une amélioration
rapide de la fonction systolique globale et régio-
nale du ventricule gauche a été démontrée [29].
Seul l’avenir dira si cette technique représente
une alternative à la chirurgie pour des patients
inopérables avec SA sévère et symptomatique.
Choix d’une prothèse valvulaire:
prothèse mécanique versus bioprothèse
Pour le RVA, des prothèses mécaniques ou des
bioprothèses sont utilisées. Les prothèses méca-
niques ont comme avantage une longévité supé-
rieure, mais elles entraînent un risque plus élevé
de complications thromboemboliques ou d’hé-
CURRICULUM Forum Med Suisse 2006;6:647–651 649
cardiaque ni un changement significatif du gra-
dient, ce qui indique l’absence d’une réserve
contractile du myocarde. Dans ces cas, le RVA
n’est pas conseillé puisque le risque opératoire
est très élevé et n’entraîne pas d’amélioration cli-
nique [22]. La présence concomitante d’une
maladie coronarienne augmente le risque opé-
ratoire et la mortalité postopératoire [20]. En
résumé, les patients avec SA sévère et à bas
gradient profitent d’un RVA, hormis ceux qui
présentent une augmentation importante de la
surface de l’orifice valvulaire après stimulation
inotrope du myocarde et ceux qui n’ont pas de
réserve contractile.
Morbidité opératoire et mortalité
La morbidité et la mortalité postopératoires ont
été revues à l’aide d’une grande banque de don-
nées englobant plus de 60000 patients dont en-
viron la moitié ont subi un RVA isolé alors que les
autres ont subi un RVA associé à un ou plusieurs
pontages entre les années 1994 et 1997 [23]. Les
patients ayant subi la double procédure avaient
une incidence plus élevée de complications post-
opératoires, telles qu’un accident vasculaire cé-
rébral ou une ventilation mécanique prolongée.
La mortalité opératoire était également supé-
rieure chez les patients opérés d’une double
procédure (6,8 contre 4% chez les patients avec
RVA isolé) [23].
Les facteurs qui influencent la survie après un
RVA sont l’âge du patient, la classe fonctionnelle
selon la NYHA (New York Heart Association),
la fonction ventriculaire gauche, la présence
d’une SA à faible gradient et le nombre de pro-
cédures pratiquées dans un hôpital donné. On a
aussi constaté que les résultats sont moins bons
si le RVA a été effectué en urgence ou dans un
contexte d’infarctus aigu, de reprise chirurgicale
ou d’insuffisance rénale.
La proportion de patients âgés qui subissent un
RVA augmente et l’âge ne semble pas être un fac-
teur critique pour le résultat chirurgical immé-
diat. Une étude rétrospective comportant 1100
patients âgés de plus de 80 ans a montré une
mortalité cardiaque à 30 jours de 4% et une mor-
talité globale de 6,6% [24]. Les décès au-delà des
30 jours postopératoires étaient dus à des cau-
ses non cardiaques dans 70% des cas. Une autre
étude sur 2359 patients a également documenté
que les patients âgés avaient un excellent taux de
survie ajusté pour l’âge [25].
Bilan et suivi préopératoire
Il est impératif de rechercher des anomalies
cardiaques associées qui peuvent nécessiter des
procédures chirurgicales supplémentaires, telles
qu’une valvulopathie mitrale, une dilatation

processus immunitaire ou inflammatoire chroni-
que qui, par des mécanismes encore mal définis,
peut mener à une SA. Une meilleure connais-
sance de ces facteurs de risque dans le dévelop-
pement et la progression rapide de la SA s’avère
nécessaire. L’hypothèse que l’inflammation est
un promoteur important de la pathogenèse et
que le LDL-cholésterol y est impliqué fournit
actuellement le rationnel pour examiner si les
statines ralentissent la progression de la SA.
Pendant la dernière décennie, le perfectionne-
ment progressif de l’échocardiographie a beau-
coup amélioré le diagnostic de la SA. Actuelle-
ment, les progrès réalisés en IRM cardiaque sont
tels que cette technique est susceptible non seu-
lement de remplacer l’échocardiographie chez
les patients ayant de mauvaises fenêtres acous-
tiques, mais aussi de préciser de nombreuses
anomalies associées chez les patients avec SA.
Par conséquent, le nombre de ces examens va
certainement croître ces prochaines années.
En ce qui concerne la prise en charge des
patients, des progrès ont pu être obtenus par
l’utilisation du test d’effort, qui permet de poser
l’indication opératoire chez un sous-groupe de
patients asymptomatiques. De même, l’échocar-
diographie à la dobutamine réalise une meilleure
stratification des patients dans des cas de SA
à bas gradient, en identifiant les patients qui
bénéficieront d’un RVA.
Pour ce qui est des méthodes thérapeutiques,
on place actuellement un grand espoir dans les
nouvelles approches d’implantation percutanée
d’une valve aortique. Ces approches pourraient
dans un proche avenir soulager des patients
inopérables.
CURRICULUM Forum Med Suisse 2006;6:647–651 650
morragie car elles nécessitent une anticoagu-
lation à vie. Les bioprothèses ont comme avan-
tage que l’anticoagulation peut être arrêtée au
sixième mois postopératoire, mais leur longévité
est beaucoup moins bonne que celle des prothè-
ses mécaniques. Il existe une indication en faveur
d’une bioprothèse chez les patients qui ne peu-
vent tolérer une anticoagulation, transitoirement
(par ex. femmes en âge de procréer) ou à vie,
chez les patients ayant une mauvaise compliance
et chez des patients de plus de 65 ans qui n’ont
pas de facteurs de risque pour une maladie
thromboembolique.
L’autogreffe pulmonaire selon Ross est une alter-
native pour des patients de moins de 50 ans
chez qui ont souhaite avoir une hémodynamique
optimale. Le geste consiste à placer la valve pul-
monaire du patient en position aortique (auto-
greffe) et à remplacer la valve pulmonaire par
une homogreffe. Puisque l’intervention selon
Ross est plus longue et plus compliqué que le
RVA simple, l’indication chez des patients plus
âgés est controversée [30].
Conclusions et perspectives
Il est intéressant de constater que l’étiologie de
la SA acquise chez l’adulte reste relativement peu
connue malgré l’incidence croissante de cette pa-
thologie dans la population occidentale. En effet,
on ne se doute que depuis peu de temps que la
pathogenèse de la SA est influencée par les
mêmes facteurs de risque que ceux impliqués
dans l’athérosclérose. La sclérose aortique re-
présente probablement un stade précoce d’un
Correspondance:
Dr Pedro Trigo Trindade
Klinik für Kardiologie
UniversitätsSpital Zürich
Rämistrasse 100
CH-8091 Zürich
Références
17 Schwarz F, Baumann P, Manthey J, Hoffmann M, Schuler
G, Mehmel HC, et al. The effect of aortic valve replacement
on survival. Circulation 1982;66:1105–10.
18 Lung B, Baron G, Butchart EG, Delahaye F, Gohlke-Barwolf
C, Levang OW, et al. A prospective survey of patients with
valvular heart disease in Europe: The Euro Heart Survey on
Valvular Heart Disease. Eur Heart J 2003;24:1231–43.
19 Gerber IL, Stewart RA, Legget ME, West TM, French RL,
Sutton TM, et al. Increased plasma natriuretic peptide lev-
els reflect symptom onset in aortic stenosis. Circulation
2003;107:1884–90.
20 Connolly HM, Oh JK, Schaff HV, Roger VL, Osborn SL, Hodge
DO, et al. Severe aortic stenosis with low transvalvular
gradient and severe left ventricular dysfunction: result of
aortic valve replacement in 52 patients. Circulation 2000;
101:1940–6.
21 Pereira JJ, Lauer MS, Bashir M, Afridi I, Blackstone EH,
Stewart WJ, et al. Survival after aortic valve replacement
for severe aortic stenosis with low transvalvular gradients
and severe left ventricular dysfunction. J Am Coll Cardiol
2002;39:1356–63.
22 Monin JL, Quere JP, Monchi M, Petit H, Baleynaud S, Chau-
vel C, et al. Low-gradient aortic stenosis: operative risk
stratification and predictors for long-term outcome: a mul-
ticenter study using dobutamine stress hemodynamics. Cir-
culation 2003;108:319–24.
23 Edwards FH, Peterson ED, Coombs LP, DeLong ER,
Jamieson WR, Shroyer ALW, et al. Prediction of operative
mortality after valve replacement surgery. J Am Coll Car-
diol 2001;37:885–92.
24 Asimakopoulos G, Edwards MB, Taylor KM. Aortic valve re-
placement in patients 80 years of age and older: survival
and cause of death based on 1100 cases: collective results
from the UK Heart Valve Registry. Circulation 1997;96:3
403–8.
25 Kvidal P, Bergstrom R, Horte LG, Stahle E. Observed and
relative survival after aortic valve replacement. J Am Coll
Cardiol 2000;35:747–56.
26 Khot UN, Novaro GM, Popovic ZB, Mills RM, Thomas JD,
Tuzcu EM, et al. Nitroprusside in critically ill patients with
left ventricular dysfunction and aortic stenosis. NEJM
2003;348:1756–63.
27 Cribier A, Savin T, Saoudi N, Rocha P, Berland J, Letac B.
Percutaneous transluminal valvuloplasty of acquired aortic
stenosis in elderly patients: an alternative to valve replace-
ment? Lancet 1986;1:63–7.
28 Cribier A, Eltchaninoff H, Bash A, Borenstein N, Tron C,
Bauer F, et al. Percutaneous transcatheter implantation of
an aortic valve prosthesis for calcific aortic stenosis: first
human case description. Circulation 2002;106:3006–8.
29 Bauer F, Eltchaninoff H, Tron C, Lesault PF, Agatiello C, Ner-
colini D, et al. Acute improvement in global and regional left
ventricular systolic function after percutaneous heart valve
implantation in patients with symptomatic aortic stenosis.
Circulation 2004;110:1473–6.
30 Oury JH. Clinical aspects of the Ross procedure: indications
and contraindications. Semin Thorac Cardiovasc Surg
1996;8:328–35.
1
/
4
100%