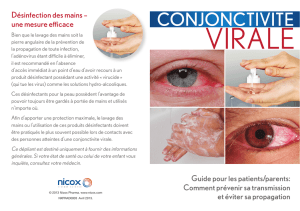
FACULTE DE MEDECINE HENRI WAREMBOURG Conjonctivites d

1
UNIVERSITE LILLE 2 DROIT ET SANTE
FACULTE DE MEDECINE HENRI WAREMBOURG
Année : 2014
THESE POUR LE DIPLOME D'ETAT
DE DOCTEUR EN MEDECINE
Conjonctivites d’allure allergique au cours de tests de provocation
oraux alimentaires
Présentée et soutenue publiquement le 31 octobre 2014 à 16h
Au Pôle Formation
Par Alexandre OMIDI
_______________
JURY
Président :
Monsieur le Professeur Jean François ROULAND
Assesseurs :
Monsieur le Professeur Benoît WALLAERT
Monsieur le Professeur Pierre LABALETTE
Madame le Docteur Christine SAUVAGE
Directeur de Thèse :
Monsieur le Professeur Pierre LABALETTE
_______________

12
Table des matières
RESUME…………………………………………………………………………………….1
INTRODUCTION………………………………………………….........................................3
1ERE PARTIE : GENERALITES SUR LES ALLERGIES…….........................................5
1. EPIDEMIOLOGIE………………………………………...………………………..6
a) La conjonctivite allergique....................................................................................…......6
b) Les allergies alimentaires……………………………………………….…………….7
2. PHYSIOPATHOLOGIE……………………………………………………………..9
2.1 Les réactions d’hypersensibilité…………………………….………………………9
a) La réaction d’hypersensibilité de type I…………………………………..……10
b) Les autres réactions d’hypersensibilité……………………………………...…..17
2.2 Les allergènes et leur épitope………………………………………………………18
2.3 Le tissu lymphoïde associé aux muqueuses (MALT)…………………………….18
3. CLINIQUE………………………………………………………………………….19
3.1 La conjonctivite allergique………………………………………………………..19
a) Les conjonctivites allergiques saisonnières et perannuelles…………………20
b) La kératoconjonctivite vernale……………………………………………...23
c) La kératoconjonctivite atopique……………………………………………24
3.2 L’allergie alimentaire………………………………………………………………24
4. EXAMENS COMPLEMENTAIRES……………..……………………………….25
a) Tests épicutanés………………………………………………………………….25
b) Bilan biologique………………………………………………………………….26
c) Test de provocation conjonctival……………………………………………….26
d) Le dosage des IgE lacrymales…………………………………………………..27
e) Les empreintes conjonctivales………………………………………………….29
5. LE TEST DE PROVOCATION ORAL……………………………………………30

13
2NDE PARTIE : ETUDE SUR LES CONJONCTIVITES D’ALLURE ALLERGIQUE
DANS LE CADRE DES TESTS DE PROVOCATION ORAUX
ALIMENTAIRES……………………………………………………………………………31
1. INTRODUCTION…………………………………………….……………………..32
2. PATIENTS ET METHODE………………………………………………………..32
a) Patients…………………………………………………………………………..32
b) Méthode………………………………………………………………………….33
3. RESULTATS…………………………………………………………………………34
3.1 Données générales…………………………………………………………..34
a) Les allergènes…………………………………………………………….34
b) Les symptômes initiaux…………………………………………………34
c) Les symptômes lors des TPO…………………………………………….37
3.2 Les conjonctivites……………………………………………………………39
a) Epidémiologie…………………………………………………………….39
b) L’arachide…………………………………………………………………42
c) La noix de cajou………………………………………………………….44
d) L’œuf……………………………………………………………………...45
e) La noix……………………………………………………………………46
f) La noisette……………………………………………………………….47
g) La pistache……………………………………………………………….48
3.3 Les éléments prédictifs………………………………………………………49
a) Le terrain clinique………………………………………………………..49
b) Le prick-test……………………………………..……………………….51
c) Le taux sanguin d’IgE spécifiques………………………………………51
4. DISCUSSION………………………………………………………………………..52
4.1 Tableau de conjonctivite allergique et TPO alimentaire…………………….52
4.2 Eléments prédictifs…………………………………………………………..53
4.3 Pourquoi une atteinte conjonctivale…………………………………………54
4.4 Perspectives…………………………………………………………………..58
4.5 Limites de l’étude…………………………………………………………….59
5. CONCLUSION………………………………………………………………………60

14
REFERENCES BIBLIOGRAPHIQUES…………………………………………………..61
ANNEXE…………………………………………………………………………………….73

15
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
 47
47
 48
48
 49
49
 50
50
 51
51
 52
52
 53
53
 54
54
 55
55
 56
56
 57
57
 58
58
 59
59
 60
60
 61
61
 62
62
 63
63
 64
64
 65
65
 66
66
 67
67
 68
68
 69
69
 70
70
 71
71
 72
72
 73
73
 74
74
 75
75
 76
76
 77
77
 78
78
1
/
78
100%