R e v u e d e ... Kisspeptine hypophysaire contrôle l’apoptose

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - nos 1-2 - janvier-février 2012
13
Revue de presse
Coordination : Estelle Louiset (Rouen)
Kisspeptine hypophysaire
contrôle l’apoptose
Le syndrome de Cushing
par sécrétion ectopique
d’ACTH : caractéristiques
cliniques, diagnostiques
et thérapeutiques
chez l’adolescent
L’acide palmitoléique
et l’obésité
Utilisation
de la metformine
dans le diabète
gestationnel : devenir
des enfants à 2 ans
Probiotiques
et accouchement
prématuré
Kisspeptine hypophysaire
contrôle l’apoptose
Le gène KISS1 code pour le précurseur des kisspeptines
qui est clivé en peptides de 14, 11 et 10 acides aminés. Les
kisspeptines se lient au récepteur KISS1R exprimé dans
le cerveau, les gonades, le placenta et l’hypophyse. Le
système kisspeptinergique joue un rôle essentiel dans le
contrôle neuroendocrine de la reproduction. Des études
récentes ont montré que les kisspeptines modulent in
vitro la sécrétion de LH et GH par une action directe
sur des cellules hypophysaires de rat. Ces données
ont conduit Martinez-Fuentes et al. à rechercher, chez
l’homme, l’expression de gènes codant pour les kisspep-
tines et leur récepteur dans des hypophyses saines et
pathologiques. Leurs données montrent que KISS1 et
KISS1R sont exprimés dans les hypophyses normales.
L’expression concomitante des deux gènes est fortement
réduite dans les différents types d’adénomes. Toutefois,
l’expression du récepteur persiste dans environ la moitié
des prolactinomes et des adénomes corticotropes, soma-
totropes et non sécrétants, mais elle n’est pas retrouvée
dans les tumeurs thyréotropes. Les auteurs ont observé
que kisspeptine-10 augmente l’apoptose des cellules en
culture dérivées d’adénomes sécréteurs de GH ou non
sécrétants. Cette étude révèle une dérégulation du sys-
tème kisspeptinergique dans les tumeurs hypophysaires
et suggère que le récepteur des kisspeptines constitue
une cible thérapeutique potentielle pour induire l’apop-
tose des cellules adénomateuses.
E. Louiset
•Mart
í
nez-Fuentes AJ, Molina M, Vàsquez-Martinez R et al. Eur J Endocrinol
2011;164:355-62.
Le syndrome de Cushing
par sécrétion ectopique d’ACTH :
caractéristiques cliniques,
diagnostiques et thérapeutiques
chez l’adolescent
Le syndrome de Cushing par sécrétion ectopique d’adré-
nocorticotropine (ACTH) [SEA] représente 10 à 15 %
des étiologies des syndromes de Cushing de l’adulte,
mais il est exceptionnel chez l’enfant ou l’adolescent.
Dans une étude rétrospective réalisée dans 18 centres
français entre 1985 et 2008, un hypercortisolisme ACTH-
dépendant et une tumeur endocrine extrahypophysaire
avec immunomarquage par l’anticorps anti-ACTH ont
été identifiés chez 10 patients âgés de 20 ans au plus.
Un groupe de 20 patients porteurs d’une maladie de
Cushing (MC) d’origine hypophysaire appariés pour
l’âge a servi de comparateur. Les caractéristiques cli-
niques des patients SEA étaient les suivantes : âge : 17 ±
0,5 ans (14-20 ans) ; sex-ratio H/F : 1/1,5 ; tumeurs identi-
fiées : carcinoïde bronchique unique (n = 5) ou multiple
(n = 1), thymique (n = 1), adénopathie médiastinale
(n = 1), tumeur hépatique en nid (n = 1) et sarcome
pleural d’Ewing (n = 1). En comparant les groupes
SEA et MC, on observait la même prévalence de prise
pondérale (70 et 95 %) et de cassure de la courbe de
croissance (100 %). Étaient plus fréquents dans le groupe
des patients SEA : la faiblesse musculaire (80 versus
15 %), l’HTA (80 versus 35 %) et l’hypokaliémie (70 ver-
sus 26 %). Les caractéristiques biologiques différaient
également avec, chez les patients SEA : un cortisol libre
urinaire des 24 heures plus élevé (× 77 versus × 5,6), avec
un seuil de 13 × N séparant les 2 groupes (sensibilité :
80 %, spécificité : 95 %) ; une ACTH basale plus élevée
(4,4 × N versus 1,4 × N), avec une réponse plus faible au
CRH (+ 20 % versus + 295 %), mais un freinage fort par
dexaméthasone non discriminant. Le cathétérisme des
sinus pétreux (KTSP) a identifié la source d’ACTH chez
tous les patients testés (6 SEA, 8 MC). Le diagnostic de
localisation thoracique a été réalisé par scanner avec ou
sans Octreoscan® chez 7 sur 9 SEA thoraciques et 1 SEA
à tumeur hépatique, l’IRM et la TEP (FDG et FDOPA)
identifiant 2 lésions pulmonaires occultes. Du point
de vue thérapeutique, 9 des 10 SEA ont bénéficié d’un
traitement par 1 (pour 6 patients) ou 2 (pour 3 patients)
anticortisolique(s) : kétoconazole (n = 5), métopirone
(n = 2), mitotane (n = 4) ou cabergoline (n = 1), éven-
tuellement associés (n = 3). Les patients ont bénéficié
d’une intervention chirurgicale sur la tumeur (n = 10),
avec, dans 4 cas, recours à une surrénalectomie bila-
térale (n = 2) et/ ou une chimiothérapie associée à une
radiothérapie (n = 3). Le contrôle tumoral et hormonal
prolongé a été obtenu chez 7 patients, une ou plusieurs
récidives survenant pour 2 carcinoïdes bronchiques
typiques et 1 thymome.
Cette série rétrospective souligne la possibilité chez
l’adolescent d’une SEA pouvant mimer la MC, l’ab-
sence de test biologique discriminant entre SEA et
MC, l’indication en première intention du scanner
thoracocervical et l’utilité du KTSP dans certaines situa-
tions. La stratégie diagnostique et thérapeutique chez
l’adolescent peut utiliser les algorithmes établis chez
l’adulte atteint de SEA.
Y. Reznik
•More J. et al. J Clin Endocrinol Metab 2011;96:1213-22.

Revue de presse
Bithérapie du pancréas.
Eucreas® est indiqué dans le traitement du diabète de type 2 chez les patients dont le contrôle glycémique est insuf sant
à leur dose maximale tolérée de metformine en monothérapie orale, ou chez les patients déjà traités par l’association
de vildagliptine et de metformine sous forme de comprimés séparés.
Ce traitement ne dispense pas du bon respect des mesures hygiéno-
diététiques du patient diabétique de type 2.
Diabète de type 2
ASSOCIATION FIXE D’UN INHIBITEUR DE LA DPP-4
AVEC LA METFORMINE
La vildagliptine améliore la sécrétion
gluco-dépendante d’insuline*
La vildagliptine freine la sécrétion
inappropriée de glucagon*
- V120581 - Décembre 2011.
* RCP Eucréas
V120581 MHDN 210x297 Quad.indd 1 31/01/12 11:43
V120581 - Décembre 2011.
EUCREAS
®
50 mg/1000 mg Comprimé pelliculé (vildagliptine, metformine) Eucreas 50 mg/1000 mg est un comprimé pelliculé contient 50 mg de vildagliptine et 1000 mg de chlorhydrate de metformine (correspondant à 780 mg de metformine). Boîtes de 60 et 180. DONNEES CLINIQUES: Indications
thérapeutiques: Eucreas est indiqué dans le traitement du diabète de type 2 chez les patients dont le contrôle glycémique est insuf sant à leur dose maximale tolérée de metformine en monothérapie orale, ou chez les patients déjà traités par l’association de vildagliptine et de metformine sous forme de comprimés séparés. Posologie et mode
d’administration: Adultes: Selon la dose actuelle de metformine du patient, Eucreas peut être initié à la dose de 50mg/850mg* ou de 50 mg/1000 mg 2 fois / jour, un cp le matin et le soir. La dose quotidienne recommandée est de 100 mg de vildagliptine plus 2000 mg de chlorhydrate de metformine. CTJ: 1,58€ jusqu’au 31.12.11; 1,56€
à partir du 1.01.12. * dosage 50 mg/ 850mg: non commercialisé en France. Les patients recevant de la vildagliptine et de la metformine sous forme de cp séparés peuvent prendre à la place les comprimés d’Eucreas. Des doses supérieures à 100 mg de vildagliptine ne sont pas recommandées. L’utilisation de la vildagliptine et de la metformine en association
triple avec d’autres antidiabétiques n’a pas fait l’objet d’études cliniques. La prise d’Eucreas pendant ou juste après la prise d’aliments peut diminuer les symptômes gastro-intestinaux associés à la metformine. Ne pas utiliser Eucreas chez les patients dont la clairance de la créatinine est inférieure à 60ml/min. Ne pas utiliser Eucreas chez les patients présentant
une insuf sance hépatique, incluant ceux présentant des taux d’alanine aminotransférase (ALAT) ou d’aspartate aminotransférase (ASAT) avant traitement supérieurs à 3 fois la limite supérieure à la normale (LSN). La metformine étant éliminée par le rein et compte tenu du fait que la fonction rénale des patients âgés a tendance à être diminuée, la fonction
rénale des patients âgés 65 ans et plus doit être surveillée régulièrement. Eucreas ne doit pas être utilisé chez les enfants et les adolescents de moins de 18 ans compte tenu de l’absence de données concernant la sécurité et l’ef cacité. Contre-indications: -Hypersensibilité aux substances actives ou à l’un des excipients, -Diabète acidocétosique ou
précoma diabétique, -Insuf sance rénale ou altération de la fonction rénale dé nie par une clairance de la créatinine < 60 ml/min (cf. Mises en garde spéciales et précautions d’emploi), -Affections aiguës susceptibles d’altérer la fonction rénale, telles que: •déshydratation, •infection grave, •choc, •administration intravasculaire de produits de contraste
iodés (cf. Mises en garde spéciales et précautions d’emploi). -Maladie aiguë ou chronique pouvant entraîner une hypoxie tissulaire, telle que: •insuf sance cardiaque ou respiratoire, •infarctus du myocarde récent, •choc. -Insuf sance hépatique (cf. Contre-indications, Mises en garde spéciales et précautions d’emploi et Effets indésirables), -Intoxication alcoolique
aiguë, alcoolisme, -Allaitement (cf. Fécondité, grossesse et allaitement). Mises en garde spéciales et précautions d’emploi: Eucreas ne remplace pas l’insuline chez les patients insulinodépendants et ne doit pas être utilisé chez les patients présentant un diabète de type 1. L’acidose lactique est une complication métabolique très rare mais
grave qui peut survenir en cas d’accumulation de metformine. Chez les patients présentant une altération de la fonction hépatique, la clairance du lactate peut être réduite. L’incidence de l’acidose lactique peut et doit être réduite par une évaluation des autres facteurs de risque associés, tels qu’un diabète mal équilibré, une cétose, un jeûne prolongé, l’éthylisme,
une insuf sance hépatique, ainsi que toute affection associée à une hypoxie. L’acidose lactique est caractérisée par une dyspnée acidosique, des douleurs abdominales, et une hypothermie suivie d’un coma. Le diagnostic biologique repose sur une diminution du pH sanguin, une lactacidémie supérieure à 5mmol/l, et une augmentation du trou anionique et du
rapport lactates/pyruvates. Devant toute suspicion d’acidose métabolique, il convient d’arrêter le traitement et d’hospitaliser le patient d’urgence. Dans la mesure où la metformine est éliminée par le rein, les concentrations de créatinine sérique doivent être mesurées régulièrement. Chez les patients âgés, la survenue d’une insuf sance rénale est fréquente et
asymptomatique. Observer des précautions particulières lorsque la fonction rénale est susceptible de s’altérer, par ex. la mise en place d’un traitement antihypertenseur ou diurétique, ainsi qu’au début d’un traitement par un AINS. En cas d’insuf sance hépatique, incluant ceux présentant des taux d’ALAT ou d’ASAT avant traitement supérieurs à 3 fois la LSN ne
doivent pas être traités par Eucreas. De rares cas de dysfonctionnement hépatique (incluant des hépatites) ont été observés avec la vildagliptine. Des contrôles de la fonction hépatique doivent être effectués avant l’instauration d’un traitement par Eucreas a n de connaître les valeurs initiales du patient. Surveiller la fonction hépatique lors du traitement par
Eucreas à intervalles de 3 mois pendant la 1
ère
année puis régulièrement par la suite. En cas d’élévation des transaminases, un 2
nd
bilan hépatique sera effectué a n de con rmer les résultats et une surveillance régulière de la fonction hépatique sera ensuite effectuée jusqu’à normalisation des paramètres hépatiques. En cas de persistance de l’élévation des taux
d’ASAT ou d’ALAT ≥ 3 fois la limite supérieure à la normale (LSN), il est recommandé d’arrêter le traitement par Eucreas. Les patients développant un ictère ou d’autres signes suggérant un dysfonctionnement hépatique doivent arrêter Eucreas. Un traitement par Eucreas ne doit pas être réinitié à la suite d’un arrêt de traitement par Eucreas et d’une normalisation
du bilan hépatique. En cas d’insuf sance cardiaque congestive de classe I-II selon la classi cation NYHA, l’expérience du traitement par la vildagliptine est limitée donc prudence chez ces patients. Il n’y a pas d’expérience de l’utilisation de la vildagliptine chez des patients présentant une insuf sance cardiaque de classe III-IV selon la classi cation NYHA, son
utilisation n’est donc pas recommandée. La metformine est contre-indiquée chez les patients présentant une insuf sance cardiaque; Eucreas est par conséquent contre-indiqué dans cette population. Des lésions cutanées à type de vésicules et d’ulcérations ont été observées au niveau des extrémités chez des singes dans des études précliniques de toxicologie. Une
surveillance des lésions cutanées telles que les vésicules et ulcérations est donc recommandée lors des soins habituels chez un patient diabétique. Depuis la commercialisation, des cas d’effet indésirable de pancréatite aiguë ont été spontanément rapportés. Les symptômes de la pancréatite aiguë: douleur abdominale intense et persistante. En cas de suspicion de
pancréatite, la vildagliptine ainsi que les autres médicaments potentiellement suspects doivent être arrêtés. Eucreas contenant de la metformine, le traitement doit être interrompu 48 heures avant une intervention chirurgicale programmée avec anesthésie générale et ne doit en règle générale être repris que 48 heures après l’intervention. L’administration
intravasculaire de produits de contraste iodés au cours d’explorations radiologiques peut entraîner une insuf sance rénale. En conséquence, en raison de la présence de metformine, arrêter Eucreas avant ou au moment de l’examen, pour n’être réintroduit que 48 heures après, et seulement après s’être assuré de la normalité de la fonction rénale. Interactions
avec d’autres médicaments et autres formes d’interactions: Vildagliptine: La vildagliptine n’est ni un substrat, ni un inhibiteur, ni un inducteur des enzymes du CYP450. De ce fait, elle est peu susceptible d’interagir avec des substances actives qui sont des substrats, des inhibiteurs ou des inducteurs de ces enzymes. Association avec la
pioglitazone, la metformine et le glibenclamide: pas d’interactions pharmacocinétiques cliniquement pertinentes. Digoxine (substrat de la gp-P), warfarine (substrat du CYP2C9): pas d’interactions pharmacocinétiques cliniquement pertinentes. Toutefois, ceci n’a pas été établi dans la population cible. Association avec l’amlodipine, le ramipril, le valsartan ou la
simvastatine: aucune interaction pharmacocinétique cliniquement pertinente n’a été observée après une administration concomitante avec la vildagliptine. Comme pour d’autres antidiabétiques oraux, l’effet hypoglycémiant de la vildagliptine peut être diminué par certaines substances actives, notamment par les diurétiques thiazidiques, les corticoïdes, les hormones
thyroïdiennes et les sympathomimétiques. Metformine:
Associations déconseillées:
Il existe un risque accru d’acidose lactique en cas d’intoxication alcoolique aiguë (particulièrement en cas de jeûne, de malnutrition ou d’insuf sance hépatique) dû à la présence de la substance active metformine dans Eucreas. La consommation d’alcool et la prise de médicaments
contenant de l’alcool doivent être évitées. Les substances actives cationiques qui sont éliminées par sécrétion tubulaire rénale (par exemple la cimétidine) peuvent interagir avec la metformine en entrant en compétition au niveau des systèmes de transport tubulaire communs et ainsi retarder l’élimination de la metformine, ce qui pourrait augmenter le risque
d’acidose lactique. Par conséquent, une surveillance étroite du contrôle glycémique, une adaptation de la dose dans l’intervalle posologique recommandé et des modi cations du traitement antidiabétique doivent être envisagées en cas d’administration concomitante de médicaments cationiques qui sont éliminés par sécrétion tubulaire rénale. L’injection intravasculaire
de produits de contraste iodés peut conduire à une insuf sance rénale et à une accumulation de metformine avec un risque d’acidose lactique. La metformine doit être arrêtée avant ou au moment de l’examen, pour n’être réintroduite que 48 heures après, et seulement après s’être assuré de la normalité de la fonction rénale.
Associations nécessitant des
précautions d’emploi:
Les glucocorticoïdes, les bêta-2 agonistes et les diurétiques ont une activité hyperglycémiante intrinsèque. Il convient d’en informer le patient et de contrôler plus fréquemment la glycémie. La posologie d’Eucreas peut être adaptée au cours du traitement par l’autre médicament et après son arrêt. Les IEC peuvent entraîner une baisse de
la glycémie. La posologie de l’antidiabétique peut être adaptée au cours du traitement par l’autre médicament et après son arrêt. Fécondité, grossesse et allaitement: Eucreas ne doit pas être utilisé pendant la grossesse. Eucreas ne doit pas être utilisé pendant l’allaitement. Effets sur l’aptitude à conduire des véhicules et
à utiliser des machines: En cas d’effets indésirables à type de sensations vertigineuses éviter de conduire des véhicules ou d’utiliser des machines. Effets indésirables: De rares cas de dysfonctionnement hépatique (incluant des hépatites) ont été observés avec la vildagliptine. Dans ces cas, les patients étaient généralement asymptomatiques
sans séquelles cliniques et présentaient un retour à la normale du bilan hépatique après l’arrêt du traitement. Dans les essais contrôlés en monothérapie et en association, d’une durée allant jusqu’à 24 semaines, l’incidence des élévations des taux d’ALAT ou d’ASAT ≥3xLSN (présentes lors d’au moins deux dosages consécutifs ou lors de la dernière visite sous
traitement) a été respectivement de 0,2 %, 0,3 % et 0,2 % pour 50 mg / jour de vildagliptine, 50 mg 2 fois / jour de vildagliptine et tous les comparateurs. De rares cas d’angioedèmes ont été rapportés sous vildagliptine à un taux comparable à celui des groupes contrôles. Une proportion plus importante de cas a été observée lorsque la vildagliptine a été
administrée en association avec un IEC. Les effets indésirables rapportés dans les études en double aveugle chez les patients traités par Galvus en monothérapie et en association sont listés ci-dessous. Les fréquences sont dé nies comme suit: TF (≥1/10), F (≥1/100, <1/10), PF (≥1/1 000, <1/100), R (≥1/10 000, <1/1 000), TR (<1/10000), fréquence
indéterminée. Effets indésirables rapportés chez les patients ayant reçu 100mg/ jour de vildagliptine en traitement adjuvant de la metformine par rapport aux patients recevant le placebo plus la metformine dans les études en double aveugle (n = 208).
Troubles du métabolisme et de la nutrition: F: Hypoglycémie. Affections du système nerveux: F: Tremblements, Céphalées, Sensations vertigineuses. PF: Fatigue. Affections gastro-intestinales: F: Nausées. Dans les essais cliniques, l’incidence des épisodes d’hypoglycémie a été de 1 % chez les patients recevant de
la vildagliptine en association avec la metformine et de 0,4 % chez les patients recevant le placebo en association avec la metformine. Aucun événement hypoglycémique sévère n’a été observé dans les groupes recevant de la vildagliptine. Dans les essais cliniques, aucune variation du poids n’a été observée par rapport aux valeurs initiales lorsque 100 mg par
jour de vildagliptine ont été ajoutés à la metformine. Informations supplémentaires sur chacune des substances actives de l’association xe:
Vildagliptine:
Effets indésirables rapportés chez les patients ayant reçu 100 mg par jour de vildagliptine en monothérapie dans les études en double aveugle
(n = 1 855). Infections et infestations: TR: Infection des voies respiratoires supérieures, Rhinopharyngite. Troubles du métabolisme et de la nutrition: PF: Hypoglycémie. Affections du système nerveux: F: Sensations vertigineuses. PF: Céphalées. Affections vasculaires: PF: Œdèmes périphériques.
Affections gastro-intestinales: PF: Constipation. Affections musculo-squelettiques et systémiques: PF: Arthralgie. Dans les études comparatives contrôlées en monothérapie, les épisodes d’hypoglycémie ont été peu fréquents, observés chez 0,4 % des patients traités par 100 mg par jour de vildagliptine en comparaison à 0,2%
des patients traités par un comparateur actif ou le placebo; aucun événement grave ou sévère n’a été observé. Dans les essais cliniques, aucune variation de poids par rapport aux valeurs initiales n’a été observée pour 100 mg par jour de vildagliptine administrés en monothérapie.
Metformine:
Effets indésirables connus de la metformine:
Troubles du métabolisme et de la nutrition: TR: Diminution de l’absorption de la vitamine B12 et acidose lactique*. Affections du système nerveux: F: Goût métallique. Affections gastro-intestinales: TF: Nausées, vomissements, diarrhées, douleurs abdominales et perte d’appétit. Affections hépatobiliaires:
TR: Anomalies des tests de la fonction hépatique ou hépatite**. Affections de la peau et du tissu sous-cutané: TR: Réactions cutanées telles qu’érythème, prurit et urticaire.
* Une diminution de l’absorption de la vitamine B12 avec diminution des taux sériques a été très rarement observée chez des patients recevant un traitement au long
cours par la metformine. Cette étiologie doit être envisagée si un patient présente une anémie mégaloblastique. ** Des cas isolés d’anomalies des tests de la fonction hépatique ou d’hépatite qui se sont résolus après l’arrêt de la metformine ont été rapportés.
Les effets indésirables gastro-intestinaux sont survenus le plus fréquemment lors de l’instauration du
traitement et se sont résolus spontanément dans la plupart des cas. A n de les éviter, il est recommandé que la metformine soit prise en 2 doses quotidiennes pendant ou après le repas. Une augmentation progressive de la dose peut également améliorer la tolérance gastro-intestinale. Données après commercialisation: •Des cas d’anomalies des bilans hépatiques
et des cas d’hépatites, réversibles à l’arrêt du médicament. •A une fréquence indéterminée: urticaire, pancréatite. PROPRIETES PHARMACOLOGIQUES: Propriétés pharmacodynamiques: Classe pharmacothérapeutique: Associations d’hypoglycémiants oraux, code ATC: A10BD08. ListeI- Eucreas50mg/1000mg:
EU/1/07/425/009 (14.11.2007, révisée décembre 2011); CIP: 34009 382 770.5 0– boîte de 60 comprimés sous plaquettes thermoformées. Prix: 47,51 € jusqu’au 31.12.11; 46,83 € à partir du 1.01.12. Remb. Séc. soc. à 65 %. Agréé Collect. Eucreas 50mg/1000mg: EU/1/07/425/017 (14.11.2007, révisée décembre 2011); CIP: 34009 571
766.55 – boîte de 180 comprimés sous plaquettes thermoformées. Agréé Collect. Seul le dosage à 50mg/1000mg est commercialisé en France. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE: Novartis Europharm Limited- Royaume-Uni- Représentant local: Novartis Pharma S.A.S 2 et 4, rue Lionel Terray 92500 Rueil-
Malmaison- Tél: 01.55.47.60.00- Information et Communication Médicales: Tél: 01.55.47.66.00- [email protected]-FMI086-10
« *Pour une information complète, consulter le texte intégral du résumé des caractéristiques du produit, soit sur le site internet de l’Afssaps si disponible, soit sur demande auprès du laboratoire. »
V120581 MHDN 180x130 ML.indd 1 31/01/12 11:44
L’acide palmitoléique et l’obésité
Les stéroyl-coenzyme A désaturases (SCD)
sont des enzymes pouvant faciliter le stoc-
kage des lipides. En effet, elles sont impli-
quées dans la synthèse de novo des acides
gras mono-insaturés, les acides palmito-
léique (C16:1n-7) et oléique (C18:1-n9) à par-
tir des acides palmitique (C16:0) et stéarique
(C18:0). Il existe 2 isoformes de la SCD chez
l’homme : la SCD1 et la SCD2. Des études
réalisées chez l’animal ont montré que l’acti-
vité de la SCD1 et ses métabolites pourraient
jouer un rôle important dans l’obésité. Les
souris déficitaires en SDC1 sont protégées
de l’obésité induite par l’alimentation, alors
qu’une activité élevée de la SCD1 est liée à
l’obésité chez l’animal. Chez l’homme, des
concentrations plasmatiques élevées d’acide
palmitoléique sont associées à une hypertri-
glycéridémie, à l’obésité en particulier abdo-
minale. À l’inverse, des modèles animaux ont
montré que l’acide palmitoléique du tissu
adipeux pouvait être considéré comme une
lipokine contribuant à la résistance à l’obé-
sité et à l’amélioration de l’insulinosensibi-
lité. Cette discordance pourrait être liée au
fait que l’acide palmitoléique plasmatique
ne reflète que l’activité hépatique de la SCD1
et non pas celle du tissu adipeux. Enfin, on
sait que les glucides peuvent augmenter
l’activité de la SCD1 au niveau hépatique, ce
qui pourrait contribuer à la stéatose hépa-
tique induite par les glucides. Ces derniers
induisent une lipogenèse hépatique de
novo à partir de l’acétate jusqu’à l’acide
palmitique. L’équipe de A. Baylin poursuit
l’exploitation de sa cohorte au Costa Rica
avec 1 926 sujets adultes chez qui la préva-
lence de l’obésité a été établie. Deux index
indirects de l’activité des désaturases (C16:1/
C16:0 et C18:1/C18:0) ont été calculés par
les mesures des concentrations en acides
gras et de l’activité de la SCD1 au niveau
du tissu adipeux. Une association positive
entre la concentration tissulaire en acide
palmitoléique du tissu adipeux et l’obésité
a été mise en évidence (RR = 2,27 ; IC95 :
1,52-3,38 % ; p < 0,0001), ce qui signifie que
l’obésité, après ajustement multivarié, aug-
mente avec cette concentration et l’index de
désaturation (RR = 2,38 ; IC95 : 1,60-3,53 % ;
p < 0,0001). Cette association entre l’acide
palmitoléique du tissu adipeux et l’obésité
est atténuée chez les personnes ayant un
faible apport en glucides.
Ainsi, l’acide palmitoléique du tissu adipeux
ne réduit pas l’obésité chez l’homme mais est
associé à une plus grande prévalence d’obé-
sité. L’atténuation du lien entre concentration
en acide palmitoléique et obésité en cas de
faible apport en glucides montre au contraire
que les glucides en excès peuvent favoriser
l’adiposité en activant la désaturase SCD1 et
aggraver la stéatose hépatique.
J.M. Lecerf
•Gong J et al. Am J Clin Nutr 2011;93:186-9.
>>>

Correspondances en Métabolismes Hormones Diabètes et Nutrition - Vol. XVI - nos 1-2 - janvier-février 2012
16
Revue de presse
Dans le cadre d’une bithérapie, chez l’adulte diabétique de type 2 âgé de
18 ans et plus, insuffi samment contrôlé par une monothérapie bien conduite,
associée à un régime alimentaire et à la pratique d’un exercice physique.
DONG 7138 - 2011/08 287091182
®
5 mg
faite périodiquement par la suite. Insuffi sance hépatique : La saxagliptine doit être utilisée avec précaution
chez les patients ayant une insuffi sance hépatique modérée, et n’est pas recommandée chez les patients ayant
une insuffi sance hépatique sévère. Utilisation avec les sulfamides hypoglycémiants : Une dose plus faible de
sulfamides hypoglycémiants peut être nécessaire afi n de réduire le risque d’hypoglycémie, lors d’une utilisation
en association avec Onglyza. Réactions d’hypersensibilité : Onglyza ne doit pas être utilisé chez les patients
ayant déjà présenté une réaction d’hypersensibilité grave à un inhibiteur de la dipeptidyl peptidase 4 (DPP-4).
Sujets âgés : Une attention particulière est requise chez les patients âgés de 75 ans. Troubles cutanés : Bien
qu’une augmentation de l’incidence des lésions cutanées n’ait pas été observée lors des essais cliniques,
l’expérience est limitée chez les patients présentant des complications cutanées liées au diabète. Des cas
d’éruption cutanée ont été rapportés avec la classe des inhibiteurs de la DPP4 depuis leur commercialisation.
Les éruptions cutanées sont également mentionnées comme un évènement indésirable d’Onglyza. Par
conséquent, conformément aux soins de routine des patients diabétiques, la surveillance des troubles cutanés,
tels que des cloques, une ulcération ou une éruption cutanée est recommandée. Insuffi sance cardiaque :
L’expérience chez les patients insuffi sants cardiaques de classe NYHA I-II est limitée, et il n’y a pas d’expérience
dans les études cliniques avec la saxagliptine chez les patients de classe NYHA III-IV. Patients immunodéprimés :
L’effi cacité et le profi l de tolérance de la saxagliptine n’ont pas été établis chez les patients immunodéprimés,
tels que les patients qui ont subi une transplantation d’organe ou les patients atteints d’un syndrome de l’immuno-
défi cience humaine. Utilisation avec les inducteurs puissants du CYP 3A4 : L’utilisation d’inducteurs du CYP
3A4 (carbamazépine, dexaméthasone, phénobarbital, phénytoïne et rifampicine) peut réduire l’effet hypoglycémiant
d’Onglyza. Lactose : Les comprimés contiennent du lactose monohydraté. Les patients présentant des problèmes
héréditaires rares d’intolérance au galactose, de défi cience en Lapp lactase ou de malabsorption du glucose
galactose ne doivent pas prendre ce médicament. INTERACTIONS AVEC D’AUTRES MÉDICAMENTS ET
AUTRES FORMES D’INTERACTIONS* : Les données cliniques présentées ci-dessous indiquent que le
risque d’interactions cliniquement signifi catives avec des médicaments administrés conjointement est faible.
Au cours d’études cliniques réalisées chez des sujets sains, ni la pharmacocinétique de la saxagliptine ni celle
de son principal métabolite n’ont été modifi ées de manière signifi cative par la metformine, le glibenclamide,
la pioglitazone, la digoxine, la simvastatine, l’oméprazole, les antiacides ou la famotidine. En outre, la saxagliptine
n’a pas modifi é de manière signifi cative la pharmacocinétique de la metformine, du glibenclamide, de la
pioglitazone, de la digoxine, de la simvastatine, du diltiazem ou du kétoconazole. Interactions avec : + diltiazem
+ kétoconazole + rifampicine. GROSSESSE ET ALLAITEMENT* : Grossesse : Onglyza ne doit pas être
utilisé au cours de la grossesse à moins d’une nécessité absolue. Allaitement : Une décision doit être prise
d’arrêter l’allaitement ou d’interrompre le traitement en tenant compte du bénéfi ce de l’allaitement pour l’enfant
et du bénéfi ce du traitement pour la mère. EFFETS SUR L’APTITUDE À CONDUIRE DES VÉHICULES
ET À UTILISER DES MACHINES* : Des vertiges ont été rapportés dans les études avec de la saxagliptine. EFFETS
INDÉSIRABLES* : Les effets indésirables rapportés chez au moins ≥ 5% des patients traités avec la
saxagliptine 5 mg et plus fréquemment que chez les patients traités par placebo ou qui ont été rapportés chez
≥ 2% de patients traités avec la saxagliptine 5 mg et chez ≥ 1% plus fréquemment comparé au placebo sont
présentés ci-après : 1. En association à la metformine (en ajout et en association initiale avec la metformine) :
infections des voies respiratoires supérieures, infections des voies urinaires, gastroentérites, sinusites,
rhinopharyngites (uniquement en association initiale avec la metformine), céphalées, vomissements :
fréquents. 2. En association à un sulfamide hypoglycémiant (glibenclamide) : infections des voies
respiratoires supérieures, infections des voies urinaires, gastroentérites, sinusites, céphalées, vomissements :
fréquents ; hypoglycémies : très fréquentes (pas de différence statistiquement signifi cative par rapport au
placebo. Incidence des hypoglycémies confi rmées peu fréquente pour Onglyza 5 mg (0.8%) et placebo
(0.7%)). 3. En association à une thiazolidinedione : infections des voies respiratoires supérieures, infections
des voies urinaires, gastroentérites, sinusites, céphalées, vomissements, œdèmes périphériques : fréquents
(tous les effets indésirables rapportés d’œdème périphérique ont été d’intensité légère à modérée et aucun
n’a entraîné l’arrêt du traitement). En plus, des évènements indésirables secondaires ont été rapportés
indépendamment d’une relation de causalité avec le traitement et survenant plus fréquemment chez les patients
traités avec Onglyza incluent une hypersensibilité (0,6% versus 0%) et une éruption cutanée (1,4% versus 1%)
par comparaison avec le placebo. Les évènements indésirables, considérés par l’investigateur comme au moins
possiblement liés au traitement et rapportés chez au moins deux patients de plus traités avec la saxagliptine
5 mg par rapport au contrôle, sont décrits ci-dessous. - En association à la metformine : dyspepsie (fréquent)
et myalgie (fréquent). - En association à un sulfamide hypoglycémiant (glibenclamide) : fatigue (peu fréquent),
dyslipidémie (peu fréquent) et hypertriglycéridémie (peu fréquent). En association initiale avec la metformine :
gastrite (fréquent), arthralgie (peu fréquent), myalgie (peu fréquent) et dysfonction érectile (peu fréquent).
Investigations : Dans l’ensemble des études cliniques, l’incidence des évènements indésirables biologiques
a été similaire chez les patients traités par la saxagliptine 5 mg et chez les patients traités par placebo.
Les diminutions du nombre de lymphocytes n’ont pas été associées à des effets indésirables cliniquement
signifi catifs. La signifi cativité clinique de cette diminution du nombre de lymphocytes comparativement au
placebo n’est pas connue. SURDOSAGE* : PROPRIETES PHARMACOLOGIQUES* : PROPRIÉTÉS
PHARMACODYNAMIQUES* : Classe pharmacothérapeutique : médicaments utilisés dans le diabète. Inhibiteur
de la Dipeptidyl peptidase 4 (DPP-4), code ATC : A10BH03. PROPRIÉTÉS PHARMACOCINÉTIQUES * :
DONNÉES DE SÉCURITÉ PRÉCLINIQUE* : DONNÉES PHARMACEUTIQUES* : DURÉE DE
CONSERVATION : 3 ans. PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION : Pas de précautions
particulières de conservation. PRÉSENTATION ET NUMÉROS D’IDENTIFICATION ADMINISTRATIVE-
CLASSIFICATION EN MATIÉRE DE DÉLIVRANCE : Liste I. EU/1/09/545/009 – CIP 3400939735887
– 30 comprimés pelliculés sous blister perforé unitaire (Aluminium/Aluminium) – Prix : 45,38 €. Remb. Séc.
Soc. à 65% - Collect. EU/1/09/545/010 – CIP 3400957595630 – 90 comprimés pelliculés sous blister
perforé unitaire (Aluminium/Aluminium) – Collect. Information médicale et Pharmacovigilance Bristol-Myers
Squibb : Tél (numéro Azur) : 0 810 410 500 ou 01 58 83 84 96. [email protected]. Fax : 0 805 405 558
ou 01 58 83 66 98. EXPLOITANT : Bristol-Myers Squibb - 3, rue Joseph Monier - BP 325 - 92500
Rueil-Malmaison. DATE DE REVISION : [ONGLY5/MLR/0411.1].
* Des informations détaillées sur ce médicament sont disponibles sur le site internet de
l’Agence Européenne du Médicament (EMA) : http://www.ema.europa.eu/.
ONGLYZA® 5 mg, comprimés pelliculés. COMPOSITION* : Saxagliptine (sous forme de chlorhydrate) :
5 mg / comprimé. Excipients dont lactose qsp 1 comprimé. FORME PHARMACEUTIQUE* : Comprimé
pelliculé (comprimé). DONNÉES CLINIQUES : INDICATIONS THÉRAPEUTIQUES : En association :
Onglyza est indiqué chez les patients adultes âgés de 18 ans et plus atteints de diabète de type 2 pour améliorer
le contrôle de la glycémie : • en association avec la metformine, lorsque la metformine seule, associée à un
régime alimentaire et à la pratique d’un exercice physique, ne permet pas d’obtenir un contrôle adéquat de la
glycémie. • en association avec un sulfamide hypoglycémiant, lorsque le sulfamide hypoglycémiant seul,
associé à un régime alimentaire et à la pratique d’un exercice physique, n’assure pas un contrôle adéquat de
la glycémie chez les patients pour lesquels l’utilisation de metformine est considérée comme inappropriée.
• en association avec une thiazolidinedione, lorsque la thiazolidinedione seule, associée à un régime alimentaire
et à la pratique d’un exercice physique, n’assure pas un contrôle adéquat de la glycémie chez les patients pour
lesquels l’utilisation d’une thiazolidinedione est considérée comme appropriée. POSOLOGIE ET MODE
D’ADMINISTRATION* : Posologie : En association : La dose recommandée d’Onglyza est de 5 mg une fois
par jour en association avec la metformine, une thiazolidinedione ou un sulfamide hypoglycémiant. Populations
particulières : Sujets âgés (
≥
65 ans) : Aucune adaptation de la dose n’est recommandée en fonction de l’âge
uniquement. L’expérience chez les patients âgés de 75 ans et plus est très limitée et une attention particulière
est requise lorsque l’on traite cette population. Patients insuffi sants rénaux : Aucune adaptation de la dose
n’est recommandée chez les patients atteints d’insuffi sance rénale légère. La dose d’Onglyza doit être réduite
à 2,5 mg une fois par jour chez les patients ayant une insuffi sance rénale modérée ou sévère. L’expérience chez
les patients ayant une insuffi sance rénale sévère est limitée. Par conséquent, la saxagliptine doit être utilisée
avec précaution dans cette population. Onglyza n’est pas recommandé chez les patients avec une insuffi sance
terminale (ESDR) requérant une hémodialyse. Parce que la dose d’Onglyza doit être limitée à 2,5 mg sur la
base de la fonction rénale, une évaluation de la fonction rénale est recommandée avant l’initiation du traitement
par Onglyza et, dans le cadre du suivi de routine, l’évaluation rénale doit être faite périodiquement par la suite.
Patients insuffi sants hépatiques : Aucune adaptation de la dose n’est nécessaire chez les patients atteints
d’insuffi sance hépatique légère ou modérée. La saxagliptine doit être utilisée avec précaution chez les patients
ayant une insuffi sance hépatique modérée, et n’est pas recommandée chez les patients ayant une insuffi sance
hépatique sévère. Population pédiatrique : La tolérance et l’effi cacité d’Onglyza chez les enfants âgés de moins
de 18 ans n’ont pas encore été établies. Aucune donnée n’est disponible. Coût du traitement journalier :
1,51 €. Mode d’administration : Onglyza peut être pris au cours ou en dehors des repas à n’importe quel
moment de la journée. Si le patient oublie de prendre une dose du médicament, il doit la prendre dès qu’il s’en
rend compte. Il ne doit pas prendre une double dose le même jour. CONTRE-INDICATIONS : Hypersensibilité
à la substance active ou à l’un des excipients. MISES EN GARDE SPECIALES ET PRÉCAUTIONS
D’EMPLOI* : Général : Onglyza ne doit pas être utilisé chez les patients atteints de diabète de type 1 ou pour
le traitement de l’acidocétose diabétique. Insuffi sance rénale : Un ajustement posologique unique est recommandé
chez les patients ayant une insuffi sance rénale modérée ou sévère. La saxagliptine doit être utilisée avec
précaution chez les patients ayant une insuffi sance rénale sévère, et n’est pas recommandée chez les patients
ayant une insuffi sance rénale terminale (ESDR) requérant une hémodialyse. L’évaluation de la fonction rénale
est recommandée avant l’initiation d’Onglyza, et dans le cadre du suivi de routine, l’évaluation rénale doit être
17792011 - AP Onglyza 5 Mg 210x297.indd 1 01/09/11 14:10
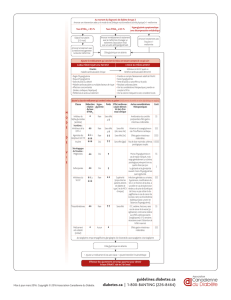
Utilisation de la metformine
dans le diabète gestationnel :
devenir des enfants à 2ans
Metformin in Gestational diabetes (MIG) a
étudié les conséquences de l’utilisation de
la metformine et de l’insuline dans le cadre
du diabète gestationnel. Les enfants exposés
au diabète in utero ont un risque augmenté
d’obésité et une insulinorésistance majorée.
Cette insulinorésistance est probablement liée
à des modifications épigénétiques in utero.
Avec la metformine, la modification de l’insu-
linorésistance maternelle a probablement
une influence sur ces phénomènes. De plus,
la metformine traverse la barrière placentaire
et a donc un effet direct probable chez l’en-
fant. Les enfants de cette étude MIG ont donc
bénéficié d’une mesure de la composition
corporelle pour évaluer la masse adipeuse à
l’âge de 2 ans. L’hypothèse était celle d’une
diminution de l’obésité abdominale chez les
enfants du groupe metformine comparati-
vement à ceux du groupe insuline. Au total,
318 enfants ont eu une mesure de la composi-
tion corporelle. Les enfants du groupe metfor-
mine avaient une circonférence brachiale plus
élevée (p = 0,002), un pli cutané subscapulaire
et bicipital plus élevé (p = 0,02 et p = 0,04,
respectivement) que les enfants du groupe
insuline. En revanche, ils ne présentaient
pas de différence de la masse grasse totale
et abdominale. Ces résultats suggèrent que
l’exposition à la metformine in utero a conduit
à un stockage préférentiel de la graisse en
sous-cutané, pouvant résulter en une dimi-
nution du stockage de la graisse en situation
ectopique ou au niveau viscéral. La mesure
de la masse grasse abdominale n’est proba-
blement pas adaptée pour mesurer l’obésité
abdominale dans cette tranche d’âge. Cette
meilleure distribution des graisses peut être
considérée comme le premier marqueur d’un
profil métabolique favorable hérité de l’expo-
sition à la metformine. La surveillance à long
terme des enfants de cette étude se poursuit
et l’effet de la metformine sur la masse grasse
abdominale sera probablement mesurable
plus tard dans l’enfance.
C. Sanz
•Rowan JA et al. Diabetes Care 2011;34:2279-84.
Probiotiques
et accouchement prématuré
La prématurité est la plus grande cause de
morbidité et de mortalité néonatale dans le
monde. Elle concerne 6 % des naissances dans
les pays développés, comme en Scandinavie.
Ses causes sont multiples, allant de l’ infection
ou de l’inflammation chorioamniotique ou
systémique à la stimulation de l’axe hypotha-
lamo-hypophyso-surrénalien chez le fœtus ou
chez la mère, ou encore à la distension uté-
rine. Les infections représentent 25 à 40 % des
causes d’accouchement prématuré spontané.
Elles peuvent provenir d’une flore vaginale
anormale qui contamine la cavité amniotique,
active le système immunitaire et induit la pro-
duction de cytokines pro-inflammatoires, via
le lipopolysaccharide bactérien (LPS). Les cyto-
kines accroissent la production de prostaglan-
dines qui augmentent la contractilité utérine.
Or, les probiotiques pourraient corriger les
infections génitales basses et réduire l’effet
du LPS sur la réponse immunitaire.
L’objectif de cet essai est d’étudier l’effet de
l’absorption de probiotiques avec l’alimenta-
tion sur les complications d’origine infectieuse
de la grossesse, et notamment l’accouchement
prématuré. Cette étude épidémiologique nor-
végienne se fonde sur le suivi d’une cohorte
de 19 000 naissances et sur une enquête
alimentaire portant sur la fréquence de
consommation de lait fermenté contenant
des lactobacilles. Au total, 950 accouchements
prématurés (moins de 37 semaines de gesta-
tion) ont été comparés à 17 938 naissances à
terme. Les femmes ayant accouché prématu-
rément avaient consommé moins souvent des
laits fermentés riches en probiotiques (− 14 %)
[p = 0,038 ; OR : 0,857 ; IC95 : 0,741-0,99], même
après ajustement pour la parité, l’activité phy-
sique et l’éducation. En classant les femmes en
3 catégories (pas de lait fermenté, apport faible
[13 ml/j en moyenne], apport élevé [85 ml/j
en moyenne]), une association significative
était observée pour des apports élevés avec
une réduction de 18 % du risque d’accouche-
ment prématuré (OR : 0,820 ; IC95 : 0,681-0,986).
Il s’agit de la première grande étude sur cette
relation. Elle a fait l’objet d’un éditorial dans
l’American Journal of Clinical Nutrition, ce qui
n’est pas rien. Cela mérite maintenant une
étude d’intervention randomisée soit pour
toute une population de femmes enceintes,
soit chez celles ayant des antécédents d’accou-
chement prématuré.
J.M. Lecerf
•Myhre R et al. Am J Clin Nutr 2011;93:151-7.
>>>
1
/
3
100%