E Les essais thérapeutiques PRODIGE en cours DOSSIER THÉMATIQUE

212 | La Lettre du Cancérologue • Vol. XXI - n° 4 - avril 2012
DOSSIER THÉMATIQUE
XXIIIe Journée scientifi que
FFCD-PRODIGE
Les essais thérapeutiques
PRODIGE en cours
PRODIGE ongoing trials
S. Manfredi1, T. Aparicio2, A. Adenis3, J. Bennouna4
1 Secrétaire du conseil scientifi que
de la FFCD ; service des maladies
de l’appareil digestif, CHU de Pont-
chaillou, Rennes.
2 Président du conseil scientifi que
de la FFCD ; service de gastroentéro-
logie, hôpital Avicenne, Bobigny.
3 Président du conseil scientifi que
UNICANCER digestif ; centre Oscar-
Lambret, Lille.
4 Secrétaire du conseil scientifi que
UNICANCER digestif ; centre René-
Gauducheau, Nantes.
E
n 2011, 2 essais ont été menés à terme, 1 essai
a été clos prématurément pour défaut d’inclu-
sion et 2 nouvelles cohortes ont été mises en
place. En 2012, 2 nouveaux essais vont être ouverts
pour permettre la couverture d’un grand nombre
de situations cliniques en cancérologie digestive.
Actuellement, 17 essais PRODIGE sont ouverts aux
inclusions.
Cancer de l’œsophage
L’essai de phase I-II PRODIGE 3 (FFCD 0505), asso-
ciant la radiochimiothérapie au cétuximab dans
le traitement des cancers opérables, a été mené
à terme en 2011. Il a inclus 33 patients. L’analyse
est en cours.
L’essai de phase III PRODIGE 5 (ACCORD 17)
compare la chimiothérapie par 5FU + cisplatine au
FOLFOX associé à la radiothérapie dans les cancers
localement avancés. La fi n des inclusions est prévue
en 2012.
L’essai de phase III SAKK 75/08 compare, dans
les cas de cancer opérable, la séquence chimio-
thérapie (docétaxel-cisplatine) + cétuximab/radio-
chimiothérapie + cétuximab/chirurgie/cétuximab
en adjuvant à la séquence chimiothérapie (docé-
taxel-cisplatine)/radio-chimiothérapie/chirurgie.
Les inclusions ont commencé en 2012.
Cancers de l’estomac
L’étude de phase II randomisée PRODIGE 17
(ACCORD 20) évalue une chimiothérapie par
FOLFOX4 versus FOLFOX4 + panitumumab versus
FOLFOX4 + AMG 102 pour le traitement des adéno-
carcinomes de l’œsophage, du cardia et de l’estomac
localement avancés ou métastatiques. Cet essai, qui
a inclus 39 patients et teste l’effi cacité d’une molé-
cule innovante, l’AMG 102 (anticorps monoclonal
anti-HGF [Hepatocyte Growth Factor]), est en cours.
Cancers du pancréas
L’essai intergroupe de phase III PRODIGE 8-LAP 07
évalue l’utilité de la radiothérapie commencée après
4 mois de chimiothérapie première par gemcita-
bine avec ou sans erlotinib, dans le traitement des
cancers localement avancés. Il est en cours et a inclus
442 patients à ce jour.
Une étude de pharmacogénétique, FFCD 1004-
PRODIGE-GERCOR, qui examine l’effet du statut
CDA (cytidine désaminase) sur les toxicités liées à
la gemcitabine en adjuvant, est en cours et a inclus
28 patients.
Cancers des voies biliaires
L’essai de phase II randomisé FFCD 9902 évalue une
association radiochimiothérapie (5FU-cisplatine)
versus chimiothérapie seule (GEMOX) dans le traite-
ment des cancers non résécables, non métastatiques.
Cet essai a été clos avant son terme pour cause de
défaut d’inclusions, avec 35 patients inclus. L’analyse
des données est en cours.
L’essai de phase III PRODIGE 12 (ACCORD 18)
compare l’effet d’une chimiothérapie adjuvante
par GEMOX de 6 mois à celui d’une surveillance
sur la survie sans récidive et la qualité de vie chez
LK4-2012.indb 212LK4-2012.indb 212 04/05/12 15:3604/05/12 15:36

La Lettre du Cancérologue • Vol. XXI - n° 4 - avril 2012 | 213
Résumé
Le partenariat PRODIGE coordonne, par l’intermédiaire de la Fédération française de cancérologie
digestive (FFCD) ou d’UNICANCER, ou participe en cas d’essai intergroupe à 17 essais cliniques en cours
dans les cancers digestifs.
Mots-clés
Essai thérapeutique
Cancer de l’œsophage
Cancer de l’estomac
Cancer du pancréas
Cancer du côlon
Carcinome
hépatocellulaire
Summary
PRODIGE partnership coordi-
nates through FFCD or FNCLCC,
or participates in the case of
intergroup trials, in 17 ongoing
clinical trials in digestive cancer.
Keywords
Clinical trial
Oesophagus cancer
Gastric cancer
Pancreatic cancer
Colon cancer
Hepatocellular carcinoma
des patients opérés de cancers des voies biliaires
intra- et extra-hépatiques et de cancers de la
vésicule, après résection chirurgicale complète.
Cet essai, en cours, a inclus 90 patients.
Carcinome hépatocellulaire
L’essai de phase II randomisé PRODIGE 10 compare
le sorafénib au sorafénib + GEMOX dans les carci-
nomes hépatocellulaires (CHC) avancés. En cours,
il a inclus 60 patients.
L’essai de phase III PRODIGE 11 (FFCD 0803)
compare sorafénib et sorafénib + pravastatine
pour le traitement des CHC avancés en cas de
cirrhose Child A. Cet essai, en cours, a inclus
150 patients.
L’essai de phase II randomisé PRODIGE 16 (FFCD
0905) compare chimioembolisation et chimio-
embolisation + sunitinib pour le traitement de CHC
localisés non opérables. La phase pilote est close
après inclusion de 9 patients, la phase II est en cours
et a déjà inclus 17 patients.
L’essai de phase II randomisé à 4 bras PRODIGE 21
compare sorafénib, pravastatine, sorafénib +
prava statine, et soins de support. En cours, cet essai
a inclus 5 patients.
Adénocarcinomes
de l’intestin grêle
NADEGE est une cohorte nationale intergroupe,
promue par le GERCOR, qui a pour objectif d’enregis-
trer tous les cas d’adénocarcinome de l’intestin grêle
quel qu’en soit le stade (www.cohorte-nadege.com).
Deux cent soixante-six patients ont été enregistrés.
Cancer du côlon adjuvant
L’essai de phase III PRODIGE 13 (FFCD 0902)
compare 4 modalités de surveillance : ACE versus
pas d’ACE, scanner versus échographie radio du
thorax. Une étude de transfert sur sang et tissus
est adossée à cet essai, qui est en cours et a inclus
716 patients.
L’essai de phase III intergroupe IDEA compare une
chimiothérapie par FOLFOX, 3 mois versus 6 mois,
après la résection d’un cancer du côlon de stade III.
Cette étude de désescalade thérapeutique donnera
lieu à une méta-analyse de plusieurs études simi-
laires réalisées dans d’autres pays et devant inclure
plus de 10 000 patients. Cet essai, en cours, a inclus
940 patients.
L’essai randomisé de phase II PRODIGE 22 compare
une chimiothérapie néo-adjuvante par FOLFOX4 ±
cétuximab à une chirurgie d’emblée pour les cancers
coliques résécables localement avancés. Le début
des inclusions est prévu pour cette année.
Cancer du côlon métastatique
L’essai randomisé de phase II PRODIGE 9 (FFCD 0802)
évalue l’intérêt du maintien d’un traitement anti-
angiogénique (bévacizumab) pendant les périodes
de pause de chimiothérapie en première ligne pour
permettre de prolonger l’intervalle libre de chimio-
thérapie. Cette étude, en cours, a inclus 201 patients.
L’essai de phase III PRODIGE 7 (ACCORD 15) compare
une chirurgie maximale de la carcinose péritonéale
à une chirurgie + chimiohyperthermie intrapéri-
tonéale (CHIP). Il ne peut être effectué que dans
les centres habitués à réaliser les CHIP, auxquels
les patients atteints d’une carcinose péritonéale
exclusive peuvent être référés. Cette étude, en cours,
a inclus 153 patients.
L’essai de phase II randomisé PRODIGE 20 compare
une chimiothérapie de première ligne à base de
5FU avec bévacizumab à la même chimiothérapie
sans bévacizumab. Cette étude, en cours, a inclus
13 patients.
L’essai randomisé de phase II PRODIGE 14 (ACCORD 21)
évalue le meilleur protocole de chimiothérapie selon
le statut KRAS dans les cas de métastases hépatiques
exclusives initialement non résécables. Cette étude,
en cours, a inclus 35 patients.
L’essai de phase II randomisé PRODIGE 18 (ACCORD 22)
compare une chimiothérapie de deuxième ligne par
5FU ± cétuximab ou ± bévacizumab après échec
d’une première ligne avec bévacizumab dans les
cas de KRAS sauvage. Cette étude, en cours, a inclus
29 patients.
LK4-2012.indb 213LK4-2012.indb 213 04/05/12 15:3604/05/12 15:36

214 | La Lettre du Cancérologue • Vol. XXI - n° 4 - avril 2012
Les essais thérapeutiques PRODIGE en cours
DOSSIER THÉMATIQUE
XXIIIe Journée scientifi que
FFCD-PRODIGE
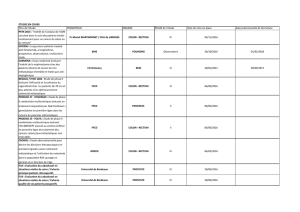
Tableau. Essais PRODIGE et FFCD en cours, inclusions arrêtées le 31 décembre 2011.
Localisation Schéma du protocole Nombre de sujets
prévus (inclus)
Cancer de l’œsophage
PRODIGE 3 (FFCD 0505), clos : phase I-II, indication d’exérèse à visée curative
(Coordonnateur : Pr J.F. Seitz, coresponsable : Pr A. Adenis) 5FU-cisplatine + RT + cétuximab 33
(15 en phase I et 27 en phase II)
PRODIGE 5 (ACCORD 17) : phase II-III, cancers inopérables
(Coordonnateur : Pr T. Conroy, coresponsable : Pr L. Bedenne)
RT (50 Gy) + FOLFOX versus RT (50 Gy)
+ 5FU-cisplatine
266
(256)
SAKK 75/08* : phase III ouvert, carcinome de l’œsophage localement avancé
(Coordonnateur : Pr L. Bedenne, coresponsable : Pr C. Mariette)
Traitement combiné avec ou sans cétuximab
dans le cancer de l’œsophage opérable (300)
Cancer du cardia
FFCD 0901 : phase II monobras multicentrique, adénocarcinomes de l’estomac
et de la JOG
(Coordonnateur : Pr C. Mariette coresponsable : Pr. O. Bouche)
6 cures 5FU cisplatine + cétuximab
suivies d’une chirurgie
+ 6 cures 5FU-cisplatine + cétuximab
63
(22)
Cancer gastrique
PRODIGE 17 (ACCORD 20) : phase II randomisée, adénocarcinomes
del’œsophage, du cardia et de l’estomac localement avancés ou métastatiques
(Coordonnateur : Dr D. Malka, coresponsable : Pr J. Taieb)
FOLFOX4 versus FOLFOX4 + panitumumab
versus FOLFOX4 + AMG 102
180
(39)
Cancer du pancréas
PRODIGE 8-LAP 07 : phase III, cancers localement évolués
(non résécables non métastatiques) puis pour les tumeurs contrôlées
(Coordonnateur : Pr P. Hammel, coresponsables : Dr S. Lagarde et Dr D. Malka)
R1 : gemcitabine versus gemcitabine + erlotinib
R2 : RTCT versus RTCT suivie de erlotinib versus
gemcitabine + erlotinib versus gemcitabine seule
902 dont 540 en France
(442)
FFCD 1004-PRODIGE-GERCOR : pharmacogénétique de la gemcitabine
(effet du statut CDA sur les toxicités liées à la gemcitabine)
(Coordonnateur : Dr L. Dahan, coresponsable : Dr J. Ciccolini)
Traitement adjuvant d’un adénocarcinome
du pancréas par gemcitabine
120
(28)
Cancer colorectal adjuvant
IDEA : phase III, cancers du côlon de stade III réséqués
(Coordonnateur : Pr T. André, coresponsable : Pr J. Taieb) FOLFOX4 simplifi é 3mois versus 6mois 2 000
(940)
PRODIGE 13 (FFCD 0902) : phase III, surveillance postopératoire
(Coordonnateur : Pr C. Lepage, coresponsable : Pr A. Adenis)
Surveillance standard versus surveillance
renforcée avec ou sans ACE
1 928
(716)
PRODIGE 22 (FFCD 1003)* : phase II randomisée, cancers coliques résécables
localement avancés)
(Coordonnateur : Dr M. Karoui, coresponsable : Pr J. Taieb)
CT néo-adjuvante par FOLFOX4
avec ou sans cétuximab versus chirurgie d’emblée
165
(0)
Cancer colorectal métastatique
FFCD 0604 : phase II, génotype UGT1A1 7/7
(Coordonnateur : Pr T. Lecomte) FOLFIRI + bévacizumab en première ligne + G-CSF 30
(19)
PRODIGE 7 (ACCORD 15) : phase III, carcinoses péritonéales
CHIP après résection d’une carcinose péritonéale
(Coordonnateur : Dr F. Quenet, coresponsables : Dr D. Elias et Dr O. Glehen)
Chirurgie maximale de la carcinose + CHIP
versus chirurgie maximale de la carcinose seule
266
(153)
PRODIGE 9 (FFCD 0802) : phase III randomisée, première ligne de chimiothérapie
(Coordonnateur : Pr T. Aparicio, coresponsable : Dr J. Bennouna)
Maintien du bévacizumab pendant une pause
de CT versus pas de traitement
492
(201)
PRODIGE 20 : phase II randomisée de traitement de première ligne
chez les sujets âgés de 75ans ou plus
(Coordonnateur : Pr T. Aparicio, coresponsable : Dr E. François)
CT FOLFOX, FOLFIRI ou LV-5FU2
avec ou sans bévacizumab
102
(13)
PRODIGE 14 (ACCORD 21) : phase II, randomisée évaluant le meilleur protocole
de CT selon le statut KRAS dans les cas de métastases hépatiques initialement
non résécables des CCR M+
(Coordonnateur : Pr M. Ychou, coresponsable : Pr R. Adam)
Meilleur protocole de CT associée à une thérapie
ciblée choisie selon le statut KRAS
256
(35)
LK4-2012.indb 214LK4-2012.indb 214 04/05/12 15:3604/05/12 15:36

La Lettre du Cancérologue • Vol. XXI - n° 4 - avril 2012 | 215
DOSSIER THÉMATIQUE
PRODIGE 18 (ACCORD 22) : phase II, randomisée de deuxième ligne
chez des patients KRAS sauvage
(Coordonnateur : Dr J. Bennouna, coresponsable : Pr M. Hebbar)
CT à base de fl uoropyrimidine ± cétuximab ou
±bévacizumab dans CCR M+ en progression après
une première ligne de traitement par bévacizumab
132
(29)
Cancer du rectum
FFCD 1102* : phase II, première ligne par FOLFIRINOX en cas de métastases
synchrones non résécables
(Coordonnateur : Dr J.B. Bachet, coresponsable : Pr P. Rougier)
FOLFIRINOX pour cancer du rectum avec métastases
synchrones non résécables
65
(0)
Cancer des voies biliaires
FFCD 9902, clos : phase II-III, cancers non résécables, non métastatiques
(Coordonnateur : Pr B. Chauffert, coresponsable : Pr J.M. Phelip) 5FU-cisplatine + radiothérapie versus GEMOX 70
(35)
PRODIGE 12 (ACCORD 18) : voies biliaires adjuvant
(Coordonnateur : Dr E. Boucher, coresponsable : Pr J.M. Phelip) GEMOX versus surveillance 190
(90)
Carcinome hépatocellulaire
PRODIGE 10 : phase II randomisée, carcinomes non résécables
(Coordonnateur : Dr E. Assenat, coresponsable : Dr V. Boige) Sorafénib versus sorafénib + GEMOX 90
(60)
PRODIGE 11 (FFCD 0803) : phase III, carcinomes non résécables Child A
(Coordonnateur : Dr J.L. Jouve, coresponsable : Dr J. Denis) Sorafénib versus sorafénib + pravastatine 474
(150)
PRODIGE 16 (FFCD 0905) : phase II randomisée, carcinomes localisés
nonopérables
(Coordonnateur : Pr. M Hebbar, coresponsables : Dr T. De Baere et Dr J.D. Grange)
Chimioembolisation
versus chimioembolisation + sunitinib
70
Phase pilote : 9 (clos)
Phase II : 17/70
Phase III : 120
PRODIGE 21 : phase II randomisée, carcinomes Child B
(Coordonnateur : Pr J.F. Blanc, coresponsable : Dr E. Boucher)
Sorafénib versus pravastatine versus sorafénib +
pravastatine versus soins de support
160
(5)
Adénocarcinomes de l’intestin grêle
NADEGE : cohorte nationale intergroupe
(Coordonnateur : Pr T. Aparicio, coresponsable : Dr P. Afchain)
Enregistrement de tous les cas d’adénocarcinome
del’intestin grêle quel qu’en soit le stade
118
(266)
Cancer anal
FFCD 0904* : phase I, phase II, carcinomes épidermoïdes de l’anus localisés
(Coordonnateur : Pr T. Aparicio, coresponsable : Dr V. Vendrely) RT-CT associée au panitumumab Phase I : 9 à 18
Phase II : 40
Cohorte Tumeurs rares
Cohorte “Tumeurs rares”
(Coordonnateur : Pr J.F. Émile) 50
Tumeurs endocrines
Cohorte “Carcinome endocrine peu différencié”
(Coordonnateur : Dr T. Walter, coresponsable : Pr G. Cadiot) 9
FFCD 0906
(Coordonnateur : Pr E. Mitry)
Étude de l’évolution de la fonction rénale
chez des patients traités par streptozocine
140
Rétrospective : 77/110
Prospective : 19/30
ACE : antigène carcinoembryonnaire ; CHIP : chimiohyperthermie intrapéritonéale ; CT : chimiothérapie ; G-CSF :
Granulocyte Colony-Stimulating Factor ;
JOG : jonction œsogastrique ;
RT : radiothérapie ; RTCT : radiochimiothérapie
.
* Essai dont l’ouverture est prévue courant 2012.
Cohortes
Cinquante cas ont été enregistrés dans la cohorte
“Tumeurs rares”, dont l’eCRF est disponible sur le
site de la FFCD. L’eCRF de la cohorte “Carcinome
endocrine peu différencié” est consultable sur le
site de la FFCD. Pour le moment, 9 cas ont été
enregistrés. ■
LK4-2012.indb 215LK4-2012.indb 215 04/05/12 15:3604/05/12 15:36
1
/
4
100%