SOMMAIRE Y. PANIS (Clichy) E. TIRET (Paris)

FCC11–Colitesinflammatoires(RCH,Crohn):Commentchoisirlemeilleurtraitementchirurgical?
SOMMAIRE
Organisateur:
Y.PANIS(Clichy)
Modérateurs:
E.TIRET(Paris)
S.BENOIST(LeKremlinBicêtre)
CommentdifférencierunecolitedeCrohnd’uneRCH?
X.TRETON(Clichy)
Crohncolique:colectomiesegmentaireousubtotale?
E.COTTE(Lyon)
RCH:iléorectaleouiléoanale?
Y.PANIS(Clichy)
QuandproposerunestomiedéfinitivedanslamaladiedeCrohn?
E.TIRET(Paris)

FCC11–Colitesinflammatoires(RCH,Crohn):Commentchoisirlemeilleurtraitementchirurgical?
COMMENTDIFFERENCIERUNECOLITEDECROHND'UNERCH?
XavierTRETON
Pôledesmaladiesdel’appareildigestif
HôpitalBEAUJON,Clichy
Selonlesséries,chez10à30%despatientssouffrantd’unecoliteinflammatoire,l’établissementd’un
diagnosticprécisdemaladiedeCrohn(MC)ouderectocolitehémorragique(RCH)resteincertain.Onparle
alorsdecoliteinflammatoireinclassée.Cettesituationneposegénéralementpasdedifficultémajeuredeprise
enchargepuisquelaplupartdestraitementsmédicauxactuelssontefficacespourlesdeuxsous‐typesde
maladiesinflammatoireschroniquesintestinales(MICI),etquelesprogrammesdedépistagesendoscopiques
deladysplasieetducancersontégalementidentiques.Enrevanche,cetteincertitudepeutposerdes
difficultésdechoixthérapeutiquesprincipalementdanstroissituations:1‐lesmaladiesréfractaires,puisque
certainstraitementsd’utilisationplusdélicaten’ontpasd’efficacitédémontréepourl’uneoul’autreformede
MICI(parexemple,l’efficacitéduméthotrexaten’estactuellementpasdémontréedanslaRCH),2‐l’indication
àuntraitementchirurgical(lacertitudedudiagnosticdemaladiedeCrohnferaengénéralpréférerla
conservationdurectum,sauflésionsrectalesbassesouanalessévères)et3‐ aprèsunecolectomie,pour
évaluerlesrisquesderécidivesetchoisird’introduireounonuntraitementpost‐opératoire.
Laprincipaledifficultéprovientdufaitqu’actuellementlediagnosticd’uneMICIetdesontypereposesurun
faisceaud’argumentscliniques,endoscopiesethistologiques,sansgoldstandard,nijugedepaixdansles
formesoùl’ensembledesélémentsn’estpasstrictementcohérent.Afind’essayerd’affinerlediagnostique,on
devradoncrechercherlesélémentscliniques,morphologiquesetbiologiquessuivants:
1. Élémentscliniquesd’orientation
Ons’attacheraàfairepréciseruneéventuelleconsommationdetabacetsacinétique,puisqu’ilest
habituel,encasdeRCH,devoirapparaitrelespremierssymptômesaprèsunsevrage.Cependant,
quelquesargumentslaissentpenserquelesformespurementcoliquesdemaladiedeCrohnpourraient
avoirlemêmecomportementvis‐à‐visdutabacquelaRCH.Unantécédentd’appendicectomieavantl’âge
de20ans,iraplutôtcontrelediagnosticdeRCH.Larecherched’antécédentsproctologiquesancienssera
égalementutile(fistulescomplexes,ulcérationsanales),mêmesiunantécédentdefistuleuniqueavec
trajetsimplesoussphinctérien,d’évolutionfavorablesansrécidive,posesouventdesproblèmes
d’interprétationnosologique(fistuleCrohnienne?banale?).Cesargumentscliniquesd’orientationsont
doncgénéralementinsuffisantspourclasseraveccertitudeletypedeMICI.Ilsdevrontdonc
habituellementêtrecomplétéspardesdonnéesmorphologiquesetbiologiques.

FCC11–Colitesinflammatoires(RCH,Crohn):Commentchoisirlemeilleurtraitementchirurgical?
2. Elémentsmorphologiquesd’orientation
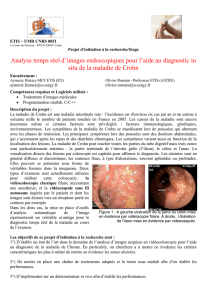
Ilfautreprendrelesdonnéesdesexamensendoscopiques/histologiquesantérieursetparfoiscompléterle
bilanmorphologiquelésionnel.Ilconvientgénéralementdevérifierl’absencedegranulomeshistologiquesqui
signentévidemmentlediagnosticd’unemaladiedeCrohn.Surlesexamensendoscopiquesclassiques
(endoscopiesdigestiveshautesetbasses),onrechercheralaprésenced’uneiléitemacroscopiqueou
histologique.L’iléiten’auradevaleurpourorienterversundiagnosticdemaladiedeCrohnquelorsqu’elleest
constatéeàdistanced’uneatteinteinflammatoireducolonproximalcontigu.Eneffet,encasdepancoliteavec
inflammationcaecaleetbéancedelavalvuledeBauhin,uneiléitederefux(Backwashileitis),peutêtre
observéedansd’authentiquesRCH.Enrevanche,laprésenced’unegastritefocaleactivesansHelicobacter
Pylori,demêmequedesulcérationsaphtoides,ouuneduodénitehistologique,sont,chezl’adulte,debons
argumentsenfaveurd’unemaladiedeCrohn.Ilfautdoncinsistersurlaréalisationdebiopsies,mêmeencas
d’examenendoscopiquejugémacroscopiquementnormal.
Lapertinencedesexplorationsmorphologiquesmodernesdel’intestingrêledanscettesituationdemeilleure
caractérisationdescolitesinclassées,àlarecherchedelésionsintestinalesenfaveurd’unemaladiedeCrohna
récemmentétéanalyséeparlesexpertsduconsensuseuropéenECCO(Crohn’sandColitisOrganisation).Les
explorationsradiologiques,ycomprisl’entéro‐IRM,nesemblentpasapporterd’argumentssupplémentaires,
saufchezlespatientsayantunesymptomatologiesuggérantdepossibleslésionsdel’intestingrêle(syndrome
deKoenig,hypoalbuminémieetenteropathieexsudative,carenceenvitamineB12).L’entéro‐IRMpouvantêtre
considéréecommenormaleencasdelésionsintestinalescrohniennespurementmuqueuses(fauxnégatifdu
diagnosticdeMC).
Larentabilitéd’uneentéroscopieparvidéocapsuleendoscopique(VCE)danscetteindicationaétéétudiée
dansquelquesétudes.Lesrésultatssontglobalementassezdécevantspuisquesideslésionsdel’intestingrêle
sontidentifiéeschez17à70%despatients,celles‐cisontsouventaspécifiquesetnesontgénéralementpas
considéréescommesuffisantespourfairechangerl’attitudethérapeutiquedéjàengagée.Parailleurs,uneVCE
normalenepeutéliminerformellementlapossibilitéd’uneMC,commelesuggèreuneétudeprospectivedans
laquelle5/25patientsavecVCEnormaleontdéveloppéultérieurementdeslésionsintestinaledeMC.Le
consensusrecommandenéanmoinslaréalisationdecetexamenengardantàl’espritd’interprétersesdonnées
aveclesréservesnécessaires.
3. Elémentsbiologiquesd’orientation
LapartmodéréedelagénétiquedanslaphysiopathologiedesMICIetlavariabilitéphénotypiquedespatients,
expliquentquemalgrélefaitd’avoirdécouvertunecentainedegênesdesusceptibilitédesMICI,aucuntest
génétiqueàviséediagnostiquen’estactuellementdisponible.
CertainsprofilssérologiquessontassociésàlaMC(ASCA)etàlaRCH(pANCA).LedosagecombinédesASCAet
pANCAencasdeMICI«classique»permetleclassemententreMCetRCHavecunesensibilitémédiocre(40‐
50%)etunespécificitésupérieureà90%.Cependantencascoliteinflammatoireinclasséelesrésultatsdes
sérologiessontplusdécevants,carplusdelamoitiédespatientsdanscettesituationsontséronégatifs.De

FCC11–Colitesinflammatoires(RCH,Crohn):Commentchoisirlemeilleurtraitementchirurgical?
plus,seuls45%despatientsfinissentpardévelopperunphénotypecertaindeMCoudeRCH«prédit»parleur
profilsérologiqueinitialautermed’unsuivide10ans.D’autressérologiespermettentd’affinerceprofil(anti‐
flagelline,anti‐OMPCetc..),maisellesnesontactuellementpasdisponiblesenpratiquequotidienne.
4. Nouveauxetfutursbiomarqueurs
Denombreuseséquipess’attachentàidentifierdesnouveauxbiomarqueursdansledomainedesMICI,pouren
faciliterlediagnostic,pourtenterd’enprédirel’évolutivitéetlaréponsepersonnaliséeauxdifférents
traitementsdisponibles.Ainsi,certainesentreprisesdebiotechnologiesontcommercialisé,principalementaux
USA,destestscomplexesetextrêmementcouteuxcombinantplusieurssérologiesetdesanalysesgénétiques.
Lesrésultatsdisponiblesdecestestsbiologiques«combinés»sontpourl’heurepeuconvaincantsetloind’une
utilisationroutinière.Parmilespisteslesplussolidesentermesdebiomarqueurs,lesmicroARN(petitsARN
noncodants),quiontdéjàlapreuvedeleurpertinencedansdiverscancers,représententprobablement
l’avenir.Eneffet,plusieursétudesindépendantesmontrentquedessignaturesmoléculairesenmicroARN
spécifiquesdelaMCetdelaRCHpeuventêtreobtenuesàpartirdebiopsiesendoscopiques.
Pourconclure,puisqu’iln’existeaucunexamen(«goldstandard»)permettantd’affirmeràluiseul,ensituation
classique,lediagnosticdecertituded’uneMCoud’uneRCH,ceciestencoreplusvrailorsquelediagnostic
hésiteentrelesdeuxformes.Ceciexpliquelanécessitédemettreaupointdenouveauxbiomarqueurs
relevantsdesMICI.Aujourd’hui,ilfautassocierlesélémentscliniquesetmorphologiques,demanderune
explorationparVCE(précédéed’unecapsulefactice‐Patency‐afindes’assurerdel’absencederisque
d’obstructionsursténoseméconnue)etprescrirelessérologiesASCAetpANCA.Malgrécesprécautions,près
delamoitiédespatientsresterontaveclediagnosticdecoliteinflammatoireinclasséequeseulletemps
permettradefaireévoluerendiagnosticdeMCoudeRCH.

FCC11–Colitesinflammatoires(RCH,Crohn):Commentchoisirlemeilleurtraitementchirurgical?
Références:
SatsangiJ,SilverbergMS,VermeireS,etal.TheMontrealclassificationofinflammatoryboweldisease:
controversies,consensus,andimplications.Gut2006;55:749–753.
MartlandGT,ShepherdNA.Indeterminatecolitis:definition,diagnosis,implicationsandapleafornosological
sanity.Histopathology2007;50:83–96.
MitchellPJ,RabauMJ,HaboubiNY.Indeterminatecolitis.TechColoprocol2007;11:91–96.
BruiningDH,LoftusEV.Evolvingdiagnosticstrategiesforinflammatoryboweldisease.CurrGastroenterolRep
2006;8:478–485.
PapadakisKA,YangH,IppolitiA,etal.Anti‐flagellin(CBir1)phenotypicandgeneticCrohn’sdisease
associations.InflammBowelDis2007;13:524–530.
BourreilleA,IgnjatovicA,AabakkenLetal.WorldOrganisationofDigestiveEndoscopy(OMED)andthe
EuropeanCrohn'sandColitisOrganisation(ECCO).Roleofsmall‐bowelendoscopyinthemanagementof
patientswithinflammatoryboweldisease:aninternationalOMED‐ECCOconsensus.Endoscopy.2009
Jul;41(7):618‐37
LewisDJ.TheUtilityofBiomarkersintheDiagnosisandTherapyofInflammatory
BowelDisease.Gastroenterology2011;140:1817–1826
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
1
/
16
100%