Télécharger le poster

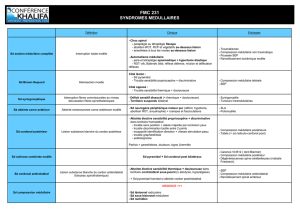
Syndrome médullaire et/ou syndrome de la
queue de cheval dans un contexte néoplasique
I. Khafajy, N. Naggara, I. Radhouani, Y Ould Hmeidi, PY. Brillet, A. Augier
Service de Radiologie - Hôpital Avicenne – Bobigny - France

Introduction
La survenue d’un syndrome médullaire (SM) ou de la queue de cheval (SQC) chez un patient suivi pour une pathologie
néoplasique est une situation clinique fréquente.
Dans ce contexte, ce type de syndrome est le plus souvent expliqué par la présence d’une métastase vertébrale lytique,
s’étendant dans le canal rachidien et comprimant les éléments neurologiques : Epidurite tumorale (90%).
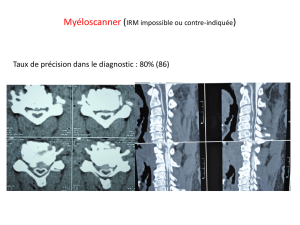
L’IRM est indispensable pour affirmer l’épidurite tumorale et en faire le bilan anatomique afin de planifier la prise en charge
thérapeutique (radiothérapie, chirurgie).
Plus rarement, ces syndromes peuvent être expliqués par d’autres types de lésions dont il sera capital de faire le
diagnostic en raison de choix thérapeutiques différents :
- Méningite carcinomateuse
- Métastase médullaire
- Myélopathie para-néoplasique
- Myélopathie radio-induite
- Myélopathie chimio-induite
- Lipomatose cortico-induite
- Hématome intra-canalaire post-PL favorisée par une thrombopénie chimio-induite
En cas de SM et/ou SQC dans un contexte néoplasique, L’IRM doit donc :
- Etre réalisée en urgence.
- Acquérir l’ensemble du rachis.
- Etre réalisée systématiquement avec injection de gadolinium, même en l’absence de compression médullaire.

Introduction : Gamme diagnostique dans un contexte néoplasique
Espace épidural
Epidurite tumorale
Lipomatose
Hématome
Espace sous-dural
Méningite carcinomateuse
Hématome
Espace sous-arachnoïdien
Méningite carcinomateuse
« Espace » intra-médullaire
Métastases médullaires
Myélopathie para-néoplasique
Myélopathie radique
Myélopathie chimio-induite

Introduction : Intérêt dans la prise en charge thérapeutique
Contexte néoplasique
SM et/ou SQC
IRM du rachis
Epidurite
tumorale Méningite
carcinomateuse Métastase
médullaire Lipomatose
épidurale Hématome
intra-canalaire
Corticothérapie
Biphospohate
Chimiothérapie
Radiothérapie
Chirurgie
Chimiothérapie
Radiothérapie Corticothérapie
Chimiothérapie
Radiothérapie
Chirurgie
Arrêt de la
corticothérapie
Chirurgie
Arrêt des
anti-coagulant
Chirurgie

90% des causes de SM et/ou SQC dans un contexte néoplasique.
30% des patients atteints de cancers développent des métastases rachidiennes.
Les métastases rachidiennes sont responsable d’une compression médullaire dans
10-20% des cas.
5-10% des patients atteint de cancers développent une compression médullaire.
Les cancers mammaires, broncho-pulmonaires et prostatiques sont les
principaux responsables (15-20% pour chacun de des cancers).
Révélatrice du cancer dans 8% à 34%.
Epidémiologie
Physiopathologie
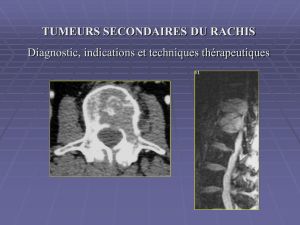
Secondaire à l’extension intra-canalaire d’une métastase osseuse de voisinage :
- 75% des cas : en rapport avec l’infiltration tumorale des tissus mous intra-canalaires.
- 25% des cas : en rapport avec les fragment osseux intra-canalaires d’un tassement corporéal tumoral.
Autres mécanismes :
- Rarement : en rapport avec l’extension intra-canalaire d’une lésion tumorale para-vertébrale, via l’envahissement des
foramens (lymphome, tumeur solide avec extension retro-péritonéale).
- Exceptionnelle : localisation secondaire épidurale isolée, sans atteinte osseuse.
Epidurite tumorale
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
1
/
40
100%