LES NOUVELLES DONNÉES ÉPIDÉMIOLOGIQUES ment adapté aux stades T3.

LES NOUVELLES DONNÉES ÉPIDÉMIOLOGIQUES
Le cancer de la prostate est devenu la première cause de cancer
chez l’homme de plus de 50 ans (plus de 40 000 nouveaux cas
en 2000) et la deuxième cause de décès par cancer. Il représente
25 % des nouveaux cas de cancers masculins (1, 2).
Le dosage régulier du prostate-specific antigen (PSA) en pratique
courante a modifié considérablement le “profil” des patients
atteints d’un cancer de la prostate. Ainsi, l’âge médian au diagnostic
tend à diminuer puisqu’il est de moins de 70 ans (1), et il n’est pas
rare de diagnostiquer ce cancer chez des hommes âgés de moins
de 55 ans (3).
Parallèlement, le nombre de tumeurs révélées à un stade méta-
statique devient faible, surtout dans les études évaluant le dépis-
tage par le PSA (moins de 1 % de patients M+ dans l’étude euro-
péenne ERSPC en cours). Déjà, dans les données issues de
l’enquête CCAFU-FRANCIM incluant 798 patients diagnosti-
qués en 1995, la répartition entre les stades était la suivante :
stades T1-T2 : 60,1 % ; stades T3-T4 : 15 % ; N+ et M+ : 17 %
(4). Le taux de progression de l’incidence du cancer de la pros-
tate est de + 4,8 % par an (+ 8 % entre 1995 et 2000) (1).
Dès 2003, et devant ces données épidémiologiques, l’Associa-
tion Française d’Urologie (AFU) a recommandé la réalisation du
dépistage du cancer de la prostate par dosage annuel du PSA total
et pratique du toucher rectal pour les hommes entre 50 et 75 ans,
si leur espérance de vie est estimée supérieure à dix ans (1). De
plus, les traitements à visée curative prennent de plus en plus
d’importance dans la pratique uro-oncologique.
LES TRAITEMENTS RADICAUX
Place de la prostatectomie totale seule aux stades localisé
et localement avancé
Pour un stade localisé T1-T2, la prostatectomie totale est le trai-
tement de référence chez l’homme de moins de 70-75 ans, avec
une probabilité de survie supérieure à dix ans. De plus, la chi-
rurgie assure le contrôle local de la maladie dans la majorité
des cas (1).
En revanche, la prostatectomie totale isolée n’est pas un traite-
ment adapté aux stades T3.
Cependant, elle peut être proposée devant :
– Une tumeur T3a “limitée” et de bas grade, avec un PSA infé-
rieur à 10 ng/ml, lorsque l’espérance de vie est supérieure à
dix ans. De plus, 10 à 15 % des cancers localement avancés
correspondent en réalité, à l’examen histologique, à une tumeur
intracapsulaire reclassée pT2.
– Devant l’atteinte unique et microscopique des ganglions lors
de l’examen extemporané du curage ganglionnaire pour une
tumeur localisée à “haut risque” (1).
Place de la radiothérapie (hors curiethérapie)
aux stades localisé et localement avancé
Au stade localisé, la radiothérapie est proposée en alternative à
la chirurgie pour les patients de plus de 70 ans, avec une morbi-
dité compétitive importante, s’il existe une contre-indication à la
chirurgie ou si le patient en exprime le souhait (1).
La radiothérapie conformationnelle doit être utilisée préféren-
tiellement à la radiothérapie conventionnelle (1).
Au stade localement avancé, la radiothérapie est associée à l’hor-
monothérapie dite concomitante : cette association constitue le trai-
tement de référence des tumeurs localement avancées (T3) pour
les patients dont l’espérance de vie est supérieure à dix ans (1).
LES TRAITEMENTS ADJUVANTS
Rationnel
Les traitements radicaux seuls (prostatectomie totale ou radio-
thérapie) peuvent s’accompagner d’un taux de rechute non négli-
geable chez des patients à haut risque : la probabilité de rechute
biochimique à cinq ans après prostatectomie totale est de 36 %
pour un patient T2c-T3 avec PSA inférieur à 20 ng/ml et un score
de Gleason égal à 8-10 (5). Après radiothérapie, cette probabi-
lité est de 49 % pour un patient T1b-T2 avec un PSA initial
compris entre 20 et 30 ng/ml (6).
D’autre part, la remontée du taux de PSA après traitement cura-
tif, associé à un temps de doublement court (inférieur à dix mois),
est un facteur prédictif du risque de survenue de métastases (7) ;
l’ascension rapide du PSA est un des marqueurs fiables d’une
maladie métastatique infraclinique (8).
Cancer de la prostate : gestion du risque carcinologique
après traitement à visée curative
Carcinologic prostate cancer risk: management after curative treatment
●
M. Soulié*
*Service d’urologie et d’andrologie, centre hospitalier universitaire Rangueil,
Toulouse.
MISE AU POINT
60
La Lettre du Cancérologue - Volume XIV - n° 2 - mars-avril 2005

61
La Lettre du Cancérologue - Volume XIV - n° 2 - mars-avril 2005
L’ensemble de ces arguments plaide, dans des populations bien
définies et sélectionnées, pour la recherche d’une stratégie d’asso-
ciation couplant geste curatif et traitement adjuvant.
Le traitement adjuvant se définit comme l’administration d’agents
antitumoraux après exérèse de la tumeur d’origine lorsqu’il
n’existe aucune preuve de l’existence d’une maladie résiduelle (9).
Son objectif est la destruction de la population cellulaire tumo-
rale alors qu’il persiste, après traitement curatif, un résidu tumo-
ral local microscopique ou une maladie micrométastatique – cette
maladie étant, par définition, indétectable (9-11).
Le principe du traitement adjuvant repose sur une attitude pro-
babiliste liée au risque de progression. Le traitement est instauré
au décours ou dans les suites du traitement à visée curative. Il
vise à prévenir la récidive.
Chez les patients à haut risque de progression, le bénéfice d’un
traitement adjuvant immédiat par rapport à un traitement différé
a été prouvé.
Populations concernées
Les populations concernées par le traitement adjuvant sont celles
à haut risque de progression, c’est-à-dire (1) :
– les patients T1-T2 avec PSA supérieur à 20 ng/ml et/ou score
de Gleason égal à 7 (4+3) ou plus (8-10) ;
– les patients cT3 et pT3 (15 à 35 % des tumeurs initialement
considérées T1c ou T2).
Chez ces patients, le risque de progression est accru en cas de
marges positives (12 à 30 % des prostatectomies totales) ou
d’atteinte des vésicules séminales (rémission complète dans seu-
lement 25 % des cas) (1).
Études cliniques
aLH-RH : les études RTOG et EORTC
Quatre études de phase III comparant les effets de la radiothé-
rapie seule versus radiothérapie + goséréline 3,6 mg[1], analogue
de la LH-RH, chez des patients atteints d’un cancer de la
prostate localement avancé ont fait l’objet de plusieurs publica-
tions (12-15).
Trois de ces études randomisées ont été rapportées par le Radia-
tion Therapy Oncology Group [RTOG] (13-15), et la quatrième
par l’European Organisation for Research and Treatment of Cancer
[EORTC] (12).
Les résultats de ces études sont présentés dans le tableau I.
Tableau I. Radiothérapie (CRT) et hormonothérapie (HT) adjuvante par aLH-RH.
Nombre Type Protocole et durée Survie Survie Métastases
de patients de traitement d’administration globale sans à distance
progression
EORTC 415 Goséréline Goséréline 78 % 74 % 9,8 %
22863 (suivi médian : en adjuvant dès le 1
er
jour de RT, (RT + HT) versus 62 % (RT + HT) (RT + HT)
(12) 66 mois) pendant 3 ans (RT seule) versus 40 % versus 29,2 %
p = 0,0002 (RT seule) (RT seule)
p = 0,0001 p < 0,0001
RTOG 945 Goséréline Goséréline dès la dernière 53 % Biologique 25 %
85-31 (suivi médian : en adjuvant semaine de RT (RT + HT) 30 % (RT + HT)
(14) 7,3 ans) jusqu’à progression versus versus versus
ou dès la rechute 38 % 9 % 39 %
(RT seule) p < 0,0001 (RT seule)
p < 0,0043 p < 0,0001
RTOG 456 Goséréline Goséréline 53 % 33 % 34 %
86-10 (suivi médian : en néo-adjuvant 1 mois avant (RT + HT) (RT + HT) (RT + HT)
(13) 8,6 ans) et 2 mois versus 44 % (RT seule) versus versus
pendant p > 0,05 21 % 45 %
la RT Score de Gleason (RT seule) (RT seule)
2-6 : 70 % p = 0,004 p = 0,04
(RT + HT) versus
52 % (RT seule)
p=0,015
RTOG 1 524 Goséréline Goséréline longue durée 80 %
92-02 (suivi médian : en adjuvant (2 mois avant (RT + HT longue)
(15) 5,8 ans) et pendant la RT versus 78,5 % 46,4 % 11,5 %
puis pendant 2 ans) (RT + HT courte) (RT + HT longue) (RT + HT longue)
versus p > 0,05 versus versus 17 %
goséréline Score de Gleason 28,1 % (RT + HT courte)
courte durée 8-10 : (RT + HT courte) p = 0,0035
(2 mois avant 81 % p < 0,0001
et pendant la RT) (RT + HT longue)
versus 70,7 %
(RT+ HT courte)
p = 0,044
[1]
Ce schéma d’administration est devenu obsolète depuis la mise sur le marché de la goséréline 10,8 mg administrée par voie sous-cutanée une fois tous les trois mois.
.../...

Les études RTOG et l’étude EORTC démontrent l’intérêt d’un
traitement adjuvant par la goséréline associée à la radiothérapie
dans le cancer de la prostate localement avancé.
Chez les patients à haut risque de progression, une hormonothé-
rapie adjuvante longue par la goséréline associée à la radiothé-
rapie permet notamment d’améliorer significativement la survie
sans progression, la survie globale et la survie spécifique.
ANTIANDROGÈNE NON STÉROÏDIEN : LE PROGRAMME EPC
(EARLY PROSTATE CANCER)
Le programme EPC est un programme d’études de phase III, mul-
ticentriques, prospectives, randomisées, en double aveugle éva-
luant l’efficacité et la tolérance versus placebo d’un traitement
adjuvant par antiandrogène (bicalutamide à la dose de 150 mg)
après prise en charge (prostatectomie totale, radiothérapie, abs-
tention/surveillance) d’un cancer de la prostate localisé ou loca-
lement avancé (16-19).
Après traitement initial laissé à l’initiative de l’investigateur,
8113 patients ont été randomisés en deux groupes : un groupe
bicalutamide 150 mg (n=4052) dans lequel le traitement est
instauré dans les deux semaines après la randomisation, et un
groupe placebo (n = 4 061). La durée de traitement prévue était
de cinq ans maximum ou jusqu’à progression (16, 17).
Les critères principaux de l’étude étaient la progression clinique
objective, documentée soit par l’imagerie, soit par des preuves
histologiques de dissémination à distance, et la survie globale.
Les durées minimale et médiane de suivi sont respectivement de
4,5 et 5,4 ans.
Les caractéristiques de la population étaient équilibrées dans les
deux groupes :
– Un tiers des patients était porteur d’une tumeur localement
avancée (T3-T4). Le statut ganglionnaire était majoritairement
N0 (environ 60 % des cas) ou Nx (environ 40 % des cas).
– Un tiers des patients était porteur d’une tumeur peu différenciée
(score de Gleason 7-10). Plus de 70 % des patients étaient trai-
tés de façon curative (prostatectomie totale ou radiothérapie) (17).
Enfin, chez les patients traités par prostatectomie totale, les
patients T3 inclus dans la randomisation étaient tous des patients
ayant fait l’objet d’un reclassement après analyse histologique
de la pièce opératoire [pT3] (20).
Programme EPC : résultats tous stades confondus,
quelle que soit l’attitude thérapeutique initiale (n = 8 113)
La supériorité du groupe bicalutamide 150 mg sur le groupe pla-
cebo est démontrée, avec une réduction du risque de progression
clinique de 27 % (taux de patients qui progressent : 19,7 % ver-
sus 23,6 % ; hazard-ratio [HR] = 0,73 ; p < 0,0001) (16).
En ce qui concerne la survie globale, on note, à ce stade de l’étude,
une absence de différence significative entre les deux groupes.
En effet, avec cinq ans de suivi médian le recul est insuffisant et
ne permet pas de tirer une conclusion.
Les résultats du programme EPC montrent que le bénéfice d’un
traitement adjuvant par bicalutamide 150 mg est d’autant plus
important que les patients présentent des facteurs de mauvais pro-
nostic, en particulier au stade localement avancé.
Programme EPC : résultats au stade localement avancé
en adjuvant à la prostatectomie totale ou à la radiothérapie
(n = 2 024)
Ce sous-groupe comprend 2 024 patients répartis comme suit :
1719 patients dans le groupe prostatectomie totale et 305 patients
dans le groupe radiothérapie (16).
La supériorité du groupe association thérapeutique (prostatecto-
mie totale ou radiothérapie + bicalutamide 150 mg) sur le groupe
prostatectomie totale ou radiothérapie seules est démontrée avec
(tableau II) :
– une réduction du risque de progression clinique de 33 % (taux
de patients qui progressent : 18,4 % versus 24,2 % ; HR = 0,67 ;
p=0,00005) (16) ;
– une réduction du risque de progression biologique de 53 %
mesurée par le doublement du PSA, la limite inférieure de détec-
tion étant de 1 ng/ml [taux de patients qui progressent : 33,8 %
versus 53 % ; HR = 0,47 ; p < 0,001] (21) ;
–une réduction du risque d’apparition de métastases de 27 %
[taux de patients avec métastases osseuses objectivées par scin-
tigraphie osseuse : 6,0 % versus 10,2 % ; HR = 0,73 ; p < 0,05]
(21).
La réduction du risque de progression clinique est confirmée quelle
que soit l’attitude thérapeutique initiale.
Elle est de 29 % dans le groupe prostatectomie totale + bicaluta-
mide 150 mg par rapport au groupe prostatectomie totale seule
(taux de patients qui progressent : 15,6 % versus 20,0 % ;
p=0,0034) et de 42 % dans le groupe radiothérapie + bicalutamide
150 mg par rapport au groupe radiothérapie seule [taux de patients
qui progressent : 33,5 % versus 48,6 % ; p = 0,00348] (16).
L’analyse de la tolérance retrouve des effets indésirables en rap-
port avec les propriétés pharmacologiques du bicalutamide. Les
taux de gynécomasties et de mastodynies sont respectivement de
68,3 % et de 73,6 % dans le groupe bicalutamide, tous patients
confondus. Ces mastodynies sont d’intensité légère à modérée
dans 90 % des cas (16).
Les résultats du programme EPC ont permis au bicalutamide dosé
à 150 mg d’obtenir cette année une AMM (autorisation de mise
sur le marché) dans l’indication suivante : “cancer de la prostate
non métastasé au stade localement avancé, en traitement adju-
vant à la prostatectomie radicale ou à la radiothérapie”. La durée
de traitement recommandée est de cinq ans.
Tableau II.
Résultats du programme Early Prostate Cancer (EPC) au
stade localement avancé, en adjuvant à la prostatectomie radicale ou à la
radiothérapie.
Groupe Groupe
Patients (%) bicalutamide placebo p HR*
150 mg (IC
95
)
Progression 0,67
clinique 18,4 % 24,2 % 0,00005 (0,56-0,82)
Progression 33,8 % 53 % < 0,001 0,47
biologique (0,408-0,538)
Métastases 6,0 % 10,2 % < 0,05 0,73
(0,59-0,91)
* Hazard-ratio.
MISE AU POINT
64
La Lettre du Cancérologue - Volume XIV - n° 2 - mars-avril 2005
.../...

65
La Lettre du Cancérologue - Volume XIV - n° 2 - mars-avril 2005
Radiothérapie adjuvante : étude EORTC 22911 (22)
L’étude EORTC 22911, étude de phase III, multicentrique,
randomisée, a comparé la prostatectomie totale seule ou asso-
ciée à la radiothérapie.
Ont été inclus 1 500 patients T0-3N0M0 en préopératoire,
présentant au moins une des caractéristiques suivantes en
postopératoire : un dépassement capsulaire (pT3), des marges
chirurgicales positives, une invasion des vésicules séminales.
Ces patients ont été randomisés en deux groupes : un groupe
prostatectomie totale seule (n = 502) et un groupe prostatec-
tomie totale + radiothérapie (n = 503).
Les patients du groupe prostatectomie totale + radiothérapie
adjuvante ont reçu une dose totale de 60 Gy sur six semaines.
La radiothérapie était débutée en postopératoire.
La durée médiane de suivi a été de cinq ans.
Les résultats à cinq ans (tableau III) montrent que l’asso-
ciation prostatectomie totale + radiothérapie améliore de
façon significative :
– la survie sans progression clinique : 74,8 % versus 83,3 %
(réduction du risque : 32 % ; p = 0,004) ;
– la survie sans progression biochimique (doublement du PSA
par rapport au nadir ou première rechute clinique ou décès) :
51,8 % versus 72,2 % (réduction du risque : 48 % ;
p<0,0001) ;
– le contrôle locorégional (p < 0,0001).
Un suivi plus important est nécessaire pour évaluer l’impact
sur le taux de métastases et sur la survie globale.
En termes de tolérance, ces premiers résultats montrent qu’il
existe un accroissement des effets indésirables immédiats et
tardifs de grades 1 et 2 liés à la radiothérapie. Les effets indé-
sirables de grade 3 sont restés inférieurs à 5 %.
Chimiothérapie : études en cours
Le docétaxel a récemment démontré son efficacité, en asso-
ciation à la prednisone ou à la prednisolone, dans le traitement
du cancer de la prostate métastatique hormono-résistant
(se reporter au résumé des caractéristiques du produit du
docétaxel).
Le docétaxel est actuellement évalué en adjuvant dans le
cadre d’une étude clinique incluant des patients porteurs d’un
cancer de la prostate localement avancé ou à haut risque de
progression.
GESTION DU RISQUE CARCINOLOGIQUE
APRÈS TRAITEMENT CURATIF :
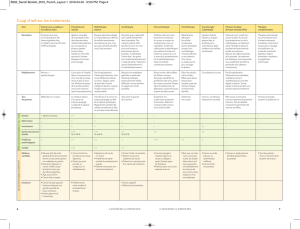
LES RECOMMANDATIONS DU CCAFU 2004 [figure 1] (1)
Au regard des données disponibles pour l’élaboration de recom-
mandations concernant le cancer de la prostate, le CCAFU a éla-
boré l’algorithme de décision décrit en figure 1.
Tableau III.
Résultats de l’étude EORTC 22911 (22).
Patients Groupe Groupe HR
(%) prostatectomieprostatectomie p (IC
95
)
totale seule
Survie sans
progression 74,8 % 83,3 % 0,004 0,68
clinique (0,52-0,89)
Survie sans
progression 51,8 % 72,2 % < 0,0001 0,52
biologique (0,42-0,64)
Figure 1. Patients T3 : recommandations de prise en charge (1).

MISE AU POINT
66
La Lettre du Cancérologue - Volume XIV - n° 2 - mars-avril 2005
CONCLUSION
L’identification de patients à haut risque de progression a conduit
à l’élaboration de stratégies thérapeutiques spécifiques.
Dans ce contexte, différentes alternatives thérapeutiques ont
prouvé leur efficacité en traitement adjuvant.
L’urologue et le radiothérapeute possèdent désormais pour ces
patients des moyens de diminuer significativement le risque de
progression clinique après traitement à visée curative. L’effet
bénéfique de la chimiothérapie dans cette situation reste encore
à démontrer.
Le choix thérapeutique est déterminé par le profil du patient,
l’objectif thérapeutique et les données issues de la littérature. Il
sera au mieux discuté au cours de réunions multidisciplinaires
qui permettront l’élaboration d’un programme de soin person-
nalisé et adapté au patient. Ce programme devra ensuite être dis-
cuté avec le patient et son entourage familial et médical.
■
R
ÉFÉRENCES BIBLIOGRAPHIQUES
1. Soulié M et al. Cancer de la prostate. In: CCAFU. Recommandations en
uro-oncologie 2004 ; Prog Urol 2004;14(suppl.1):913-57.
2. Remontet L et al. Estimations nationales : tendances de l’incidence et de la
mortalité par cancer en France entre 1978 et 2000. Bull Epidemiol Hebdo
2003;41-2.
3. Nguyen TD et al. Cancer de la prostate diagnostiqué avant 55 ans : une
étude rétrospective du groupe des cancers rares. Bull Cancer 2004;91:959-64.
4. Soulié M et al. Le cancer de la prostate : résultats de l’étude CCAFU-
FRANCIM. Prog Urol 2001;11:478-85.
5. Grossfeld GD et al. Predicting disease recurrence in intermediate and high
risk patients undergoing radical prostatectomy using percent positive biopsies:
results from CAPSURE. Urology 2002;39:560-5.
6. SOR. Cancer de la prostate non métastatique. John Libbey Eurotext Eds
2002:142.
7. Pound C et al. Natural history of progression after PSA elevation following
radical prostatectomy. JAMA 1999;281:1591-7.
8. Droz JP et al. Prostate cancer: management of advanced disease. Ann Oncol
2002;89-94.
9. Evens EA et al. Adjuvant chemotherapy. In: Perry MC The Chemotherapy
source book. Third Edition. Lippincott Williams & Wilkins Eds 2001:48-69.
10. Pantel K et al. Detection and clinical importance of micrometastatic
disease. J Natl Cancer Inst 1999;91:1113-24.
11. Chu E et al. Principles of cancer management: chemotherapy. In: De Vita
VT, Jr Cancer. Principles & Practice of Oncology. 6th Edition. Lippincott &
Williams Eds 2001:289-307.
12. Bolla M et al. Long-term results with immediate androgen suppression
and external irradiation in patients with locally advanced prostate cancer (an
EORTC study): a phase III randomised trial. Lancet 2002;360:103-8.
13.Pilepich M et al. Phase III Radiation Therapy Oncology Group (RTOG) trial 86-10
of androgen deprivation adjuvant to definitive radiotherapy in locally advanced
carcinoma of the prostate. Int J Radiat Oncol Biol Phys 2001;50:1243-52.
14. Pilepich M et al. Androgen suppression adjuvant to radiotherapy in carcinoma
of the prostate. Long-term results of phase III RTOG study 85-31. Int J Radiat
Oncol Biol Phys 2003;57:S172-3.
15. Hanks G et al. Phase III trial of long-term adjuvant androgen deprivation
after neoadjuvant hormonal cytoreduction and radiotherapy in locally advan-
ced carcinoma of the prostate: the Radiation Therapy Oncology Group Proto-
col 92-02. J Clin Oncol 2003;21:3972-8.
16. Wirth MP et al. Bicalutamide 150 mg in addition to standard care in
patients with localized or locally advanced prostate cancer: results from the
second analysis of the Early Prostate Cancer program at median follw-up of
5,4 years. J Urol 2004;172:1865-70.
17. See W et al. The bicalutamide Early Prostate Cancer program: demogra-
phy. Urol Oncol 2001:43-7.
18. Kolvenbag GJ et al. Bicalutamide dosages used in the treatment of pros-
tate cancer. Prostate 1999:39:47-53.
19. Iversen P et al. Bicalutamide monotherapy compared with castration in
patients with nonmetastatic locally advanced prostate cancer: 6.3 years of
follow-up. J Urol 2000;64:1579-82.
20. Fourcade RO et al. Effect of bicalutamide 150 mg, after 3 years of median
follow-up, in nonmetastatic prostatic cancer. Prog Urol 2003;13:430-9.
21. Dossier d’AMM.
22. Bolla M et al. Does post-operative radiotherapy (P-RXT) after radical
prostatectomy (Px) improve progression-free survival (PFS) in pT3N0 prostate
cancer (PC)? (EORTC 22911). Meeting: 2004 ASCO Annual Meeting (abstract 4504).
Les articles publiés dans La Lettre du Cancérologue le sont sous la seule responsabilité de leurs auteurs.
Tous droits de reproduction, d’adaptation et de traduction par tous procédés réservés pour tous pays. Edimark SAS © mai 1992
Imprimé en France - Point 44 - 94500 Champigny-sur-Marne - Dépôt légal à parution
Un encart NOVARTIS PHARMA de 6 pages est joint à ce numéro.
1
/
5
100%