Syndrome néphrotique secondaire au bévacizumab. Cas clinique, revue de la littérature et recommandations

CAS CLINIQUE
144 | La Lettre du Cancérologue • Vol. XIX - n° 2 - février 2010
Syndrome néphrotique secondaire
au bévacizumab.
Cas clinique, revue de la littérature
et recommandations
Nephrotic syndrome after bevacizumab.
Case report, literature review and recommandations
P. Beuzeboc 1, C. Daniel 1, J.L. Elguozi 2, V. Launay-Vacher 3
1 Département oncologie médicale, Institut Curie, Paris.
2 Service de néphrologie, hôpital Necker, Paris.
3 Service de néphrologie, hôpital Pitié-Salpêtrière, Paris.
L
es syndromes néphrotiques secondaires à un traitement par
bévacizumab sont rares et réversibles. Les auteurs rappor-
tent l’observation d’une femme ayant présenté un syndrome
néphrotique lors d’un traitement à base de bévacizumab pour un
cancer du sein métastatique. Ce cas clinique est l’occasion de
faire une mise au point sur la physiopathologie et la gestion de
la toxicité rénale des antiangiogéniques.
Observation
Mme C., née en octobre 1937, a été traitée en 1983 par tumorec-
tomie, curage axillaire et radiothérapie pour un cancer du sein droit.
En novembre 2007, la patiente a présenté une récidive locale et
métastatique (métastases ganglionnaires axillaires et médiasti-
nales, pulmonaires et osseuses). Le taux de CA 15,3 était élevé, à
285 UI/ml. Les microbiopsies au niveau du sein droit concluaient
à un carcinome peu différencié SBR III, RO+ RP–, HER2–, avec un
index mitotique élevé. La fibroscopie bronchique retrouvait un
aspect inflammatoire au niveau des bronches lobaires inférieure
droite, moyenne et inférieure gauche. Les biopsies bronchiques
concluaient à une lymphangite d’origine mammaire.
La patiente a comme antécédents médicaux un stripping gauche et
une hypertension artérielle (HTA) traitée par l’association capto-
pril-hydrochlorothiazide à raison d’un demi-comprimé par jour.
Une chimiothérapie par docétaxel 75 mg/m² (120 mg) associée à
du bévacizumab 15 mg/kg (900 mg) tous les 21 jours est débutée
le 1
er
décembre 2007. Lors de la mise en route du traitement, la
fraction d’éjection ventriculaire gauche (FEVG) isotopique était
strictement normale, à 80 %. La tolérance a été correcte tant sur
le plan tensionnel que sur le contrôle régulier de la protéinurie aux
bandelettes urinaires. En mars 2008, après 6 cycles de docétaxel-
bévacizumab, le bilan d’évaluation a mis en évidence une bonne
régression des lésions tumorales au niveau du sein, des ganglions
et du poumon. Le traitement par bévacizumab est alors poursuivi,
associé au létrozole et au clodronate.
En juin 2008, la patiente consulte pour l’apparition depuis 15 jours
d’œdèmes des membres inférieurs. Un traitement par bêtablo-
quant avait été initié peu de temps auparavant par son médecin
traitant pour une hypertension artérielle mal contrôlée. L’examen
clinique constate une prise de poids de 4 kg associée à une HTA
(pression systolique à 18 mmHg). La NFS est normale, ainsi que
la créatininémie (90 µmol/l) ; par contre, il existe une importante
protéinurie, à 4,36 g par 24 heures. L’évaluation de la fonction
rénale à l’aide de la formule aMDRD révèle une insuffisance rénale
à 57 ml/ mn/1,73 m², soit une insuffisance rénale chronique de
stade 3 suivant la classification internationale KDOQI-KDIGO.
L’électrocardiogramme (ECG) est normal. Le bévacizumab est
arrêté. La patiente est alors adressée en consultation de néphrologie
pour prise en charge du syndrome néphrotique.
Vu la persistance d’une HTA (199/102 mmHg) et d’une protéinurie
à 4,4 g, un traitement par valsartan-hydrochlorothiazide est pres-
crit en remplacement du traitement antihypertenseur qui avait
été antérieurement modifié (Renitec® plus Ecazide®) associé à
un régime hyposodé. Les œdèmes disparaissent rapidement, la
tension artérielle se normalise (125/70 mmHg).
Mots-clés
Syndrome néphrotique – Bévacizumab – Cancer du sein métastatique.
Keywords
Nephrotic syndrome – Bevacizumab – Metastatic breast cancer.

CAS CLINIQUE
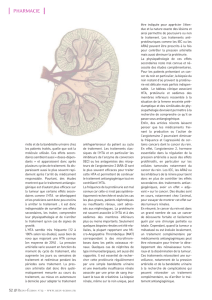
Figure 1. Mécanisme de la toxicité rénale des antiangiogéniques.
L’inhibition de la voie du VEGF entraîne des perturbations au
niveau :
– des podocytes
– des cellules
endothéliales
des capillaires
glomérulaires
PROTÉINURIE
Membrane glomérulaire
La Lettre du Cancérologue • Vol. XIX - n° 2 - février 2010 | 145
Sur le plan tumoral, la situation est contrôlée, avec disparition des
lésions tumorales mammaires, ganglionnaires et pulmonaires, et
une régression du CA 15,3 à 37 UI/ml.
En février 2009, la protéinurie est en baisse, à 0,16 g/24 h. En
octobre 2009, la patiente va toujours bien sur le plan tumoral
(CA 15,3 à 24 UI/ml). La protéinurie est mesurée à 0,10 g/24 h et
la créatininémie à 87 µmol/l. Par contre, le traitement antihyper-
tenseur a de nouveau été modifié et remplacé par l’association
bisoloprol-énalapril-hydrochlorothiazide.
Discussion
Le bévacizumab est un anticorps monoclonal humanisé anti-VEGF
(Vascular Endothelial Growth Factor) de type IgG1. Cette molécule a
une autorisation de mise sur le marché dans le traitement de première
et de seconde ligne du cancer colorectal métastatique, dans le traite-
ment de première ligne du cancer bronchique non à petites cellules
(CBNPC) de type non épidermoïde métastatique, dans le traitement
de première ligne du cancer du sein métastatique et dans le traitement
du cancer du rein métastatique. La dose de bévacizumab utilisée est
variable selon la localisation cancéreuse primitive traitée.
Le bévacizumab étant utilisé de plus en plus couramment dans
plusieurs localisations cancéreuses, ses effets secondaires sont
de mieux en mieux connus. Le bévacizumab présente comme
caractéristique commune avec les autres antiangiogéniques une
toxicité vasculaire et rénale (1-3).
Les incidences de l’HTA et de la protéinurie sous bévacizumab (4)
sont résumées dans une analyse de 7 études contrôlées dans les
tableaux I et II.
L’hypertension artérielle est l’effet indésirable le plus fréquemment
observé chez les patients traités par des anti-VEGF. Son incidence
réelle n’est pas connue, car la pression artérielle est mesurée dans
des conditions non optimales et est rapportée selon les critères
usuels de la classification NCI-CTCAE et non ceux définissant l’HTA
selon les recommandations de l’ensemble des sociétés savantes et
instances de santé publique nationales et internationales (> 140
et/ou 90 mmHg ou utilisation d’un traitement antihypertenseur,
quel que soit le chiffre de la pression artérielle).
Parmi les complications rénales observées chez les patients rece-
vant un anti-VEGF, la plus fréquente est la protéinurie. Le taux de
survenue d’une protéinurie liée à l’administration du bévacizumab
varie entre 21 et 64 % selon les études. Elle peut apparaître selon
un délai variable après la mise sous traitement antiangiogénique.
Elle est presque constamment associée à l’HTA. Cette protéinurie
iatrogène est habituellement réversible à l’arrêt des anti-VEGF. La
protéinurie est dépendante de la dose de bévacizumab. Le risque
relatif de développer une protéinurie à une dose de 10 à 15 mg/kg
est de 2,2 (IC95 : 1,6-2,9 ; p < 0,001). L’incidence de la protéinurie
de grade 3 (> 3,5 g/j) varie de 1,0 à 6,5 % selon les études.
Quels sont les mécanismes potentiels
de la protéinurie ?
Elle est le plus souvent simplement liée à une augmentation de
la perméabilité vasculaire (figure 1), mais elle peut aussi signer
une atteinte rénale. Enfin, il existe une association significative
entre HTA et protéinurie.
Dans le rein, le VEGF est produit par les podocytes et joue un
rôle autocrine essentiel dans le fonctionnement de l’endothé-
Tableau I. Incidence de l’HTA sous bévacizumab. Méta-analyse de 7 études
du bévacizumab en situation métastatique.
Type de cancer Protéinurie (%)
Contrôles Faible dose
(3,5 et 7,5 mg/kg/
dose)
Dose élevée
(10 et 15 mg/kg/dose
correspondant dose AMM)
Cancer colorectal 3 11 28
Cancer colorectal 5 32
Cancer colorectal 8,3 22,4
CBNPC 3,1 15,6 17,6
Sein 2,4 23,5
Rein 0 2,7 35,9
Mésothéliome 6 28
Tableau II. Incidence de la protéinurie sous bévacizumab. Méta-analyse de
7 études du bévacizumab en situation métastatique.
Type de cancer Protéinurie (%)
Contrôles Faible dose
(3,5 et 7,5 mg/kg/
dose)
Dose élevée
(10 et 15 mg/kg/dose
correspondant dose AMM)
Cancer colorectal 11 23 28
Cancer colorectal 19 41
Cancer colorectal 21,7 26,5
CBNPC 2 21 42
Sein 7,4 22,3
Rein 38 41 62,7
Mésothéliome 23 36

CAS CLINIQUE
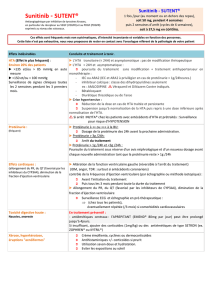
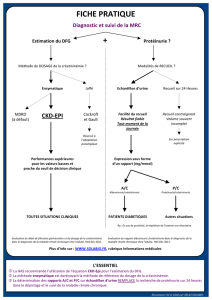
Figure 2. Recommandations de la Société de néphrologie. Avant de commencer un traitement par antiangiogénique.
Bandelette urinaire (BU) – clairance calculée (eDFG)
eDFG ≥ 30 ml/mn et BU : 0 à 1+
< 1 g/g ou > 1 g/j
Première dose administrée
débutée
sans avis
eDFG ≥ 30 ml/mn et BU : 2+ ou 3+
Quantification de la protéinurie :
échantillon matinal
(rapport en g/g créatinine urinaire)
ou urines de 24 h (en g/j)
1 à 3 g/g ou 1 à 3 g/j
Première dose administrée débutée,
avis néphrologique demandé
(ne doit pas retarder l’administration)
eDFG < 30 ml/mn
< 1/g ou < 1 g/j
Avis néphrologique obtenu
avant administration
première dose
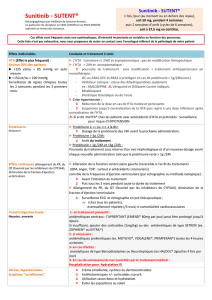
Figure 3. Recommandations de la Société de néphrologie. Au cours du suivi du traitement par antiangiogénique.
Continuer
administration
de l’AA
eDFG ≥ 30 ml/mn
Débit de filtration glomérulaire
(formule du aMDRD ou de Cockroft)
Continuer
administration
de l’AA
BU : 0 à 1+
Bandelette urinaire (BU)
< 1 g/g
ou > 1 g/j
Avis néphrologique
obtenu avant prochaine
administration de l’AA
eDFG < 30 ml/mn
Avis néphrologique
obtenu avant prochaine
administration de l’AA
> 3 g/g
ou > 3 g/j
Continuer administration
de l’AA ; initier traitement
par IEC ou ARA2 ; avis
néphrologique souhaitable
BU : 2+ ou 3+
1 à 3 g/g
ou 1 à 3 g/j
Protéinurie :
échantillon matinal
(g/g créatinine urinaire)
ou urines de 24 h (g/j)
AA contre-indiqué
Syndrome néphrotique
(> 3 g/g ou > 3 g/j et
albuminémie < 30 g/l)
146 | La Lettre du Cancérologue • Vol. XIX - n° 2 - février 2010
lium fenestré des capillaires glomérulaires, via sa liaison avec ses
récepteurs exprimés par la cellule endothéliale. L’invalidation du
VEGF podocytaire chez la souris entraîne une protéinurie, une
microangiopathie thrombotique et une HTA. La neutralisation du
VEGF par des anticorps chez la souris induit une protéinurie asso-
ciée à un détachement des cellules endothéliales de la membrane
basale glomérulaire et une altération des diaphragmes de fente.
Les autres complications rénales beaucoup plus rares observées
chez les patients recevant des traitements antiangiogéniques
sont le syndrome néphrotique (5), l’insuffisance rénale aiguë, des
glomérulopathies prolifératives, une néphrite interstitielle (6) et
une microangiopathie thrombotique (MAT). La MAT est définie
par une hypertension artérielle sévère, une protéinurie (ou un
syndrome néphrotique), une anémie et une thrombocytopénie.
Des cas ont été décrits avec le bévacizumab (7). Il existe très peu
de données publiées concernant les liens entre insuffisance rénale
et antiangiogéniques. Les antiangiogéniques peuvent même être
utilisés en cas d’insuffisance rénale.
Des recommandations (8) concernant la gestion des effets
vasculaires et rénaux des médicaments antiangiogéniques ont
été rédigées par plusieurs sociétés savantes françaises (Société
de néphrologie, Société française d’hypertension artérielle, Asso-
ciation pédagogique nationale des enseignants de thérapeutique
et Fédération francophone de cancérologie digestive).
Avant l’administration d’un traitement antiangiogénique (figure 2),
le bilan initial doit comporter une mesure de la pression artérielle,

CAS CLINIQUE
La Lettre du Cancérologue • Vol. XIX - n° 2 - février 2010 | 147
la réalisation d’une bandelette urinaire à la recherche d’une protéi-
nurie et d’une hématurie, l’évaluation de la fonction rénale (créa-
tininémie et clairance calculée) et une évaluation cardiologique
(ECG, échographie cardiaque souhaitable et avis cardiologique
si nécessaire).
Au cours du suivi (fi gure 3), en cas de protéinurie à la bandelette
urinaire supérieure ou égale à 2 croix, une quantifi cation de la
protéinurie doit être effectuée sur un échantillon ou, à défaut, une
analyse des urines des 24 heures. La présence d’une hématurie à
la bandelette urinaire est souvent indicatrice de lésions glomé-
rulaires lorsqu’elle est associée à une protéinurie.
Quand la protéinurie est associée à une HTA, il faut traiter les
deux en première intention en utilisant les inhibiteurs de l’en-
zyme de conversion (IEC) ou les antagonistes des récepteurs AT1
de l’angiotensine II (sartans), qui présentent des propriétés sur
la réduction de la protéinurie par un mécanisme d’action fonc-
tionnel, spécifi que (9).
L’apparition d’un syndrome néphrotique sous traitement antiangio-
génique constitue la seule indication d’arrêt du traitement. Dans
ce cas, il faut en premier lieu arrêter le traitement antiangiogé-
nique, ce qui peut suffi re pour faire régresser la protéinurie et, en
deuxième lieu, traiter par antihypertenseurs, de préférence IEC ou
sartans, pour faire régresser la protéinurie. La reprise éventuelle
d’un traitement antiangiogénique sera discutée après avis néphro-
logique. Il n’existe à ce jour aucune donnée sur les conséquences,
bénéfi ques ou délétères, d’un switch pour un autre médicament
antiangiogénique.
Étude Mars
Le groupe français IRMA (insuffi sance rénale et médications anti-
cancéreuses) est le premier à avoir rapporté la prévalence élevée
de l’insuffi sance rénale chez les patients porteurs de tumeurs
solides, le plus souvent sous-diagnostiquée, quel que soit le trai-
tement utilisé (10). Ce groupe vient de commencer une étude
française multicentrique prospective MARS (Management of
Antiangiogenics’ Renovascular Safety) qui a pour objectif prin-
cipal de décrire la prise en charge des effets rénovasculaires des
médicaments antiangiogéniques et de valider les recommanda-
tions cliniques existantes. L’objectif secondaire de cette étude est
d’évaluer les incidences respectives et la sévérité de ces effets
rénovasculaires selon la drogue antiangiogénique utilisée et la
pathologie traitée. ■
1. Launay-Vacher V, Deray G. Hypertension and proteinuria: a class-effect of anti-
angiogenic therapies. Anticancer Drugs 2009;20(1):81-2.
2. Mourad JJ, des Guetz G, Debbabi H, Levy BI. Blood pressure rise following angio-
genesis inhibition by bevacizumab. A crucial role for microcirculation. Ann Oncol
2008;19(5):927-34.
3. Yang JC, Haworth L, Sherry RM et al. A randomized trial of bevacizumab, an anti-
vascular endothelial growth factor antibody, for metastatic renal cancer. N Engl J
Med 2003;349(5):427-34.
4. Zhu X, Wu S, Dahut WL, Parikh CR. Risks of proteinuria and hypertension with
bevacizumab, an antibody against vascular endothelial growth factor: systematic
review and meta-analysis. Am J Kidney Dis 2007;49(2):186-93.
5. George BA, Zhou XJ, Toto R. Nephrotic syndrome after bevacizumab: case report
and literature review. Am J Kidney Dis 2007;49(2):e23-9.
6. Barakat RK, Singh N, Lal R et al. Interstitial nephritis secondary to bevacizumab
treatment in metastatic leiomyosarcoma. Ann Pharmacother 2007;41(4):707-10.
7. Frangié C, Lefaucheur C, Medioni J et al. Renal thrombotic microangiopathy
caused by anti-VEGF-antibody treatment for metastatic renal-cell carcinoma.
Lancet Oncol 2007;8(2):177-8.
8. Halimi JM, Azizi M, Bobrie G et al. Vascular and renal effects of anti-angiogenic
therapy. Nephrol Ther 2008;4(7):602-15.
9. Van Heeckeren WJ, Ortiz J, Cooney MM, Remick SC. Hypertension, proteinuria,
and antagonism of vascular endothelial growth factor signaling: clinical toxicity,
therapeutic target, or novel biomarker? J Clin Oncol 2007;25(21):2993-5.
10. Launay-Vacher V, Spano JP, Janus N et al. Prevalence of renal insuffi ciency in
cancer patients and implications for anticancer drug management: the Renal Insuf-
fi ciency and Anticancer Medications (IRMA) study. Cancer 2007;110(6):1376-84.
Références bibliographiques
Colloque
Reims, 18 juin 2010
■1er colloque francophone sur les cancers
du sein in situ
Programme :
Revue complète des aspects épidémiologiques,
diagnostiques, anatomopathologiques et théra-
peutiques
– Actualisation des études rétrospectives et des
essais randomisés
– Facteurs de risque de rechute
– Recommandations INCa-SFSPM
Coordonnateur scientifi que :
Dr Bruno Cutuli (Polyclinique Courlancy)
Tél. : 03 26 84 02 84 – Fax : 03 26 84 70 20
E-mail : [email protected]
Organisation et inscription :
Reims événements organisation :
12, bd du Général-Leclerc – 51722 Reims cedex
Contact : Mme Sophie Fournal
Tél. : 03 26 77 44 60 – Fax : 03 26 77 44 81
Inscription sur Internet à partir du 4 janvier 2010 :
http://www.reims-evenements.fr
Agenda
1
/
4
100%