Embolie pulmonaire : les nouvelles recommandations stratifient le risque Attitudes

6CONSENSUS CARDIO
pour le praticien
- N° 43 • Novembre 2008
Les nouvelles recommandations de l’ESC
concernant la prise en charge de l’embolie
pulmonaire (EP) viennent de paraître. Elles
marquent une nette évolution par rapport
aux recommandations de 2000 et font appel
à une nouvelle stratification du risque qui
conditionne à la fois la démarche diagnostique
et thérapeutique.
Une nouvelle stratification du risque
La sévérité de l’EP doit être interprétée en fonction du risque
de décès précoce, et non plus en fonction de la sévérité de
l’amputation vasculaire pulmonaire. Les nouvelles recom-
mandations européennes suggèrent de remplacer la termi-
nologie des EP massives, submassives, ou non massives, par
une terminologie basée sur le risque de décès hospitalier ou
à 30 jours lié à l’EP. L’évaluation de ce risque repose sur la
présence de marqueurs, témoins de la sévérité du tableau
clinique, d’une dysfonction ventriculaire droite, ou d’une
ischémie myocardique (Tableaux 1 et 2).
La présence d’un choc cardiogénique initial ou d’une hypo-
tension artérielle systémique caractérise les EP à risque élevé,
dont la mortalité précoce est supérieure à 15 %. Parmi les
EP à risque « non élevé », on distingue les EP à risque inter-
médiaire des EP à bas risque, sur la présence ou non de mar-
queurs de dysfonction ventriculaire droite ou d’ischémie
myocardique. Une dilatation du ventricule droit, une éléva-
tion des pressions pulmonaires ou des dosages de BNP ou
NT-proBNP, ainsi qu’une augmentation de la troponine
(I ou T) définissent les EP à risque intermédiaire et sont asso-
ciées à une mortalité précoce comprise entre 3 et 15 %. À
l’inverse, l’absence de ces marqueurs de risque caractérise
les EP à bas risque dont la mortalité précoce ne dépasse pas
1 %. Les stratégies diagnostique et thérapeutique de l’EP
reposent entièrement sur cette nouvelle stratification.
Les éléments diagnostiques
Probabilité clinique
L’évaluation clinique de l’EP s’intègre aux examens paracli-
niques de dépistage comme l’ECG, la radiographie pulmo-
naire et la gazométrie artérielle. Les signes cliniques de l’EP
sont peu sensibles et peu spécifiques. Associés à la présence
de facteurs de risque et aux antécédents du patient, ils per-
mettent l’évaluation empirique ou standardisée de la pro-
babilité clinique d’EP. Les scores de Wells et de Genève basés
sur des évaluations standardisées définissent trois niveaux
Embolie pulmonaire :
les nouvelles recommandations
stratifient le risque
Nicolas Meneveau
CHU Jean-Minjoz, Besançon
Attitudes
IFMC - recommandations - sociétés savantes - pratique clinique I
Stratification du risque de décès
précoce lié à l’EP
Principaux marqueurs utilisés dans
la stratification du risque de l’EP
Tableau 1. Tableau 2.
Marqueurs cliniques
• Choc
• Hypotension artérielle
systémique*
Marqueurs de dysfonction VD
• ETT : dilatation VD,
hypocinésie VD, HTAP
• Angioscanner :
dilatation VD
• Biologique : élévation BNP,
NT-proBNP
• KT droit : élévation
des pressions droites
Marqueurs d’ischémie
myocardique
• Elévation troponine I
ou T**
* Définie par PAS < 90 mmHg ou baisse de PAS > 40 mmHg pendant >
15 min en dehors d’un trouble du rythme ventriculaire, d’un sepsis,
ou d’une hypovolémie.** L’utilisation d’une élévation des H-FABP
demande à être confirmée.
Risque de décès précoce
lié à l’EP
Marqueurs de risque
Cliniques
(choc,
OTA)
Dysfonc-
tion VD
Ischémie
myocar-
dique
Risque élevé (>15%) + + +
Risque
non élevé
Risque
intermé-
diaire
(3-15%)
-
+ +
-+
+-
Bas risque
(<1%) - - -
attitude_Meneveau:boccara 18/11/08 17:29 Page 6

de risque (faible, intermédiaire ou élevé) en fonction de la
prévalence estimée d’EP (respectivement de 10, 30 et 65 %)
(Tableau 3).
D-dimères
La valeur prédictive négative (VPN) d’un dosage de
D-dimères < 500 µg/l, réalisé avec un test ELISA, est supé-
rieure à 95 % et permet d’exclure le diagnostic d’EP chez un
tiers des patients ambulatoires ayant une probabilité cli-
nique faible ou intermédiaire. Les autres tests diagnostiques,
moins sensibles, doivent se limiter aux patients avec proba-
bilité clinique faible. Toutefois, en utilisant la classification
du score de Wells à 2 niveaux, un dosage négatif des
D-dimères permet d’écarter le diagnostic d’EP quel que soit
le test employé, si l’EP est classée « improbable ».
Echographie de compression veineuse
La recherche d’une thrombose veineuse profonde (TVP)
proximale par la réalisation d’une échographie de compres-
sion veineuse est positive chez 20 % des patients avec EP
documentée. Cet examen est justifié pour réduire le taux de
faux négatifs après angioscanner monocoupe, et en cas de
contre-indication relative à la réalisation d’un angioscanner
(insuffisance rénale, allergie au produit de contraste).
Scintigraphie de ventilation-perfusion
Une scintigraphie de ventilation-perfusion normale permet
d’exclure le diagnostic d’EP. À l’inverse, une scintigraphie pul-
monaire de forte probabilité confirme le diagnostic d’EP dans
la majorité des cas. La combinaison d’une scintigraphie non diag-
nostique et d’une probabilité clinique faible est un critère jugé
acceptable pour éliminer le diagnostic d’EP, bien que cette asso-
ciation soit moins bien validée. Dans tous les autres cas, la
scintigraphie pulmonaire ne permet pas de conclure, et d’autres
examens diagnostiques doivent être envisagés.
Angioscanner multicoupe
L’apport de l’angioscanner constitue une avancée déterminante
dans la stratégie diagnostique de l’EP. La sensibilité et la spéci-
ficité sont respectivement de 70 et 90 % pour un angioscanner
monocoupe, et de 83 et 96 % pour un angioscanner multi-
coupe. La visualisation d’un thrombus proximal ou segmen-
taire permet d’affirmer le diagnostic d’EP. À l’inverse, la néces-
sité d’un traitement anticoagulant devant un thrombus
sous-segmentaire isolé n’est pas formellement établie en
l’absence de TVP associée. En règle générale, un angioscanner
multicoupe négatif permet d’exclure le diagnostic d’EP. Il est
associé à un taux d’événements thromboemboliques à 3 mois
qui n’excède pas 1,5 % en l’absence de traitement anticoagu-
lant. Un angioscanner monocoupe négatif justifie, quant à lui,
le recours à un écho-Doppler veineux, en raison d’une sensibi-
lité et d’une valeur prédictive négative médiocres.
Echocardiographie-Doppler transthoracique
L’échocardiographie-Doppler permet rarement d’affirmer le
diagnostic d’EP en visualisant la présence d’un thrombus dans
l’artère pulmonaire ou les cavités droites. Son intérêt est déter-
minant dans la prise en charge de l’EP à risque élevé. Dans ce
contexte, la présence de signes de cœur pulmonaire aigu per-
met d’instaurer sans attendre un traitement approprié. Le rôle
de l’échographie transthoracique dans la prise en charge des
EP à risque « non élevé » se limite à stratifier les patients entre
risque intermédiaire et bas risque. Les critères diagnostiques
de dysfonction ventriculaire droite varient d’une étude à l’autre,
mais s’appuient le plus souvent sur la vitesse du flux
d’insuffisance tricuspide et la dilatation ventriculaire droite
mise en évidence chez plus de 25 % des patients avec EP et asso-
ciée à un doublement de la mortalité. D’autres critères ont été
décrits, comme l’analyse du flux d’éjection VD, la cinétique seg-
mentaire de la paroi libre du VD ou l’utilisation du Doppler tis-
sulaire dans l’appréciation de la performance myocardique.
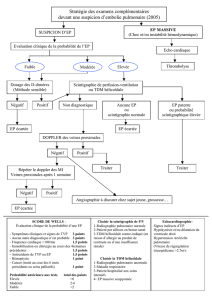
La stratégie diagnostique
Les figures 1 et 2résument les stratégies diagnostiques pos-
sibles dans la prise en charge de l’EP. Ces stratégies privilé-
gient une approche non invasive et s’articulent autour de
l’angioscanner.
En cas de suspicion d’EP à risque élevé, la probabilité clinique
est le plus souvent élevée, et l’examen le plus utile dans ce
contexte est l’échographie cardiaque transthoracique.
L’échographie permettra d’éliminer un choc cardiogénique
post-infarctus, une tamponnade, une valvulopathie aiguë,
7
CONSENSUS CARDIO
pour le praticien
- N° 43 • Novembre 2008
Tableau 3.
Variables Score
Antécédents TVP/EP + 1,5
Chirurgie ou immobilisation récente + 1,5
Tachycardie > 100/min + 1,5
Signes cliniques de TVP + 3
Autre diagnostic moins probable que l’EP + 3
Hémoptysie + 1
Cancer + 1
Probabilité d’EP (3 niveaux)
Faible 0 - 1
Intermédiaire 2 - 6
Elevée > 7
Probabilité d’EP (2 niveaux)
EP improbable 0 - 4
EP probable > 4
Score de prédiction clinique de Wells
attitude_Meneveau:boccara 18/11/08 17:29 Page 7

CONSENSUS CARDIO
pour le praticien
- N° 43 • Novembre 2008
8
une dissection aortique, ou un choc hypovolémique.
L’existence de signes échographiques de cœur pulmonaire
aigu chez un patient instable suspect d’EP peut suffire à envi-
sager un traitement approprié (fibrinolyse ou embolecto-
mie) sans autre confirmation diagnostique. Si l’état clinique
du patient le permet, la réalisation d’un angioscanner, s’il
est immédiatement disponible, est toutefois souhaitable.
L’angiographie pulmonaire doit être évitée, compte tenu
du risque hémorragique lié à la thrombolyse et du caractère
très instable du patient.
La première étape du diagnostic chez les patients suspects d’EP
à risque « non élevé » repose sur l’évaluation de la probabilité
clinique. En cas de probabilité clinique faible ou intermédiaire,
un dosage de D-dimères négatif (< 500 µg/l) permet d’écarter
le diagnostic d’EP. Si le dosage de D-dimères est positif, le
diagnostic d’EP sera infirmé ou confirmé par la réalisation d’un
angioscanner multicoupe. À l’inverse, les patients avec proba-
bilité clinique élevée devront bénéficier de la réalisation d’un
angioscanner multicoupe, sans avoir recours aux D-dimères dont
la valeur prédictive négative est basse dans cette population. La
réalisation d’un écho-Doppler veineux ou d’une scintigraphie
pulmonaire de ventilation-perfusion peut être utile chez les
patients ayant une contre-indication relative à l’angioscanner
(insuffisance rénale, allergie au produit de contraste). Certaines
stratégies combinant probabilité clinique, dosage des D-dimères,
scintigraphie pulmonaire et écho-Doppler veineux se sont éga-
lement montrées très efficaces pour exclure ou confirmer le
diagnostic d’EP.
La prise en charge thérapeutique
Traitement anticoagulant
Le traitement anticoagulant par héparine non fractionnée (HNF),
héparine de bas poids moléculaire ou fondaparinux doit être
initié sans délai dès que le diagnostic d’EP est confirmé, mais
également en attendant la confirmation du diagnostic lorsque
la probabilité clinique d’EP est élevée ou intermédiaire
(Tableau 4). Il doit être maintenu au moins 5 jours, et les antivi-
tamines K (AVK) doivent être débutées le plus précocement pos-
sible, de préférence dès le premier jour. Les HBPM et le fonda-
parinux se sont montrés au moins aussi efficaces et sûrs
d’utilisation que l’HNF et doivent être privilégiés en raison de
leur simplicité d’utilisation et de l’absence de risque de throm-
bopénie induite avec le fondaparinux. Les indications de
l’HNF se limitent aujourd’hui aux patients avec insuffisance rénale
sévère (clairance de la créatinine < 30 ml/min) ou risque hémor-
ragique élevé, en association au traitement thrombolytique.
Suspicion d’EP à risque élevé
(choc ou hypotension)
Angioscanner immédiatement disponible
Dysfonction VD échographique
Angioscanner
disponible, pt stable
OuiNon
Non Oui
Autre diagnostic
Angioscanner
Angioscanner non
disponible, pt instable
-
+
Thrombolyse,
embolectomie Autre diagnostic
Figure 1.
Suspicion d’EP à risque « non élevé »
Probabilité
clinique élevée
Probabilité
clinique basse
ou intermédiaire
Evaluation de la probabilité clinique d’EP
D-Dimères
Pas de
traitement
Angioscanner
multicoupe
Pas d’EP
Pas de traitement
Examens complémentaires ?
Angioscanner
multicoupe
EP
Traitement
Pas d’EP
Pas de traitement
EP
Traitement
-
-
-
+
+
+
Figure 2.
Démarche diagnostique dans les suspicions
d’EP à risque élevé Démarche diagnostique dans les suspicions
d’EP à risque « non élevé »
Tableau 4.
Dose
HNF
• 80 UI/kg en bolus suivies
d’une perfusion de 18 UI/kg/h
Enoxaparine
• 1 mg/kg/12h SC
Ou 1,5 mg/kg/24h SC
Tinzaparine
• 175 UI/kg/24h SC
Fondaparinux
• 5 mg/24h SC (poids < 50 kg)
• 7,5 mg/24h SC (poids 50-100 kg)
• 10 mg/24h SC (poids > 100 kg)
Anticoagulants validés
dans le traitement de l’EP
attitude_Meneveau:boccara 18/11/08 17:29 Page 8

9
CONSENSUS CARDIO
pour le praticien
- N° 43 • Novembre 2008
Traitement thrombolytique
Les indications de la thrombolyse n’ont pas varié (Tableau 5).Le
traitement thrombolytique demeure le traitement de pre-
mière intention des EP à haut risque. La plupart des contre-
indications dans ce contexte doivent être considérées comme
relatives. La thrombolyse n’est pas recommandée dans les
autres types d’EP. Elle ne doit pas être utilisée dans la prise
en charge des EP à bas risque, mais peut être considérée dans
certains cas d’EP à risque intermédiaire en portant une atten-
tion accrue au risque hémorragique.
Embolectomie chirurgicale, thrombectomie percutanée,
filtre cave
L’amélioration des résultats obtenus avec l’embolectomie chi-
rurgicale permet aujourd’hui de l’envisager comme une alter-
native thérapeutique efficace en cas de contre-indication au
traitement thrombolytique ou d’échec de celui-ci chez les
patients à haut risque. La place de la thrombectomie percuta-
née est, quant à elle, plus difficile à définir, et pourrait s’envisager
dans les mêmes indications, lorsque l’accès à la chirurgie cardio-
thoracique est impossible dans des délais très courts.
L’interruption de la veine cave inférieure par un filtre définitif
est associée à une réduction du risque de récidive embolique
à long terme, mais également à un risque accru de thrombose
veineuse profonde (incluant les thromboses de filtre) et de syn-
drome post-phlébitique. Les indications de filtre cave doivent
se limiter aux contre-indications absolues au traitement anti-
coagulant chez les patients ayant un risque élevé de récidive
thromboembolique veineuse.
Les cas particuliers
Grossesse
La démarche diagnostique de l’EP au cours de la grossesse ne
diffère en rien de la démarche habituelle. Plus qu’en toute autre
circonstance, un diagnostic de certitude est impératif qui justi-
fiera un traitement héparinique prolongé. Toutes les procédures
diagnostiques sont applicables à la grossesse, en particulier celles
faisant appel à l’angioscanner. La dose maximale de radiation
fœtale tolérée est de 50 mSv (50 0000 µGy), très largement supé-
rieure à la dose reçue quel que soit l’examen radiologique choisi.
Les héparines de bas poids moléculaire (HBPM) doivent être pri-
vilégiées en cours de grossesse en raison des risques
d’embryopathie, d’hémorragies fœtales ou placentaires et
d’anomalies du système nerveux central liées aux AVK.
Pathologie cancéreuse
Le risque d’événement thromboembolique veineux est multi-
plié par 4 en cas de pathologie cancéreuse évolutive, et par 7 si
une chimiothérapie est instaurée. À l’inverse, 10 % des patients
pris en charge pour une EP idiopathique développent une patho-
logie cancéreuse dans les 5 à 10 ans. La réalisation dans ce
contexte d’un bilan exhaustif à la recherche d’un cancer sous-
jacent n’a pas fait la preuve de son bénéfice en termes de sur-
vie au long cours et n’est donc pas justifiée. Le traitement de
l’EP en cas de cancer solide non métastasé évolutif repose au
cours des 3 à 6 premiers mois sur les HBPM qui se sont montrées
supérieures aux AVK en termes de survie. Au-delà, il convient
de poursuivre le traitement par HBPM ou AVK indéfiniment ou
jusqu’à la guérison de la pathologie cancéreuse.
Thrombus intracardiaque
La présence de thrombus des cavités droites est rapportée dans
4 % des EP. Ce chiffre s’élève à 7-18 % pour les patients pris en
charge dans les unités de soins intensifs. Il s’agit d’un facteur de
mauvais pronostic associé à un risque accru de mortalité hospi-
talière et de récidive d’EP, qui justifie un traitement thromboly-
tique ou une embolectomie chirurgicale urgente.
Ce qu’il faut retenir
La prise en charge diagnostique et thérapeutique de l’embolie
pulmonaire a beaucoup évolué au cours de ces dernières années.
Une nouvelle stratification de la sévérité de l’EP est apparue qui
fait appel au risque de décès précoce lié au phénomène throm-
boembolique. Le diagnostic repose aujourd’hui sur des straté-
gies séquentielles non invasives s’articulant autour de
l’angioscanner multicoupe. Sur le plan thérapeutique, les hépa-
rines de bas poids moléculaire (HBPM) et le fondaparinux ont
supplanté l’héparine non fractionnée (HNF), alors que la throm-
bolyse reste le traitement de première intention des EP à risque
élevé et que l’embolectomie chirurgicale est devenue une alter-
native valable en cas de contre-indication ou d’échec du traite-
ment thrombolytique. ■
Pour toute correspondance avec l’auteur
Pour en savoir plus
-Guidelines on the diagnosis and management of acute pulmonary embolism.
Eur Heart J 2008 ; 29 : 2276-2315.
Tableau 5.
Dose
Streptokinase
• 250 000 UI IV en dose de
charge sur 30 min, suivies
d’une perfusion IV de
100 000 UI/h sur 12-24h
Ou 1,5 million UI IV sur 2h
Urokinase
• 4 400 UI/kg IV en dose de
charge sur 10 min, suivies
d’une perfusion IV de
4 400 UI/kg/h sur 12-24h
Ou 3 millions UI IV sur 2h
rtPA
• 100 mg IV sur 2h
Ou 0,6 mg/kg IV sur 15 min
(max 50 mg)
ent
+
Thrombolytiques validés
dans le traitement de l’EP
attitude_Meneveau:boccara 18/11/08 17:29 Page 9
1
/
4
100%