Télécharger l'article au format PDF

L’Encéphale (2010) 36, 314—325
Disponible en ligne sur www.sciencedirect.com
journal homepage: www.em-consulte.com/produit/ENCEP
NEUROPSYCHOLOGIE
Dans la maladie d’Alzheimer, l’expression des
troubles psychologiques et comportementaux est
précoce et spécifique des stades lésionnels
In Alzheimer’s disease, the clinical expression of behavioral and
psychological signs and symptoms is early and specific of
neuropathological stages
B.F. Michela,b,d,e,∗, V. Luciania, Y.E. Gedab,c, N. Sambuchia,b,
V. Paband, J.-M. Azorine
aUnité de neurogériatrie, hôpital Sainte-Marguerite, 270, boulevard de Sainte-Marguerite, 13009 Marseille, France
bGroupe de recherche sur la maladie d’Alzheimer, faculté de pharmacie, boulevard Jean-Moulin, 13005 Marseille, France
cAlzheimer’s Disease Research Center, Mayo-Clinic College of Medicine, Rochester, Minesota, États-Unis
dUMR-CNRS 6149, université de Provence, pôle 3 C, avenue Victor-Hugo, 13003 Marseille, France
ePôle de psychiatrie universitaire, hôpital Sainte-Marguerite, 270, boulevard de Sainte-Marguerite, 13009 Marseille, France
Rec¸u le 16 octobre 2008 ; accepté le 2 juin 2009
Disponible sur Internet le 3 d´
ecembre 2009
MOTS CLÉS
Maladie d’Alzheimer ;
SSCPD ;
Inventaire
neuropsychiatrique ;
Anxiété ;
Dépression ;
Agitation ;
Irritabilité
Résumé Le diagnostic précoce de la maladie d’Alzheimer (MA) est devenu une nécessité
médicale de plus en plus évidente. Cette étude a porté sur 50 patients atteints de maladie
d’Alzheimer (MA), 34 femmes (68%) et 16 hommes (32 %), dont les critères de diagnostic obéis-
saient aux recommandations NINCDS-ADRDA. En vue d’évaluer de fac¸on systématique, chez tous
les patients, l’importance des signes et symptômes comportementaux et psychologiques de la
démence (SSCPD) en fonction du stade de gravité de la MA, nous avons séparé notre popu-
lation en deux sous-groupes, en fonction du score au «Mini Mental State »(MMS). Le premier
sous-groupe était formé de patients ayant un score MMS compris entre 21 et 28 (huit hommes
et 15 femmes). Les patients appartenant au second sous-groupe avaient un score MMS compris
entre 10 et 20 (huit hommes et 19 femmes). L’inventaire neuropsychiatrique (NPI) a été utilisé
pour recueillir des informations sur la présence de SSCPD chez les patients atteints de MA.
Les scores du NPI ont été corrélés à ceux de l’Alzheimer’s Disease Assesment Scale (ADAS) qui
∗Auteur correspondant.
Adresse e-mail : [email protected] (B.F. Michel).
0013-7006/$ — see front matter © L’Encéphale, Paris, 2009.
doi:10.1016/j.encep.2009.10.012

Expression des troubles psychologiques et comportementaux selon les stades lésionnels de l’Alzheimer 315
permet, dans sa partie cognitive (ADAS-Cog) d’évaluer la sévérité des troubles cognitifs des
patients atteints de MA. Avant d’entrer dans l’étude, les patients ont été informés par écrit
du protocole et ont signé un consentement éclairé pour participer à l’étude clinique sur les
SSCPD dans la MA. Le traitement statistique des données a été réalisé grâce au logiciel STAT-
VIEW. Notre étude démontre que les SSCPD peuvent être présents, aussi bien aux stades légers,
qu’aux stades modérés de la MA. Comme les troubles cognitifs, les SSCPD font partie intégrante
du tableau clinique de la MA. Avec une fréquence de 74 % pour l’ensemble de notre population,
«l’anxiété »représente le SSCPD prédominant pour tous nos patients et à tous les stades de la
MA. Aux stades très précoces de la MA, les SSCPD paraissent précéder les troubles cognitifs.
L’association symptomatique «dépression »,«agitation »et «irritabilité de l’humeur »pour-
rait rester pendant de longs mois isolée, précédant l’apparition des troubles de la mémoire
épisodique verbale, caractéristiques de l’atteinte hippocampique. L’irritabilité de l’humeur
semble caractériser de fac¸on spécifique la phase de début de la MA. A contrario, deux SSCPD
caractérisent la phase évoluée de la MA : «troubles du sommeil »et «hallucinations ».
© L’Encéphale, Paris, 2009.
KEYWORDS
Alzheimer’s disease;
Behavioral and
psychological signs
and symptoms of
dementia;
Neuro-Psychiatric
Inventory;
Anxiety;
Depression;
Agitation;
Irritability
Summary
Introduction. — The early diagnosis of Alzheimer’s disease is a new challenge. This study
concerns 50 patients, 34 females (68 %) and 16 males (32 %) with Alzheimer (AD), according to
NINCDS-ADRDA diagnostic criteria.
Objectives. — To systematically evaluate in all patients behavioral and psychological signs and
symptoms of dementia (BPSSD), according to the stage of AD, with the patients of our population
separated into two MMS groups.
Methods. — The first group was composed of patients with an MMS score from 10 to 20
(eight males and 19 females). Patients of the second group had an MMS score between 21 and 28
(eight males and 19 females). The Neuro-Psychiatric Inventory (NPI) was used to collect infor-
mation on the presence of BPSSD in AD patients. NPI scores were correlated to the cognitive
part of the Alzheimer’s Disease Assessment Scale (ADAS-Cog) that permits evaluation of the
severity of cognitive impairment in AD patients. Before starting the study, all patients gave
their informed consent to participate in the study of BPSSD in AD. Statistical treatment of data
was performed using STATVIEW.
Results. — Our study demonstrates that BPSSD are present not only in early but also in moderate
stages of AD. As cognitive impairment, BPSSD are an integrate part of the clinical picture. With
a frequency of 74 % for the whole population, ‘‘anxiety’’ represented the more predominant
BPSSD for all our patients at all stages of AD. At the very early stages of AD, BPSSD appeared
to precede cognitive disorders.
Conclusion. — The symptomatic association of ‘‘depression’’, ‘‘agitation’’, and ‘‘irritability of
mood’’ may remain in a steady state for a few months before the appearance of verbal epi-
sodic memory impairment, which is characteristic of hippocampus involvement. ‘‘Irritability’’
seems to specifically characterise the initial phase of AD. On the other hand, two BPSSD are
characteristic of the late stages of AD: ‘‘sleep disorder’’ and ‘‘hallucinations’’.
© L’Encéphale, Paris, 2009.
Introduction
Du fait de la fréquence de la maladie, de la généralisation
des consultations mémoire et des progrès de la thérapeu-
tique, le diagnostic précoce de la maladie d’Alzheimer (MA)
est devenu une nécessité médicale de plus en plus évidente.
De très nombreuses approches ont été développées, pour
tenter d’identifier les patients à risque, aux phases les
plus précoces de la MA. Des marqueurs biologiques ont été
proposés, dans le sang ou dans le liquide céphalorachidien
(LCR) [1]. D’autres marqueurs anatomiques, comme la
mesure de l’atrophie hippocampique en imagerie par
résonance magnétique (IRM) nucléaire ont fait l’objet de
travaux remarquables [2]. Toutefois, l’approche clinique
est restée prépondérante dans le domaine du diagnostic
précoce. Elle s’est limitée cependant à mettre en exergue
les premiers troubles cognitifs et à décrire les différentes
phases d’altération des systèmes de mémoire, corrélées à la
progression des lésions au sein de l’hippocampe [3]. De nou-
veaux concepts ont été proposés, pour tenter d’appréhender
la phase prédémentielle de la MA, comme celui de mild
cognitive impairment (MCI) [4]. Ces concepts sont en cours
de validation, mais ils restent très attachés aux corrélations
cognitivoanatomiques, au sein du système hippocampique.
Hormis la dépression tardive qui a fait l’objet de travaux
épidémiologiques relativement importants, les troubles
non cognitifs — ou comportementaux — ont continué à être
considérés comme tardifs, associés à la diffusion des lésions
au néocortex, en particulier aux lobes frontaux [5].
Peu d’études se sont attachées à décrire l’ensemble des
«signes et symptômes comportementaux et psychologiques
de la démence »(SSCPD) de la phase précoce de la MA [6].
Nous-nous sommes donc proposés d’évaluer de fac¸on systé-
matique, grâce à l’inventaire neuropsychiatrique (NPI) [7],

316 B.F. Michel et al.
tous les SSCPD d’une population de 50 patients atteints de
MA, à deux stades différents — stade léger ou IV de Braak
et stade modéré ou V de Braak [3]. Puis nous avons corrélé
les SSCPD à l’atteinte cognitive, mesurée par «l’Alzheimer’s
Disease Assessment Scale »[8], dans sa partie cognitive
(ADAS-Cog).
Nos hypothèses étaient que :
•les SSCPD sont précoces dans la MA et détectables tôt si
on les recherche systématiquement ;
•l’expression clinique des SSCPD est spécifique de chaque
stade anatomoclinique défini selon Braak ;
•les SSCPD reflètent la topographie des lésions cérébrales
sous-jacentes dans des structures spécifiques.
Methologie
Sujets
La population de notre étude est composée de 50 patients
atteints de MA, dont le diagnostic a été posé dans les uni-
tés de neurogériatrie (UNG) de l’hôpital Sainte-Marguerite à
Marseille (pôle de psychiatrie universitaire), au cours d’une
consultation mémoire, puis d’une hospitalisation en hôpi-
tal de jour, sous la responsabilité de l’un d’entre nous
(B.-F. Michel, neurologue). Les patients ont tous bénéficié
d’un bilan neuropsychologique approfondi et d’une explora-
tion de neuro-imagerie en IRM. Les critères de diagnostic
obéissaient aux recommandations NINCDS-ADRDA [9].La
répartition selon le sexe correspondait à ce que l’on observe
habituellement dans la MA : 34 femmes (68 %) et 16 hommes
(32 %). En vue d’évaluer de fac¸on systématique, chez tous
les patients, l’importance des SSCPD en fonction du stade
de gravité de la MA, nous avons séparé notre population en
deux sous-groupes, en fonction du score au «Mini-Mental-
State »(MMS) [10]. Dans le premier sous-groupe (MMS hauts),
comprenant 23 patients (huit hommes et 15 femmes), le
score MMS était compris entre 21 et 28. Dans le second sous-
groupe (MMS bas), le score MMS se situait entre 10 et 20 ;
ce groupe était composé de 27 individus (huit hommes et
19 femmes).
Protocole expérimental
Inventaire neuropsychiatrique
Le NPI a été développé aux États-Unis et traduit en franc¸ais
par P. Robert et al., en 1998 [11]. Le but du NPI est
de recueillir des informations sur la présence de SSCPD
chez les patients atteints de MA, en analysant 12 séries
de symptômes : «idées délirantes »,«hallucinations »,
«agitation »,«dépression »,«anxiété »,«exaltation de
l’humeur »,«apathie »,«désinhibition »,«irritabilité »,
«comportements moteurs aberrants »,«troubles du som-
meil »,«troubles de l’appétit ». Il s’agit d’un entretien
semi-dirigé basé sur les réponses d’un accompagnant. En
plus de la présence des troubles, leur fréquence (Fde 1 à 4)
et leur gravité (Gde 1 à 3) sont évaluées, ce qui permet de
calculer un score pour chaque item. Le retentissement sur
l’aidant (Rde 0 à 5), de chaque symptôme est aussi estimé.
Après avoir multiplié le score de chaque item, (F×R)on
obtient un score noté sur 12. La mesure de Rn’intervient
pas dans le calcul du score. Pour chaque item du NPI,
nous avons calculé la moyenne des scores, l’écart-type, la
fréquence des réponses et le pourcentage de réponses posi-
tives. Le score global est la somme des 12 scores qui va de
0 à 144 points. Un score global supérieur à 24 est considéré
comme pathologique.
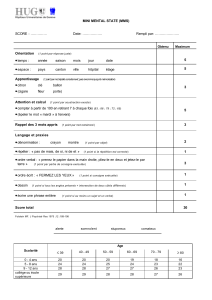
Mini Mental State
Le MMS permet de quantifier rapidement les capacités
cognitives chez les sujets âgés. Le test contient six sub-
tests qui explorent les domaines suivants : «orientation »
(temporelle et spatiale), «apprentissage »,«attention et le
calcul mental »,«rappel »,«langage »,«praxies construc-
tives ». Le MMS est un outil très utilisé car sa passation
est rapide (deux à dix minutes) et qu’il ne requiert aucun
matériel particulier. C’est un instrument de dépistage qui
permet d’évaluer la sévérité de la démence mais un bilan
neuropsychologique supplémentaire est nécessaire pour
le diagnostic. Le score maximal est de 30 points. Un score
inférieur à 26/30 pose la question d’une démence légère,
inférieur à 21/30 d’une démence modérée et inférieur à
10/30, d’une démence sévère.
Alzheimer’s Disease Assesment Scale
L’ADAS est composée de deux sous-ensembles : une par-
tie cognitive (ADAS-Cog) et une partie non cognitive.
L’ADAS-Cog est un instrument de diagnostic qui permet
d’évaluer la sévérité des troubles cognitifs des patients
atteints de MA. Elle comprend 11 sous-tests qui explorent les
items : «intelligibilité du langage oral »,«compréhension »,
«manque du mot »,«rappel de mots »,«dénomination »,
«orientation »,«exécution d’ordres »,«praxies »,«praxies
constructives »,«reconnaissance de mots »et «rappel de
consignes ». La passation est environ de 30 minutes et le
test est bien toléré car il n’y a pas de limites de temps. La
cotation se fait sur 70 points. Les scores les plus élevés cor-
respondent aux altérations les plus profondes, en sachant
que chez les sujets normaux, le score moyen est environ
de 4,3 (±2,1). Dans la mesure où le score de l’ADAS-Cog
représente le nombre d’erreurs, pour une meilleure compa-
raison des échelles, nous avons calculé aussi le pourcentage
de bonnes réponses.
Réalisation pratique
Les patients étaient hospitalisés, en hôpital de jour dans
l’UNG de l’hôpital Sainte-Marguerite à Marseille, pour un
bilan de démence. Les différentes échelles cognitives (MMS,
ADAS-Cog) ont été réalisées au cours de l’hospitalisation par
l’un d’entre nous (N. Sambuchi, neuropsychologue). Avant
d’entrer dans l’étude, les patients ont été informés par
écrit du protocole et ont signé un consentement éclairé
pour participer à l’étude clinique sur les SSCPD dans la MA.
Lors de la rencontre avec la famille et/ou l’accompagnant,
l’interrogatoire du NPI était administré par l’un d’entre
nous, pour tous les patients (V. Lucciani, psychiatre).
Traitement statistique des données
Le traitement statistique des données a été réalisé grâce au
logiciel STATVIEW, sous la responsabilité de l’un d’entre nous
(V. Pabban). Dans un premier temps, nous avons regardé, sur

Expression des troubles psychologiques et comportementaux selon les stades lésionnels de l’Alzheimer 317
Tableau 1 Corrélations statistiques (p< 0,01) entre le neuropsychiatrique (NPI), l’Alzheimer’s Disease Assesment Scale-Cog
(ADAS-COG) et le «Mini Mental State »(MMS).
Items du NPI Items de L’ADAS-COG Items du MMS
Idées délirantes Rappel de consigne
Hallucinations Intelligibilité du langage oral Orientation spatiale
Manque du mot
Exécution d’ordre
Comportement moteur aberrant Rappel de consignes
Troubles du sommeil Intelligibilité du langage oral Orientation spatiale
Praxies constructives Attention et calcul
Rappel de consigne
l’ensemble de la population, si certains items de l’échelle
NPI, se détachaient d’autres items, grâce au test tde
Student. Ensuite, nous avons recherché des corrélations
entre items de l’échelle NPI, puis avec les items des échelles
cognitives. Enfin, sur chaque sous-groupe MMS (MMS hauts
et MMS bas), nous avons effectué les mêmes recherches que
sur l’ensemble de la population. Puis, nous avons recherché,
grâce au test tde Student, une différence significative entre
les deux sous-groupes pour les items de l’échelle NPI.
Résultats
Étude de l’ensemble de la population
Analyse descriptive
La distribution des patients de l’ensemble de la popula-
tion (34 femmes et 16 hommes), selon les tranches d’âge,
s’étendait entre 50 et 95 ans, avec un pic de fréquence entre
70 et 90 ans (âge moyen 77,62 ±1,29 ans). Le score total
moyen du MMS était de 18,56 (±0,73) et le score moyen
de l’ADAS-Cog de 19,34 (±1,63). En ce qui concerne les
signes et symptômes comportementaux et psychologiques
de la démence, le score total du NPI était de 31 ±3,50
(donc > 24), ce qui correspond à une fréquence de SSCPD
de 56 % dans l’ensemble de notre population.
Recherche de corrélations cognitivocomportementales
En vue d’établir une relation entre les SSCPD et les troubles
cognitifs, nous avons recherché des corrélations entre les
items du NPI et ceux de l’ADAS-Cog et du MMS.
Le Tableau 1 nous montre que certains items du NPI
«idées délirantes »,«comportement moteur aberrant »et
«troubles du sommeil »sont corrélés aux troubles de la
mémoire, trouble cognitif le plus précoce de la MA (toutefois
il s’agit de l’item «rappel de consigne »plus tardivement
altéré que l’item «rappel de mots »corrélé á aucun item du
NPI). Par ailleurs les autres items du NPI «hallucinations »et
«troubles du sommeil »sont corrélés à la fois aux troubles
du langage «intelligibilité du langage oral »et «manque
du mot »et aux troubles praxiques «exécution d’ordre »et
«praxies constructives »d’apparition plus tardive.
Étude des sous-populations
La répartition par tranches d’âge des deux sous-populations
montre que les patients à MMS hauts sont plus jeunes (4 % ont
moins de 59 ans) que les patients à MMS bas (10 % ont plus de
90 ans). L’étude de la répartition des patients par tranches
d’âge confirme que la sous-population à MMS hauts (28 à 21)
est plus représentée dans les tranches d’âge les plus jeunes
que la sous-population à MMS bas (20 à 10). Inversement, la
sous-population à MMS bas est proportionnellement mieux
représentée dans les tranches d’âge les plus âgées, que la
sous-population à MMS hauts.
Sous-population à MMS hauts (28—21)
Les données du NPI sont résumées dans le Tableau 2.
Nous observons que, même dans une sous-population de
patients MA peu évolués (MMS > 20), les SSCPD sont présents
de fac¸on importante, puisque le score global du NPI est à
32,17 ±5,62, supérieur à celui de notre population générale
[31], ce qui correspond à une fréquence de 56 %. L’étude
des fréquences des différents SSCPD montre nettement que
cinq SSCPD sont particulièrement fréquents (> 50 %) dans
cette sous-population. Il s’agit des items : «anxiété »(70 %),
«dépression »(70 %), «agitation »(61 %), «irritabilité de
l’humeur »(61 %) et «apathie »(56 %). Par ailleurs, les deux
SSCPD relativement rares (< 20 %) en population générale —
«exaltation de l’humeur »(10 %) et «hallucination »(18 %) —
se retrouvent chez les patients MA à MMS hauts, à des scores
encore plus faibles : «l’exaltation de l’humeur »à13%et
«hallucinations »à9%.
Sous-population à MMS bas (20—10)
Les données du NPI sont résumées dans le Tableau 3.
Nous observons que, dans cette sous-population de
patients MA plus évolués (MMS < 20), les SSCPD sont pré-
sents de fac¸on relativement moins importante que dans la
population de patients MA moins évolués, puisque le score
global du NPI est à 30 ±4,45, inférieur à celui de la sous-
population des MMS hauts (32,17 ±5,62). Cela correspond
toutefois à une fréquence identique de 56 %. L’analyse des
fréquences des différents SSCPD montre nettement que les
quatre SSCPD, particulièrement fréquents dans l’ensemble
de notre population (> 50 %), sont retrouvés avec une haute
fréquence dans la sous-population à MMS bas : «anxiété »
(78 %), «apathie »(74 %), «dépression »(63 %) et «agitation »
(60 %). Les «troubles du sommeil »paraissent spécifiques à
cette sous-population de sujets relativement évolués dans
leur MA, puisqu’ils s’observent avec une fréquence de 48 %,
alors que leur fréquence n’est que de 35 % chez les MMS
hauts. Par ailleurs, parmi les deux SSCPD qui sont relati-
vement rares en population générale (< 20 %), seul l’item

318 B.F. Michel et al.
Tableau 2 Données du neuropsychiatrique (NPI) dans la sous-population à «Mini Mental State »(MMS) hauts.
Differents items du NPI Score moyen (12) Écart-type Pourcentage (%)
Idées délirantes 2,17 0,76 30
Hallucinations 0,70 0,53 9
Agitation 3,96 0,86 61
Dépression 4,91 0,85 70
Anxiété 5,17 0,91 70
Exaltation de l’humeur 0,61 0,39 13
Apathie 3,74 0,83 56
Désinhibition 2,30 0,74 35
Irritabilité de l’humeur 3,65 0,84 61
Comportement moteur aberrant 2,00 0,66 39
Troubles du sommeil 1,74 0,63 35
Troubles de l’appétit 1,22 0,45 30
Total 32,17 5,62 56
«exaltation de l’humeur »(7 %) est retrouvé chez les MMS
bas. Il est à noter que les «hallucinations »qui n’ont une
fréquence que de 9 % dans les MMS hauts, augmentent net-
tement de fréquence aux stades évolués de la MA, pour
atteindre 33 %.
Comparaison des SSCPD dans les sous-populations à MMS
hauts et MMS bas
Trois SSCPD sont clairement plus représentés à la phase
de début de la MA (MMS hauts) qu’à la phase modérée de
la MA (MMS bas). Il s’agit des modifications de l’humeur :
«dépression »,«exaltation de l’humeur »et «irritabilité de
l’humeur ». Sept SSCPD caractérisent plus particulièrement
la phase évoluée de la MA (MMS bas) : «hallucinations »,
«anxiété »,«apathie »,«désinhibition »,«comportement
moteur aberrant »,«troubles du sommeil »et «troubles
de l’appétit ». Deux SSCPD se retrouvent tout au long de
l’évolution de la MA, d’une intensité à peu près égale au
début (MMS hauts) et en fin de l’évolution (MMS bas) de la
MA : «idées délirantes »,«agitation ». La comparaison des
moyennes de chaque item du NPI montre de fac¸on très nette
que trois items se détachent nettement entre les deux sous-
populations (Fig. 1). Il s’agit des items :
•«irritabilité de l’humeur »caractérisant la sous-
population MMS hauts ;
•«hallucinations »et «troubles du sommeil »prédominant
dans les MMS bas.
Recherche de corrélations internes au NPI
La recherche de corrélations interne au NPI, entre les
différents items qui le composent, montre que les items
corrélés ne sont pas les mêmes dans les deux sous-
populations, MMS hauts et MMS bas (Fig. 2). Nous avons
retrouvé 66 corrélations internes. Trente huit corrélations
sont congruentes entre MMS hauts et bas, 27 ne le sont pas.
Cela permet de penser que l’origine des SSCPD est différente
aux deux stades évolutifs de la MA que nous avons étudiés et
que les SSCPD ne recouvrent probablement pas les mêmes
mécanismes physiopathogéniques.
Évaluation des fonctions cognitives
L’ensemble des données concernant l’ADAS-Cog est résumé
sur la Fig. 3. L’étude des pourcentages de réponses posi-
tives aux items de l’ADAS-Cog, pour la sous-population à MMS
hauts, montre que tous les items sont au-dessus de 80 % de
réponses positives, hormis l’item rappel de mot, fortement
Tableau 3 Données du neuropsychiatrique (NPI) dans la sous-population à «Mini Mental State »(MMS) bas.
Differents items du NPI Score moyen (12) Écart-type Pourcentage (%)
Idées délirantes 2,11 0,67 33
Hallucinations 1,70 0,56 33
Agitation 3,48 0,72 59
Dépression 4,00 0,68 63
Anxiété 5,33 0,78 78
Exaltation de l’humeur 0,22 0,15 7
Apathie 3,30 0,58 74
Désinhibition 1,37 0,42 41
Irritabilité de l’humeur 2,00 0,54 52
Comportement moteur aberrant 2,04 0,50 48
Troubles du sommeil 2,96 0,76 48
Troubles de l’appétit 1,48 0,50 37
Total 30,00 4,45 56
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
1
/
12
100%