Neuropathie hypertrophique du plexus brachial H Observation n° 2

Correspondances en Nerf & Muscle - Vol. II - n° 1-2 - janvier-juin 2007
11
Observation n° 2
Neuropathie hypertrophique du plexus brachial
A. Truffert*
* Clinique de neurologie,
hôpitaux universitaires de Genève.
En août 1997, M.C. est hospitalisé pour une
affection qui évoque une atteinte radiculaire
L5 droite, traitée médicalement. Mais au cours
de cette hospitalisation, il développe brutale-
ment une symptomatologie sensitive doulou-
reuse des deux membres supérieurs avec une
prédominance gauche. Il est également noté
une discrète parésie de la main gauche. Cette
symptomatologie régresse spontanément en une
dizaine de jours.
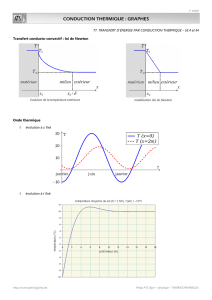
Durant ce séjour hospitalier, on retient l’étude des
potentiels sensitifs réalisée au membre supérieur
gauche (tableau I) : une semaine avant le début
des symptômes (29 août 1997), pendant l’acmé
de la symptomatologie (17 septembre 1997)
et une semaine après la fin des symptômes
(29 septembre 1997). La diminution des vitesses
de conduction et l’augmentation de l’amplitude
au troisième examen pourraient être dues à une
température basse.
Toujours est-il que, pendant les sept années
suivantes (de 1997 à 2004), le patient voit ses
troubles sensitifs distaux s’aggraver et une
faiblesse des membres supérieurs s’accentuer,
toujours plus marquée à gauche, évoluant plutôt
par à-coups, entraînant à chaque fois une rééva-
luation électroneuromyographique (ENMG).
Il se développe ainsi une amyotrophie progressive
des deux mains. L’étude ENMG réalisée pendant
cette période montre, à gauche, une certaine alté-
ration des amplitudes des potentiels sensitifs,
alors que la conduction motrice reste dans les
limites de la normale (tableau II). Il existe
cependant une hypoexcitabilité au point
d’Erb sur le cubital gauche ( gure 1).
En février 2004, un dé cit de l’extension
de la main gauche apparaît de façon
brutale, dé cit qui restera inchangé par
la suite. L’examen ENMG réalisé une
semaine après l’installation du déficit
montre un potentiel sensitif du nerf
radial gauche à 9 μV pour une vitesse
de conduction à 54 m/s et une vitesse
de conduction motrice à 42 m/s pour une
amplitude distale à 5,9 mV.
Histoire CLiniQUe
M.C., âgé de 88 ans, est un ancien pilote de la RAF,
accidenté pendant la Seconde Guerre mondiale,
seul rescapé du crash de son avion. Il en garde
une certaine culpabilité et noie en quelque sorte
son chagrin dans l’alcool (whisky).
Tableau I. Étude des potentiels sensitifs en 1997.
Nerfs Amplitude (μv) VCS (m/s)
29 août
1997 17 septembre
1997 29 septembre
1997 29 août
1997 17 septembre
1997 29 septembre
1997
Médian
9 3 9 41 44 38
Ulnaire
11 4 8 41 36 32
Tableau II. Étude des conductions sensitives et motrices.
Études des potentiels sensitifs
Amplitude (μV) VCS (m/s)
Médian gauche 3 46
Ulnaire gauche 6 45
Études de la conduction motrice
Latence
distale (ms) Amplitude
distale (mV) VCM
(m/s) Latence
de l’onde F (ms)
Médian gauche 3,5 6,6 46,3 50
Ulnaire gauche 3,1 7 42,6 56
Figure 1. Stimulation étagée du cubi-
tal G (20 août 2001). Hypoexcitabilité
au point d’Erb. Il ne s’agit pas d’un
bloc de conduction, car la stimulation
magnétique transcrânienne fait appa-
raître des potentiels moteurs de taille
(surface) normale. De plus, l’aire sous
la courbe de 40 ms d’EMG de contrac-
tion volontaire maximale est approxi-
mativement celle attendue.

Figure 2. Examen par résonance magnétique
nucléaire du plexus brachial (février 2004).
En T2 : un élargissement fusiforme des
racines C5, C6 et C7 et des troncs primaires
et secondaires du plexus brachial gauche.
Figure 3. En T1 avec gadolinium : prise de
contraste des racines C5 et C6 gauches et
des troncs secondaires du plexus brachial
gauche.
Figure 4. Stimulation étagée
du nerf cubital gauche
(13 septembre 2006). Pas
de désynchronisation impor-
tante, ni de ralentissement
marqué de la conduction
nerveuse à 10 ans d’évolu-
tion.
Figure 5.
Stimulation étagée du nerf
radial gauche (13 septembre
2006). Démonstration indi-
recte d’un bloc de conduction
proximal.
Figure 6. Ondes F obtenues sur
le cubital gauche (13 septembre
2006). Augmentation majeure
des latences des ondes F,
plus importante que ne le
laisserait attendre la mesure
des vitesses de conduction
segmentaires en distalité, qui
ne sont que modérément ralen-
ties, attestant ainsi le caractère
proximal du ralentissement de
la conduction nerveuse.
Correspondances en Nerf & Muscle - Vol. II - n° 1-2 - janvier-juin 2007
12
L’examen par résonance magnétique nucléaire
(RMN) [réalisé en février 2004] montre en T2 un
élargissement fusiforme des racines C5, C6 et C7
et des troncs primaires et secondaires du plexus
brachial gauche (gure 2), et en T1 avec gadoli-
nium, une prise de contraste des racines C5 et
C6 gauches et des troncs secondaires du plexus
brachial gauche (gure 3).
En septembre 2006, l’examen neurologique montre
une amyotrophie très marquée de la musculature
intrinsèque des deux mains, un décit notable de
l’extension du poignet et des doigts à gauche,
une parésie des autres muscles du membre supé-
rieur gauche (y compris le triceps) et également
à droite, une hypoesthésie uctuante à tous les
modes des deux membres supérieurs avec un
aspect en gant plus marqué des deux côtés. On
note aussi une aréexie généralisée.
L’étude ENMG du 13 septembre 2006 montre une
conduction nerveuse motrice normale pour le
nerf ulnaire gauche (gure 4). En revanche, on
observe un bloc de conduction proximal sur les
bres motrices du nerf radial gauche (gure 5).
Les latences des ondes F sont très allongées sur
le nerf ulnaire gauche (gure 6).
Le LCR est normal. Il n’y a pas de taux élevés des
anticorps antigangliosides. Il existe une gamma-
pathie monoclonale IgG kappa à taux modéré.
Pour résumer, les études ENMG réalisées sur
10 ans (13 examens) montrent que :
Pour les potentiels sensitifs, les vitesses de
conduction distales sont modérément diminuées ;
les amplitudes sont en revanche nettement
réduites, de façon asymétrique et hétérogène
avec une tendance à la décroissance régulière au
l des ans, avec quelques uctuations.
Pour la conduction motrice, les vitesses de
conduction distales sont normales ou modéré-
ment réduites, les latences distales modérément
allongées. En revanche, on observe un ralentis-
sement proximal de la conduction nerveuse et
des latences des ondes F très augmentées. Les
amplitudes distales sont normales ou modéré-
ment diminuées de façon asymétrique et hété-
rogène. Des troubles de l’excitabilité proximale
puis des blocs de conduction proximaux (intérêt
de la triple stimulation) apparaissent progressi-
vement (gure 7).
L’évolution depuis 1996 est montrée dans la
gure 8.
Concernant l’évolution sous traitement, plusieurs
thérapeutiques ont été utilisées (Ig i.v., plasma-
phérèses, corticoïdes et rituximab), avec peu ou
pas d’effets bénéques.
♦
♦

2 - Aggravation progressive,
sensitivo-motrice, asymétrique
à prédominance G sur 7 années Aggravation
tr. sensitifs
3 - Main tombante G
1 - Paresthésies/allodynies MS
IRM plexus 18.02.04
2 ans
ENMG successifs
Décembre
1996
Décembre
1998
Décembre
2000
Décembre
2002
Décembre
2004
Décembre
2006
Figure 8. Prol évolutif et chronologie des événements. En bleu, échelle arbitraire d’intensité
des symptômes et d’invalidité au membre supérieur gauche.
Figure 7. Distinction entre désynchronisation et bloc de conduction radiculaire par la triple
stimulation. (Attarian S et al., Muscle Nerve 2005.)
Wrist CMAP TST test curve
TST control curve
Wrist CMAP TST control curve
TST test curve
2 mV
5 ms
2 mV
10 ms
Wrist CMAP
Erb CMAP
Cortical MEP
Cortical MEP
A
C
B
D
Correspondances en Nerf & Muscle - Vol. II - n° 1-2 - janvier-juin 2007
13
Commentaires
Ce patient présente donc une atteinte bilatérale
des membres supérieurs évoluant sur près de
10 ans avec une assez nette prédominance gauche
où le décit moteur est marqué, touchant les
muscles distaux et ceux de l’avant-bras (plutôt
extenseurs des doigts et du poignet). L’évolution
a été quelque peu uctuante et les membres infé-
rieurs n’ont jamais été concernés par l’affection,
bien qu’il existe une aréexie généralisée. Les
différentes études électrophysiologiques ont
montré qu’il existait une atteinte plutôt proxi-
male avec un ralentissement de la conduction
nerveuse proximale, un bloc de conduction
proximal (détecté par l’usage de la triple stimula-
tion) et une hypoexcitabilité également proximale.
Les potentiels sensitifs distaux sont altérés de
façon asymétrique et hétérogène. Néanmoins, ces
données cliniques et électrophysiologiques orien-
taient le diagnostic vers une atteinte bilatérale
du plexus brachial, mais sans systématisation.
C’est l’imagerie par résonance magnétique qui
a permis de localiser le site principal des lésions
en montrant une hypertrophie localisée du plexus
brachial gauche. Il faut rappeler que la protéino-
rachie était normale et qu’il existait une gamma-
pathie monoclonale IgG κ.
Dans un premier temps, le diagnostic a donc porté
sur les causes de neuropathies hypertrophiques
du plexus brachial.
Ainsi, les autres causes d’atteintes non trau-
matiques du plexus brachial ont pu être facile-
ment éliminées : syndrome de Parsonage-Turner
(d’autant que l’atteinte est d’installation aiguë),
atteinte plexique dans le cadre d’une maladie
héréditaire par hypersensibilité à la pression ou
encore plexopathie néoplasique (rappelons que
l’évolution a été lente sur près de 10 ans).
La notion de neuropathie hypertrophique du
plexus brachial remonte à R.D. Adams et al.,
qui rapportèrent en 1965 cette entité clinique
caractérisée par une hypertrophie multiple des
nerfs, indolore, asymétrique, évoluant de façon
chronique avec des rémissions et des rechutes
(1). L’atteinte du plexus brachial était prédomi-
nante dans le cas où une masse sus-claviculaire
se développait avec le temps. M.D. Cusimano et
al. ont rapporté en 1988 deux cas de neuropa-
thie hypertrophique du plexus brachial avec des
symptômes récurrents évoluant sur des années
et aboutissant là aussi à la formation de masses
indolores sus-claviculaires (2). L’étude anato-
mopathologique montrait qu’il s’agissait d’une
hypertrophie nerveuse d’origine inammatoire
avec formations en bulbe d’oignon. A.A. Amato
et al. ont rapporté un cas de neuropathie indo-
lore à rechute du plexus brachial avec bloc de
conduction persistant et répondant très bien aux
immunoglobulines humaines i.v. (3). Cela a incité
les auteurs à classer cette neuropathie dans le
Observation n° 2

Correspondances en Nerf & Muscle - Vol. II - n° 1-2 - janvier-juin 2007
14
large spectre des polyneuropathies inamma-
toires démyélinisantes chroniques (PIDC) et des
neuropathies motrices multifocales. Les PIDC
forment en effet un large spectre de neuropa-
thies dont les traits principaux sont le caractère
inammatoire, la démyélinisation multifocale et
la chronicité. Certaines ont un caractère franche-
ment multifocal, avec blocs de conduction persis-
tants (4). Une autre entité, d’origine dysimmune,
est caractérisée par une distribution multifocale
des blocs de conduction, mais ne concerne que
les bres motrices (5). Ces deux affections répon-
dent aux traitements par Ig i.v. L’avènement de
l’IRM a permis de mieux étudier ces neuropathies
focales ou multifocales. Dans les neuropathies
motrices multifocales, les anomalies visualisées
par la RMN sont semblables à celles observées
dans les PIDC, mais il n’y a pas d’hypertrophie
brachiale (6). En revanche, dans certaines PIDC,
la RMN montre la présence d’une hypertrophie
des racines cervicales et du plexus brachial (7).
L’hypertrophie du plexus brachial montrée par la
RMN dans le cadre des PIDC n’est pas rare, mais
la localisation préférentielle des lésions sur le
plexus brachial en fait une variante inhabituelle
des PIDC (8). Une atteinte isolée unilatérale (9) ou
bilatérale (10) du plexus brachial a été rapportée.
Néanmoins, R.M. Van den Berg-Vos et al. font
de la neuropathie inammatoire démyélinisante
multifocale une entité distincte des PIDC et des
neuropathies motrices multifocales (11).
Quoi qu’il en soit et quelle que soit l’appella-
tion, ces neuropathies hypertrophiques focales
ou multifocales procèdent d’un mécanisme
dysimmun et répondent habituellement bien
aux thérapeutiques immunomodulatrices. Elles
doivent être distinguées des autres neuropathies
hypertrophiques localisées dues à une hypertro-
phie du périnèvre intraneural (12).
L’étude électrophysiologique revêt ici un carac-
tère essentiel : la mise en évidence des blocs
de conduction proximaux par méthode directe
ou triple stimulation (13) et l’hypoexcitabilité
focale (9). Cette hypoexcitabilité serait due à
une altération des propriétés de la membrane
nodale des axones en cours de remyélinisation
(14, 15). ■
référenCes
1.
Adams RD, Asbury AK, Michelsen JJ. Multifocal pseudo-
hypertrophic neuropathy. Trans Am Neurol Assoc 1965;
90:30-3.
2. Cusimano MD, Bilbao JM, Cohen SM. Hypertrophic bra-
chial plexus neuritis: a pathological study of two cases.
Ann Neurol 1988;24:615-22.
3. Amato AA, Jackson CE, Kim JY, Worley KL. Chronic
relapsing brachial plexus neuropathy with persistent
conduction block. Muscle Nerve 1997;20:1303-7.
4.
Lewis RA, Sumner AJ, Brown MJ, Asbury AK. Multifocal
demyelinating neuropathy with persistent conduction block.
Neurology 1982;32:958-64.
5. Parry GJ, Sumner AJ. Multifocal motor neuropathy.
Neurol Clin 1992;10:671-84.
6. Van Es HW, Van den Berg LH, Franssen H et al. Magnetic
resonance imaging of the brachial plexus in patients with
multifocal motor neuropathy. Neurology 1997;48:1218-24.
7.
Duggins AJ, McLeod JG, Pollard JD et al. Spinal root
and plexus hypertrophy in chronic inflammatory demye-
linating polyneuropathy. Brain 1999;122:1383-90.
8. Bradley LJ, Wilhelm T, King RH, Ginsberg L, Orrell RW.
Brachial plexus hypertrophy in chronic inflammatory
demyelinating polyradiculoneuropathy. Neuromuscul
Disord 2006;16:126-31.
9. Van den Bergh PY, Thonnard JL, Duprez T, Laterre EC.
Chronic demyelinating hypertrophic brachial plexus neu-
ropathy. Muscle Nerve 2000;23:283-8.
10. Stumpo M, Foschini MP, Poppi M, Cenacchi G, Martinelli
P. Hypertrophic inflammatory neuropathy involving bila-
teral brachial plexus. Surg Neurol 1999;52:458-65.
11.
Van den Berg-Vos RM, Van den Berg LH, Franssen H et
al. Multifocal inflammatory demyelinating neuropathy: a
distinct clinical entity? Neurology 2000;54:26-32.
12. Simmons Z, Mahadeen ZI, Kothari MJ, Powers S, Wise
S, Towfighi J. Localized hypertrophic neuropathy: magne-
tic resonance imaging findings and long-term follow-up.
Muscle Nerve 1999;22:28-36.
13. Attarian S, Azulay JP, Verschueren A, Pouget J. Magnetic
stimulation using a triple-stimulation technique in patients
with multifocal neuropathy without conduction block.
Muscle Nerve 2005;32:710-4.
14. Kaji R, Oka N, Tsuji T et al. Pathological findings at the
site of conduction block in multifocal motor neuropathy.
Ann Neurol 1993;33:152-8.
15. Yokota T, Saito Y, Yuki N, Tanaka H. Persistent increased
threshold of electrical stimulation selective to motor nerve in
multifocal motor neuropathy. Muscle Nerve 1996;19:823-8.
1
/
4
100%