Manuel qualité Hospices Civils de Lyon

Ce document ne peut être reproduit sans l’autorisation du laboratoire
Référence Kalilab : MU-POL-MQ-001-03
Manuel qualité
Laboratoire de Biologie Médicale Multi Sites du CHU de LYON
Hospices Civils de Lyon
Bâtiment A
162 Avenue Lacassagne
69424 LYON Cedex 03
Tel : 04 72 11 51 72
Fax : 04 72 11 51 79
Référentiels NF ISO EN 15189 et NF ISO EN 22870
Diffusion contrôlée Diffusion non contrôlée

SOMMAIRE
SOMMAIRE 2
ABREVIATIONS 4
INTRODUCTION 5
PRESENTATION DU LABORATOIRE 6
ORGANISATION DU LABORATOIRE 8
A / DEFINIR LA POLITIQUE ET L’ORGANISATION DU LBMMS 11
A1. Politique qualité et engagement de la direction 12
A2. Organisation des responsabilités 12
A3. Organisation de la qualité au LBMMS 14
A4. Communication et éthique 15
A4.1 Communication interne 15
A4.2 Communication avec les professionnels de santé 15
A4.3 Communication avec les patients 16
A4.4 Ethique 17
B / SURVEILLER ET AMELIORER LES PERFORMANCES 18
B1. Satisfaction clients 19
B2. Suivi des indicateurs 19
B3. Gestion des audits internes 20
B4. Maîtrise des non-conformités 20
B5. Gestion des actions correctives et préventives 21
B6. Revue de processus et revue de direction 21
C / PRE-ANALYTIQUE 22
D / ANALYTIQUE 24
E / POST-ANALYTIQUE 26
F / BIOLOGIE DELOCALISEE 28
G / GERER LES RESSOURCES HUMAINES 30
H / GERER LE SYSTEME D’INFORMATION 32
H1. Maîtrise de la documentation 32
H2. Maîtrise du système informatique 33
I / ACQUERIR ET GERER LES MATERIELS ET LES PRESTATIONS 34
I1. Maîtrise des achats 35
I2. Maîtrise des matériels, réactifs et prestations 36
I3. Sous-traitance 37
J / MAITRISER LES LOCAUX, L’HYGIENE, ET LA SECURITE 38
K / PROCESSUS HORS PERIMETRE D’ACCREDITATION 40
K1. Gérer le dossier administratif et la facturation 40
K2. Assurer la mise en œuvre des protocoles de recherche 40
K3. Gérer la Biothèque hors Centre de Ressources Biologiques des HCL 41
K4. Assurer des consultations d’expertises 41
K5. Former des étudiants 41
ANNEXE 1- POLITIQUE QUALITE DU LBMMS DU CHU DE LYON 42
ANNEXE 2- DOMAINES, SOUS DOMAINES et familles du LBMMS du CHU de Lyon 44
ANNEXE 3- Corrélation NF EN ISO 15189 et MAQ 45
Sommaire

MANUEL QUALITE Version : 03
Laboratoire de Biologie Médicale Multi sites du CHU de LYON
Référentiels NF ISO EN 15189 et NF ISO EN 22870 Page 3/46
Ce document ne peut être reproduit sans l’autorisation du laboratoire (MU-POL-MQ-001-03)
Version : 01 Date d’application : 01/06/2013
Version : 02 Date d’application : 15/05/2014
Version : 03 Date d’application : kalilab
Motif de révision : Mise à jour
Rédaction : PILOTES DE PROCESSUS
Vérification : Mylène GADOUX, RAQ LBMMS
Approbation :
Pr Claude NEGRIER, Biologiste responsable du LBMMS, Chef de Pôle Activité Médicale
Biologie et Anatomie et Cytologie Pathologiques

ABREVIATIONS
AMP ……… Assistance Médicale à la Procréation
AMA ……… Assistant(e) Médico Administratif (ve)
AO ……… Appel d’Offre
CARF ……… Centrale d’Approvisionnement en Réactifs et Fournitures
CB. ……….. Centre de Biologie
CBC ……….. Centre Biotechnologie Cellulaire
CBPE……… Centre de Biologie et Pathologie Est
CBPN……… Centre de Biologie et Pathologie Nord
CBAPS……… Centre de Biologie et Pathologie Sud
CCTP……… Cahier des Clauses Techniques Particulières
CHU……… Centre Hospitalier Universitaire
CIQ ………. Contrôle Interne de Qualité
CLIN ………. Centre de Lutte contre les Infections Nosocomiales
CME ………. Commission Médicale d’Etablissement
CNR ………. Centre National de Référence
CR ………… Centre de Responsabilité
DA… ……… Direction des Achats
DDFP… ……… Direction des Dxxxx
DAEL ……… Direction des Affaires Economiques et Logistiques
DAM……….. Direction des Affaires Médicales
DAT ………. Direction des Affaires Techniques
DOQ-RU ………. Direction de l’Organisation de la Qualité Relation Usagers
DM DIV………. Dispositif Médical de Diagnostic In Vitro
DPAS ……... Direction du Personnel et des Affaires Sociales
DPMT ……… Direction des Plateaux Médico Techniques
DRCI …… Direction de la Recherche Clinique et de l’Innovation
DRFCG …… Direction des Ressources Financières et du Contrôle de Gestion
DSII ………. Direction des Systèmes d’Information et de l’Informatique
DSE ………. Direction des Services Economiques
EBMD…….. Examen de Biologie Médicale Délocalisée
EEQ ………. Evaluation Externe de la Qualité
GED……. Gestion Electronique des Documents
GHEH……. Groupement Hôpital Edouard Herriot
HCL ……….. Hospices Civils de Lyon
LBMMS…… Laboratoire de Biologie Médicale Multi Sites
MAQ ……… Manuel d’Assurance Qualité
NRBC ……… Nucléaire Rayonnement Biologique Chimique (risques)
PAM BAP…. Pôle d’Activité Médicale Biologie et Anatomie Pathologique
PAM SRRV.. Pôle d’Activité Médicale Santé, Recherche, Risques et Vigilances
PTPP …….. Plateau Technique Polyvalent Partagé
PUB …….. Projet d’Urbanisation de la Biologie
RCP…………... Réunion de Concertation Pluridisciplinaire
RIA…………... Radio Immuno Analyse
SAV…………... Service Après-Vente
SGL…………... Système de Gestion de Laboratoire
STBM…………... Service des Techniques BioMédicales
TIS ………… Transport Inter Sites
Biobook ou
Easily Biobook……… Catalogue des examens de Biologie développé par les HCL
Kalilab®…………... Logiciel de gestion de l’assurance qualité fourni par Netika

MANUEL QUALITE Version : 03
Laboratoire de Biologie Médicale Multi sites du CHU de LYON
Référentiels NF ISO EN 15189 et NF ISO EN 22870 Page 5/46
Ce document ne peut être reproduit sans l’autorisation du laboratoire (MU-POL-MQ-001-03)
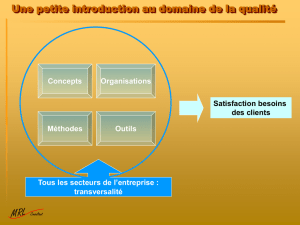
INTRODUCTION
Le manuel qualité présente les dispositions générales adoptées et mises en œuvre par le laboratoire pour
obtenir et garantir la qualité de ses prestations conformément aux exigences de la réglementation en
vigueur et aux exigences des normes NF EN ISO 15189, NF EN ISO 22870, NF EN ISO 17025.
Il décrit notamment l’organisation du laboratoire, ses différents types d’activités et les dispositions mises
en place et appliquées systématiquement en matière d’assurance de la qualité.
Il s’adresse à la structure interne, aux clients, prescripteurs, correspondants, partenaires, auditeurs…
Il s’applique, pour les phases pré-analytique, analytique, et post-analytique dans les installations
permanentes du laboratoire, sur les secteurs suivants : Biochimie, Génétique, Hématologie, Immunologie,
Microbiologie, ainsi que pour les examens de biologie médicale réalisés en anatomie et cytologie
pathologiques et en assistance médicale à la procréation.
Le manuel qualité est tenu à jour sous l’autorité et la responsabilité du responsable qualité du laboratoire.
La vérification et l’approbation de ce manuel garantissent la cohérence sur le fond et sur la forme des
dispositions qui y sont décrites avec la réglementation, les exigences normatives et les autres documents
du laboratoire.
Ce manuel qualité est diffusé sous la responsabilité de la Direction via le mode de diffusion adapté.
Les modifications effectuées sont approuvées par la direction. L’objet des modifications est indiqué sur la
page de garde du manuel qualité.
Le manuel qualité fait partie de la documentation du système qualité du laboratoire. Il est soumis, de fait,
aux exigences de la procédure de gestion documentaire.
Dans la suite du manuel, ce logo fait référence aux procédures, documents associés dont les
enregistrements, qui précisent les dispositions de maîtrise de l’activité.
Dans la suite du manuel, ce logo fait référence aux documents disponibles sur le site des HCL
(intranet ou internet)
MU-POL-MQ-001 : Manuel Qualité du LBMMS
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
 20
20
 21
21
 22
22
 23
23
 24
24
 25
25
 26
26
 27
27
 28
28
 29
29
 30
30
 31
31
 32
32
 33
33
 34
34
 35
35
 36
36
 37
37
 38
38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
 46
46
1
/
46
100%