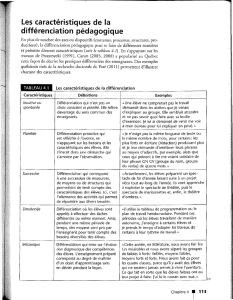
DÉTERMINATION ET DIFFÉRENCIATION DU SEXE I ) DÉTERMINATION DU SEXE

DÉTERMINATION ET DIFFÉRENCIATION DU SEXE
I ) DÉTERMINATION DU SEXE
I- 1) ORGANISATION DES CHROMOSOMES SEXUELS
I- 2) CHROMATINE SEXUELLE – INTERPHASE
I- 3) GÈNES DE LA DÉTERMINATION DU SEXE
II ) DIFFÉRENCIATION DU SEXE
II- 1) DIFFÉRENCIATION DU SEXE MÂLE
II- 1- 1) DIFFÉRENCIATION TESTICULAIRE
II- 1- 2) CONTRÔLE HORMONAL DE LA
DIFFÉRENCIATION DU SEXE MÂLE
II- 1- 3) MODE D’ACTION DES ANDROGÈNES AU
NIVEAU DES CELLULES CIBLES
II- 2) DIFFÉRENCIATION DU SEXE FEMELLE

DÉTERMINATION DU SEXE = DIFFÉRENCIATION
DES GONADES EMBRYONNAIRES EN TESTICULES
OU OVAIRES
ESPÈCE HUMAINE
22 PAIRES AUTOSOMES
(Morphologiquement semblables 2 à 2)
1 PAIRE HÉTÉROCHROMOSOMES
Morphologiquement semblables chez la FEMME (XX)
Morphologiquement différents chez l’HOMME (XY)
FEMME 44 Autosomes + XX AA + XX
HOMME 44 Autosomes + XY AA + XY
+

MÉÏOSE
FÉCONDATION
SEXE GÉNÉTIQUE
DÉTERMINÉ DÈS LA
FORMATION DU ZYGOTE

HÉTÉROCHROMOSOMES
Chromosome X
Sub-Métacentrique
Longueur 5 μm en
métaphase
154 x 106 pb/
Chromatide
5% ADN nucléaire
Chromosome Y
Acrocentrique
Longueur 1,5 μm en
métaphase
53 x 106pb/
Chromatide
1,7% ADN nucléaire
Région Pseudoautosomale
1/4 distal du petit bras de X , 95% du petit bras de Y
Appariement lors de la méïose Vésicule sexuelle

CHROMATINE SEXUELLE (Corps de BARR)
INACTIVATION AU HASARD EN INTERPHASE DE
L’UN DES 2 CHROMOSOMES X DANS LES
CELLULES DES SUJETS FÉMININS (AA + XX)
PETIT AMAS DE CHROMATINE DENSE (Hétérochromatine
Constitutive) ACCOLÉ A L’ENVELOPPE NUCLÉAIRE
CORPS DE BARR
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
 19
19
1
/
19
100%