MATERIOVIGILANCE ET DISPOSITIFS IMPLANTABLES CARDIOLOGIE

MATERIOVIGILANCE ET DISPOSITIFS IMPLANTABLES EN CARDIOLOGIE
L'ACTUALITERECENTEAMISENRELIEFLESENJEUXDELAMATERIOVIGILANCEDANSLEDOMAINEDESDISPOSITIFSMEDICAUX.LES
DISPOSITIFSMEDICAUXIMPLANTABLESOUNONIMPLANTABLESSONTAUCŒURDENOTREACTIVITE,QU'ILS'AGISSEDELA
RYTHMOLOGIEINTERVENTIONNELLE,DELASTIMULATION,DEFIBRILLATIONOURESYNCHRONISATIONCARDIAQUES.L'ORGANISATION,
LESREGLESETLESOBLIGATIONSDANSLECHAMPDELAMATERIOVIGILANCE,ALLANTDELADECLARATIONALAGESTIONDES
SITUATIONSARISQUE,DOIVENTETRECONNUESDETOUS.LETEXTECIDESSOUSENRESUMELESPRINCIPESETMODALITESDEMISEEN
OEUVRE.TOUTETECHNOLOGIEEXPOSEAUNRISQUEDEDYSFONCTIONNEMENT,DYSFONCTIONNEMENTQU'ILNOUSFAUTSAVOIR
DETECTERETGERERAUMIEUXDANSL'INTERETDESPATIENTS.RESTONSVIGILANTS!
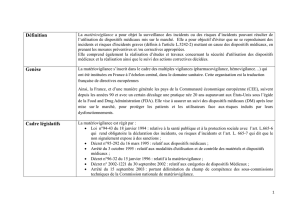
Lamatériovigilance,définieàl’articleR.665‐48duCodedelasantépubliqueapourobjetlasurveillancedes
incidentsoudesrisquesd’incidentsrésultantdel’utilisationdesdispositifsmédicauxquisonteux‐mêmes
définisàl’articleL.5211‐1.Elles’exercesurlesdispositifsmédicauxaprèsleurmisesurlemarché.
Officiellement,lamatériovigilancecomporteainsilesignalementetl’enregistrementdesincidentsoudes
risquesd’incidents,l’évaluationetl’exploitationdecesinformationsdansunbutdeprévention.Elle
comporteégalementlaréalisationdetoutesétudesoutravauxconcernantlasécuritéd’utilisationdes
dispositifsmédicauxetlaréalisationetlesuividesactionscorrectivesdécidées.Cecitrouvesonoriginedansles
directiveseuropéennesrelativesauxdispositifsmédicaux,etlatranspositionendroitnationaldecesdirectives
définitl’organisationretenueparlaFrancepoursonsystèmedematériovigilance.Ilaétéinstituéunsystème
nationaldematériovigilancequicomprend:
•àl’échelonnational:
‐ l’Agencefrançaisedesécuritésanitairedesproduitsdesanté(Afssaps);
‐ laCommissionnationaledesécuritésanitairedesdispositifsmédicaux
•àl’échelonlocal:
‐ lescorrespondantslocauxdematério‐vigilancedésignésdanschaqueétablissementde
santé,associationdistribuantdesmatériels
‐ lesfabricants
‐ quiconqueayantconnaissanced’unincidentoud’unrisqued’incident:lesutilisateursoulestiers
‐
Î Modalitésdesignalement
Lasurvenued’unincidentourisqued’incidentlorsdel’utilisationd’undispositifmédicalengénéraldoit
conduireledéclarantàs’interrogersurlesmesuresàprendre.Celles‐cionttroisobjectifs:
•éviterquel’incidentneseproduiseoufairecesserl’incidentquiseproduit,dansl’intérêtdeceuxqui
pourraientenêtreouquiensontlesvictimes;
•éviterquel’incidentourisqued’incidentnesereproduiselocalementaveclemêmedispositifmédicalou
avecundispositifmédicaldumêmetype;
•faciliterultérieurementlaconduitedel’évaluationdel’incidentourisqued’incidentparl’Afssaps.
Lesmesuresconservatoiresàprendrelocalementsontextrêmementvariablesselonlanaturedesincidentsou
risquesd’incidents.Ilconvientauminimum:
•desuspendrel’utilisationdel’équipementdanslecasoùlapoursuitedesonutilisationpourraits’avérer
dangereuse.Cecipermetenoutrel’expertiseultérieuredudispositifparlefabricantouunexpertindépendant,
dansl’étatoùétaitledispositifaumomentdel’incident,etd’accéderàdesparamètresdefonctionnement
enregistrésinformatiquement;
•derécupérerlesconsommablesimpliquésdansunincident,etsipossible,leuremballage;
•d’organiserlerappeldansl’établissementd’unouplusieurslotssilanaturedel’incidentfaitcraindreque
touslesdispositifsdu(des)lot(s)sontdangereux;
•deconserverenl’étatlesprothèsesayantfaitl’objetd’uneexplantationdansdesconditionsdeconservation
aptesàenpermettrel’expertise;
•deprocéderàl’informationdespersonnelsconcernésafindefairecesserl’incidentouéviterqu’ilnese
reproduise.
Lesmesuresconservatoirespriseslocalementnedoiventpasconstituerunobstacleàlaconduitede
l’évaluationparl’Afssaps.Acontrariol’absencedetellesmesuresnedoitpasmettreenpérillasantéd’un
patient,d’unutilisateuroud’untiers.Ilconvientdoncd’agiravecdiscernementselonlescirconstanceslocales.
Lesmodalitésdesignalementsontdifférentesselonqu’ils’agissed’unincidentgraveoud’unincidentnon

grave.LeformulairededéclarationCerfa,publiéauJournalOfficieldelaRFdu8juillet2000,comporteau
versounorganigrammed’aideausignalementpermettantd’apprécierlagravitédel’incidentetlerôledu
dispositifmédicaldanslasurvenuedel’incident.Ceformulaireestdisponiblesurlesitedel’Afssaps
[http://www.afssaps.fr/Produits‐de‐sante/Dispositifs‐medicaux].
Î Quedoit‐ondéclarer?
Donnentlieuàunsignalementobligatoirementetsansdélai(danslajournée)lesincidentsourisques
d’incidentsayantentraînéoususceptiblesd’entraînerlamortouladégradationgravedel’étatdesantéd’un
patient(menacedupronosticvital,prolongationd’hospitalisation,nécessitéd’interventionouderé‐
interventionmédicaleouchirurgicale,incapacitéimportante).
Donnentlieufacultativementàunsignalement(danslasemaine)lesincidentssuivants:
•réactionnociveetnonvouluelorsdel’utilisationd’undispositifmédical;
•dysfonctionnementoualtérationdescaractéristiquesoudesperformancesd’undispositifmédical;
•touteindicationerronée,omissionetinsuffisancepourl’usagedanslanoticed’instructionoulemode
d’emploi.
Lesalertesrécentespeuventêtreconsultéessurlesiteinternethttp://afssaps.sante.fretcellesdesannées
précédentes(depuis1990)peuventêtreconsultéessurhttp://www.hosmat.com/som11.html.
Î Quidoitdéclarer?
Toutepersonne,fabricant,utilisateuroutiersfaisantlaconstatationouayantconnaissanced’incidentsoude
risquesd’incidentsmettantencauseundispositifmédical.Sontconsidéréscommedestiers,lespersonnesqui
nesontnidesfabricantsoudesutilisateurs,nidespatients.Entrentnotammentdanscettecatégorie,lorsqu’ils
ontconnaissanced’incidentsouderisquesd’incidents,lesresponsablesdelamisesurlemarchéetles
distributeursdedispositifsmédicaux.L’articleL.5212‐2duCodedelasantépubliquepréciseenoutreque«le
fait,pourlefabricant,lesutilisateursd’undispositifetlestiersayanteuconnaissanced’unincidentoud’un
risqued’incidentmettantencauseundispositifmédicalayantentraînéoususceptibled’entraînerlamortoula
dégradationgravedel’étatdesantéd’unpatient,d’unutilisateuroud’untiers,des’abstenirdelesignalersans
délaiàl’Afssapsestpunid’unemprisonnementdequatreansetd’uneamendede75000€oudel’unedeces
deuxpeinesseulement».
Î Commentdéclarer?
Lessignalementsdoiventêtrefaitsauprèsducorrespondantlocaldematériovigilancelorsquecessignalements
sonteffectuéspardesmembresdesprofessionsdesantéquiexercentleursfonctionsdansunétablissement
desantéoudirectementauprèsdudirecteurgénéraldel’Afssapsdanslesautrescas,enparticulierlorsqueles
signalementssonteffectuésparlesprofessionnelsdesantéexerçantàtitrelibéraletparlesfabricantsetleurs
mandataires.Lecorrespondantlocaldematériovigilancetransmetlessignalementsàl’Afssaps.Danstousles
cas,ladéclarationdoitêtrefaiteàl’Afssapsàl’aideduformulaireCerfa,complété,pourcertainsdispositifs
médicaux,parunquestionnaire‐typeappropriéaudispositifmédicalincriminé.Danslesétablissementsde
santéetdanslesassociationsdistribuantdesdispositifsmédicauxàdomicile,ilestrecommandédemettreàla
dispositiondesutilisateursdedispositifsmédicauxdesformulairesdesignalementàusageinterne,afinde
réserverleformulaireCerfaaucorrespondantlocaldematériovigilancepoursignalementàl’Afssaps.Lerecto
duformulairepermetd’identifierl’émetteurdusignalement(lecorrespondantlocaldematériovigilancepour
lesétablissementsdesantéetlesassociationsdistribuantdesdispositifsmédicauxàdomicile)etledispositif
médicalimpliquédansl’incidentoulerisqued’incident.Unerubriqueestconsacréeàladescriptionde
l’incidentoudurisqued’incident.Chaquerubriquedoitêtrerempliedefaçonclaireetlisiblepourune
compréhensionsynthétiquedescirconstancesdesfaits,desconséquencescliniquesetdeleurgravité,ainsique
desmesuresconservatoiresentrepriseslocalement.Auversofigurel’arbredécisionnelpourguiderl’émetteur
dusignalementetlecorrespondantlocaldematériovigilance.Uncertainnombredequestionsposées
conduisentàtroissituationsdesignalement:déclarationobligatoire,déclarationfacultativeoupasde
déclaration.Selonlecheminement,chacunedessituationsestidentifiéeparunelettrequeledéclarantdoit
reporteraurectoduformulaire.Desquestionnairestypesdéclarantpermettentd’apporterpourcertains
dispositifslesélémentscomplémentaires,nécessairesàl’évaluationdel’incidentetnefigurantpassurle
formulaire.
1
/
2
100%