Untitled

!!!

Un modèle scientifique est toujours provisoire. En effet, au fil des découvertes et des perfectionnements de
nos outils de mesure, un nouveau modèle devient nécessaire lorsque des faits nouvellement observés ne peuvent
être expliqués avec l’ancienne théorie. L’étude de la structure de la matière illustre bien cette notion d’évolution
scientifique.
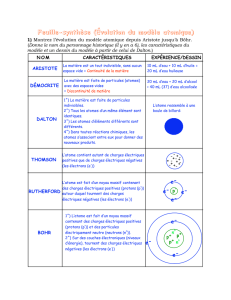
Les philosophes de la Grèce antique comme
Démocrite (460-370 av JC)
furent les premiers à supposer
l’existence de particules invisibles et indivisibles : les atomes (« atome » vient du grec
atomos
qui signifie « qu’on ne
peut diviser »). Cette idée ne reposait pas sur des faits expérimentaux ni sur des observations, mais sur une
« simple » intuition !
Lorsqu’en 1803 le
chimiste britannique John Dalton (1766-1844)
étudia les transformations chimiques, il
fonda sa théorie sur l’existence de petites particules sphériques et insécables, les atomes. Il mit en évidence qu’au
cours d’une transformation chimique, les atomes se re-combinent pour former de nouveaux composés. Chaque type
d’atome, représenté par un symbole (C pour le carbone, H pour l’hydrogène, O pour l’oxygène…), a des propriétés
particulières et peut se combiner avec des atomes différents.
Reconsidérant les travaux de Dalton, Le
chimiste italien Amadeo Avogadro (1776-1856)
établit, en 1811, la
distinction entre atome et molécule : une molécule est constituée d’un ou de plusieurs atomes.
En 1869, le
savant russe Dimitri Mendeleïev (1834-1907)
, étudiant les propriétés chimiques communes de
certains types d’atomes, fut le premier à proposer une classification des atomes.
Ce ne fut qu’à la fin du XIXéme siècle que la notion d’atome indivisible fut mise en doute. Plusieurs expériences
sur les décharges électriques dans les gaz amenèrent le
physicien français Jean Perrin (1870-1942)
à postuler
l’existence de particules électriquement chargées, 2000 fois plus légère que l’atome d’hydrogène.
Quelques années plus tard, le
physicien britannique Joseph Thomson (1856-1940)
démontra que ces petits
grains de matière, qu’il appela électrons, étaient identiques, quel que soit le corps qu’il étudiait. La découverte de
l’existence des électrons conduisit
Joseph Thomson
à proposer un nouveau modèle de l’atome : les électrons,
chargés négativement, et des particules plus massives, de charge positive, se trouvent confinés dans une sphère de
rayon environ égal à 10 –10 m.
En 1911, le
physicien britannique Ernest Rutherford (1871-1937),
voulant étudier la disposition spatiale de ces
particules à l’intérieur de l’atome, fit une découverte capitale. En bombardant, une mince feuille d’or avec des
particules neutres, il observa que la plupart des particules traversait la feuille sans être déviées, alors que
certaines étaient cependant détournées. Une théorie révolutionnaire apparut alors : l’atome est constitué
principalement de vide. Il est formé, au centre, d’un noyau massif, chargé positivement, autour duquel gravitent les
électrons. De nombreuses recherches affinèrent par la suite ce modèle…
1) Quel est approximativement l’âge de la notion d’atome ?
2) Explique les termes : modèle – insécable – reconsidérer – postuler – confiné – affiner
(utilise un dictionnaire).
3) Relève les noms et les nationalités des différents savants cités.
4) Qui peut-être considéré comme le père de la théorie atomique ?
5) Est-il question de vide dans le modèle de Thomson ?
6) Que signifie l’expression « particule neutre » ? L’atome est-il une particule neutre ?
1
/
2
100%