Les nouveaux analogues de la somatostatine : perspectives

141
Métabolismes Hormones Diabètes et Nutrition (X), n° 3, mai/juin 2006 et n° 4, juillet/août 2006
Nouvelles approches
Nouvelles approches
Les nouveaux analogues de la somatostatine :
perspectives thérapeutiques
New somatostatin analogs: therapeutical perspectives
P. Jaquet*, A. Saveanu*, A. Barlier*
U
n grand nombre de tumeurs expriment des récep-
teurs de la somatostatine (ssts) qui peuvent être
des cibles pour les analogues de la somatostatine
(SRIF) (1). Actuellement, les drogues utilisées en thé-
rapeutique, l’octréotide (Sandodastine®, Novartis AG,
Bâle, Suisse) ou le lanréotide (Somatuline®), ne recon-
naissent pas également les cinq sous-types de récepteurs
à la somatostatine (sst1-sst5). Ces octapeptides présen-
tent une constante d’affinité préférentielle pour sst2 et se
lient de façon plus faible à sst5 et sst3 (2, 3). Ce profil
de liaison des analogues synthétiques contraste avec
celui des somatostatines natives, qui se lient également
aux cinq sous-types de sst, avec des affinités de l’ordre
de la nanomole.
L’octréotide et le lanréotide ont été utilisés dans les trai-
tements au long cours de diverses tumeurs neuroendo-
crines, avec des effets assez variables selon le phénotype
tumoral. Par exemple, ces drogues permettent d’obtenir
un bon contrôle de l’hypersécrétion d’hormone de crois-
sance (GH) et une réduction de la masse tumorale des
adénomes somatotropes (4). Les mêmes analogues sont
inefficaces dans le contrôle de l’hypersécrétion de pro-
lactine (PRL) et de la croissance tumorale des adénomes
hypophysaires lactotropes (5). Ces observations suggè-
rent une répartition et une fonctionnalité différentes des
* Laboratoire interactions cellulaires neuroendocriniennes, ICNE-UMR6544-
CNRS, Institut Jean-Roche, Faculté de médecine Nord, Marseille.
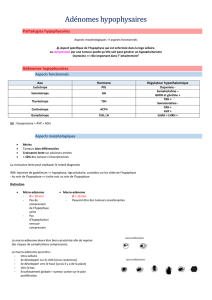
Les récepteurs de la somatostatine s’inscrivent
dans une famille de cinq récepteurs transmembra-
naires liés aux protéines G.
Leur distribution est variable et dépend du type
cellulaire, ce qui suggère différentes fonctions
pour les ligands endogènes ou les analogues syn-
thétiques.
Cette variabilité de répartition est illustrée dans
les tumeurs antéhypophysaires humaines. Les
adénomes somatotropes expriment constamment
les récepteurs 2 et 5. Les adénomes lactotropes
expriment constamment les récepteurs 5 et 1. Les
adénomes corticotropes expriment constamment
le récepteur 5 et faiblement le récepteur 2. Les
adénomes non fonctionnels expriment les récep-
teurs 3 et 2.
Cette variabilité des récepteurs correspond à des
fonctionnalités différentes. La sécrétion de GH des
adénomes somatotropes est freinée par les ligands
sst2 préférentiels. Les sécrétions de PRL et d’ACTH,
issues respectivement des adénomes lactotropes
et corticotropes, sont freinées par les ligands sst5
préférentiels. Cela explique l’efficacité partielle
des analogues synthétiques actuels, essentielle-
▲
▲
▲
▲
ment dirigés vers le récepteur 2, pour contrôler
l’hypersécrétion somatotrope dans les adénomes
somatotropes faiblement équipés en récepteurs de
type 2.
Ces notions récentes ont conduit à développer de
nouveaux analogues de la somatostatine, effica-
ces sur divers récepteurs (sst2 + sst5 : BIM-23244,
sst1 + sst2 + sst3 + sst5 : SOM-230). Ces ligands
somatostatinergiques multiples se sont avérés
plus efficaces que l’octréotide dans des tumeurs
pauvres en récepteur 2.
Les tumeurs somatotropes, comme les tumeurs
corticotropes, coexpriment un récepteur dopaminer-
gique D2 capable d’inhiber les sécrétions de GH ou
d’ACTH. La synthèse de ligands chimériques diri-
gés à la fois vers sst2, sst5 et le récepteur D2 a
permis un contrôle plus efficace de la sécrétion de
GH des adénomes somatotropes répondeurs par-
tiels à l’octréotide. Ces données récentes permet-
tent d’envisager des thérapeutiques mieux ciblées
des tumeurs hypophysaires. Il reste à savoir si ce
concept de traitement par des ligands universels
ou des ligands chimériques, à la carte, pourra s’ap-
pliquer de façon plus générale aux tumeurs neu-
roendocrines.
▲
▲
points FORTS

142
Métabolismes Hormones Diabètes et Nutrition (X), n° 3, mai/juin 2006 et n° 4, juillet/août 2006
Nouvelles approches
Nouvelles approches
ssts selon l’origine des tumeurs qui pourraient expliquer
l’efficacité variable de l’octréotide ou du lanréotide prin-
cipalement dirigés vers sst2 (6).
Diversité des ssts selon le phénotype
tumoral : l’exemple des tumeurs
hypophysaires
Dans les adénomes hypophysaires humains, les études
par PCR quantitative ont illustré cette diversité d’expres-
sion des ssts. Dans l’hypophyse normale, comme dans
les divers types d’adénomes, tous les sous-types de sst
sont exprimés à l’exception de sst4 (6, 7). Les adéno-
mes somatotropes coexpriment de façon constante sst2
et sst5 (8, 9). Sst1 n’est exprimé que lorsque ces adé-
nomes sont mixtes et cosécrètent GH et PRL (10). Sst3
est modérément exprimé dans environ la moitié de ces
tumeurs (8). Dans les prolactinomes, deux types de ssts
sont essentiellement exprimés, sst1 et sst5 (5). Dans les
adénomes corticotropes, le sous-type dominant est sst5,
alors que sst2 est toujours faiblement exprimé (11). Les
adénomes gonadotropes non fonctionnels expriment de
façon prédominante sst3 associé à un moindre degré à
sst2 (1). Ces profils d’expression des ssts correspon-
dent à des différences fonctionnelles. L’utilisation de
ligands somatostatinergiques préférentiels pour chaque
sous-type de récepteur a permis de telles conclusions.
Par exemple, le BIM-23268, ligand préférentiel de sst5,
inhibe préférentiellement la sécrétion de PRL (5) des
prolactinomes et la sécrétion d’ACTH des adénomes
corticotropes (11). Ces tumeurs sont équipées de sst5 et
de sst1 pour les prolactinomes et de sst2 et de sst5 pour
les adénomes corticotropes. Les ligands sst1 préféren-
tiels sont sans effet sur la relâche de PRL des prolac-
tinomes exprimant fortement sst1 (7). L’expression des
ssts et leur fonctionnalité peuvent aussi être plus com-
plexes. Dans les adénomes somatotropes, une bonne
corrélation a été établie entre l’inhibition de la sécrétion
de GH et la quantité de sst2 (7, 9). Cependant, lorsque
ces adénomes expriment faiblement sst2, les ligands
sst5 préférentiels s’avèrent efficaces pour restaurer l’ef-
fet inhibiteur précédemment dévolu à sst2 (7, 9). En
outre, lorsque ces adénomes cosécrètent GH et PRL, les
ligands sst1 préférentiels sont alors capables d’inhiber à
la fois les sécrétions de GH et de PRL (10). Ces obser-
vations, témoignant d’une expression différentielle de
divers ssts non seulement selon le phénotype cellulaire
mais aussi selon le degré de dédifférenciation tumorale,
appuient l’idée d’un ciblage par des ligands différents
selon le type tumoral (12). De telles localisations des ssts
ne sont pas restreintes à l’antéhypophyse. Le pancréas
humain exprime sst1 et sst5 dans les cellules bêta. Sst2
est plus sélectivement exprimé dans les cellules alpha et
sst5 l’est presque exclusivement dans les cellules delta
(13). Une telle sélectivité ne correspond cependant pas à
la règle générale. Une étude récente sur différentes aires
cérébrales, à l’aide de techniques immunohistochimi-
ques, trouve des nombres de neurones positifs pour sst1,
sst2, sst3, sst4 et sst5 peu différents les uns des autres
dans le cerveau humain normal (14).
Les nouveaux analogues
de la somatostatine (tableau)
L’hétérogénéité des réponses à l’octréotide dans diverses
pathologies tumorales a récemment conduit à l’élabora-
tion de nouveaux analogues de la somatostatine qui puis-
sent présenter une efficacité plus grande. Initialement,
quatre aminoacides (Phe-Dtrp-Lys-Thr), en position 7-
10 au sein de la molécule de somatostatine native, sont
identifiés comme le site pharmacophore (15). C’est ce
motif, avec quelques substitutions, qui se retrouve dans
la première génération de drogues telles que l’octréotide,
le lanréotide ou le vapréotide. Ces octapeptides cycli-
ques couramment utilisés dans les traitements de diver-
ses tumeurs neuroendocrines présentent essentiellement
une affinité pour sst2, comparable à celle de SRIF14.
Leur affinité pour sst5 et sst3 est respectivement 10 à 15
et 60 à 160 fois inférieure. Cette sélectivité vis-à-vis de
sst2 explique l’absence d’efficacité de ces drogues dans
certaines tumeurs exprimant peu sst2.
Une première approche, après la découverte des cinq
sous-types de ssts, fut de construire des ligands haute-
ment préférentiels pour chaque sst. Les premiers ligands
sst2 préférentiels, BIM-23190 et BIM-23197 (2, 3)
présentaient une affinité pour sst2 identique à celle de
SRIF14 et une affinité 50 à 100 fois inférieure pour sst5.
Ces drogues étaient capables de supprimer la sécrétion
de GH mais non de PRL (7). Le premier analogue sst5
préférentiel, le BIM-23268 (16, 17), a permis d’obtenir
une inhibition de la sécrétion de la PRL (6). Parmi les
analogues de sst1, le BIM-23926 a démontré des effets
antisécrétoires vis-à-vis de la calcitonine, de la GH, de la
PRL et de la sous-unité alpha, respectivement, dans une
lignée cellulaire de carcinome médullaire thyroïdien,
des adénomes mixtes à GH et PRL et des adénomes non
fonctionnels (10, 18, 19). Récemment, le premier effet
anti-angiogénique d’un analogue sst3, non peptidique, le
L-6796778, a été décrit (20). Ces exemples ne font qu’il-
lustrer l’efficacité potentielle d’analogues sst spécifiques
divers développés ces dernières années (21-24).
Une seconde approche a consisté en la synthèse de molé-
cules dirigées simultanément vers plusieurs ssts. Le pre-
mier peptide, le BIM-23244, sst2 et sst5 préférentiel,
s’est révélé actif pour inhiber à la fois GH et PRL (8, 25)
dans l’hypophyse normale et les cultures d’adénomes

143
Métabolismes Hormones Diabètes et Nutrition (X), n° 3, mai/juin 2006 et n° 4, juillet/août 2006
Nouvelles approches
Nouvelles approches
hypophysaires. Ce ligand a permis d’obtenir une sup-
pression de la sécrétion de GH plus efficace que celle
produite par l’octréotide, dans les adénomes exprimant
faiblement sst2. Un autre ligand, le SOM-230, est plus
universel car il possède des affinités nanomolaires pour
sst1, sst2, sst3 et une affinité pour sst5 supérieure à celle
de la somatostatine native (26, 27). Le SOM-230 s’est
avéré capable d’inhiber fortement la sécrétion de GH,
tant en culture cellulaire qu’in vivo, dans environ 25 %
des tumeurs somatotropes résistantes à l’octréotide (9,
28). Récemment, le SOM-230 s’est avéré plus efficace
que l’octréotide pour inhiber la sécrétion d’ACTH dans
des cultures d’adénomes corticotropes (11). Cet effet est
essentiellement médié par sst5, comme le démontre une
étude utilisant la lignée cellulaire AtT-20 (29). L’ensem-
ble de ces résultats confirme l’intérêt en thérapeutique de
ligands de sst universels.
Une autre approche consiste à créer des molécules hybri-
des dirigées contre des récepteurs différents. Cette appro-
che de ciblage de multiples récepteurs a été développée
après constat de l’expression de divers récepteurs dans
plusieurs classes de tumeurs neuroendocrines digestives
(30). Une cible évidente est l’adénome somatotrope qui
est équipé en récepteurs dopaminergiques D2 fonction-
nels (31). Chez les patients acromégales, le bénéfice
d’une association de l’octréotide à un analogue dopa-
minergique, la cabergoline, a été récemment démontré
(32). Une molécule chimérique porteuse de ligands ssts
et dopaminergiques D2, le BIM-23A387, a été récem-
ment développée (33, 34). Elle a permis une suppression
de la sécrétion de GH plus efficace que celle produite
par l’octréotide dans des séries de culture d’adénomes
somatotropes partiellement répondeurs à l’octréotide.
De telles chimères présentent un effet antitumoral bien
supérieur à celui de leurs constituants somatostatinergi-
que ou dopaminergique isolés ou associés sur l’inhibi-
tion de croissance de cellules de carcinomes bronchiques
(35). Enfin, une série de triples hybrides sst2, sst5 et
dopaminergique D2 paraît encore plus puissante que les
molécules précédentes pour inhiber la sécrétion de GH
(36). L’ensemble de ces données conflue pour faire pré-
sager, dans un futur proche, de l’utilisation, en clinique,
de ce type de ligands multiples. Leurs effets adverses, in
vivo, restent bien entendu un facteur limitant potentiel à
évaluer. À ce jour, les analogues complexes de la soma-
tostatine ont été essentiellement testés dans des patholo-
gies hypophysaires. L’extension de ces études à d’autres
tumeurs neuroendocrines reste limitée à des exemples
préliminaires (37).
Mécanismes d’action des ligands
multiples (figure 1)
L’effet additif des ligands sst multiples ou des ligands
sst-dopaminergiques étaie le concept qu’ils puissent
modifier la signalisation cellulaire induite par l’exposi-
tion aux constituants individuels de ces ligands. À l’état
basal, les récepteurs membranaires sont configurés en
monomères ou en oligomères (38). La dimérisation des
récepteurs peut se faire lors de leur synthèse et de leur
traffic vers la membrane (39). Elle peut aussi s’effectuer
Structure IC50 (nmol/l)
sst1 sst2 sst3 sst4 sst5
SRIF14 Ala-Gly-c[Cys-Lys-Asn-Phe-Phe-Trp-Lys-Thr-Phe- Thr-Ser-Cys]-OH 2,3 0,2 1,4 1,8 0,9
Première génération
Octréotide D-Phe-c[-Cys-Phe-D-Trp-Lys-Thr-Cys]-Thr-OL > 1 000 0,6 34,5 > 1 000 7
SMS201995
sst2 préférentiel
BIM-23197 N-[N’-(2-Hydroxyéthyl)piperazinyl]-2-éthylsulfonylD-Phe-c[Cys-Tyr-DTrp-Lys- > 1 000 0,2 26,8 > 1 000 9,8
Abu-Cys]-Thr-NH2
sst5 préférentiel
BIM-23268 Cys-Phe-Phe-DTrp-Lys-Thr-Phe-Cys-NH2 18 15 61,6 16,3 0,4
sst1 préférentiel
BIM-23926 ND 3,6 > 1 000 > 1 000 833 788
sst2 et sst5 bi- ou multipréférentiels
BIM-23244 ND 1 020 0,2 133 > 1 000 0,7
BIM-23A387 ND 293 0,2 77 ND > 1 000
SOM-230 c[2-Aminoéthyl-carbamoyl-oxy-Pro-Phg-Tyr(Bzl)-Trp-Lys-DTrp] 9,3 1 1,5 > 1 000 0,2
ND = non disponible.
Tableau. Structures et affinités des principaux analogues somatostatinergiques. D’après Patel, 1999, et Hofland et al., 2002.

144
Métabolismes Hormones Diabètes et Nutrition (X), n° 3, mai/juin 2006 et n° 4, juillet/août 2006
Nouvelles approches
Nouvelles approches
sous l’influence de ligands. Cela a été mis en évidence
par l’introduction de sst5 dans des cellules cotransfec-
tées par sst5 et sst1 (40). L’hétérodimérisation de récep-
teurs distincts est capable d’en modifier les propriétés.
Ainsi, l’hétérodimérisation de sst2 avec un récepteur
opioïde en modifie l’internalisation et le trafic cellu-
laire (41). En présence d’un ligand dopaminergique, un
récepteur hétérodimérique sst5-dopaminergique pro-
voque une inhibition de l’activité de l’adénylylcyclase
plus importante que lorsque ces récepteurs sont à l’état
monomérique (42). Ces réarrangements de récepteurs,
sous l’effet de ligands, ne vont pas nécessairement dans
le sens d’un effet synergique. Le réarrangement de sst2
et sst3 en oligomères peut produire un retard à l’interna-
lisation de sst2 sous l’effet d’un ligand sst2 préférentiel
(43). Une telle variabilité dans les réponses suggère que
le processus de dimérisation membranaire des récepteurs
ne suffit pas à expliquer les modifications dans la qua-
lité des signaux déclenchés par des ligands complexes.
Ces récepteurs liés aux protéines G se couplent en aval
avec diverses protéines, dont les β-arrestines, qui, elles-
mêmes, régulent l’activité et le traffic des récepteurs
(44-46). Dans des cellules transfectées, sst2 lié à une β-
arrestine est rapidement recyclé vers la membrane alors
Figure 1. Présentation schématique des récepteurs sst 1-5 humains. CHO indique les emplacements potentiels pour la glycosylation dans la
portion N-terminale et la deuxième boucle extracellulaire (ECL2) ; PO4 indique les emplacements putatifs pour la phosphorylation par la
protéine kinase A, la protéine kinase C et les GRKs. Le résidu cystéine situé à 12 acides aminés en aval du 7
e
passage transmembranaire (TM7)
est conservé dans les sst1, sst2, sst4 et sst5 et peut représenter l’emplacement d’ancrage potentiel à la membrane par palmitoylation. La séquence
YANSCAN PI/VLY du TM7 est hautement conservée dans tous les membres de la famille sst. Les résidus Asp122, Asn276 et Phe294 des TMs 3,
6 et 7 du sst2A font partie de la poche supposée de liaison du ligand (octréotide) et sont figurés par les cercles noirs pleins.

145
Métabolismes Hormones Diabètes et Nutrition (X), n° 3, mai/juin 2006 et n° 4, juillet/août 2006
Nouvelles approches
Nouvelles approches
que sst3 et sst5 sont liés à β-arrestine de façon instable
et orientés vers une dégradation lysozomale (47). Ces
données récentes montrent bien que les récepteurs mem-
branaires ne sont qu’une part des constituants qui déter-
minent la transmission des signaux.
Prises dans leur ensemble, ces données suggèrent un
rôle clef de ligands multiples capables de modifier l’état
physique et la fonctionnalité des récepteurs (figure 2).
Il est aussi possible que la structure chimique de ces
ligands complexes prolonge leur demi-vie et leur effica-
cité biologique. Il restera à établir, dans diverses situa-
tions pathologiques, si les drogues de choix seront plutôt
des ligands sst universels ou plutôt des ligands hybrides.
Si, dans ce dernier cas, il était aisé de choisir un ligand
dopaminergique déjà connu pour être un suppresseur
efficace de la sécrétion de GH des adénomes somato-
tropes, le choix du ligand à associer aux ssts dans des
pathologies aussi diverses que les tumeurs neuroendo-
crines digestives reste, en revanche, problématique. Les
prochaines années nous apprendront si un tel ciblage,
universel ou à la carte, des tumeurs neuroendocrines a
produit une avancée thérapeutique chez les patients, en
n’occultant pas le risque de désensibilisation à de tels
analogues administrés à long terme (48).
Références
1.
Hofland LJ, Lamberts SW. The pathophysiological consequences of soma-
tostatin receptor internalization and resistance. Endocr Rev 2003;24:28-47.
2.
Patel YC. Somatostatin and its receptor family. Front Neuroendocrinol
1999;20:157-98.
3.
Reubi JC, Waser B, Schaer JC, Laissue JA. Somatostatin receptor sst1-sst5
expression in normal and neoplastic human tissues using receptor autoradio-
graphy with subtype-selective ligands. Eur J Nucl Med 2001;28:836-46.
4.
Reubi JC. Peptide receptors as molecular targets for cancer diagnosis and
therapy. Endocr Rev 2003;24:389-427.
Extracellulaire
Intracellulaire
RE
Golgi
RE
Golgi
RE
Golgi
Figure 2. Trois scénarios possibles pour l’assemblage des récepteurs en dimères/oligomères. A : Les récepteurs couplés aux protéines G (RCPG)
sont synthétisés dans le réticulum endoplasmique (RE), mûrissent en tant qu’unités monomériques dans l’appareil de Golgi et sont transportés
à la surface de cellules comme monomères. L’application d’agoniste induit la dimérisation des récepteurs. B : Les RCPG sont synthétisés dans
le RE et se réunissent en unités homo- ou hétérodimériques. Ils sont transportés à la surface de cellules comme dimères. L’application d’ago-
niste peut déterminer la dissociation du dimère en unités monomériques. C : Les RCPG sont synthétisés dans le RE et se réunissent en unités
oligomériques. Ils sont transportés à la surface de cellules comme oligomères. L’application d’agoniste détermine des changements du nombre
et/ou de la conformation d’oligomères.
A B C
 6
6
 7
7
1
/
7
100%