I - Oursins

LSV1 – Semestre 2 – Biologie de la Reproduction et du Développement Animal - Les Oursins - 1
BIOLOGIE DE LA REPRODUCTION ET DU
DEVELOPPEMENT
LES INVERTEBRES : OURSINS
Christian Ghiglion, ghiglion@unice.fr, 3
ème
étage du centre de biochimie, 04 92 07 64 62. Oursin : 4 heures de
cours et 1 TP, drosophile 4 heures de cours. Bibliographie : « Principes du développement », Lewis Wolpert ;
« Biologie du développement », Scott Gilbert. http://www.unice.fr/PATMP/
INTRODUCTION
Tous les oursins ont ceci de remarquable qu’ils présentent tous des piquants aux diverses caractéristiques
malgré une structure similaire de forme globulaire, à quelques exceptions près, dont les « dollars de sable ».

LSV1 – Semestre 2 – Biologie de la Reproduction et du Développement Animal - Les Oursins - 2
PHYLOGENIE
Les oursins appartiennent au phylum des échinodermes, il en existe 7000 espèces, toutes
marines, réparties en 7 classes.
• Classe des Echinides (oursins, 900 espèces)
• Classe des Astérides (étoiles des mers)
• Classe des Holothurides (concombres de mer)
• Classe des Ophiurides (ophiures)
• Classe des Crinoïdes (lilas des mers)
Echinoderme signifie littéralement « peau hérissée ».
Du point de vue évolutif, contrairement à leur aspect à l’état adulte, les échinodermes
appartiennent aux deutérostomes, tout comme les vertébrés. Ils sont donc plus proches
que les autres systèmes modèles (Arthropodes et Nématodes utilisés en biologie du
développement) pour l’étude de l’Homme.
On rappelle qu’une des principales caractéristiques évolutive des Deutérostomes consiste
en la formation de l’anus à partir du blastopore. La région anale se développe donc
logiquement avant la région buccale.
Les oursins ont une segmentation holoblastique, totale. La segmentation est radiaire, c'est-à-dire qu’elle aura
lieu à partir d’un rayon, ainsi, on aura des plans de clivages soit parallèles, soit perpendiculaires à l’axe
primordial. Les Deutérostomes ont une capacité de régulation des blastomères.

LSV1 – Semestre 2 – Biologie de la Reproduction et du Développement Animal - Les Oursins - 3
ANATOMIE
Les oursins sont des animaux benthiques, toujours disposés
de la même façon : la face orale tournée vers le sol. Les
piquants des oursins sont mobiles, mais ils ne permettent
pas le déplacement, contrairement aux pieds ambulacraires,
sur lesquels sont fixés des podia. Le test calcaire de l’oursin
donne la forme globulaire de l’oursin adulte. Celui-ci est
formé de cinq plaques riches en calcium soudées les unes
aux autres. Tous les échinodermes présentent à l’état adulte
une symétrie radiaire d’ordre 5, dite pentaradiaire.
Sur la face orale se trouve la bouche, et
sur la face aborale la région ano-
génitale. En regardant en détail cette
première, on observe facilement
l’orifice buccal clairement délimité par
le test, les piquants et les podia. Les
différentes teintes du test permettent
de repérer aisément la symétrie
pentaradiaire, ainsi que cinq régions
ambulacraires où seront présents des
orifices permettant aux pieds
ambulacraires de passer. Le reste du
test constitue les régions interambulacraires, où se trouveront les piquants mobiles. Au niveau de la face
aborale, on repère également de façon claire la région ano-génitale, et, plus en détail, des orifices permettant
la sortie des gamètes.
L’oursin se nourrit d’algues, il dispose donc d’un
appareil masticateur nommé « lanterne d’Aristote »,
consistant en une zone munie de cinq dents ainsi que
des muscles rétracteurs permettant de les mettre en
mouvement. Sur la dissection ci-contre, on reconnaît
les dents calcaires alternées avec les compas, pièces
squelettiques articulées faisant office de pince. On
remarquera la rigoureuse conservation de la
symétrie pentaradiée.

LSV1 –
Semestre 2
L’OURSIN POUR L’ETUD
E DU DEVELOPPEMEN T A
AVANTAGES
Afin de comprendre les mécanismes du développement, les chercheurs
utilisent des espèces bien décrites du monde scientifique, s
modèles dits « inférieurs
», permettant une plus grande facilité de
compréhension. Il n’existe
pour cela
mais
certains présentent des avantages, tel l’oursin
•
Les oursins sont capables de produire des gamètes en t
grandes quantités. Les femel
œufs, et les mâles 10
12
spermatozoïde
en pleine eau, et
le grand nombre de gamètes
• La fécondation et le déve
loppement sont externe
observables au microscope, et
•
Le développement de l’embryon d’oursin est très rapide, on obtient au bout de deux jours un
et est
aussi synchrone, signifiant que toutes les larves croitront de manière identique au fil du temps.
•
L’œuf et l’embryon d’oursin sont transparents, ainsi, on peut facilement observer les types cellulaires
à l’intérieur du blastocœle.
• La structure de l’embry
on au stade larvaire est simple,
•
Les œufs d’oursin ont une taille permettant une manipulation facile par
morpholinos) grâce à des micropipettes.
• Les embryons sont manip
ulables facilement, on
• Le génome de l’oursin
a été entièrement séquencé,
les expressions géniques codant pour les protéines.
INCONVENIENTS
Hélas !
Comme dit précédemment, il
« oursin » :
•
La production de gamètes est saisonnière, par exemple de janvier à juin pour l’oursin de
méditerranée.
• L’analyse génétique «
classique
plusieurs années afin d’
obtenir un individu apte à la reproduction. Par analyse génétique
on entend l’i
solement des gènes particuliers
consistent en des
mutations sur des gènes uniques, et on observe les éventuelles modifications.
Semestre 2
–
Biologie de la Reproduction et du Développement Animal
E DU DEVELOPPEMEN T A
NIMAL
Afin de comprendre les mécanismes du développement, les chercheurs
utilisent des espèces bien décrites du monde scientifique, s
ouvent des
», permettant une plus grande facilité de
pour cela
aucun individu modèle parfait,
certains présentent des avantages, tel l’oursin
:
Les oursins sont capables de produire des gamètes en t
rès
grandes quantités. Les femel
les peuvent produire jusqu’à 10
7
spermatozoïde
s. La fécondation se fait
le grand nombre de gamètes
permet de pallier aux faibles
probabilités
loppement sont externe
s. Les différentes étapes sont
observables au microscope, et
peuvent être effectuées facilement in vitro.
Le développement de l’embryon d’oursin est très rapide, on obtient au bout de deux jours un
aussi synchrone, signifiant que toutes les larves croitront de manière identique au fil du temps.
L’œuf et l’embryon d’oursin sont transparents, ainsi, on peut facilement observer les types cellulaires
à l’intérieur du blastocœle.
on au stade larvaire est simple,
avec
un faible nombre de cellules.
Les œufs d’oursin ont une taille permettant une manipulation facile par
micro injections
morpholinos) grâce à des micropipettes.
ulables facilement, on
peut ainsi effectuer aisément
des transplantations
a été entièrement séquencé,
facilitant les recherches, car on connait
les expressions géniques codant pour les protéines.
Comme dit précédemment, il
n’existe aucun modèle parfait. Voici donc les inconvénients du modèle
La production de gamètes est saisonnière, par exemple de janvier à juin pour l’oursin de
classique
» est impraticable, car le temps de gé
nération est trop long
obtenir un individu apte à la reproduction. Par analyse génétique
solement des gènes particuliers
; o
n réalise pour cela des cribles génétiques,
mutations sur des gènes uniques, et on observe les éventuelles modifications.
Biologie de la Reproduction et du Développement Animal
- Les Oursins - 4
probabilités
de rencontre.
s. Les différentes étapes sont
donc très facilement
Le développement de l’embryon d’oursin est très rapide, on obtient au bout de deux jours un
e larve,
aussi synchrone, signifiant que toutes les larves croitront de manière identique au fil du temps.
L’œuf et l’embryon d’oursin sont transparents, ainsi, on peut facilement observer les types cellulaires
un faible nombre de cellules.
micro injections
(ADN, ARNm,
des transplantations
.
facilitant les recherches, car on connait
désormais
n’existe aucun modèle parfait. Voici donc les inconvénients du modèle
La production de gamètes est saisonnière, par exemple de janvier à juin pour l’oursin de
nération est trop long
: il faut
obtenir un individu apte à la reproduction. Par analyse génétique
« classique »,
n réalise pour cela des cribles génétiques,
qui
mutations sur des gènes uniques, et on observe les éventuelles modifications.

LSV1 – Semestre 2 – Biologie de la Reproduction et du Développement Animal - Les Oursins - 5
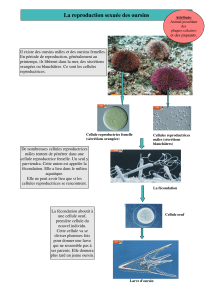
CYCLE DE REPRODUCTION DE L’OURSI N
La larve échinopluteus, issue de la fécondation, est
capable de nager librement et de se nourrir.
Quatre à cinq semaines plus tard, on a obtention
d’un juvénile par métamorphose, qui va donner un
nouvel oursin mâle ou femelle adulte, benthique.
FECONDATION
La reproduction est sexuée, avec des individus
mâle et femelle. L’observation d’individus entiers
ne renseigne pas le genre : il n’y a pas de
caractères sexuels secondaires. En revanche, si un
oursin possède de nombreux gamètes matures
prêts à être expulsés, il y aura en son sein, soit une
substance orangée, soit une substance blanche
près du pôle aboral. Ces substances seront
respectivement des ovules et des spermatozoïdes.
On remarque que les œufs sont beaucoup plus
gros et denses que les spermatozoïdes, les oursins
étant anisogames.
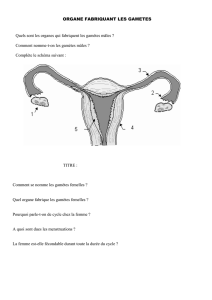
LES GAMETES
Pour les observer, on dissèque les oursins au
niveau de l’équateur. Les gonades se retrouvent
également en symétrie pentaradiaire. Ces gamètes
seront expulsés grâce à des petits canaux
débouchant sur cinq orifices génitaux.
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 18
18
1
/
18
100%